独行菜抗冷相关基因的克隆及表达分析
2018-07-09傅代辉丁金鹏
张 娜,胡 昕,傅代辉,丁金鹏,李 群
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
0 引 言
【研究意义】低温是限制植物生长发育、地域分布、作物品质及产量的主要因素之一,常造成植物细胞膜流动性下降、酶活性降低、产生活性氧等,抑制植物的正常生长发育[1]。为降低伤害,植物从感知低温信号到产生抗性之间存在一个复杂的信号传导网络系统。其中,CBF(C-repeat binding factor)转录调控因子的信号传导途径是主要的传导系统之一,CBFs特异地与下游功能基因启动子区域的顺式作用元件DRE/CRT(dehydration-responsive element/C-repeat element,A/GCCGAC)结合,从而激活COR(Cold-responsive genes)等一系列低温响应基因的表达,提高植株抗冷性[2]。对CBF为枢纽的调控网络及抗冷机理的研究不仅有助于了解植物的抗冷机制,还可为作物抗冷品种的选育及改良提供理论依据。【前人研究进展】1970年,Weiser提出植物在适应低温胁迫过程中激活特异基因的转录并合成新的蛋白质[3]。1985年,Guy等研究发现低温和短日照处理能诱导和增强部分基因的表达,提高植物的抗寒性,将其称为低温响应基因[4]。Thomashow等从拟南芥中克隆出3个低温响应基因cor6.6、cor47、cor15a[5]。其中cor15a基因编码分子量为15kD的多肽,在叶绿体基质片层中被加工成为成熟的9.4kD的多肽,称之为CORl5am[6]。Nancy等构建组成型表达CORl5am多肽的转基因植物拟南芥,与野生型相比转基因拟南芥中叶绿体和原生质体的耐低温性以及原生质膜的稳定性有所提高,降低了低温所造成的损伤[7]。1997年Stockinger在研究拟南芥低温响应基因中发现CBF基因并命名为CBF1/DREB1b(C-repeat binding factor1/ dehydration -responsive element binding 1b)[8]。之后10年中以CBF为枢纽的信号途径中的关键基因陆续被克隆,同时发现该途径介导的低温抗性机制在植物中普遍存在。CBF途径是植物冷驯化过程中重要的信号传导途径之一,其核心是ICE-CBF-COR的调控。植物在正常生长环境中,ICE(induction of CBF expression region)处于非活化状态,一旦植株受低温胁迫时,ICE被迅速激活并与CBF启动子中相关顺式作用元件特异识别并结合,启动CBF基因表达,进一步诱导其下游功能基因的表达,提高植物的抗寒性[9]。在拟南芥中,CBF1/DREB1B、CBF2/DREB1C、CBF3/DREB1A、CBF4这四个基因分别编码CBF转录因子,其中,CBF1、CBF2、CBF3能被低温迅速诱导表达做出响应,而CBF4则受干旱诱导,在低温条件下变化不明显[10]。研究发现CBF1、CBF3基因的过表达能大大提高植物的抗寒能力,其中CBF3的作用更强[11]。COR作为CBF转录因子的下游靶基因参与低温响应信号通路[12]。目前,已从油菜(Brassicanapus)[13]、苜蓿(Medicagofalcate)[14]、菠菜(Spinaciaoleracea)[15]、荠菜(Capsellabursa-pastoris)[16]、大麦(Hordeunvulgare)[17]、小麦(Triticumaestivum)[18]等植物中克隆出低温响应基因。ICE-CBF-COR信号通路的发现和阐明对于提高植物的抗寒性具有重要的指导意义。【本研究切入点】独行菜(LepidiumapetalumWilld.)是十字花科独行菜属一年生草本植物,生长周期较短,常于早春时节萌发生长,种子萌发阶段和幼苗生长对低温胁迫具有一定的耐受性[19]。研究通过克隆独行菜抗冷信号传导途径中的关键基因并进一步进行功能分析,为探讨独行菜抗冷性的分子机制提供线索。【拟解决的关键问题】克隆获得独行菜抗冷途径中的关键基因LaCBF3、LaCOR15a的核心片段,利用半定量RT-PCR方法分析其在不同胁迫处理条件下的表达情况,对其在独行菜低温抗性中的作用进行初步分析。
1 材料与方法
1.1 材 料
独行菜种子于2016年6月采自新疆大学校园内。供试种子成熟、饱满、颗粒均匀。自然环境下干燥后储存于4℃冰箱。
在超净工作台内对独行菜种子进行表面灭菌(70%乙醇30s,0.5%NaClO 20 min,无菌水冲洗3次)后布于1/2MS培养基,于生长室进行培养,生长室培养条件为16 h/25℃光照,8 h/20℃黑暗。
1.2 方 法
1.2.1 胁迫处理
独行菜种子萌发生长两周后将幼苗分别转至含有100 μmol/L ABA、2% NaCl、20% PEG6000的1/2MS培养基及置于4℃低温培养箱中进行胁迫处理,在胁迫处理0、0.5、2、8、12和24 h时收集叶片于液氮中迅速低温冻后置于-80℃冰箱保存备用。
1.2.2 总RNA的提取及cDNA的合成
取上述1.2.1处理的材料各0.1 g,使用BioTeke通用植物总RNA提取试剂盒(RP3302)进行总RNA的提取。用DNaseI纯化RNA以消除DNA污染,通过NANODROP微量核酸定量分析仪测定RNA的浓度、吸光度比值(A260/280、A260/230),以及1%琼脂糖凝胶电泳检测提取的样品RNA质量。
使用TaKaRa PrimeScriptTMRT reagent Kit试剂盒(RR037A)进行cDNA的合成, 以EF-1a作为内参基因,反应体系为:5×PrimeScript Buffer 4 μL;PrimeScript RT Enzyme Mix I 1 μL; Oligo dT Primer(50 μM)1 μL;Total RNA 1.5 μg/μL RNase Free dH2O up to 20 μL。反转录反应程序为:37℃ 15 min;85℃ 5 s;4℃ 30 min。
1.2.3 LaCBF3、LaCOR15a基因的克隆
从Genebank获得十字花科植物(拟南芥、欧洲油菜、播娘蒿和荠菜等)已有的CBF3、COR15a基因的CDS序列进行同源比对,在其保守区遵循引物设计原则,利用 Primer Premier 5.0及DNAMAN7软件设计引物,华大基因公司进行引物合成。以1.2.2获得的独行菜叶片cDNA为模板进行PCR扩增,反应程序为:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min;4℃保存。用1%琼脂糖凝胶电泳检测PCR产物,切胶回收目的条带后与pMD19-T载体连接,通过热激法转入E.coliDH5α感受态细胞,筛选获得阳性克隆后将其菌液送至新疆昆泰锐生物有限公司测序,DNAMAN7软件分析序列同源性。
1.2.4 半定量RT-PCR
对1.2.2获得的独行菜叶片cDNA为模板进行LaCBF3、LaCOR15a基因的半定量RT-PCR分析。总体系为20 μL,包括10×ExTaqBuffer(Mg2+Plus)(20 mM)0.1 μL;2.5 mM dNTP Mixture 1.6 μL,Template 0.5 μL上游引物0.5 μL,下游引物0.5 μL,ddH2O up to 20 μL。反应程序同步骤1.2.3。以EF-1a作为内参基因。扩增产物经1.0%琼脂糖凝胶电泳后在紫外灯下进行检测。表1
表1 引物序列
Table 1 Primer sequence
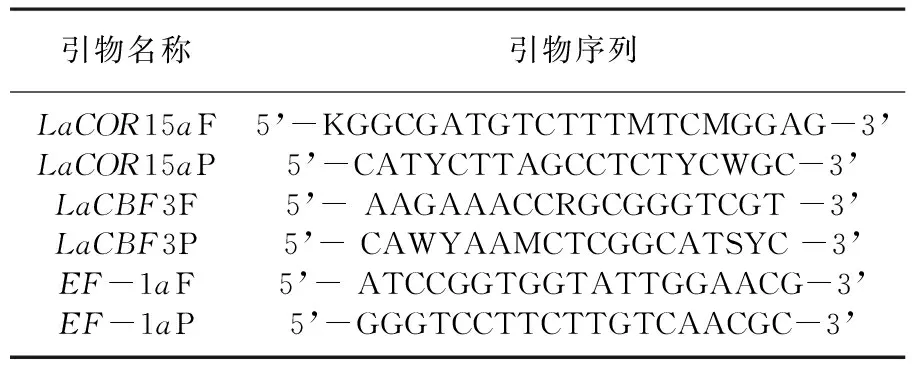
引物名称引物序列LaCOR15aFLaCOR15aPLaCBF3FLaCBF3PEF-1aFEF-1aP5’-KGGCGATGTCTTTMTCMGGAG-3’5’-CATYCTTAGCCTCTYCWGC-3’5’- AAGAAACCRGCGGGTCGT -3’5’- CAWYAAMCTCGGCATSYC -3’5’- ATCCGGTGGTATTGGAACG-3’5’-GGGTCCTTCTTGTCAACGC-3’
2 结果与分析
2.1 独行菜总RNA的提取
独行菜总RNA经1%琼脂糖凝胶电泳检测,可观察到清晰的28S rRNA与18S rRNA两条带,无拖尾现象。A260/230 >2.00,A260/280=1.85~2.05,蛋白质、多糖等污染较少。图1
2.2 LaCBF3、 LaCOR15a核心片段的克隆及菌液PCR鉴定
以低温处理后的独行菜幼苗叶片cDNA为模板,设计并合成兼并引物,经PCR扩增,获得大小约为400 bp的两条特异条带。将该条带切胶回收、连接、转化、培养后各随机挑取3个单克隆菌落进行菌液PCR检测,将鉴定的阳性克隆菌液送至新疆昆泰锐生物有限公司测序,分别获得442 bpLaCBF3及405 bpLaCOR15a的目的片段。利用DNAMAN 7软件对独行菜LaCBF3及LaCOR15a基因序列与琴叶拟南芥、拟南芥的基因序列进行比对,相似性分别为84.38%、81.8%。图2~5

图1 独行菜总RNA检测结果
Fig.1 Total RNA electrophoresis results of Lepidium apetalum
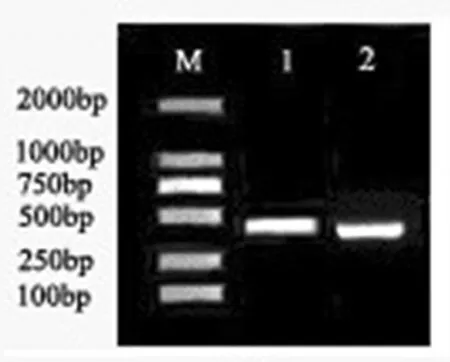
注:M:2 000 bp marker;1:目的基因LaCBF3 442 bp片段;2:目的基因LaCOR15a405 bp片段
Note: M:2,000 bp marker; 1: Target geneLaCBF3 442 bp; 2: Target geneLaCOR15a405 bp
图2 LaCBF3及 LaCOR15a PCR扩增结果
Fig.2 LaCBF3 and LaCOR15a gene fragment electrophoresis test results of PCR amplification

注:M:2 000 bp marker;1~3:LaCBF3阳性克隆PCR扩增结果;4~6:LaCOR15a阳性克隆PCR扩增结果
Note: M: 2,000 bp marker ; 1-3: amplification result ofLaCBF3; 4-6: amplification result ofLaCOR15a
图3 阳性克隆的菌液PCR扩增结果
Fig.3 PCR amplification results of positive clones

图4 独行菜LaCBF3与拟南芥的同源序列比对结果
Fig.4 LaCBF3 alignment results compared with Arabidopsis thaliana

图5 LaCOR15a与拟南芥的同源序列比对结果
Fig.5 LaCOR15a alignment results compared with Arabidopsis thaliana
2.3 胁迫处理下LaCBF3和LaCOR15a表达结果
半定量RT-PCR结果显示在不同胁迫处理下,LaCOR15a基因均被诱导表达,表达模式有一定差异,而在未经处理的独行菜幼苗叶片中不表达;4℃低温处理8 h时LaCOR15a开始表达并随着处理时间的延长表达量有增加趋势,而100 μmol/L ABA、2% NaCl、20% PEG6000诱导下则在0.5 h已经开始表达。与LaCOR15a表达模式不同的是,在盐胁迫、干旱胁迫以及外源ABA处理条件下,均未检测LaCBF3的表达,仅在4℃低温处理条件下LaCBF3在0.5 h开始表达,并且LaCBF3的转录要明显早于LaCOR15a。图6
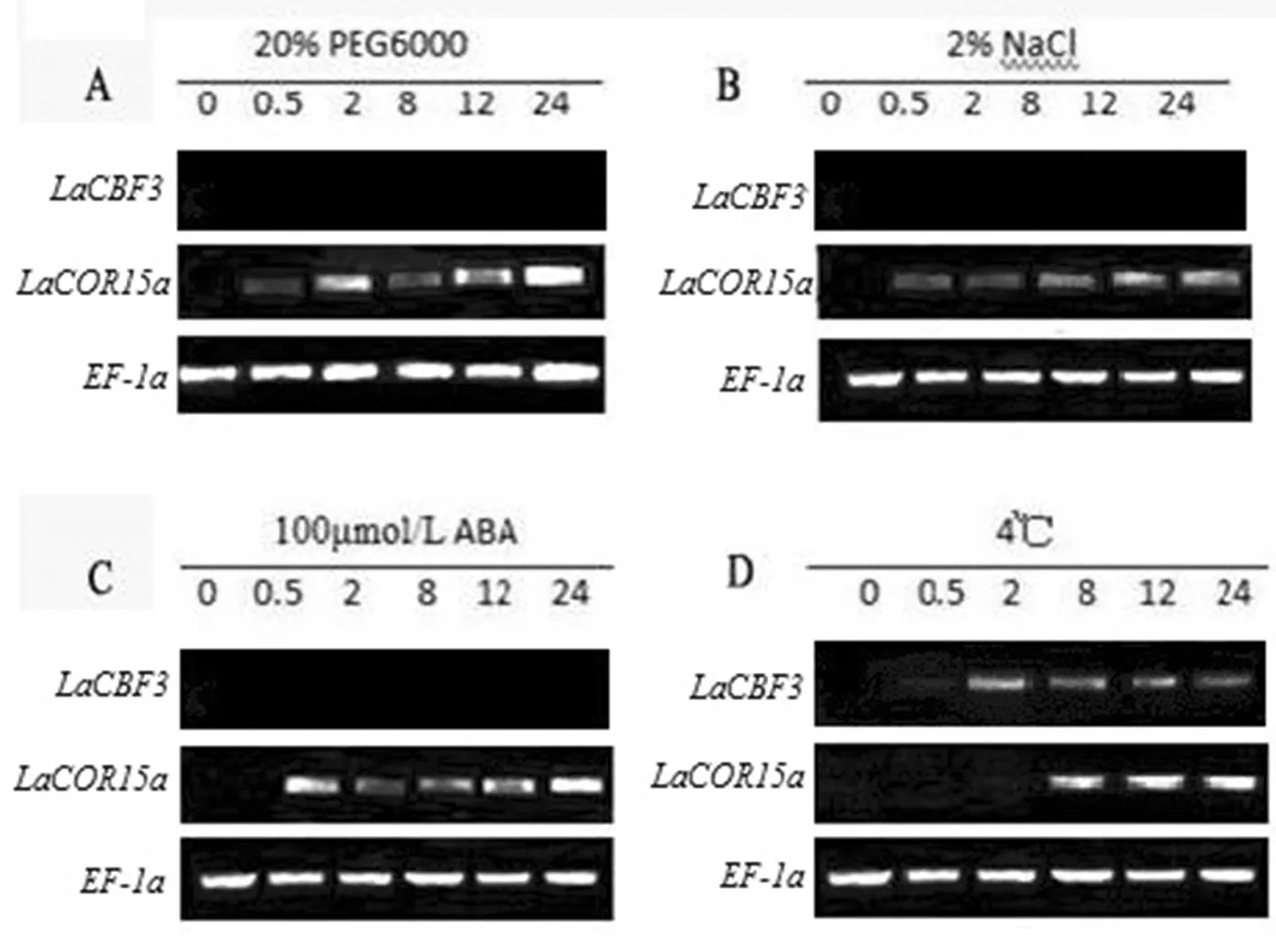
A:20% PEG6000; B: 2% NaCl ; C: 100 μmol/L ABA; D: 4℃
图6 胁迫处理下抗冷相关基因的表达分析
Fig.6 Expression analysis of cold resistance genes under stress treatment
3 讨 论
低温胁迫对植物造成的伤害主要体现在:植株细胞膜系统受损,积累大量活性氧,引起代谢紊乱;部分蛋白质变性、失活,无法执行正常的生理功能;细胞的超微结构如:叶绿体、线粒体、类囊体、染色质等受到不同程度的损伤[20]。除此之外,开花植物的生殖发育也受到一定程度的影响。研究发现,低温胁迫可造成拟南芥花粉发育不良,花粉管通道生长受阻,引起种子数量的减少[21]。长期的自然选择及进化使植物形成一套自身独特的耐低温体制,植物在应对低温胁迫的过程中主要通过依赖于ABA 和不依赖于ABA两条途径,二者相互联系形成调控网络,提高植物的耐寒性[22]。
实验材料独行菜是一种早春短命植物,能在早春低温环境中萌发并生长,为探讨其幼苗生长阶段对低温的耐受机制,对独行菜LaCBF3及LaCOR15a基因核心片段进行克隆并初步分析这两个基因的表达情况,结果表明:干旱、高盐、外源ABA和4℃低温处理条件下均能迅速诱导低温响应基因LaCOR15a的表达,而其上游的转录调控因子LaCBF3对干旱、高盐、ABA无响应,仅在低温诱导下迅速表达。Medina等[23]研究发现,野生型拟南芥植株中CBF基因为低温特异诱导表达基因,不受ABA和干旱胁迫的调控。ABA参与调控植物生长发育的重要过程,同时也作为一种信号分子应答植物对逆境胁迫的反应。Daie等[24]研究表明,外源施加ABA 能够增强植物的抗寒性。实验中100 μmol/L ABA能快速诱导LaCOR15a的表达,但不诱导LaCBF3的表达,推测LaCBF3可能通过不依赖于ABA的途径响应低温胁迫。2% NaCl 处理下,短时间内即可诱导LaCOR15a的表达。Liu等[25]发现200 mM NaCl处理可诱导拟南芥幼苗中COR15a基因的快速表达。植物响应干旱胁迫的分子机制与响应低温胁迫类似,在拟南芥中COR作为低温信号通路中重要的下游基因同时响应干旱胁迫[26]。实验中20% PEG6000及4℃低温处理均能引起LaCOR15a的表达,而LaCBF3只对4℃低温胁迫有快速应答,LaCOR15a则在4℃低温处理8 h时开始表达,这与Gilmour[27]的研究结果相似,拟南芥中CBF3基因的转录水平在15 min内开始增长,COR基因的表达启动稍晚,2 h后开始被诱导,低温响应途径中的基因表达具有时序性。
已有许多植物物种中的COR15a基因进行了分离与功能鉴定。低温胁迫下,高山离子芥CbCOR15基因在叶片中特异表达,过表达该基因提高了烟草的抗冻能力[28 ]。荠菜CbCORl5a基因在常温环境下的叶片中有微量表达,而低温条件下,CbCORl5a在叶片和根中表达量增强[29]。在拟南芥中过表达CBF3基因,不仅提高了COR蛋白的含量,而且也提高了脯氨酸及可溶性糖的含量[30]。低温响应蛋白AtCORl5a是第一个具有直接证据证明其参与了抗冻的蛋白[31]。关于COR15a 蛋白的功能,Thalhammer等认为在低温冷冻过程中,随着温度的降低,植物细胞膜之间紧密连接,引起 COR15a蛋白部分折叠成α-螺旋,通过与稳定在叶绿体膜上MGDG分子的H-键相互作用,维持并稳定低温冷冻过程中的细胞膜完整性,减少电解质泄漏,从而提高植株的抗寒性[32]。
随着基因工程技术的发展,通过对不同物种CBF低温响应途径中关键基因进行分离鉴定,构建多价表达载体,通过共转化,使植株获得更高的抗寒性。尤其是对定向改良冷敏感的植物如水稻、番茄等具有积极的指导意义。
4 结 论
克隆获得LaCBF3及LaCOR15a核心片段并对其在逆境胁迫下的表达情况进行了分析,结果表明LaCBF3仅响应低温胁迫,干旱、高盐、外源ABA等不能诱导其表达,推测LaCBF3可能通过不依赖于ABA的途径响应低温胁迫。LaCOR15a对干旱、低温、高盐、外源ABA等非生物胁迫均有响应,其在独行菜响应非生物胁迫过程中均具有重要作用。
参考文献(References)
[1] 赵慧, 赵一博, 郭江波,等. 植物耐受低温胁迫研究进展[J]. 种子, 2017, 36(5): 47-50.
ZHAO Hui, ZHAO Yi-bo, GUO Jiang-bo, et al. (2017). Research Progress of Plant Under Low Temperature Stress [J].Seed, 36(5): 47-50. (in Chinese)
[2] Jaglo-Ottosen, K. R., Gilmour, S. J., Zarka, D. G., Schabenberger, O., & Thomashow, M. F. (1998). Arabidopsis cbf1 overexpression induces cor genes and enhances freezing tolerance.Science, 280(5360): 104-106.
[3] Weiser, C. J. (1970). Cold resistance and injury in woody plants. Science, 169(3952): 1,269-1,278.
[4] Guy, C. L., Niemi, K. J., & Brambl, R. (1985). Altered gene expression during cold acclimation of spinach.ProcNatlAcadSciUSA, 82(11): 3,673-3,677.
[5] 霍晨敏, 汤文强. 植物低温信号传导机制研究进展[J]. 生物技术通报, 2016, 32(10):27-33.
HUO Chen-min, TANG Wen-qiang. (2016). A Review of Plant Cold Signal Transduction Mechanisms [J].BiotechnologyBulletin, 32(10): 27-33. (in Chinese)
[6] Thomashow, M. F. (1994). Arabidopsis thaliana as a model for studying mechanisms of plant cold tolerance.ColdSpringHarborMonographArchive, 27(10): 807-834.
[7] Artus, N. N., Uemura, M., Steponkus, P. L., Gilmour, S. J., Lin, C., & Thomashow, M. F. (1996). Constitutive expression of the cold-regulated arabidopsis thaliana cor15a gene affects both chloroplast and protoplast freezing?tolerance.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 93(23): 13,404-13,409.
[8] Eric J. Stockinger, Sarah?J. Gilmour, & Michael?F. Thomashow. (1997). Arabidopsis thaliana cbf1 encodes an ap2 domain-containing transcriptional activator that binds to the c-repeat/dre, a cis-acting dna regulatory element that stimulates transcription in response to low temperature and?water?deficit.ProcNatlAcadSciUsa, 94(3): 1,035-1,040.
[9] Chinnusamy, V., Ohta, M., Kanrar, S., Lee, B. H., Hong, X., & Agarwal, M., et al. (2003). Ice1: a regulator of cold-induced transcriptome and freezing tolerance in arabidopsis.GenesDev, 17(8):1,043-1,054.
[10] Liu, Q., Kasuga, M., Sakuma, Y., Abe, H., Miura, S., & Yamaguchishinozaki, K., et al. (1998). Two transcription factors, dreb1 and dreb2, with an erebp/ap2 dna binding domain separate two cellular signal transduction pathways in drought- and low-temperature-responsive gene expression, respectively, in arabidopsis.PlantCell, 10(8): 1,391-1,406.
[11] 王俊峰, 孔维国, 张煜,等. 植物抗寒基因表达调控研究进展[J]. 西北植物学报, 2012, 32(4):852-858.
WANG Jun-feng, KONG Wei-guo, ZHANG Yu, et al. (2012). Advance in Expression and Regulation of Cold-resistant Genes of Plants [J].ActaBotanicaBoreali-OccidentaliaSinica, 32(4): 852-858. (in Chinese)
[12] Jaglo-Ottosen, K. R., Gilmour, S. J., Zarka, D. G., Schabenberger, O., & Thomashow, M. F. (1998). Arabidopsis cbf1 overexpression induces cor genes and enhances freezing tolerance.Science, 280(5360): 104-106.
[13] White, T. C., Simmonds, D., Donaldson, P., & Singh, J. (1994). Regulation of bn115, a low-temperature-responsive gene from winter brassica napus.PlantPhysiology, 106(3): 917-928.
[14] Monroy, A. F., Castonguay, Y., Laberge, S., Sarhan, F., Vezina, L. P., & Dhindsa, R. S. (1993). A new cold-induced alfalfa gene is associated with enhanced hardening at subzero temperature.PlantPhysiology, 102(3): 873-879.
[15] Luo, X., Xiao, J., Wang, Z., Zhang, A., Tian, Y., & Wu, J. (2008). [overexpression of spinacia oleracea betaine aldehyde dehydrogenase (sobadh) gene confers the salt and cold tolerant in gossypium hirsutum l].ChineseJournalofBiotechnology, 24(8): 1,464-1,469.
[16] Zhou, M., Wu, L., Liang, J., Shen, C., & Lin, J. (2012). Expression analysis and functional characterization of a novel cold-responsive gene cbcor15a from capsella bursa-pastoris.MolecularBiologyReports, 39(5): 5,169-5,179.
[17] Dunn, M. A., Brown, K., Lightowlers, R., & Hughes, M. A. (1996). A low-temperature-responsive gene from barley encodes a protein with single-stranded nucleic acid-binding activity which is phosphorylated in vitro.PlantMolecularBiology, 30(5): 947-959.
[18] Tsuda, K., Tsvetanov, S., Takumi, S., Mori, N., Atanassov, A., & Nakamura, C. (2000). New members of a cold-responsive group-3 lea/rab-related cor gene familyfrom common wheat (triticum aestivum l.).Genes&GeneticSystems, 75(4):179-188.
[19]丁金鹏, 张娜, 李群. 独行菜属植物种子总蛋白4种提取方法的比较[J]. 新疆农业科学, 2017, 54(7):1 305-1 312.
DING Jin-peng, ZHANG Na, LI Qun. (2017). Comparative Study of Four Methods of Total Protein Extraction from Seeds of Two Species ofLepidiumPlants [J].XinjiangAgriculturalScience, 54(7):1,305-1,312. (in Chinese)
[20] 李文明, 辛建攀, 魏驰宇,等. 植物抗寒性研究进展[J]. 江苏农业科学, 2017, 45(12):6-11.
LI Wen-ming, XIN Jian-pan, WEI Chi-yu,et al. (2017). Research progress of plant cold resistance[J]. Jiangsu Agricultural Sciences,45(12):6-11.
[21] Zinn, K. E., Tuncozdemir, M., & Harper, J. F. (2010). Temperature stress and plant sexual reproduction: uncovering the weakest links.JournalofExperimentalBotany, 61(7): 1,959-1,968.
[22] 徐呈祥. 提高植物抗寒性的机理研究进展[J]. 生态学报, 2012, 32(24):7 966-7 980.
XU Cheng-xiang. (2012). Research progress on the mechanism of improving plant cold hardiness [J].ActaEcologicaSinica, 32(24): 7,966-7,980.(in Chinese)
[23] Medina, J., Bargues, M., Terol, J., P? Rez-Alonso, M., & Salinas, J. (1999). The arabidopsis cbf gene family is composed of three genes encoding ap2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration.PlantPhysiology, 119(2): 463-470.
[24] Daie, J., & Campbell, W. F. (1981). Response of tomato plants to stressful temperatures : increase in abscisic acid concentrations.PlantPhysiology, 67(1): 26-29.
[25] Liu, D., Li, W., Cheng, J., & Hou, L. (2014). Expression analysis and functional characterization of a cold-responsive gene cor15a, from arabidopsis thaliana.ActaPhysiologiaePlantarum, 36(9): 2,421-2,432.
[26] Thalhammer, A., Bryant, G., Sulpice, R., & Hincha, D. K. (2014). Disordered cold regulated15 proteins protect chloroplast membranes during freezing through binding and folding, but do not stabilize chloroplast enzymes in vivo.PlantPhysiology, 166(1): 190-201.
[27] Gilmour, S. J., Zarka, D. G., Stockinger, E. J., Salazar, M. P., Houghton, J. M., & Thomashow, M. F. (1998). Low temperature regulation of the arabidopsis CBF family of ap2 transcriptional activators as an early step in cold-induced cor gene expression.PlantJournal, 16(4): 433-442.
[28] Si, J., Wang, J. H., Zhang, L. J., Zhang, H., Liu, Y. J., & An, L. Z. (2009). Cbcor15, a cold-regulated gene from alpine chorispora bungeana, confers cold tolerance in transgenic tobacco.JournalofPlantBiology, 52(6): 593-601.
[29] Zhou, M., Wu, L., Liang, J., Shen, C., & Lin, J. (2012). Expression analysis and functional characterization of a novel cold-responsive gene cbcor15a from capsella bursa-pastoris.MolecularBiologyReports, 39(5): 5,169-5,179.
[30] Gilmour, S. J., Sebolt, A. M., Salazar, M. P., Everard, J. D., & Thomashow, M. F. (2000). Overexpression of the arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation.PlantPhysiology, 124(4): 1,854-1,865.
[31] Artus, N. N., Uemura, M., Steponkus, P. L., Gilmour, S. J., Lin, C., & Thomashow, M. F. (1996). Constitutive expression of the cold-regulated arabidopsis thaliana cor15a gene affects both chloroplast and protoplast freezing?tolerance.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 93(23): 13,404-13,409.
[32] Thalhammer, A., & Hincha, D. K. (2014). A mechanistic model of cor15 protein function in plant freezing tolerance: integration of structural and functional characteristics.PlantSignaling&Behavior, 9(12): e977722.
