玉米幼苗盐胁迫条件下的生理响应机制
2018-07-09陈勋基常晓春足木热木吐尔逊李建平郝晓燕高升旗黄全生
陈勋基,陈 果,常晓春,足木热木·吐尔逊,李建平,郝晓燕,高升旗,黄全生
(新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091)
0 引 言
【研究意义】盐碱对农作物栽培和产量的影响是多方面的。盐碱条件下,作物根系发育受到抑制,影响水分吸收,同时营养吸收及代谢造成阻滞,从而影响产量[1, 2]。玉米是全球最重要的粮食作物之一,盐胁迫是限制玉米生产的重要非生物逆境胁迫[3]。耐盐性状非常复杂,由多个调控网络组成,属于数量性状位点,在盐胁迫条件下,不同材料对胁迫的应答和适应机制很大差异[4]。玉米种质资源中拥有丰富的耐盐变异,不同种质资源对盐胁迫的应答具有明显差异[5],通过分析不同自交系和杂交种对盐胁迫的应答模式,对研究玉米耐盐机制以及遗传改良有着重要作用。玉米自交系和杂交种耐盐性鉴定对于选育耐盐玉米新品种具有重要意义。【前人研究进展】植物在受到盐胁迫后会表现出一些共同的应激反应。主要表现为细胞脱水,从而使细胞体积发生变化,细胞膜受损,细胞质外流到胞外空间[6]。细胞膨压的变化会产生大量的活性氧,从而被质膜上的一些通道识别和感受,激活细胞活性氧的信号[7]。通常中度的渗透和盐碱就可导致植物根、茎、叶生长阻滞。另外,盐胁迫的剂量也决定了对植物生长抑制程度及对下游不同调节物质的响应水平[8]。植物在经历盐胁迫后,主要分为根部和地上部分对盐碱的应答。植物根部在受到持续的干旱后,其根尖分生区向下伸长,促使其吸收更多水分[9];植物地上部分会迅速积累大量的可溶性物质,从而对其进行渗透调节[10]。同样,在盐胁迫条件下,植物通过增加根部表面积从而隔离对毒害离子的吸收[11]。在玉米自交系中也有大量对盐胁迫较为耐受的材料如GEMS46和对盐胁迫敏感的自交系如B73,大部分自交系属于轻度耐盐材料,不同学者对不同杂交种进行了耐盐生理研究,筛选了大量耐盐的杂交种[12]。【本研究切入点】对自交系耐盐性杂种优势研究还相对较少[13]。通过分析玉米自交系和杂交种对盐胁迫条件下的应答模式,研究胁迫条件下玉米关键生理指标的变化趋势,分析耐盐胁迫条件下自交系及其杂交种耐盐性,比较亲本和杂交种对渗透胁迫和盐离子毒害应答模式,确定稳定的耐盐鉴定条件。【拟解决的关键问题】分析玉米自交系和杂交种在盐胁迫条件下干重、鲜重、电导率变化和Na+、K+离子积累变化,研究典型自交系和杂交种对盐胁迫的应答速率,自交系和杂交种离子毒害机制,为选育、鉴定耐盐玉米自交系和杂交种选配提供理论支持。
1 材料与方法
1.1 材 料
玉米自交系B73和GEMS46种子为实验室保藏,B73хGEMS46 F1(以下简称BхG)为实验室配制的杂交种。成熟一致的玉米种子用10%次氯酸(v/v)钠漩涡震荡,表面消毒20 min,用无菌水冲6次后,将种子发芽纸上卷纸发芽,于28℃培养箱中暗培养48 h,选取长势一致的幼苗播在装有蛭石和营养土(1∶1)的花盆中,28℃,16 h 光照/8 h 黑暗条件下正常生长,隔3 d浇一次Hoagland营养液。
1.2 方 法
1.2.1 幼苗盐胁迫处理
幼苗长到3叶1心期时,对照和处理分别开始进行营养液和盐溶液处理。对照植株正常浇营养液,盐处理植株每隔2 d浇灌150 mmol的NaCl溶液,每次浇完后倒去多余的液体,确保花盆底部不积水。分别在盐处理开始第0、3、5和7 d,剪下地上部分茎叶用于测量各项生理指标。
1.2.2 幼苗Na+、K+离子含量测定
将幼苗从花盆中取出,清洗根部基质,置于85℃烘箱24 h,取出样品称重。将样品置于消化液(浓硝酸∶高氯酸=4∶1)中,马沸炉中175℃消化3 h。当液体变为清亮透明时,按照不同浓度稀释样品。稀释后的样品在原子吸收分光光度计上测定Na+、K+离子含量。
1.2.3 玉米叶片H2O2含量测定
称取玉米叶片0.5 g,置于液氮中迅速打磨样品,按材料与提取剂1∶1的比例加入4℃下预冷的丙酮,轻轻震荡混匀,离心机上3 000 r/min,离心10 min,吸取上清即为样品提取液。用移液管吸取样品提取液1 mL,按表中体积加入5%硫酸钛和浓氨水,待沉淀形成后3 000 r/min离心10 min,弃去上清液。沉淀用丙酮反复洗涤2~3次,去除植物色素。向洗涤后的沉淀中加入5 mL 2 mol/L的硫酸溶液,待完全溶解后,比色测定吸光值。植物组织中H2O2含量 (μmol/g Fw) =(C×Vt) / (FW×V1),式中:C:标准曲线上查得样品中H2O2浓度(μmol);Vt:样品提取液总体积(mL);V1:测定时用样品提取液体积(mL);FW:植物组织鲜重(g)。
1.2.4 玉米叶片电导率测定
将幼苗叶片在去离子水中浸泡冲洗3次,再将幼苗置于20 mL去离子水中的离心管,封口浸泡8 h,用电导仪测定电导率,将离心管在沸水中煮沸20 min,待离心管降至室温,再次测定总电导率。相对电导率计算公式为:相对电导率(RE)=渗出电导值/总电导值。
2 结果与分析
2.1 盐胁迫条件下干鲜重变化
玉米自交系和杂交种在收到盐胁迫处理之后,对胁迫表现出不同的耐受水平,前期主要表现为渗透胁迫,后期为离子毒害[14]。在高渗透胁迫下植株表现吸水困难,甚至失水。从植株鲜重变化可以看出在正常条件下,自交系B73和GEMS46鲜重随着时间推移鲜重不断增加,杂交种B×G鲜重增加量显著高于自交系。在盐胁迫处理下,杂交种和自交系鲜重都呈现下降趋势,B73下降最明显鲜重从3.94 g下降到2.92 g。杂交种B×G下降趋势较小,从处理前的4.21 g下降到3.64 g,说明盐胁迫处理后,造成渗透胁迫,B73作为敏感自交系对渗透胁迫应答比较明显,而杂交种对渗透胁迫适应能力较两个亲本更强。图1
同幼苗鲜重一样,植株干重变化可以看出在正常条件下,自交系B73和GEMS46干重随着时间推移鲜重不断增加,杂交种B×G干重增加量显著高于自交系。而在盐胁迫处理下,B73下降最明显,干重从1.88 g下降到1.13 g。杂交种B×G下降趋势较小,从处理前的2.23 g下降到1.64 g,说明盐胁迫处理后,幼苗生长发育受到阻滞,干物质积累减少,B×G杂交种由于表现出杂种优势,干物质积累能力较强,表现出对盐胁迫较强的适应能力。图2
2.2 盐胁迫条件下相对电导率变化
植株受到盐胁迫后使质膜的选择透性发生改变或丧失, 导致溶质外渗, 因而质膜的透性变化可显示细胞膜结构和功能的受损程度。研究表明, 正常培养条件下,自交系和杂交种电导率变化趋势不明显,而在盐胁迫条件下,随着胁迫时间的延长, 自交系和杂交种相对电导率都呈现增长趋势,B73电导率增加趋势非常明显,在处理第7 d后达到71%,GEMS46次之,杂交种增长趋势相对平缓,处理第7 d相对电导率为48%。B73在盐胁迫条件下,离子渗出较多,质膜受损严重,GEMS46离子渗出较轻,杂交种与自交系相比其离子渗出较低,从而表现出一定的耐盐性。 图3

图1 盐胁迫处理后植株鲜重
Fig.1 The fresh weight of seeding under salt stress

图2 盐胁迫处理后植株干重
Fig.2 Seedling dry weight after under salt stress

图3 植株相对电导率
Fig.3 Seedling relative electrical conductivity
2.3 盐胁迫条件下H2O2含量变化
自交系和杂交种经200 mmol NaCl胁迫后,叶片H2O2的含量变化明显。研究表明,在正常条件下,B73、GEMS46和B×G的H2O2含量差异不显著, 胁迫7 d后H2O2的含量变化明显,B73幼苗胁迫7 d后H2O2含量是正常条件下的2.4倍,GEMS46幼苗胁迫7 d后H2O2含量达到10.03 μmol/g,杂交种胁迫7 d后,H2O2含量达到9.11 μmol/g,其增长趋势较为平缓。在NaCl胁迫下,杂交种B×G和自交系GEMS46膜脂过氧化程度低于B73。自交系GEMS46在维持膜的功能具有突出优势。图4

图4 盐胁迫后植株H2O2含量
2.4 盐胁迫条件下Na+、K+离子含量变化
高浓度的Na+导致胞内K+、磷和有机溶质的外渗。于此同时,细胞K+/Na+比率下降,抑制胞质中的H+跨液泡膜运输,导致液泡碱化,进一步阻碍Na+在液泡内积累。研究表明,盐胁迫7 d后,自交系B73的Na+离子含量是正常对照的3.42倍,达到65 mg/g,杂交种B×G的Na+离子含量是正常对照的2.7倍,达到50 mg/g。在无盐胁迫下,K+和Na+含量在自交系和杂交种之间无显著差异。图5
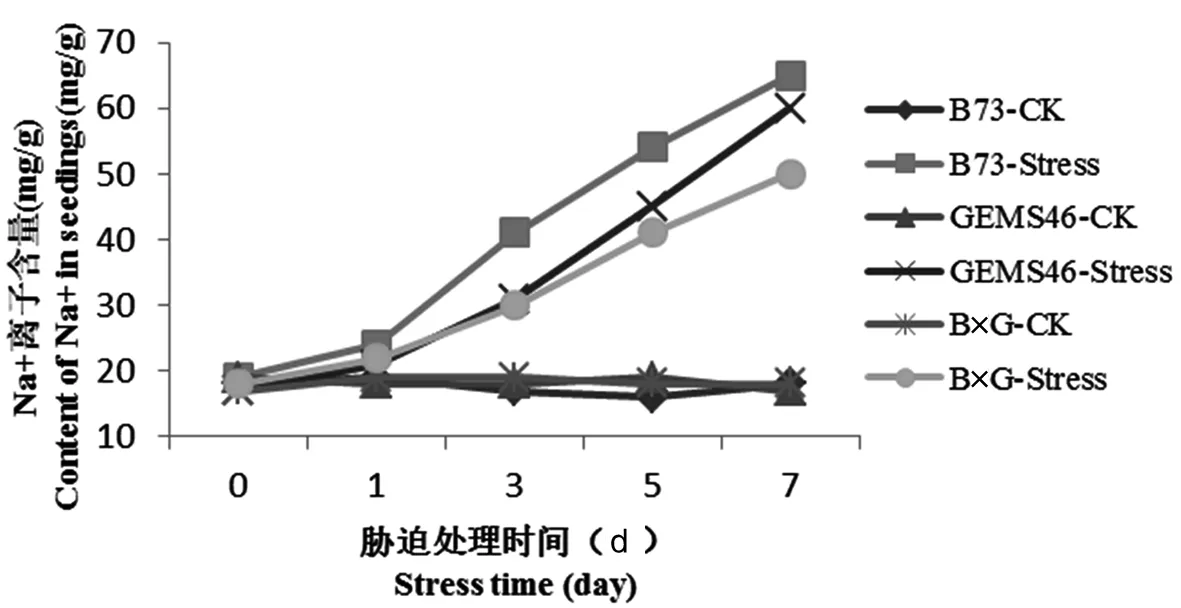
图5 植株叶片Na+离子含量
胁迫处理7 d后,B73的K+离子含量从58 mg/g下降到31 mg/g,GEMS46从54 mg/g下降到36 mg/g,而杂交种在盐胁迫下B×G的K+离子含量从55下降到39 mg/g,下降趋势较自交系更为平缓。杂交种和自交系在Na+和K+含量以及K/Na比存在显著差异。图6

图6 植株叶片K+离子含量
3 讨 论
盐胁迫可以导致水分亏缺,从而影响植物的代谢过程,这一过程是一个连续变化的过程[15]。在低盐胁迫下,玉米幼苗鲜重和干重并没有明显的变化。当较高浓度NaCl持续胁迫处理后,幼苗植株生长量受到抑制,干物质积累减少[15-18]。试验中,选用前期鉴定的盐敏感自交系B73和相对耐盐自交系GEMS46为亲本,同时配制B×G杂交种进行比较,B73在150 mmol/L NaCl处理后第3 d就表现为盐敏感,而GEMS46为相对耐盐自交系,它及其杂交种在150 mmol/L NaCl 处理5~7 d表现出盐离子毒害,不同品种在不同自交系和杂交种的耐盐启动机制及应对策略可能存在差异[18]。在玉米幼苗第15 d(3叶1心)时,生长发育迅速、生长势较强,外源的非生物胁迫对其这一发育时期影响较大[19],由此可知在玉米3叶1心期是玉米对盐分较为敏感时期,这一时期150 mmol/L NaCl即可造成盐离子毒害。
玉米的耐盐性是受多基因控制,能够反映耐盐性的生理指标和形态指标有很多[13, 20]。经过持续的盐胁迫处理后,幼苗生长随着胁迫处理加剧,植株膜系统受到损伤,导致离子外泄,而在植株体内Na+离子富集产生离子毒害并引起体内营养水平失衡而造成幼苗生长受到严重抑制[20]。同时,植株活性氧迅速增加,植株生长被完全抑制,造成严重的叶缘焦枯[21]。单一浓度或单一指标并不能对植物耐盐性进行全面、有效的评价,综合几个浓度和几个指标进行评价是必要的[22]。盐处理后地上鲜重、地上干重、和Na+、K+离子含量的指标与玉米耐盐性综合评价结果显著相关[23]。研究利用鲜重、干重、相对电导率、H2O2含量、Na+、K+离子含量作为衡量耐盐性指标,对自交系和杂交种进行了耐盐性综合评价,为有效筛选玉米耐盐性鉴定指标提供了依据。该方法具有操作性强、周期短、操作简单、效率高等优点,且鉴定结果较准确,适宜大量材料的耐盐性筛选。可作为玉米苗期耐盐鉴定的首选指标,这与前人的研究结果一致[24]。
选用高耐盐自交系为亲本材料,通过轮回改良方式来改良敏感自交系的方法是可行的,研究中,B73是相对盐敏感自交系,由于其对盐离子胁迫响应不如高抗自交系,其体内Na+、K+离子积累较多,而杂交种和另一亲本GEMS46对离子毒害响应较快,Na+、K+离子积累较少,说明其耐盐性贡献主要来自于耐盐亲本。自交系的耐盐性强,则组配的玉米杂交种耐盐性也较强,这与前人的研究结果基本一致[25]。近年来,许多玉米育种家对玉米耐盐性进行了深入的研究,也取得了一定的进展。但是,我国玉米资源相对还比较匮乏,影响了耐盐种质研究。随着分子测序技术应用,越来越多的功能基因被发现,这将有利于从功能基因组方面对耐盐性进行挖掘和利用。进而通过基因编辑手段应用到玉米遗传改良中,这必将为高效耐盐玉米的培育和玉米高产、稳产新品种选育提供理论基础。
4 结 论
在3叶1心时用盐处理玉米幼苗,连续处理第5 d后植株耐盐性差异较为显著,150 mmol/L NaCl处理植株是一个比较合理浓度;利用盐胁迫后植株的鲜重和干重以及植株Na+、K+离子含量是衡量植株耐盐性的较好的指标。在盐处理后,耐盐自交系的相对电导率、H2O2含量与杂交种变化趋势相同,耐盐自交系和杂交种对盐胁迫的响应较快,植株体内积累Na+离子较小,K+/Na+比例变化范围较小,说明杂交种的耐盐性主要贡献来自于耐盐自交系。自交系的耐盐性,选择耐盐自交系作为亲本,配制杂交组合是选育耐盐玉米新品种的必要方法。
参考文献(References)
[1] 杨晓杰, 李旭业, 王海艳, 等. 玉米自交系耐盐种质的筛选及耐盐性评价[J]. 玉米科学, 2014,22(4):19-25.
YANG Xiao-jie, LI Xu-ye, WANG Hai-yan. (2014). Screening of Maize Inbred LIne Varieties with Salt Tolearance and the Evaluation [J].JournalofMaizeSciences, 22(4):19-25. (in Chinese)
[2]Dorothea Bartels, & Ramanjulu Sunkar. (2005). Drought and salt tolerance in plants.CriticalReviewsinPlantSciences, 24(1):23-58.
[3]冯艳, 周蓉, 付蓉, 等. 玉米遗传多样性分析及耐盐种质筛选[J]. 江苏农业科学, 2015,43(7):59-61.
FENG Yan, ZHOU Rong, FU Rong, et al. (2015). Genetic Diversity Analysis of Maize and screening of Salt-tolerant Germplasm (2015). [J].JiangsuAgriculturalSciences, 43(7):59-61. (in Chinese)
[4]雷震, 裴玉贺, 赵美爱, 等. 盐胁迫下玉米叶片差异蛋白的双向电泳分析[J]. 玉米科学, 2013, 21(3):82-86.
LEI Zhen, PEI Yu-he, ZHAO Mei-ai, et al. (2013). Analysis of soluble maize leaf proteins under salinity stress by two-demensional electronphoresis [J].JournalofMaizeSciences, 21(3):82-86. (in Chinese)
[5]Benke, A., Urbany, C., Marsian, J., Shi, R., Nv, W., & Stich, B. (2014). The genetic basis of natural variation for iron homeostasis in the maize ibm population.BmcPlantBiology, 14(1): 12.
[6]杨爱芳, 张可炜, 尹小燕, 等. 转基因耐盐玉米自交系的农艺性状及杂种优势表现的分析[J]. 中国农业科学, 2007,(12):2 895-2 902.
YANG Ai-fang, ZHANG Ke-wei, YIN Xiao-yan, et al. (2007). Agronomic Traits and Combining Ability Analysis of Salt Enduring Transgenic Maize [J].ScientiaAgriculturaSinica, (12):2,895-2,902. (in Chinese)
[7] Blumwald, E. (2000). Sodium transport and salt tolerance in plants.CurrentOpinioninCellBiology, 12(4): 431-434.
[8]Fujita, M., Fujita, Y., Noutoshi, Y., Takahashi, F., Narusaka, Y., & Yamaguchishinozaki, K., et al. (2006). Crosstalk between abiotic and biotic stress responses: a current view from the points of convergence in the stress signaling networks.CurrentOpinioninPlantBiology, 9(4): 436-442.
[9]李慧. 玉米盐胁迫下组蛋白乙酰化介导的细胞壁相关基因的表达与功能[D]. 武汉大学, 2014.
Li Hui. (2014). Histone acetylation mediated expression of the cell wall related genes is involved in maize salt stress response[D].Wuhan University.(in Chinese)
[10]贾丹莉, 杨治平, 郭军玲, 等. 6种玉米品种耐盐性筛选[J]. 中国农学通报, 2017,33(11):1-8.
JIA Dan-li, YANG Zhi-ping, GUO Jun-ling, et al. (2017). Salt Tolerance Screening of Six Maize Varieties [J].ChineseAgriculturalScienceBulletin, 33(11):1-8. (in Chinese)
[11]李亮, 高明波, 于清涛. 耐盐玉米自交系的鉴定[J]. 黑龙江农业科学, 2017,(2):14-17.
LI Liang, GAO Ming-bo, YU Qing-tao. (2017). Salt Tolerance Identification of Maize Inbred Lines [J].HelongjiangAgriculturalSciences, (2):14-17. (in Chinese)
[12]陈阳松. 玉米苗期耐盐性全基因组关联分析[D]. 北京:中国农业科学院硕士学位论文, 2017.
CHEN Yang-song. (2017).Commonwideassociationstudyofsalttoleranceatmaizeseedlingstage[D]. Master Dissertation. Chinese Academy of Agriculutlral Sciences, Beijing. (in Chinese)
[13]刘春荣, 张国新, 王秀萍. 主成分分析及隶属函数法综合评价玉米苗期耐盐性[J]. 安徽农业科学, 2015,(28):13-14.
LIU Chun-rong, ZHANG Guo-xin, WANG Xiu-ping. (2015). Principal Component Analysis and Membership Function Method to Evaluate Salt Tolerance in Seedling Stage of Corn [J].JournalofAnhuiAgriculturalSciences, (28): 13-14. (in Chinese)
[14]张红雪, 史振声. 玉米耐盐性研究进展[J]. 种子, 2015,34(10):47-51.
ZHANG Hong-xue, SHI Zhen-sheng. (2015). Research Progress of Maize Salt Tolerance [J].Seed, 34(10):47-51. (in Chinese)
[15]Farooq, M., Hussain, M., Wakeel, A., & Siddique, K. H. M. (2015). Salt stress in maize: effects, resistance mechanisms, and management. a review.AgronomyforSustainableDevelopment, 35(2):461-481.
[16]姚正培, 孟君, 李冠. 玉米自交系芽苗期耐盐性的鉴定与筛选[J]. 华北农学报, 2007, (5):27-30.
YAO Zheng-pei, MENG Jun, LI Guan. (2007). Salinity Tolerance Identification and Screening of Maize Inbreeds in Seedling Emergence Stage [J].ActaAgriculturaeBoreali-Sinica, (5):27-30. (in Chinese)
[17]Galvanampudia, C. S., & Testerink, C. (2011). Salt stress signals shape the plant root.CurrentOpinioninPlantBiology, 14(3): 296-302.
[18]Zhu, J. K. (2002). Salt and drought stress signal transduction in plants.AnnualReviewofPlantBiology, 53(53): 247-273.
[19]Gruwel, M. L. H., Rauw, V. L., Loewen, M., & Abrams, S. R. (2001). Effects of sodium chloride on plant cells; a 31 p and 23 na nmr system to study salt tolerance.PlantScience, 160(5): 785-794.
[20]Golldack, D., Lüking, I., & Yang, O. (2011). Plant tolerance to drought and salinity: stress regulating transcription factors and their functional significance in the cellular transcriptional network.PlantCellReports,30(8):1,383-1,391.
[21]Shabala, S., & Cuin, T. A. (2008). Potassium transport and plant salt tolerance.PhysiologiaPlantarum, 133(4): 651-669.
[22]Agarie, S., & Cushman, J. C. (2007). Salt tolerance, salt accumulation, and ionic homeostasis in an epidermal bladder-cell-less mutant of the common ice plant mesembryanthemum crystallinum.JournalofExperimentalBotany, 58(8):1,957-1,967.
[23]刘学, 周璇, 曾兴, 等. 玉米芽期和苗期耐盐性鉴定方法的比较分析[J]. 玉米科学, 2015, 23(1):115-121.
LIU Xue, ZHOU Xuan, ZENG Xing, et al. 2015). Comparison of identification method of maize salt tolerance in Germination and seedling state [J].JournalofMaizeSciences, 23(1):115-121. (in Chinese)
[24]杜锦. 盐胁迫下不同基因型玉米的生物学特性及其遗传规律的研究[D]. 天津:天津农学院, 2010.
Du Jing.(2010).Study on Biological Characteristics and Genetic Regularity of Different Genotypes Maize(Zea mays L.) under salt stress[D].Tianjin Agricultural University. (in Chinese)
[25]商学芳. 不同基因型玉米对盐胁迫的敏感性及耐盐机理研究[D]. 济南:山东农业大学, 2007.
Shang Xue-fang. (2007). Study on Sensitivity of Salt Stress and Salt-Tolerant Mechanism of Different Genotypes Maize (Zea mays L.). Shangdong Agricultural University. (in Chinese)
