体重指数对腹腔镜全直肠系膜切除术直肠癌患者疗效及预后的影响分析*
2018-07-07杨文斌
杨文斌 李 龙 杨 恒
(江油市九〇三医院普外科 四川绵阳 621700)
腹腔镜全直肠系膜切除术(total mesorectal excision,TME)微创特点已得到临床认可,其在直肠癌中的可行性与安全性已有报道[1-2],其已为临床直肠癌根治术的主要术式之一。有资料显示,肥胖是多种慢性疾病的危险因素[3],而超重的直肠癌患者因内脏脂肪沉积,增加手术难度,可能造成淋巴结清扫不彻底和医源性损伤,影响手术疗效,但目前临床有关不同体重指数患者TME术后恢复的报道较为少见。本研究纳入本院228例不同体重指数直肠癌患者作为研究对象,探讨不同体重指数患者TME术后恢复和预后,现报告如下。
1 资料与方法
1.1 一般资料 纳入2011年7月至2014年7月于本院接受TME的228例直肠癌患者作为研究对象,开展前瞻性对比研究。纳入标准:(1)参照AJCC(第7版)肿瘤分期标准[4],所有患者术前均经结肠镜取组织病理活检确诊为直肠癌;(2)均接受TME根治术;(3)患者均签署知情同意书;(4)所有手术均由同一组医师完成。排除标准:(1)有精神疾病史或不能有效配合者;(2)严重的肝肾功能不全者;(3)术前肿瘤已发生远处转移或广泛性粘连者;(4)因肠穿孔或急性肠梗阻需急诊手术者。本研究经本院伦理委员会批准,根据国际生命科学学会中国肥胖问题工作组推荐体重指数(body mass index,BMI)分级标准[5],将228例患者分为消瘦组 (BMI<18.5 kg/m2)48例,其中男性 22 例,女性 26 例;年龄(49.38±7.36)岁;术前临床分期:Ⅰ期24例,Ⅱ期14例,Ⅲ期10例;分化程度:高分化18例,中分化20例,低分化10例;(取术前MRI矢状面图像测量)肿瘤下缘距肛缘距离(7.22±2.36) cm。 体重正常组 (18.5 kg/m2≤BMI<24 kg/m2)60例,其中男性34例,女性26例;年龄(51.37±6.68)岁;术前临床分期:Ⅰ期 25 例,Ⅱ期 17例,Ⅲ期18例;分化程度:高分化26例,中分化21例,低分化 13例;肿瘤距肛缘距离(6.98±2.56)cm。超重组 (24 kg/m2≤BMI<28 kg/m2)53 例, 其中男性33 例,女性 20 例;年龄(50.33±7.12)岁;术前临床分期:Ⅰ期20例,Ⅱ期21例,Ⅲ期12例;分化程度:高分化18例,中分化21例,低分化14例;肿瘤下缘距肛缘距离(7.31±2.09) cm。 肥胖组(BMI≥28 kg/m2)67例,其中男性35例,女性32例;年龄 (49.68±7.22)岁;分期:Ⅰ期23例,Ⅱ期25例,Ⅲ期19例;分化程度:高分化28例,中分化21例,低分化18例;肿瘤距肛缘距离(7.15±2.11)cm。四组患者性别、年龄、肿瘤部位、分期及分化程度差异均无统计学意义(均 P > 0.05)。
1.2 手术方法 行气管插管静脉复合全身麻醉,患者取头低脚高膀胱截石位,在脐孔、左右脐旁腹直肌外缘及右锁骨中线与髂前上棘连续交点处 (右下腹)戳孔,在脐部戳孔处置入腹腔镜作为观察孔,在右下腹孔置入Trocar作为主操作孔。首先分离乙状结肠系膜外侧粘连,沿肾前筋膜和Toldt’s筋膜间隙向内上分离至左髂血管,暴露肠系膜下动静脉,清扫根部淋巴结,结扎肠系膜下动脉及其伴行静脉。再对骶前间隙进行锐性分离,向两侧盆壁扩展,并逐步切开至腹膜反折。然后切开直肠前腹膜反折,沿邓氏筋膜向下分离,男性患者达前列腺上缘后横断邓氏筋膜,再沿其下间隙继续分离,女性可在直肠生殖膈平面进行分离。对于直肠肿瘤下缘距提肛肌平面<1 cm患者,沿提肛肌裂孔边缘分离直肠系膜和耻骨直肠肌,裸化直肠,在肿瘤下2~5 cm处用腹腔镜切割缝合器切断直肠,肿瘤上缘10~12 cm处切断乙状结肠,延长左下腹处切口至4 cm,移除标本,腹腔镜直视下做乙状结肠直肠端-端吻合。
1.3 观察指标 (1)记录四组患者手术时间、术中出血量、中转开腹、淋巴结清扫数目、术后肛门首次排气时间、经流质饮食时间及住院时间等手术基本情况。(2)记录术后住院期间并发症发生情况,术后即进入随访,院外通过电话(每周1次)和入院复诊(每3~6个月1次)形式开展随访,记录四组术后3年无瘤生存情况和总生存情况,无瘤生存时间指手术结束至发生复发、转移时的时间。
1.4 统计学方法 选用SPSS 19.0统计学软件对数据进行处理。计量资料以()表示,多组间比较采用方差分析,两两比较采用t检验;计数资料以[n(%)]表示,组间比较行 χ2检验或 Fisher算法。以p<0.05为差异有统计学意义。
2 结 果
2.1 四组手术相关情况比较 四组术中中转开腹的例数分别为0例、1例、1例及2例,其中2例患者因肿瘤周围组织有慢性纤维化和水肿造成解剖层次不清而开腹,1例因高碳酸血症术中对症处理无效改为开腹手术,1例患者术中出现严重骶前静脉丛出血而改为开腹手术,四组间中转开腹发生率差异无统计学意义(P=0.907)。四组间手术时间、术中出血量及淋巴结清扫数目差异均有统计学意义 (均p<0.05),四组间术后首次肛门排气时间、进流质饮食时间及住院时间差异均无统计学意义(均P>0.05)。超重组和肥胖组术中出血量多于消瘦组和正常组 (均p<0.05),消瘦组手术时间短于超重和肥胖组(p<0.05),肥胖组淋巴结清扫数目少于正常组 (p<0.05)。见表 1。
表1 四组手术基本情况比较()
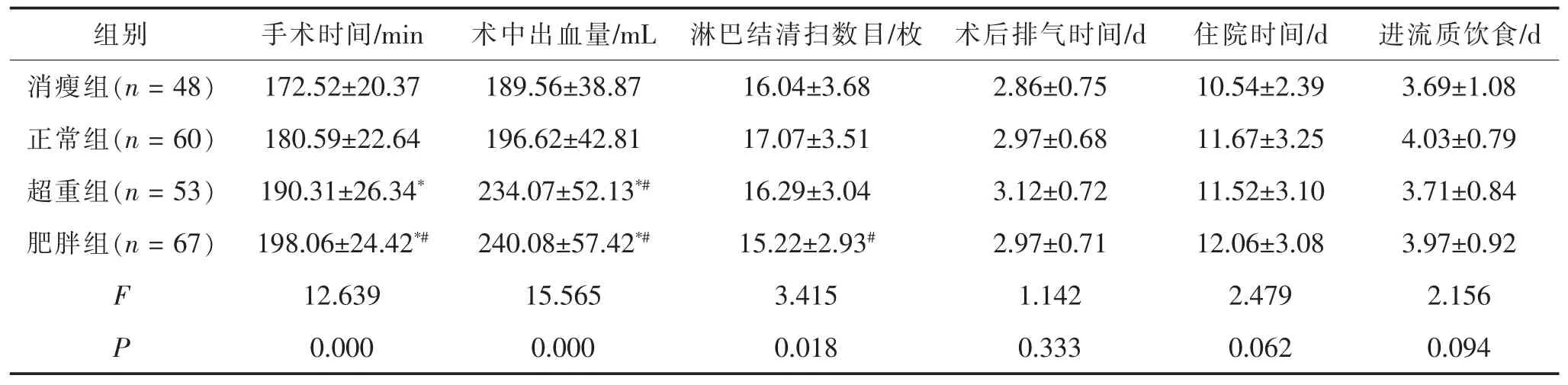
表1 四组手术基本情况比较()
与消瘦组比较,*p<0.05;与正常组比较,#p<0.05。
组别 手术时间/min 术中出血量/mL 淋巴结清扫数目/枚 术后排气时间/d 住院时间/d 进流质饮食/d消瘦组(n=48) 172.52±20.37 189.56±38.87 16.04±3.68 2.86±0.75 10.54±2.39 3.69±1.08正常组(n=60) 180.59±22.64 196.62±42.81 17.07±3.51 2.97±0.68 11.67±3.25 4.03±0.79超重组(n=53) 190.31±26.34* 234.07±52.13*# 16.29±3.04 3.12±0.72 11.52±3.10 3.71±0.84肥胖组(n=67) 198.06±24.42*# 240.08±57.42*# 15.22±2.93# 2.97±0.71 12.06±3.08 3.97±0.92 F 12.639 15.565 3.415 1.142 2.479 2.156 P 0.000 0.000 0.018 0.333 0.062 0.094
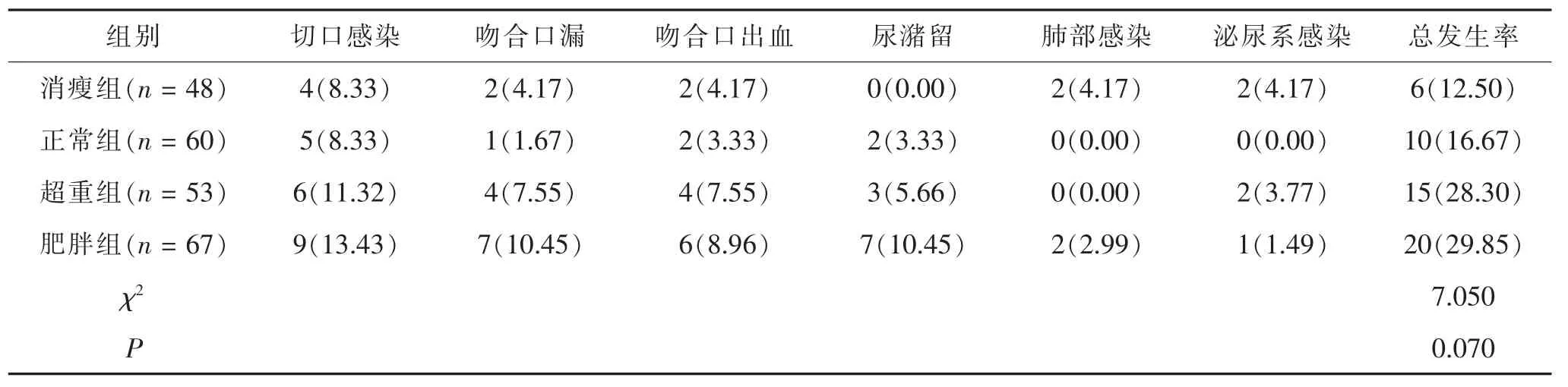
表2 四组术后并发症比较[n(%)]
2.2 四组术后并发症比较 消瘦组住院期间6例患者有并发症,发生率12.5%,4例切口感染(其中2例合并泌尿系感染),2例肺部感染,另2例吻合口漏合并吻合口出血。体重正常组住院期间10例患者有并发症,发生率16.67%,5例切口感染,2例尿潴留,2例吻合口出血,1例吻合口瘘。超重组住院期间15例患者有并发症,发生率28.30%,6例切口感染,2例泌尿系感染,3例尿潴留,4例吻合口漏合并吻合口出血。肥胖组住院期间20例患者有并发症,发生率29.85%,9例切口感染 (其中1例合并泌尿系感染),另7例吻合口漏(其中6例合并吻合口出血、5例合并尿潴留),2例患者肺部感染,2例尿潴留。四组间并发症总发生率差异无统计学意义(P>0.05)。见表2。
2.3 四组预后比较 消瘦组失访1例,肿瘤进展9例,死亡5例(其中3例死于局部复发,2例死于肝转移)。体重正常组失访2例,肿瘤进展11例,死亡6例(其中4例死于局部复发,1例死于肝转移,1例死于肺转移)。超重组1例失访,肿瘤进展10例,死亡6例 (其中5例死于局部复发,1例因多器官功能衰竭死亡)。肥胖组失访1例,肿瘤进展13例,死亡7例(其中4例死于局部复发,3例死于肝转移)。四组患者无瘤生存率和总生存率差异均无统计学意义(χ2=0.037、0.033,均 P=0.998)。
3 讨 论
肥胖与直肠癌关系密切,Morikawa等[6]研究发现肥胖的直肠癌患者CTNNB1信号通路失调风险更高,加快了肿瘤进展。此外,在TME手术过程中,因肥胖患者内脏脂质沉积,影响系膜分离时操作视野,可能造成淋巴结清扫不彻底,成为术后复发率增加的诱因,缩短无瘤生存时间,降低患者生活质量[7]。朱勇等[8]还认为超重直肠癌患者TME后更易发生切口脂肪液化和皮下积液,这可能增加切口感染率,延长切口愈合时间,影响术后康复时间。本研究分析不同BMI组别患者手术相关指标及并发症发生情况,但结果显示四组术后恢复指标及并发症总发生率方面均未见差异,仅在手术时间、术中出血量及淋巴结清扫数目方面存在差异。
杜晓辉等[9]认为完善TME学习曲线,掌握解剖层次是手术成功的关键,随着术者手术经验的积累,在达到彻底清扫淋巴结目的的同时,能逐渐减少医源性损伤,减少出血量。而在本研究的手术均由同一组医师完成,肥胖和超重组术中出血量和手术时间多于正常组,这可能是因超重和肥胖患者大量内脏脂质沉积,影响手术操作,增加裸化直肠癌肿瘤病灶的难度[10-11],TME术中需仔细辨认血管和神经,对结直肠及其周围组织反复翻扯牵拉,进而增加出血量,延长手术时间。此外,肥胖组和超重组患者出血量多,且肥胖组淋巴结清扫数目少于正常组,考虑与内脏脂质沉积程度有关,但另有报道称[12],体重并不影响淋巴结清扫效果,故认为这尚需要进行更大样本量的进一步研究。本研究中,肥胖组与消瘦组淋巴结清扫数目差异无统计学意义,这可能与样本量小有关,而结果提示消瘦者可获得与正常体重患者相近的淋巴结清扫效果。有报道指出[13],肥胖可能增加腹腔镜直肠癌患者中转开腹风险,与本文结果相左,这可能是因中转开腹受技术水平、病理分级等多因素影响[14],相信随着TME病例数的增加,腹腔镜操作更加熟练,中转开腹率和术后并发症或将随之降低。此外,本研究还发现四组间术后并发症总发生率、3年无瘤生存率和3年总生存率均无差异,提示体重差异并不影响术后并发症的发生和术后3年生存效益。Karahasanoglu等[15]研究发现不同体重的患者腹腔镜术后并发症发生情况无差异,本研究结果与之相符。
基于本研究,肥胖和超重直肠癌患者与消瘦患者相比,增加了TME手术时间和术中出血量,未见不同体重组间患者的术后恢复指标、术后并发症总发生率、3年无瘤生存率及3年总生存率存在差异。
[1] BONJER H J, DEIJEN C L, ABIS G A, et al.A randomized trial of laparoscopic versus open surgery for rectal cancer[J].New England Journal of Medicine,2015,373 (2):1324-1332.
[2]熊懿.腹腔镜直肠全系膜切除术治疗中、低位直肠癌的临床疗效分析[J].中国普通外科杂志,2015,24(4):616-618.
[3]毕建军,赵东兵,白晓枫,等.肥胖对直肠癌腹腔镜手术影响的分析[J].中国肿瘤临床与康复,2013,v.20(1):45-48.
[4] EDGE S B,COMPTON C C.The American Joint Committee onCancer:the7theditionoftheAJCCcancerstagingmanualand the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.
[5]中国肥胖问题工作组数据汇总分析协作组.我国成人体重指数和腰围对相关疾病危险因素异常的预测价值:适宜体重指数和腰围切点的研究[J].中华流行病学杂志,2002,23(1):5-10.
[6] MORIKAWA T, KUCHIBA A, LOCHHEAD P, et al.Prospective analysis of body mass index,physical activity and colorectal cancer risk associated with-catenin(CTNNB1) status[J].Cancer Research,2013,73(5):1600.
[7]张键,骆成玉,季晓昕,等.腹腔镜与开腹低位直肠癌全直肠系膜切除术的前瞻性随机对照研究[J].中国微创外科杂志,2012,12(1):27-29.
[8]朱勇,杨哲,张云,等.晚期可切除直肠癌手术后同步放化疗的疗效分析[J].中国肿瘤临床与康复,2014,18(1):68-70.
[9]杜晓辉,方国吉,宁宁,等.腹腔镜直肠癌全直肠系膜切除术的学习曲线研究[J].中华腔镜外科杂志:电子版,2013,6(1):12-14.
[10]曹金鹏,彭翔,邓建中,等.腹腔镜全直肠系膜切除术在肥胖直肠癌患者中的疗效评价[J].中国内镜杂志,2015,21(2):127-131.
[11]杨平,彭翔,邓建中,等.直肠癌新辅助治疗后联合腹腔镜下全直肠系膜切除术 44 例[J].广东医学,2012,33(17):2586-2590.
[12]李艺业,吴伟,罗奎.腹腔镜直肠癌根治术与传统开腹手术近期疗效的对比研究[J].结直肠肛门外科,2013,19(6):373-375.
[13]钟武,张磊昌,钟世彪,等.腹腔镜辅助直肠癌手术中转开腹的危险因素分析及预测模型建立[J].中国全科医学,2014,23(30):3545-3549.
[14]王永鹏,佟昕,张庆彤,等.腹腔镜直肠癌前切除术中转开腹影响因素的多因素分析[J].中国微创外科杂志,2016,16(8):694-697.
[15] KARAHASANOGLU T, HAMZAOGLU I, BACA B, et al.Robotic surgery for rectal cancer:initial experience from 30 consecutive patients[J].Journal of Gastrointestinal Surgery,2012,16(2):401-407.
