猪粪中温和高温厌氧发酵沼液对微藻培养的影响
2018-07-07王丽丽司爱龙WANGZhiwu王忠江
王丽丽 司爱龙 李 泽 WANG Zhiwu 隋 超 王忠江
(1.东北农业大学工程学院, 哈尔滨 150030; 2.弗吉尼亚理工学院暨州立大学土木环境工程系, 黑堡 VA 24061)
0 引言
微藻生物质与其他陆生生物质资源相比,具有光合作用效率高、生长速度快、不占耕地、产品附加值高等优点[1-2],近年来得到广泛关注。但微藻培养过程需要向培养液中添加大量的N、P等营养元素[3-4],极大地增加了微藻培养的成本[5],制约了微藻培养产业的发展。近年来大中型沼气工程在我国得到了迅速推广,这些沼气工程基本采用湿式厌氧发酵工艺,在产生新能源沼气的同时也产生了大量的沼液废水[6-8],而这些沼液富含浓度较高的有机物和N、P等营养成分以及种类繁多的微生物等[9-11],处置不当将会对环境造成威胁[12-13],因此沼液利用途径及利用量的拓展引起研究者的关注。如将沼气厌氧发酵后富含N、P等营养成分的沼液作为微藻培养的营养液,在一定程度上可以解决沼液的处置问题[14-17],还可以降低微藻培养过程中补充氮源和磷源的成本[18-19]。
微藻在培养过程中容易受到杂菌污染[20]。沼气发酵的原料种类众多,不同发酵原料沼气发酵后的沼液成分差别较大,如畜禽的食物及消化道内存在的大量病原微生物在畜禽粪便中大量残留,此外由于目前规模化养殖场中各种化学添加剂的滥用,也使相对较多的重金属残留在畜禽粪便中,以这些畜禽废弃物为原料进行沼气发酵产生的沼液中存在大量的病原微生物等杂菌及重金属[6],容易对微藻产生污染,所以在前期研究中很多学者[21-22]均将沼液灭菌后再进行微藻的培养试验,进而增大了微藻培养成本,影响微藻产业的后续应用和推广。
此外,目前大规模工业化生产的沼气工程普遍采用的是35℃的中温厌氧发酵和55℃的高温厌氧发酵工艺。与35℃的中温厌氧发酵工艺相比,55℃的高温厌氧发酵工艺不但对沼气发酵过程影响显著,而且由于高温厌氧发酵的灭菌效果更为明显,对厌氧发酵后的沼液特性也有显著影响,经55℃高温厌氧发酵后获得的沼液中各种病原菌的数量明显低于35℃中温厌氧发酵[23-24]。所以,中温厌氧发酵和高温厌氧发酵后沼液作为微藻培养的营养源,会对后续的微藻生长产生影响。而目前利用高温发酵沼液进行微藻培养方面的研究鲜见报道,关于中温发酵沼液和高温发酵沼液用于微藻培养的系统性对比研究未见报道。
本文针对以上问题,以猪粪中温35℃和高温55℃厌氧发酵后的沼液为原料,在灭菌和不灭菌的条件下,系统研究不同沼液对微藻培养过程各主要指标的影响规律。
1 材料与方法
1.1 材料
1.1.1沼液及预处理
试验采用的沼液取自东北农业大学生物质能源实验室,沼气发酵的原料为猪粪,发酵时间为30 d,35℃中温厌氧发酵后未固液分离沼液的初始化学需氧量(COD值)为4 861.28 mg/L,pH值为7.88,总氮质量浓度为2 652.53 mg/L,总磷质量浓度为52.61 mg/L,氨氮质量浓度为2 229.19 mg/L,Cu2+质量浓度为0.79 mg/L,Fe2+质量浓度为1.42 mg/L,Zn2+质量浓度为0.40 mg/L,浊度为1 024 NTU;55℃高温厌氧发酵后未固液分离沼液的初始化学需氧量(COD值)为5 029.95 mg/L,pH值为7.86,总氮质量浓度为2 833.73 mg/L,总磷质量浓度为49.25 mg/L,氨氮质量浓度为2 328.76 mg/L,Cu2+质量浓度为0.77 mg/L,Fe2+质量浓度为1.38 mg/L,Zn2+质量浓度为0.39 mg/L,浊度为978 NTU。沼气发酵后的剩余物经孔径0.075 mm尼龙标准筛去除大颗粒物,之后利用3-30K型高速离心机(德国Sigma公司)在10 000 r/min的条件下去除小颗粒物获得本试验所用沼液,之后储存于4℃冰箱内备用,试验前经不同处理的离心后沼液的相关指标如表1所示。
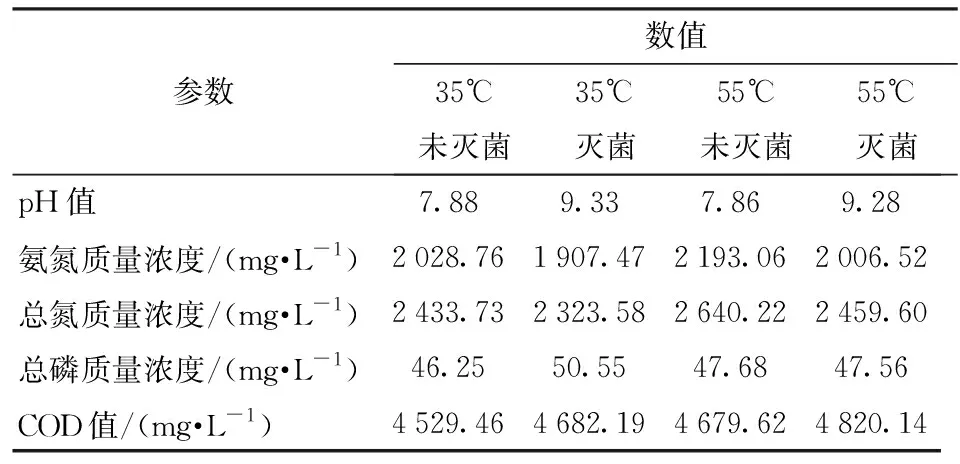
表1 沼液特性Tab.1 Characteristics of biogas slurry
1.1.2藻种
试验所用的藻种为蛋白核小球藻(Chlorellapyrenoidosa)与普通小球藻(Chlorellavulgaris),均由中国科学院水生生物研究所提供,藻种编号为FACHB-5(5号藻种)和FACHB-8(8号藻种)。
1.2 试验方法及条件
藻种采用沼液和BG11培养基的混合液进行培养,BG11培养基的配方见文献[25],猪粪沼液的添加量均为20%,试验采用的药品均为分析纯。利用OBY-Q600-SEI型人工气候培养箱(常州欧邦电子有限公司)进行微藻培养,培养温度为(26±1)℃,光照强度为4 000 lx,24 h连续光照,同时利用HG-180型旋涡式气泵(台湾亚士霸电机集团有限公司)向微藻培养液通入空气,通气量1.5 L/min,空气在进入培养液前经0.2 μm滤膜过滤。
试验容器为1 000 mL三角瓶,内装600 mL培养液,在未调节pH值条件下将对数期藻种各100 mL分别加入各组培养液中,每组2个重复,进行批式培养,培养周期为11 d,每天取样测680 nm处OD值(光密度)、pH值,每隔1 d取样,利用3-30K型高速离心机在10 000 r/min的条件下离心,之后测定上清液中氨氮质量浓度、总氮质量浓度、总磷质量浓度和COD值。
1.3 分析方法
生物量测定采用光密度法[26]。取小球藻藻液,用紫外可见分光光度计测定其在680 nm吸收波长下的OD值,以此衡量小球藻在培养过程中的相对生长量。原料沼液的浊度采用分光光度法测定680 nm下的吸光度[27-28],培养液的COD值测定采用重铬酸盐法,参照 GB 11914—1989《水质化学需氧量的测定重铬酸盐法》;总氮和氨氮采用凯氏定氮法测定[29],所用仪器为Kjeltec 2300型全自动凯氏定氮仪(丹麦FOSS公司 ),总磷测定采用钼酸铵分光光度法,参照GB 11893—1989《水质总磷的测定 钼酸铵分光光度法》[30]。采用OriginPro 9.32进行数据处理,采用SPSS 22.0进行差异显著性分析。
2 结果与讨论
2.1 微藻生长
不同沼液对微藻生长的影响如图1所示。
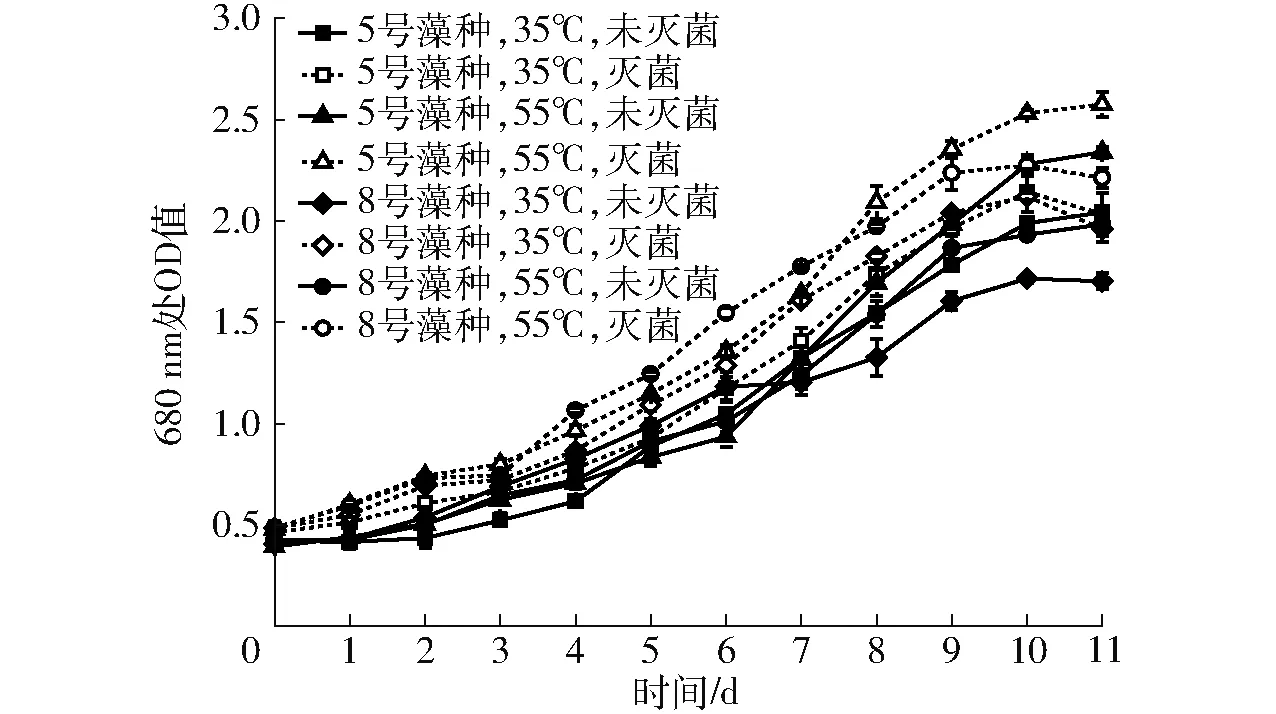
图1 微藻生长曲线Fig.1 Growth curves of microalgae
从图中可以看出,各试验组的整体变化规律基本一致,即在试验开始后前3 d的680 nm处OD值缓慢上升,从第4天开始各试验组的OD值开始快速上升,在第10天达到各自的较高值,之后逐渐趋于稳定。在本试验条件下,各试验组的微藻生长趋势符合生物学中的S型生长曲线,利用OriginPro软件拟合微藻生长曲线,经过不同S型函数的拟合结果,最终选择拟合度较高的DoseResp函数,各试验组拟合后的方程如表2所示,方程对各条曲线的拟合度均不低于0.984 6。从图中还可以看出,5号藻种和8号藻种在灭菌和未灭菌沼液中均能较好地生长,各试验组经短暂适应期后微藻的生长速率均出现较大的增加,各试验组的OD值均由试验开始时的0.40~0.48升高到1.93~2.57。此外灭菌试验组和未灭菌试验组在前期对沼液的适应性方面未表现出明显的优势,适应时间均为3 d,但灭菌各试验组680 nm处OD值均高于各自对应的未灭菌试验组,经显著性分析后差异达到极显著水平(P<0.01),这说明灭菌试验组的微藻生长速率高于未灭菌试验组,但高温灭菌也将增加微藻的培养成本,不利于后续微藻的规模化培养。从图中还可以看出,在灭菌和未灭菌试验组中55℃厌氧发酵后沼液各试验组的整体表现均优于各自对应的35℃厌氧发酵后沼液试验组,经显著性分析后差异达到极显

表2 微藻生长曲线拟合方程Tab.2 Fitting equations of microalgae growth curves
著水平(P<0.01),这与许智等[23]的研究相对应,许智等通过研究发现在55℃厌氧发酵条件下经96 h对大肠杆菌的杀灭百分比达99%,而35℃厌氧发酵条件对大肠杆菌基本没有杀灭作用,而本研究采用的是在55℃和35℃条件下经30 d厌氧发酵后获得的沼液,55℃厌氧发酵后沼液中大肠杆菌等杂菌的数量少于35℃厌氧发酵后沼液,对后续微藻培养过程的抑制作用更小,此外灭菌后的55℃高温厌氧发酵后沼液的氨氮和总氮质量浓度均略高于灭菌后的35℃高温厌氧发酵后沼液,所以才会出现55℃高温厌氧发酵沼液微藻培养组的整体表现优于35℃中温厌氧发酵沼液微藻培养组的现象。
2.2 微藻培养液pH值
不同沼液用于微藻培养时培养液的pH值变化如图2所示。

图2 pH值的变化Fig.2 Variation of pH value
从图中可以看出,各试验组的pH值变化规律基本一致,即试验开始后pH值先下降之后又逐渐上升,最后逐渐趋于稳定。这与霍书豪等[25]研究过程发现的pH值变化规律相一致,这是由于藻类在培养液中存在多种形态氮时,优先利用氨态氮[31],而藻细胞利用氨分子,使得培养液中H+浓度增加,使培养液的pH 值在微藻培养的前期出现下降,之后随着氨态氮质量浓度降低,同时沼液中的有机酸被降解,使培养液的pH值开始逐渐上升。从图中还可以看出,在整个试验过程中灭菌组的pH值整体均高于未灭菌组,这与高婷等[32]的研究结果相一致,各未灭菌试验组的pH值在整个试验过程中均维持在7.6~8.0,而各灭菌试验组的pH值在整个试验过程中均维持在8.56~9.0,经显著性分析后差异达到极显著水平(P<0.01),灭菌和未灭菌各试验组的pH值均处于张虎等[33]研究得出的小球藻适宜生长的pH值范围(7.0~9.0)。此外,从图中还可以看出,各灭菌试验组之间的pH值差值大于未灭菌组,在各灭菌试验组中35℃厌氧发酵后沼液pH值在整个试验过程中均高于55℃厌氧发酵后沼液试验组,经显著性分析后差异达到极显著水平(P<0.01),这是由于55℃厌氧发酵后沼液各试验组的微藻生长速率均优于各自对应的35℃厌氧发酵后沼液试验组,对氨氮和总氮的消耗量更大,在一定程度上使pH值下降,所以才会出现上述现象。
2.3 微藻培养液氨氮质量浓度
不同沼液用于微藻培养时培养液的氨氮质量浓度变化如图3所示。
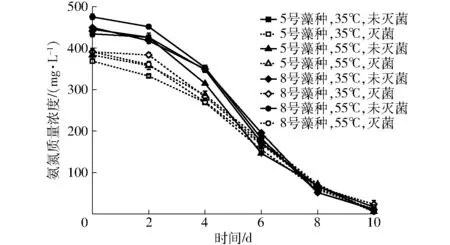
图3 氨氮质量浓度的变化Fig.3 Variation of ammonia nitrogen concentration
从图中可以看出,各试验组的氨氮质量浓度变化规律基本一致,即试验的前期(前2 d)各试验组的氨氮质量浓度缓慢下降,试验的中期(3~8 d)氨氮质量浓度开始快速下降,试验的后期逐渐趋于稳定。从图中还可以看出,试验初期各试验组的氨氮质量浓度差别较大,而且呈现出未灭菌组高于灭菌组的趋势,而试验后期未灭菌和灭菌各试验组的氨氮质量浓度差别均较小,这主要是由于高温灭菌过程造成了部分容易挥发的氨氮损失,使试验初期未灭菌组的氨氮质量浓度高于灭菌组,而随着试验的进行较容易被微藻利用的氨氮[13]质量浓度迅速降低,试验结束时所有试验组的氨氮质量浓度均降低到较低水平,差别也较小,试验结束时各试验组氨氮质量浓度由试验开始时的370~475 mg/L降到5~23 mg/L,各试验组的氨氮去除率均高于92%,这说明微藻对沼液中的氨氮具有较显著的去除效果。从图中还可以看出,55℃厌氧发酵后沼液试验组的氨氮质量浓度下降速度略高于35℃厌氧发酵后沼液试验组,这与55℃厌氧发酵后沼液试验组的微藻生长速率高于35℃厌氧发酵后沼液试验组的结果相对应。
2.4 微藻培养液总氮质量浓度
不同沼液用于微藻培养时培养液的总氮质量浓度变化如图4所示。
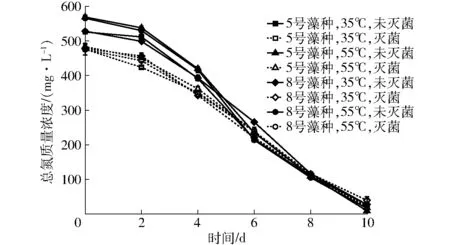
图4 总氮质量浓度的变化Fig.4 Variation of total nitrogen concentration
从图中可以看出,各试验组的总氮质量浓度变化规律基本一致,即试验的前期(前2d)各试验组的总氮质量浓度缓慢下降,试验的中后期总氮质量浓度开始快速下降。从图中还可以看出,试验初期各试验组的总氮质量浓度差别相对较大,而且呈现出未灭菌组高于灭菌组的趋势,经显著性分析后达到极显著水平(P<0.01)。而试验后期未灭菌和灭菌各试验组的总氮质量浓度差别均较小,总氮质量浓度的变化规律与氨氮质量浓度变化规律基本一致,这主要是由于在沼液中氨氮比例非常高[8,34],所以氨氮质量浓度的变化规律直接影响了总氮质量浓度的变化规律。
2.5 微藻培养液总磷质量浓度
不同沼液用于微藻培养时培养液的总磷质量浓度变化如图5所示。
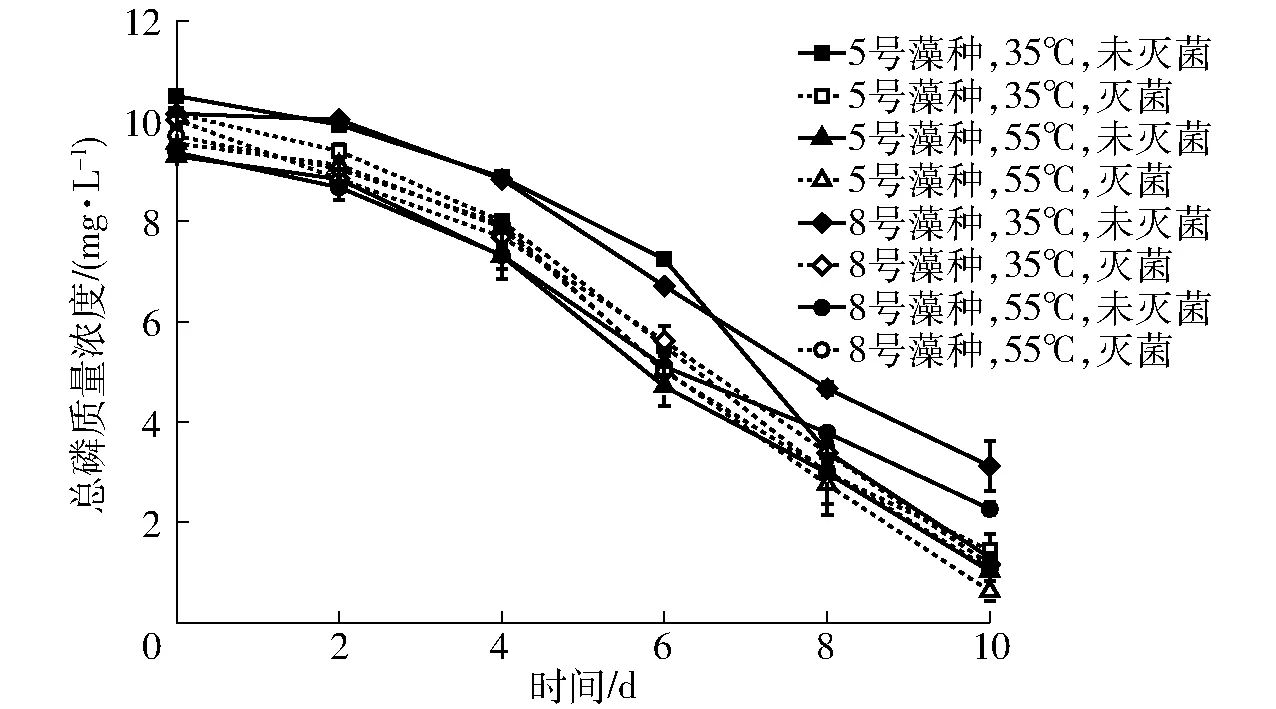
图5 总磷质量浓度的变化Fig.5 Variation of total phosphorus concentration
从图中可以看出,各试验组的总磷质量浓度变化规律基本一致,即试验的前期(前2 d)各试验组的总磷质量浓度缓慢下降,试验的中后期总磷质量浓度开始快速下降。总磷质量浓度的变化规律与总氮质量浓度的变化规律一致。从图中还可以看出,利用35℃厌氧发酵后未灭菌沼液培养微藻时,总磷的质量浓度在试验的前6 d均高于其他各试验组,而第6天后5号藻种组总磷质量浓度开始快速下降,并逐渐缩小与其他各组差距,而8号藻种组的总磷质量浓度始终保持缓慢下降的趋势,试验结束时35℃厌氧发酵后未灭菌沼液8号港口藻种试验组的总磷去除率为69%,而其他各试验组除55℃厌氧发酵后未灭菌沼液8号藻种试验组的总磷去除率略低(为76%)以外,均维持在86%~94%,这与PRAJAPATI等[35]在研究过程中得到总磷去除率相近,总磷质量浓度的变化规律和去除率与微藻生长曲线图中35℃厌氧发酵后未灭菌沼液8号藻种试验组较低的微藻生长速率相对应。经显著性分析后 35℃未灭菌8号藻种试验组和5号藻种试验组的差异不显著。35℃未灭菌8号藻种试验组与35℃灭菌5号藻种试验组的差异达到显著(P<0.05)水平,35℃未灭菌8号藻种试验组与其他各试验组的差异均达到极显著(P<0.01)水平。
2.6 微藻培养液COD值
不同沼液用于微藻培养时培养液的COD值变化如图6所示。

图6 COD值的变化Fig.6 Variation of COD
从图中可以看出,各试验组的COD值变化规律基本一致,即试验的前期(前2 d)各试验组的COD值缓慢下降,试验的中期(3~8 d)COD值开始快速下降,试验的后期逐渐趋于稳定。从图中还可以看出,试验初期各试验组的COD值差别较小,而试验中后期各试验组的COD值差别开始逐渐增大,而且呈现出5号藻种各试验组的COD去除率均高于8号藻种各对应试验组,而且8号藻种各试验组的COD去除率呈现出55℃厌氧发酵后灭菌沼液试验组高于其他各组的现象,这与各试验组的微藻生长规律相对应,也说明55℃高温厌氧发酵和灭菌处理均能显著降低沼液对后续微藻培养的不利影响。各试验组的COD值由试验开始时的913~974 mg/L降到试验结束时的141~272 mg/L,各试验组的COD去除率均维持在72%~86%范围内,这与MIN等[36]在研究中得到的COD去除率相近。COD值降低一方面是由于小球藻除了利用CO2作为碳源以外,还可以快速利用各种有机化合物作为碳源,这与LI等[37]的研究结果相一致;另一方面是由于微藻培养过程中通入的空气中含有氧气,这些氧气提高了沼液中带入的好氧和兼氧微生物以及空气中的好氧微生物的活性,加速了培养液中有机物的降解,也导致了COD值的下降。所以上述两个过程的共同作用才使培养液中COD值出现了大幅下降。
3 结论
(1)高温55℃厌氧发酵后沼液用于微藻培养的整体表现优于中温35℃厌氧发酵后沼液,微藻的生长速率更高。
(2)在本研究条件下,灭菌组与未灭菌组相比,在前期的适应期方面未表现出明显的优势,但在中后期的微藻生长速率方面略优于未灭菌组。高温灭菌不仅会造成能耗的增加,也会造成氮素的损失。
(3)本研究所选定的ChlorellapyrenoidosaFACHB-5和ChlorellavulgarisFACHB-8两种藻种均能较好地适应添加沼液的培养环境,但前者适应能力优于后者。利用沼液培养微藻,微藻可以显著降低沼液中的氨氮质量浓度、总氮质量浓度、总磷质量浓度和COD值,对沼液具有较好的净化效果。
1 GUSTAVO B L, AHMED E M A, PATRICK C H. Algal biofuels: challenges and opportunities[J]. Bioresource Technology,2013,145: 134-141.
2 CHIU Shengyi, KAO Chienya, CHEN Tsaiyu, et al. Cultivation of microalgalChlorellafor biomass and lipid production using wastewater as nutrient resource[J]. Bioresource Technology, 2015,184:179-189.
3 LOGAN C, RONALD S. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances,2011,29:686-702.
4 RACHARAKS R,GE Xumeng,LI Yebo. Cultivation of marine microalgae using shale gas flowback water and anaerobic digestion effluent as the cultivation medium[J]. Bioresource Technology,2015,191:146-156.
5 MARKOU G, GEORGAKAKIS D. Cultivation ofFilamentouscyanobacteria(blue-green algae) in agro-industrial wastes and wastewaters: a review[J]. Appl. Energy, 2011,88: 3389-3401.
6 NKOA R. Agricultural benefits and environmental risks of soil fertilization with anaerobic digestates: a review[J]. Agron. Sustain. Dev., 2014,34: 473-492.
7 HUANG H Y, CAO J L, WU H S, et al. Elevated methane emissions from a paddy field in southeast China occur after applying anaerobic digestion slurry[J]. GCB Bioenergy, 2014,6 (5): 465-472.
8 TAN Fen, WANG Zhi, ZHOUYANG Siyu, et al. Nitrogen and phosphorus removal coupled with carbohydrate production by five microalgae cultures cultivated in biogas slurry[J]. Bioresource Technology, 2016, 221:385-393.
9 AHRING B K. Biomethanation I[J]. Advances in Biochemical Engineering/Biotechnology, 2003,81: 1-30.
10 ZHANG X, QIU W, CHEN H. Enhancing the hydrolysis and acidification of steam-exploded cornstalks by intermittent pH adjustment with an enriched microbial community[J]. Bioresource Technology, 2012, 123: 30-35.
11 ZHOU Jun, ZHANG Rui, LIU Fenwu, et al. Biogas production and microbial community shift through neutral pH control during the anaerobic digestion of pig manure[J]. Bioresource Technology, 2016,217: 44-49.
12 FUCHS W, DROSG B. Assessment of the state of the art of technologies for the processing of digestate residue from anaerobic digesters[J]. Water Sci. Technol., 2013,67: 1984-1993.
13 XIA Ao, JERRY D M. Microalgal cultivation in treating liquid digestate from biogas systems[J]. Trends in Biotechnology, 2016,34(4):264-275.
14 CAI Ting, PARK S Y, RACHARAKS R, et al. Cultivation of Nannochloropsis salina using anaerobic digestion effluent as a nutrient source for biofuel production[J]. Applied Energy, 2013,108: 486-492.
15 CAI Ting, GE Xumeng, STEPHEN Y P, et al. Comparison ofSynechocystissp. PCC6803 and Nannochloropsis salina for lipid production using artificial seawater and nutrients from anaerobic digestion effluent[J]. Bioresource Technology, 2013, 144:255-260.
16 MONLAU F, SAMBUSITI C, FICARA E, et al. New opportunities for agricultural digestate valorization: current situation and perspectives[J]. Energy Environ. Sci., 2015,8: 2600-2621.
17 CHENG J, XU J, HUANG Y, et al. Growth optimisation of microalga mutant at high CO2concentration to purify undiluted anaerobic digestion effluent of swine manure[J]. Bioresource Technology, 2015,177: 240-246.
18 黄英明,王伟良,李元广,等.微藻能源技术开发和产业化的发展思路与策略[J].生物工程学报,2010,26(7): 907-913.
HUANG Yingming, WANG Weiliang, LI Yuanguang, et al. Strategies for research and development and commercial production of microalgae bioenergy[J]. Chinese Journal of Biotechnology,2010,26(7): 907-913. (in Chinese)
19 李元广,谭天伟,黄英明.微藻生物柴油产业化技术中的若干科学问题及其分析[J].中国基础科学:工业生物技术专刊,2009(5):64-70.
LI Yuanguang,TAN Tianwei,HUANG Yingming. Some scientific issues to be resolved in the process for producing biodiesel from microalgae[J]. China Basic Science,2009(5):64-70. (in Chinese)
20 WANG Hui,ZHANG Wei,CHEN Lin,et al. The contamination and control of biological pollutants in mass cultivation of microalgae[J]. Bioresource Technology, 2013,128: 745-750.
21 PARK J, JIN H F, LIM B R, et al. Ammonia removal from anaerobic digestion effluent of livestock waste using green algaScenedesmussp[J]. Bioresource Technology, 2010,101(22): 8649-8657.
22 TAN X, CHU H, ZHANG Y, et al.Chlorellapyrenoidosacultivation using anaer-obic digested starch processing wastewater in an airlift circulation photobioreactor[J]. Bioresource Technology, 2014,170: 538-548.
23 许智,叶小梅,常志洲,等.温度对厨余垃圾和人粪尿污水混合液的水解酸化影响[J].中国沼气,2011,29(3): 9-12.
XU Zhi, YE Xiaomei,CHANG Zhizhou, et al. Temperature influence on hydrolysis and acidogenesis of kitchen and toilet waste mixture[J]. China Biogas, 2011, 29(3): 9-12. (in Chinese)
24 李明,魏晓明,耿如林,等. 沼气发酵温度对沼液粪大肠菌群去除效果的研究[J].农机化研究,2015,37(5): 246-249.
LI Ming,WEI Xiaoming,GENG Rulin, et al. Effects of anaerobic fermentation temperature on extermination of fecal coliform in biogas effluent[J]. Journal of Agricultural Mechanization Research, 2015,37(5): 246-249. (in Chinese)
25 霍书豪,陈玉碧,刘宇鹏,等. 添加沼液的BG11营养液微藻培养试验[J]. 农业工程学报,2012,28(8):241-246.
HUO Shuhao, CHEN Yubi, LIU Yupeng, et al. Experiment on microalgae cultivation in BG11 nutrient solution adding biogas slurry[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(8): 241-246. (in Chinese)
26 高浩峰,李环,韦萍.半连续及连续培养小球藻减排沼液及CO2[J].生物加工过程,2012,10(4):16-20.
GAO Haofeng,LI Huan,WEI Ping. Reduction of biogas slurry and CO2byChlorellavulgarisin semi-continuous and continuous cultures[J]. Chinese Journal of Bioprocess Engineering, 2012,10(4):16-20. (in Chinese)
27 董永全, 邓安民, 郭桦冰, 等.蒙脱土/聚丙烯酰胺杂化絮凝剂制备及絮凝性能研究[J].环境科学学报, 2009,29(11):2385-2392.
DONG Yongquan, DENG Anmin, GUO Huabing, et al. Preparation and flocculation performance of a polyacrylamide/montmorilonite hybrid flocculan[J]. Acta Scientiae Circumstantiae,2009, 29(11): 2385-2392. (in Chinese)
28 刘培,张建华,王柯,等.沼液中悬浮物对乙醇发酵的影响及其絮凝处理的研究[J].环境科学学报,2014, 34(6): 1455-1463.
LIU Pei,ZHANG Jianhua,WANG Ke,et al. Effect of suspended solids in digestate on ethanol fermentation and flocculation treatment[J].Acta Scientiae Circumstantiae, 2014, 34(6):1455-1463. (in Chinese)
29 王忠江,蔡康妮,王丽丽,等.沼肥表施对土壤氮素动态分布及氨挥发的影响[J/OL].农业机械学报,2014,45(7):139-143.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20140722&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2014.07.022.
WANG Zhongjiang,CAI Kangni,WANG Lili,et al. Influence of surface application of biogas slurry on ammonia volatilization and dynamic distribution of soil nitrogen[J/OL]. Transactions of the Chinese Society for Agricultural Machinery,2014, 45(7): 139-143.(in Chinese)
30 LÜ Sujuan, ZHANG Wei, PENG Xiaowei, et al. Cultivating an oleaginous microalgae with municipal wastewater[J]. Chinese Journal of Biotechnology, 2011, 2(3): 445-452.
31 AHMAD I, HELLEBUST J A. Regulation of chloroplast development by nitrogen source and growth conditions in aChlorellaprotothecoidesstrain[J]. Plant Physiology, 1990, 94(3):944-949.
32 高婷,晏荣军,裘俊红,等.微绿球藻去除沼液氮、磷研究[J].浙江化工,2012,43(11): 34-37.
GAO Ting, YAN Rongjun, QIU Junhong, et al. N and P removal from biogas slurry withNannochlorisoculata[J]. Zhejiang Chemical Industry, 2012, 43(11): 34-37. (in Chinese)
33 张虎,张桂艳,温小斌,等.pH对小球藻Chlorellasp. XQ-200419光合作用、生长和产油的影响[J].水生生物学报,2014,38(6): 1084-1091.
ZHANG Hu, ZHANG Guiyan, WEN Xiaobin,et al. Effects of pH on the photosynthesis,growth and lipid production ofChlorellasp. XQ-200419[J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1084-1091. (in Chinese)
34 YANG A, ZHANG G, YANG G, et al. Denitrification of aging biogas slurry from livestock farm by photosynthetic bacteria[J]. Bioresource Technology, 2017, 232:408-411.
35 PRAJAPATI S K, KAUSHIK P, MALIK A, et al. Phycoremediation and biogas potential of native algal isolates from soil and wastewater[J]. Bioresource Technology, 2013,135:232-238.
36 MIN M, WANG L, LI Y, et al. CultivatingChlorellasp. in a pilot-scale photobioreactor using centrate wastewater for microalgae biomass production and wastewater nutrient removal[J]. Appl. Biochem. Biotechnol.,2011,165:123-137.
37 LI Yecong, CHEN Yifeng, CHEN Paul, et al. Characterization of a microalgaChlorellasp. well adapted to highly concentrated municipal wastewater for nutrient removal and biodiesel production[J]. Bioresource Technology, 2011,102:5138-5144.
