利用CRISPR/Csa9技术构建溶酶体运输调节因子基因缺陷C57BL/6小鼠
2018-07-06艾东旭钟德刚秦佟童高梦樵董施施孙兆增李莲瑞
艾东旭, 钟德刚, 孙 菲, 李 钰, 李 崇,秦佟童, 高梦樵, 董施施, 孙兆增, 李莲瑞
(1. 塔里木大学生命科学学院, 阿拉尔市 843300;2. 山东省日照市莒县畜牧兽医局, 日照 276529;3. 军事医学研究院实验动物中心, 北京 100071;4. 塔里木大学动物科学学院, 阿拉尔市 843300 )
溶酶体运输调节因子 (lysosomal trafficking regulator,Lyst) 基因是Chediak-Higashi 综合征的致病基因,患病机体的临床表现为:色素减退,免疫缺陷、畏光羞明,轻度凝血障碍等。对Lyst基因的研究起始于1996年在beige小鼠中分离到beige基因,Lyst基因定位于小鼠13号染色体上[1]。哺乳动物的Lyst基因高度保守,小鼠Lyst与人lyst基因的序列同源性高达86.5%,牛和大鼠也有近似程度的同源性[2]。
CRISPR/Cas9系统是近年来一种新型基因编辑方法,与以往的锌指核酸内切酶(ZFN)和转录激活因子效应物核酸酶(TALEN)相比,具有操作简单、周期短、成本低、作用高效等众多优点。CRISPR/Cas9系统对基因编辑时,主要依赖于sgRNA与靶序列DNA的互补配对。因此,只需要根据目的基因靶点识别的前间区序列邻近基序(protospacer adjacent motif, PAM)序列设计20~24 bp的sgRNA引物序列[3],sgRNA就可以识别并结合到基因序列上,Cas9内切酶就可以在靶序列位置对基因序列进行切割。从而,引起自身修复系统如同源重组(homology directed repair, HDR)方式或非同源末端连接(non-homologous end joining, NHRJ)方式对DNA进行修复,最终造成基因组DNA缺失、插入或移码突变,从而达到对目的基因进行有效敲除、插入及修饰等[4],完成基因编辑[5]。该研究利用CRISPR/Cas9技术对C57BL/6小鼠的Lyst基因进行敲除, 研究Lyst基因敲除对机体的影响, 并建立自然杀伤(NK)细胞免疫缺陷C57BL/6小鼠动物模型。
1 材料与方法
1.1 实验动物
4~8周龄雌性SPF级C57BL/6小鼠60 只, 6~8周龄雄性SPF级C57BL/6小鼠30 只,4~8周龄雌性SPF级ICR小鼠60 只,6~8周龄雄性SPF级ICR结扎小鼠30 只,由军事医学研究院动物中心提供[SYXK(军)-2012-004]。
1.2 主要实验试剂
MEGAclearTMTranscription Clean-UP Kit (Lot:00416373), MEGAshortscriptTMT7 High Yield Transcription Kit (lot: 00407473), mMESSAGE mMACHINETM T7 Ultra (lot:003377302)试剂盒购自英潍捷基(上海)贸易有限公司; Plasmid Mini Kit(D6943-01*), Gel Extraction Kit(D2500-01)购自百奥康公司; Mouse Tail Genomic DNA Kit ( lot:20118)购自康为世纪生物科技有限公司; Guide-itTMGenotype Confirmation Kit(lot:1510668A),Guide-itTMsgRNA Scrieening Kit(lot:160925A),DraI (lot:1037A),BsaI (lot:K354AA)等购自北京六合通经贸有限公司。
1.3 方法
1.3.1 重组质粒的构建 根据Genbank已报道的Lyst(NC_000079.6)基因序列,针对编码区第50个外显子设计2对22 bp左右的sgRNA用于基因打靶(引物序列)。合成后的2对sgRNA经寡核苷酸链退火后,用Ligation Mix连入经BsaⅠ酶线性化后回收的pUC57-sgRNA载体,重组构建包含sgRNA的pUC57-Lyst-sgRNA表达载体,通过测序确认是否连入目的片段,选择连入成功的克隆菌进行接菌扩增培养后,利用质粒提取试剂盒提取重组表达载体质粒用于后续试验。
1.3.2 sgRNA和Cas9体外转录 将提取的重组表达载体质粒经DraⅠ酶切线性化后, 利用乙醇沉淀法进行回收且用DEPC处理水进行溶解; 定量回收DNA的浓度, 根据MEGAshortscriptTMT7 High Yield Transcription Kit说明书进行体外转录。Cas9质粒经SacI和ApaI双酶切、纯化回收溶于DEPC处理水中, 定量其浓度, 根据mMESSAGE mMACHINETMT7 Ultra说明书进行体外转录。转录结束后,利用MEGAclearTMTranscription Clean-UP Kit对以上两个转录体进行纯化回收, 定量其浓度, 对回收产物进行1%琼脂糖凝胶电泳检测后, 于-80 ℃冰箱中保存。
1.3.3 sgRNA/Cas9 mRNA显微注射及体外移植 将sgRNA和Cas9 mRNA分别稀释到50 ng/μL和100 ng/μL, 1∶1 比例混匀, 以 12 000 r/min 4 ℃ 离心 5 min。注射用受精卵来自于同一品系雌鼠超数排卵后与雄性小鼠交配所得。受精卵从小鼠体内取出经洗涤、培养后,即可进行注射。
使用显微注射仪将上述经过离心的sgRNA和Cas9 mRNA混合溶液通过显微注射针注入受精卵单细胞期的细胞质中,注射后的受精卵在37 ℃ 体积分数5% CO2培养箱中培养半小时左右,取生长状态良好的受精卵移植到代孕ICR小鼠输卵管部位。
1.3.4 敲除小鼠PCR及基因测序 剪取C57BL/6新生小鼠0.4~0.6 cm的尾部组织于1.5 mL离心管中并打耳标进行记录, 利用Mouse Tail Genomic DNA Kit提取鼠尾基因组DNA。设计一对包含sgRNA作用靶点的引物用于PCR扩增鉴定。PCR扩增结束,取扩增产物经1%琼脂糖凝胶电泳进行分析,将扩增出目的条带的样品送检测序。通过对测序结果的分析, 将F0代杂合子C57BL/6小鼠与同品系野生型C57BL/6小鼠进行交配繁殖,获得F1代C57BL/6小鼠; F1代C57BL/6小鼠再进行同基因型间雌雄交配获得F2代C57BL/6小鼠。用Guide-itTMGenotype Confirmation Kit对子代C57BL/6小鼠的基因型进行分析鉴定。
1.3.5 敲除小鼠表型特征鉴定 对F0代和F1代敲除小鼠的体形大小,毛色,生长发育周期等进行肉眼观察分析,从而来判断Lyst基因缺失对其造成的机体外观表型特征的影响。
2 结果
2.1 成功构建重组载体并获得转录后sgRNA
通过对测序样品结果的分析(图1),可以看出1号和2号克隆菌均成功插入打靶引物序列,将引物序列连接入载体序列中,即成功构建重组载体。

图1 重组载体测序结果
2.2 获得体外转录的sgRNA和Cas9 mRNA
使用MEGAclearTMTranscription Clean-UP Kit进行转录后的回收, 回收后的mRNA经1%琼脂糖凝胶电泳分析观察结果可以看出在100 bp处出现一条单一的条带(图2),即转录、回收成功, 测其浓度在800 ng/μL左右,于-80℃保存。
2.3 子代C57BL/6小鼠基因型鉴定结果
通过对测序结果的分析, 将测序结果为双峰的F0代C57BL/6小鼠用Guide-itTMGenotype Confirmation Kit进行基因型鉴定,鉴定结果(图3)与峰图分析结果相同F0代非野生型C57BL/6均为杂合子。

图2 sgRNA转录电泳图
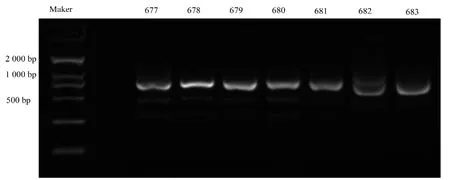
图3 Lyst基因敲除F0代C57BL/6小鼠基因型鉴定结果

图4 同周龄Lyst基因敲除C57BL/6小鼠与野生型比较
2.4 C57 BL/6敲除小鼠表型鉴定结果
基因敲除C57BL/6小鼠毛色与亲代野生型C57BL/6小鼠相比, 颜色变浅(图4); 基因敲除C57BL/6小鼠体形大小在各阶段均与野生型C57 BL/6小鼠没有明显差异; 基因敲除C57BL/6小鼠生长发育周期与野生型C57BL/6小鼠相同。
3 讨论
2013年5月,Rudolf Jaenisch教授实验室通过共同注射Cas9和sgRNA到小鼠受精卵中,实现了CRISPR/Cs9技术首次被用于多细胞生物的非同源黏性末端修复介导的多基因敲除,同年又实现了同源黏性末端修复介导的双基因精确突变[6]。本研究采用共同注射Cas9和sgRNA到小鼠受精卵中,试验初期,因经验不足及理论知识不够夯实,导致前期试验进展中遇到重组质粒经DraI酶切后经1%琼脂糖凝胶电泳切胶回收目的条带后浓度较低(体外转录模版),造成体外转录效率低下。后期经查阅资料及团队讨论、验证最终采用DraI酶切后使用乙醇沉淀法来回收目的条带,同时对转录体系进行优化,最终转录效率达到预期效果。
C57BL/6小鼠是肿瘤学、免疫学、遗传学研究中常用的品系, 易于繁殖, 体格健壮,试验结果精度高, 可比性好。本研究针对小鼠Lyst基因编码区第50外显子设计的引物有效的作用于C57BL/6小鼠基因靶点位置,并造成碱基数目的缺失,成功构建Lyst基因缺失C57BL/6小鼠。得到8只F0代小鼠,其中7只为杂合子C57BL/6小鼠一只为野生型C57BL/6小鼠,且杂合子敲除小鼠毛色均比野生型同品系小鼠毛色浅。在繁殖时发现,F0代小鼠相互合笼繁殖得到的F1代小鼠毛色均与F0代毛色相同,但F0代与野生型同品系小鼠合笼繁殖得到的F1代小鼠毛色均与野生型毛色相同。引起毛色变化的具体因素还在进一步研究中。因暂未得到F2纯合子小鼠, 所以不能确定其自然杀伤(NK)细胞是否发生变化。当确定其NK细胞发生缺陷后,可以运用该基因敲除小鼠进一步做人源化肿瘤研究。
[1]Tchernev VT, Mansfied TA, Giot L, et al. The Chediak-Higashi Protein in teracts with SNARE complex and signal trans duction proteins [J]. Mol Med, 2002, 8(1):56-64.
[2]刘玲, 谷学英, 李洪义. Chediak-Higashi综合征的相关基因及蛋白质[J]. 医学分子生物学杂志, 2008, 5(3):269-272.
[3]Hwang WY, Fu Y, Reyon D, et al. Efficient genome editing in zebrafish using a CRISPR-Cas system[J]. Nat Biotechnol,2013, 31(3):227-229
[4]Hsu P D, Lander E S, Zhang F. Development and applications of crispr-cas9 for genome engineering[J]. Cell, 2014, 157(6):1262-1278
[5]杜建勇, 邓然, 高虹, 等. 一种sgRNA快速合成及检测方法的建立[J].中国实验动物学报, 2015, 23(3):267-271.
[6]Wang HY, Yang H, Shialila CS, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Casmediated geneme engineering[J]. Cell, 2013, 153(4):910-918.
