大鼠放射性心脏损伤机制的比较医学意义
2018-07-06马金柯高世乐胡宗涛董六一唐正中
马金柯, 高世乐, 胡宗涛, 王 崇, 高 杉, 董六一, 刘 阳, 唐正中
(1. 解放军第105医院放疗中心, 合肥 230031;2. 解放军第105医院肿瘤三科, 合肥 230031;3.安徽医科大学药理学教研室,合肥 230032)
由于胸部及纵隔肿瘤的发病率呈上升趋势,确诊时多失去手术机会或根据临床分期需要术后辅助放疗,越来越多的患者接受放射治疗[1]。胸部肿瘤放射治疗的同时常引起放射性心脏损伤(radiation induced heart disease,RIHD),如放射性心包炎、心肌纤维化、冠状动脉损伤、瓣膜纤维化、心脏传导系统损伤等[2,3]; 轻者临床症状不明显,重者可有发热、心悸、气短、胸闷、胸痛,伴心脏杂音、心律失常、颈静脉怒张、窦性心动过速等体征。已有研究[4]报道,放射治疗除了可以通过电离辐射对肿瘤组织产生治疗作用外,同时增加患者治疗期间或治疗后罹患心包疾病、冠心病、心脏瓣膜疾病、充血性心力衰竭、猝死等疾病的风险,目前尚无有效应对方法,重在预防。因此,建立大鼠RIHD动物实验模型,研究相关标志物变化,初步探讨可靠的评价标准,为临床早期诊断、发现和治疗,提供重要的基础研究依据。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠90只, 5~6周龄,体质量(200 ± 25) g,由安徽医科大学实验动物中心提供[SCXK(皖)2015-007],饲养于安徽医科大学实验动物中心[SYXK(皖)2015-007],温度(20 ± 2) ℃,相对湿度50% ± 10%,适应性饲养1周后实验。
1.2 实验仪器
VARIN21-EX直线加速器(美国瓦里安医疗器械公司); 同步六导联心电图机(光电8420K,日本光电公司); GEGE Vivid 7超声心动图; SPECTRA MAX 190型酶标仪(美国Molecular De-vices公司)等。
1.3 动物分组与模型制备
将90只SD雄性大鼠随机分为正常对照组和5 Gy、10 Gy、20 Gy、30 Gy 四个不同剂量照射组, 每组18只。所有实验动物饲养1周后, 照射前晚禁食禁水8 h, 称重后给予体积分数10%水合氯醛0.35 mL/100g腹腔注射麻醉, 取仰卧位, 头部及四肢固定在鼠板上,模拟机定位下确定大鼠心脏轮廓。正常对照组只麻醉, 不照射; 照射组分别给予6 MV X线5 Gy、10 Gy、20 Gy、30 Gy四个不同剂量单次照射, 靶区面积(2~2.5) cm×(2~2.5) cm,源皮距100 cm, 剂量率4 Gy/min。照射结束待大鼠苏醒后送回动物房,整个过程无动物死亡。
1.4 指标检测
1.4.1 超声指标检测 于造模后2周、4周、12周末分批处死大鼠,每次每组6只,体积分数10%水合氯醛0.35 mL/100g腹腔注射麻醉大鼠,麻醉生效后,取左侧卧位,剔净胸部毛,表面涂耦合剂,将GE 3S相控阵探头放置于左胸前,调整深度为2.0~2.5 cm,测量并记录左心室射血分数(left ventricular ejection fraction,LVEF)、左心室收缩压(left venteicular systolic pressuer,LVSP)及左心室舒张末压(left ventricular end diastolic pressure,LVEDP)等指标[5,6]。
1.4.2 心电图描记[7]超声检测完毕后,用针电极刺入四肢及胸壁皮下,心电图记录6个导联Ⅰ、Ⅱ、Ⅲ、aVR、aVL、aVF,3个胸导联Va、Vb、Vc,胸导联Va置于胸骨中点右缘,Vc置于胸骨下1/3水平线与左腋前线交点,Vb置于两者交点,纸速为50 mm/s,定准电压1 mV=10 mm。按标准化法测量心电参数,记录心率(heart rate,HR),S T波,T波等。
1.4.3 血清标志物检测 开胸后腹主动脉取血,置于常温下3 000 r/min离心20 min, 取上清液,按照酶联免疫试剂盒说明书,测得大鼠血清肌酸激酶同工酶(creatine kinase isoenzyme-MB,CKMB)、心肌肌钙蛋白I(cardiactroponin I,cTnI)吸光度值[8]。1.4.4 心重指数测定[9]取出大鼠心脏,除去大血管和心脏外膜等脂肪组织后用生理盐水清洗,吸干后称全心质量并记录,计算心重指数(HW/BW)。
1.5 统计学方法
用SPSS18.0统计分析软件进行处理,实验数据以±s表示,组间数据采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况观察
模型组大鼠放疗后逐渐出现厌食, 活动量减少,精神差, 体质量增加缓慢,2周后照射组大鼠体表可见脱毛,表面皮肤先破溃,后结痂,未见明显感染,单次照射剂量越大,上述症状越明显, 8周后相关症状逐渐减轻; 正常对照组大鼠饮食、活动、精神状态正常,各组大鼠均无死亡(图1)。
2.2 心脏超声检查
与正常对照组相比,照射组(5 Gy、10 Gy、20 Gy)大鼠LVEF、LVSP测得值随照射剂量增加逐渐下降(P<0.05或P<0.01),并呈负相关。LVEDP测得值随照射剂量增加逐渐增加(P<0.05或P<0.01),呈正相关。照射组间比较,LVEF、LVSP测得值在5 Gy、10 Gy组较20 Gy组逐渐降低,LVEDP测得值逐渐增加(P<0.05或P<0.01)。时间分布上,照射组LVEF、LVSP测得值在4周较2周和12周高,LVEDP测得值在4周较2周和12周低,分别在4周达到峰值和谷值 (图2,表1)。

图1 大鼠放疗前、放疗中、放疗后背部被毛变化
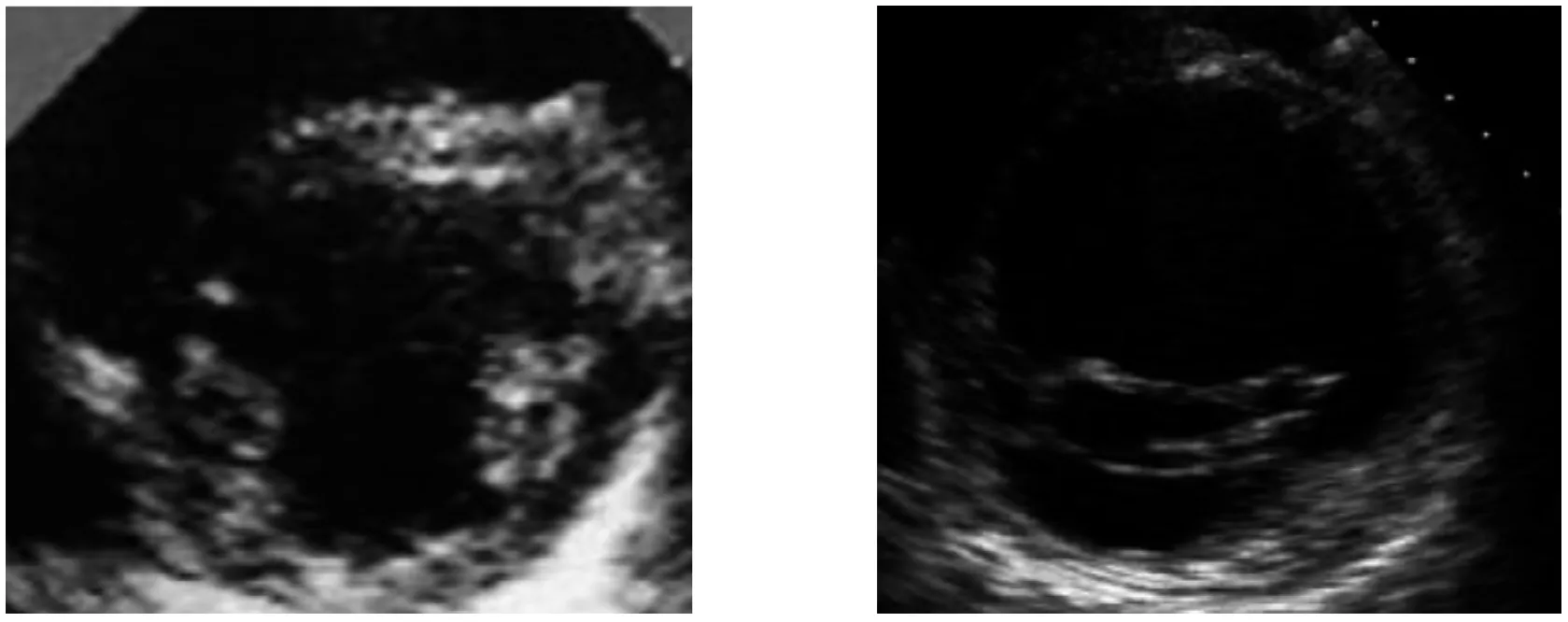
图2 大鼠放疗前、放疗后心脏超声变化
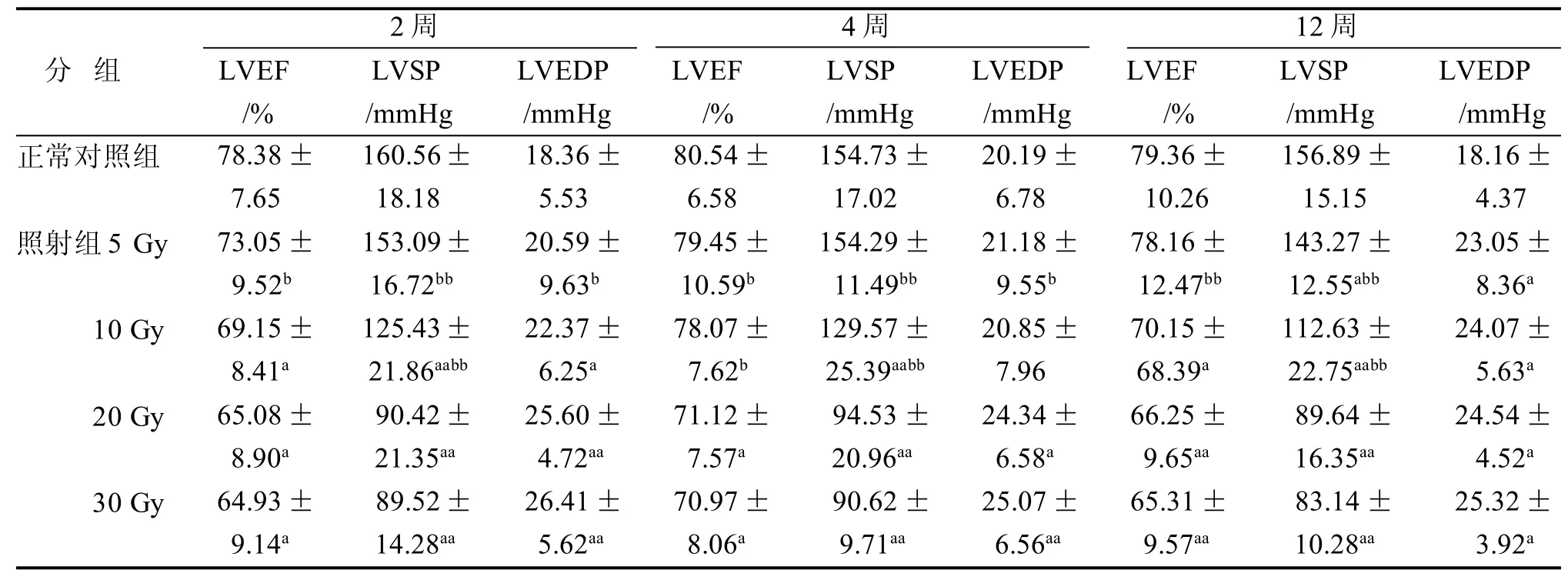
表1 各组大鼠LVEF、LVSP、LVEDP不同时间变化
2.3 心电图变化
与正常对照组相比, 照射各剂量组大鼠随着照射剂量增加, HR较正常组逐渐加快(P<0.05或P<0.01);照射组间比较, 5 Gy、10 Gy组较20 Gy组HR明显降低(P<0.05或P<0.01)。时间分布上,各照射组在4周HR加快达到峰值,12周开始下降,ST段在4周抬高值达到峰值,12周开始呈下降趋势(图 3、表 2)。
2.4 血清标志物变化
同正常对照组比较,各照射组CKMB及cTnI测得值随着照射剂量增加,逐渐升高(P<0.05或P<0.01); 各照射组之间比较,CKMB及cTnI测得值在5 Gy组、10 Gy组较20 Gy组降低(P<0.05或P<0.01),30 Gy 组与20 Gy组比较,呈下降趋势。时间分布上,CKMB及cTnI测得值在4周升高达峰值,12周逐渐降低(表3)。

图3 放疗前后大鼠心电图变化

表2 各组大鼠不同时间心电图变化

表3 各组大鼠血清CKMB、cTnI不同时间变化
2.5 大鼠体质量与心重指数变化
与正常对照组相比, 照射组大鼠体质量随着照射剂量增加,测得值逐渐减小,心重指数测得值逐渐增加(P<0.05或P<0.01); 照射组间比较,5 Gy组、10 Gy组同20 Gy组相比逐渐减少,心重指数测得值逐渐增加(P<0.05或P<0.01)。时间分布上,大鼠体质量测得值在12周达峰值,心重指数测得值在4周最低(表4)。

表4 各组大鼠心重指数不同时间变化
3 讨论
RIHD指心脏受到一次照射剂量达到10 Gy或短时间(数日)内受到分次局部外照射累及剂量达到45 Gy引起的损伤。1897年, 有学者[10,11]报道,放射线可造成心脏损伤,但因RIHD常处于亚临床状态,需经过相当长潜伏期才出现临床表现,并且认为心脏可以抵消放射线的损害,故未引起临床足够重视。1924年Davis[12]通过犬实验证实放射线的确可造成RIHD,且随着胸部肿瘤患者放疗的增加,RIHD逐渐成为肿瘤科常见放疗毒副反应, 目前认为, 仅可预防, 无有效治疗方法。因此, 研究RIHD的发生、临床表现、发病机制及诊断治疗成为临床医师研究的热点。
近年来,关于RIHD动物模型的建立及其发病机制和放疗后病理改变的研究越来越多,但目前尚无标准的放疗靶区勾画、剂量选择和评判标准。本课题组通过实验动物造模,模拟机定位下SD雄性大鼠照射组全心接受5 Gy、10 Gy、20 Gy、30 Gy四个不同剂量照射,并根据射野定位正常组织挡铅防护,照射后2~12周超声心动图、心电图、血清CKMB及cTnI测得值变化规律,判断RIHD的发生条件及相关指标在不同时间点的变化规律。通常认为,大鼠受照射后首先损伤心肌细胞间毛细血管内皮,进一步引起血管炎症、冠状动脉粥样硬化,心脏冠脉供血减少等一系列病理变化,为RIHD发生的共同病理过程。
本实验通过大鼠模型制备观察可以得出,照射组大鼠放疗后逐渐出现厌食、精神差、活动量减少、脱毛等表现,第8周之后相关症状逐渐减轻,正常对照组无此变化。超声心动图检查提示,与正常对照组相比,照射组大鼠LVEF、LVSP测得值变化与正常对照组相比,随着剂量增加,测得值逐渐减少, 30 Gy组同20 Gy组未见明显变化, 这一点与文献报道一致[13], 说明20 Gy以后增加照射剂量,没有增加损伤程度; 而LVEDP测得值随着照射剂量增加逐渐增加。LVEF、LVSP、LVEDP等指标可反映大鼠心脏功能,LVEF、LVSP值越大, LVEDP值越小, 表明大鼠心脏功能越好[14,15]。心电图是判断大鼠造模是否成功的常用指标之一,有文献[16]报道,在急性放射性心脏损伤中,心电图异常最为常见,主要以ST段改变和窦性心动过速为主。本实验照射组大鼠HR及ST段抬高值,随照射剂量逐渐增加而增加。血清标志物CKMB及cTnI是反映心肌急性损伤的敏感指标,心肌细胞损伤后,CKMB 和cTnI释放入血,血清浓度增加,且血清升高的浓度与心肌受损程度呈正相关性,可作为心肌损伤的判定标志物[17]。本实验中实验大鼠造模后血清CKMB及cTnI水平逐渐升高,且与照射剂量增加呈相关性。
综上所述,表明单次剂量照射大鼠全心,放疗至4周,RIHD产生,自5 Gy、10 Gy、20 Gy依次增加照射剂量, RIHD程度逐渐加重,30 Gy较20 Gy增加放疗剂量未增加放疗毒性,因此20 Gy可作为RIHD的造模参考剂量,值得推广。此外,大鼠RIHD与心脏标本病理结构改变的关系如何,是本课题组下一步研究的方向之一。
[1]武瑞凤, 苏晋生, 宋建波. 核磁研究犬心放射性损伤早期改变[J]. 实用医学影像杂志, 2015, 16(3):215-217.
[2]Boerma M. Experimental radiation-induced heart disease:past,present, and future[J]. Radiat Res, 2012, 178(1):1-6.
[3]Gagliardi G, Lax L, Rutqvist LE. Partial irradiation of the heart[J]. Semin Radiat Oncol, 2001, 11(3):224-233.
[4]刘阳, 高世乐, 胡宗涛. 放射性心脏损伤机制及其防治的研究进展[J]. 安徽医药, 2016, 20(10):1813-1817.
[5]曹丽, 王佩显, 林美光, 等. 大鼠超声心动图检测方法学的实验研究[J]. 临床超声医学杂志, 2009, 11(11):721-725.
[6]彭琳, 唐小海, 严伟, 等. 果胶阿霉素对大鼠心脏毒性的研究[J]. 中国药理学通报, 2016, 32(8):1075-1080.
[7]何涛, 陈蒙华, 宋凤卿. 105只健康大鼠心电图分析[J].实用心电学杂志, 2006, 15(4):289-290.
[8]徐向钊, 张冬梅, 菅云飞, 等. 静脉应用胺碘酮对急性心肌缺血大鼠CK-MB和cTnI的影响[J]. 宁夏医科大学学报,2014, 36(12):1324-1327.
[9]汪裕琪, 石开虎, 吴君旭, 等. DNMT3A和Hyp在ISO诱导大鼠心肌纤维化中的表达及相关性研究[J].安徽医科大学学报, 2014, 49(5):606-609.
[10]Lee PJ, Mallik R. Cardiovascular effects of radiation therapy:parctical approch to radiation therapy-induced heart disease[J]. Cardiol Rew, 2005, 13(2):80-86.
[11]Filopei J, Frishman W. Radiation-induced heart disease [J].Cardiol Rev, 2012, 20(4):184-188.
[12]Davis KS. Intrathoracic change following X-ray treatment: a clinical and experimental study [J]. Radiology, 1924, 3(4):301-322.
[13]王洁, 陆克义, 周军涛, 等. X线照射增加大鼠心肌对缺血/再灌注损伤的敏感性[J]. 中国病理生理杂志, 2014, 30(3):419-422.
[14]Libonati JR, Cardiac remodeling and function following exercise and angiotensin Ⅱ receptor antagonism[J]. Eur J Appl Physiol, 2012, 112(8):3149-3154.
[15]钟小兰, 景江新, 班努·库肯, 等. rhBNP对慢性心力衰竭大鼠心室重构及心功能的保护意义[J]. 重庆医学, 2015,44(25):3466-3469.
[16]王军, 王袆, 刘青, 等. 三维放疗急性放射性心脏损伤类型及影响因素分析[J]. 中华放射肿瘤学杂志, 2013, 22(3):213-216.
[17]Murphy JT, Horton JW, Purdue GF, et al. Evaluation of troponin-I as an indicator of cardiac dysfunction after thermal injury [J]. J Trauma, 1998, 45(4):700-704.
