小鼠免疫性冠状动脉炎内皮细胞线粒体的动态变化
2018-07-06濮祥强钱光辉丁粤粤吕海涛
濮祥强, 王 祥,3, 钱光辉,2, 马 锦, 丁粤粤, 吕海涛
(1. 苏州大学附属儿童医院, 苏州215025;2.苏州大学儿科临床研究院, 苏州215025;3. 淮安市第一人民医院, 淮安223300)
冠状动脉炎是儿童川崎病(Kawasaki disease,KD)的严重后果之一,也是诱发冠状动脉粥样硬化性心脏病的危险因素。目前,KD已成为儿童居首位的后天性心血管疾病[1]。未经治疗的KD患儿,约24.3%可发生冠状动脉病变[2]。目前KD冠状动脉损害的机制尚不完全清楚,近年对其发病机制的研究集中于血管内皮损伤及功能障碍,内皮细胞线粒体的研究也是热点之一[3]。
线粒体是细胞中核心产能器,在细胞氧化反应过程中发挥关键作用,线粒体功能障碍与细胞的炎症损伤关系密切。既往临床研究[4]表明,68%的KD患者的心肌及心肌旁细胞的线粒体存在形态和功能的改变。Dou 等[5]运用兔等动物制作的免疫性血管炎模型模拟KD血管改变,亦表明存在冠状动脉内皮细胞线粒体损伤。在KD患儿血小板中也证实存在着线粒体代谢的异常[6]。因此,我们推测线粒体代谢异常可能是KD血管内皮细胞损伤的发病机制之一。
为此,本研究拟通过制作免疫性冠状动脉炎小鼠模型,观察光学显微镜下组织病理学改变及电子显微镜下血管内皮细胞线粒体损伤情况,进而为探索KD冠状动脉损害机制提供依据。
1 材料与方法
1.1 动物
SPF级5周龄雄性C57BL/6小鼠60只, 购自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002], 体质量(19.47±0.64) g。饲养于苏州大学实验动物屏障设施[SYXK(苏)2016-0050], 室温(20±2) ℃, 相对湿度 50% ± 5%, 明暗各 12 h, 噪音<50 db,自由饮食,实验过程中按“3R”原则给予人道主义关怀。
1.2 白色念珠菌水溶物(Candida albicans water soluble fraction,CAWS)制备
白色念珠菌(NBRC: 1385)购自日本大阪生物研究所。按照Duong等[7]方法,将白色念珠菌接种于沙氏培养基上培养2 d,C-limiting培养基冲洗下生长旺盛的白色念珠菌,继续37 ℃培养2 d。菌株孵育完毕后,分别加入无水乙醇裂解2次,每次约24 h。提取沉淀物即为CAWS,丙酮干燥后备用。注射前将CAWS溶解于灭菌注射用水,浓度为80 mg/mL。
1.3 仪器与设备
电子天平(MS-TS),上海梅特勒-托利多公司;血细胞分析仪(BC-5310),深圳迈瑞公司;酶联免疫吸附试验(ELISA)试剂盒,深圳达科为公司;透射电子显微镜(H-7000),日本日立公司。
1.4 方法
1.4.1 动物模型建立 将小鼠随机分为实验组及对照组, 每组30只。两组小鼠平均体质量为(19.62±0.64) g及(19.29±0.61)g (P>0.05)。实验组每只小鼠腹腔注射8 mg CAWS, 对照组每只小鼠腹腔注射0.1 mL PBS, 连续5 d。在每日同一时间,观测小鼠体质量、进食量。注射期间密切观察小鼠毛发等外观及活动、进食等一般行为变化。于末次注射后24 h、3 d、7 d、14 d及28 d,每组随机取6只小鼠摘眼球取血,处死小鼠,解剖胸腔,留取心脏标本,电子天平称重心脏质量。
1.4.2 检测小鼠血常规及血浆中炎症因子的改变小鼠取血后,即以血细胞分析仪分析两组小鼠血液的血常规。然后小鼠血液以3 000g×5 min离心,取上层血浆, ELISA定量检测各日龄的两组小鼠的血浆中白介素(IL)-6及肿瘤坏死因子(TNF)-α水平。1.4.3 病理学检查 将小鼠心脏标本离体后,即刻置于体积分数10%甲醛溶液固定。常规脱水、石蜡包埋、连续切片、HE染色。观察心脏冠状动脉炎症病变情况。
以质量分数4%多聚甲醛固定所取得的冠状动脉标本, 经PBS漂洗、体积分数1%锇酸 -0.1 mol/L磷酸缓冲液后固定、酒精与丙酮逐级脱水、环氧树脂(Epon-812)浸润、包埋、烤箱聚合等处理后,包埋组织用LKB超薄切片机切片, 厚度70~80 nm,收集切片于200~400目铜网。超薄切片用饱和醋酸双氧铀、枸橼酸铅染液双染色,透射电子显微镜下观察血管内皮细胞超微结构变化情况。以Arruda等[8]方法,两组随机选取5个血管内皮细胞,随机选择每张图片中5个线粒体,定量应用以Image Pro-plus软件计算功能,去除本底值后,测出其平均灰度。
1.5 统计学处理
应用SPSS 19.0软件进行统计学处理, 计量资料用±s表示,组间比较采用配对样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般状况及分析
实验组小鼠注射CAWS后均出现活动、食量减少,体质量减轻,毛发紊乱,易激惹等外观变化,至注射后28 d,实验组及对照组小鼠均无死亡。实验组小鼠的外观变化以最后一次注射刺激物后3 d、7 d 时最为明显。实验组小鼠注射结束后24 h、3 d、7 d时体质量和心脏质量降低变化与对照组差异有统计学意义(P<0.05),注射CAWS后14 d、28 d时实验组小鼠体质量、心脏质量等均渐恢复,差异与对照组相比无统计学意义(表1)。
2.2 部分血常规及血浆中炎症因子的改变
注射CAWS结束后24 h、3 d、7 d时实验组小鼠血液WBC及PLT升高变化与对照组差异有统计学意义(P<0.05)(表 2)。
注射CAWS结束后3 d、7 d时实验组小鼠血浆IL-6浓度与对照组差异有统计学意义(P<0.05), 注射结束后24 h、3 d、7 d、14 d时实验组小鼠血浆TNF-α浓度与对照组差异有统计学意义(P<0.05)(表 3)。
2.3 冠状动脉组织病理学改变
对照组小鼠血管内皮完整光滑,内皮细胞排列整齐,内膜下弹力纤维完整,无明显炎症细胞浸润(图1 A)。实验组小鼠急性期(3 d)可见血管内皮粗糙,内皮细胞肿胀、排列紊乱,有明显炎症细胞浸润,冠状动脉壁不均匀肿胀(图1 B)。33.3%(2/6)的实验组小鼠在亚急性期(14 d)可见血管壁弹力纤维断裂,类似冠状动脉瘤改变[9](图1 C)。
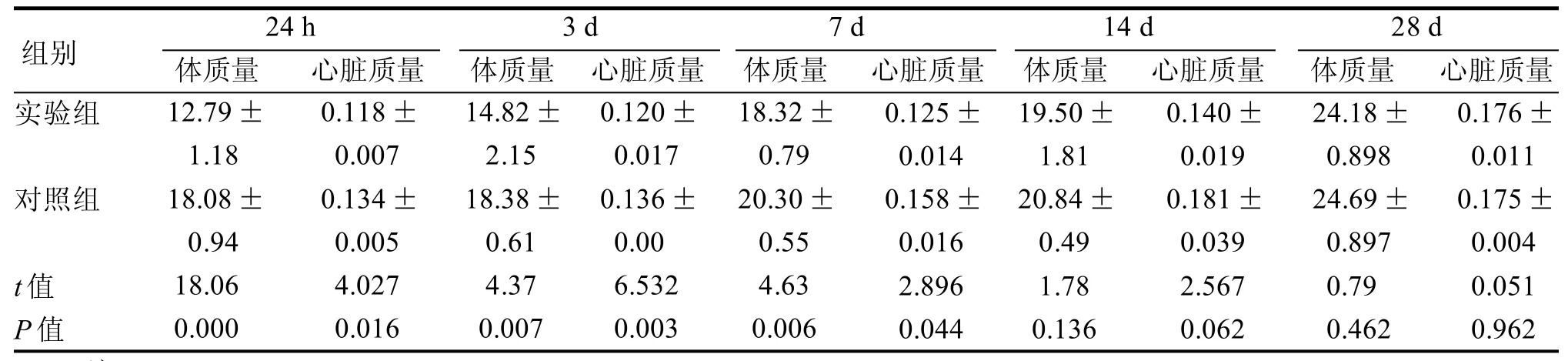
表1 小鼠体质量、心脏质量比较 g
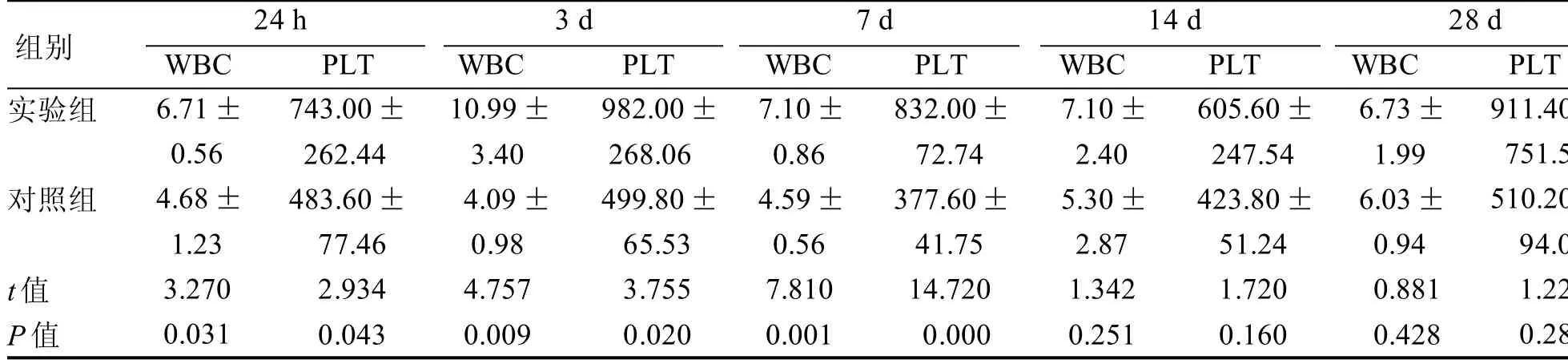
表2 小鼠血液WBC、PLT数值比较 109/L
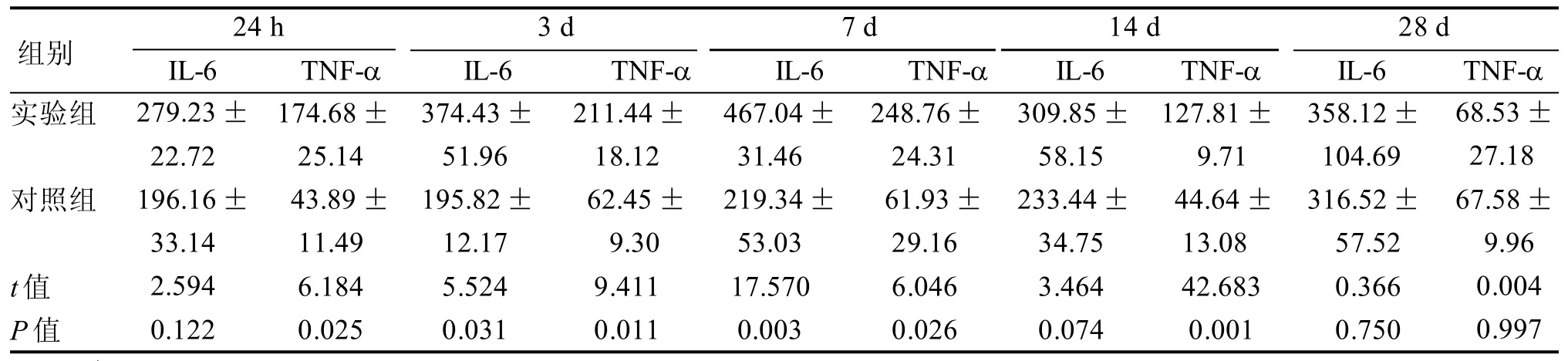
表3 小鼠血浆中IL-6、TNF-α浓度比较 ng/L
2.4 冠状动脉内皮细胞及线粒体形态学定性分析
电子显微镜下见对照组小鼠血管内皮形态正常, 血管肌层连接好, 内皮细胞内线粒体形态饱满,嵴方向统一(图2 A)。实验组小鼠在注射CAWS后24 h见血管内皮肿胀,细胞内可见空泡, 细胞核轻度染色质聚集, 线粒体肿胀, 嵴模糊、减少(图2 B);注射后3 d见血管内皮细胞空泡增多,细胞核染色质聚集,胞内溶酶体多见,线粒体明显减少,嵴基本消失(图2 C); 注射后7 d见血管内皮变性,胞内见大量脂滴样结构,线粒体肿胀较前减轻,可见嵴(图2 D); 14 d见内皮细胞变性恢复,胞内少许空泡,部分区域见脂滴样结构,线粒体肿胀较前缩减,连接顺序较好,嵴外观恢复,方向稍乱(图2 E); 28 d见内皮结构基本恢复正常,无空泡,线粒体数量恢复,形态正常,连接顺序好,嵴排列整齐(图2 F)。
随机选取冠状动脉内皮细胞线粒体电子显微镜图片, 测量去除本底值后的平均灰度, 进行统计学分析电子密度差异。其中实验组24 h、3 d、7 d、14 d, 与对照组相比差异有统计学意义(P<0.05); 实验组28 d, 与对照组相比差异无统计学意义(P>0.05)(表 4)。
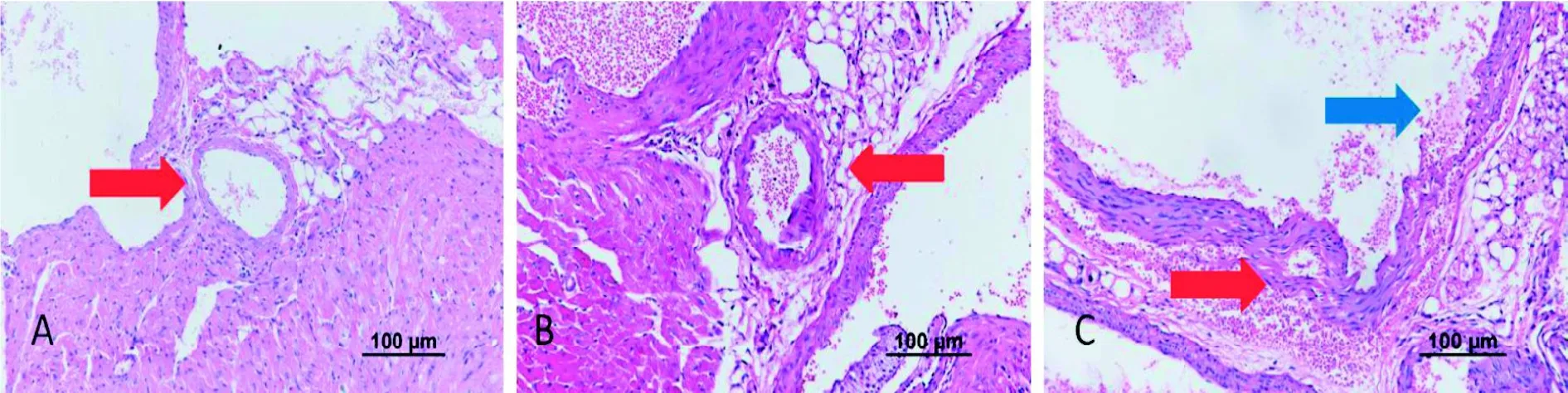
图1 CAWS注射后小鼠冠状动脉病理改变 (HE×200)
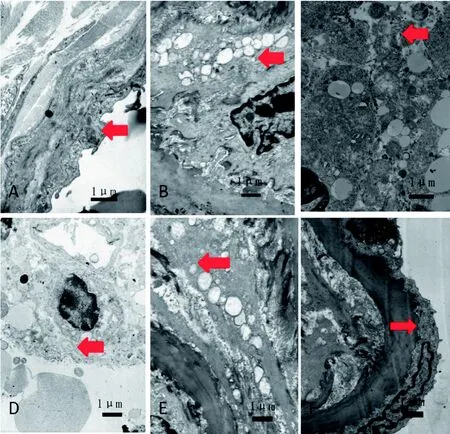
图2 小鼠冠状动脉内皮细胞超微结构改变

表4 小鼠冠状动脉内皮细胞线粒体电子显微镜灰度比较
3 讨论
目前研究认为, 中小血管炎症是KD的主要病理改变。血管炎症的长期存在, 是最终并发冠状动脉粥样硬化的基础[10]。但现阶段KD发病机制并不十分清楚, 可能与感染、环境、遗传易感性、T细胞介导的免疫应答、内皮细胞功能障碍等有关[11]。本实验构建了小鼠免疫性血管炎模型,模拟KD时的冠状动脉炎症改变,观察冠状动脉血管内皮及其线粒体的动态变化。血管内皮细胞覆盖于血管内膜表面,是血管组织与血液内部炎症因子相互作用最密切的部分。内皮细胞的损伤和功能障碍,有早期提示KD病情深化和转归的作用。KD血管炎症进一步发展,可发生血管壁平滑肌和内弹力层破坏,引发冠状动脉扩张和动脉瘤[12]。
既往研究表明,人KD患者血液中抗白色念珠菌细胞壁抗原β-葡聚糖(BG)的抗体滴度高于正常人[13]。本研究采用CAWS诱导小鼠产生免疫性血管炎,得到与人KD相似的结果。本实验中小鼠血WBC及PLT的改变,血液中炎症因子IL-6及TNF-α水平变化,与冠状动脉内皮细胞及线粒体的炎症改变趋势一致。实验组小鼠体质量及心脏质量,均较对照组减轻。此提示实验组小鼠炎症时代谢增加,存在能量代谢的负平衡。线粒体作为细胞能量代谢的主要器官,起着敏感提示细胞功能状态的作用。
线粒体是细胞进行三羧酸循环、有氧呼吸的场所。细胞中线粒体的数量和活力决定了细胞的代谢水平,代谢旺盛的细胞线粒体含量较多。在本实验电子显微镜超微结构显示中,对照组小鼠内皮细胞含大量线粒体、内质网等细胞器,说明细胞代谢活跃,生长良好。实验组小鼠内皮细胞损伤时,线粒体的功能和形态也会发生相应的变化,线粒体减少,表明细胞呼吸减退,活力下降。线粒体在细胞能量转化的同时,也是细胞内自由基的主要来源。血管内皮细胞在炎症状态时,细胞内会产生较多的活性氧及超氧化物,这些都会导致线粒体膜电位的变化,线粒体肿胀最终导致线粒体功能的障碍[14]。而线粒体活性氧的失衡,通过各种代谢途径,进一步加剧了血管内皮的损伤[15]。
既往文献[16,17]报道CAWS制作的KD小鼠模型中, 均使用4 mg/只×5 d腹腔注射法。本研究小组在预实验中, 曾设想多种剂量的CAWS诱导小鼠制作免疫性冠状动脉炎模型。但经病理学染色后分析, 炎症反应在8 mg/只×5 d时最为明显。如继续加大剂量,达到10 mg/只×5 d时,C57BL/6小鼠出现较高的死亡率,遂选用8 mg/只×5 d腹腔注射法制作模型。另外,电子显微镜还观察到免疫性冠状动脉炎状态下内皮细胞核染色质的改变,这对研究KD血管内皮细胞的修复和更新机制,起到提示作用。
本研究从病理学角度观察到在免疫性冠状动脉炎小鼠模型中, 冠脉内皮细胞线粒体形态的改变与病情发展同步。因小鼠在体的冠状动脉内皮细胞可获取数量少, 难以取得相关线粒体膜电位等线粒体功能相关数据, 相关的膜电位等研究, 拟于离体的内皮细胞相关细胞学实验中进一步研究。线粒体在免疫性血管炎中的作用机制也是需要进一步研究的方向。本实验为进一步研究KD冠状动脉损伤的发病机制及早期诊断、药物干预等,构建实验平台。
[1]Dodi I, Raggi V, Verna M, et al. Atipical Kawasaki disease with coronary aneurysm in infant[J]. Ital J Pediatr, 2011, 37(4):19.
[2]时艳艳, 刘芳, 吴琳, 等. 川崎病冠状动脉病变严重程度临床分级及高危因素研究[J]. 中国实用儿科杂志, 2014, 29(9):681-686.
[3]Gerding R. Kawasaki disease: a review[J]. J Pediatr Health Care, 2011, 25(6):379-387.
[4]Liu AM, Ghazizadeh M, Onouchi Z, et al. Ultrastructuralcharacteristics of myocardial and coronary microvascular lesions in Kawasaki disease[J]. Microvasc Res, 1999, 58(1):10-27.
[5]Dou J, Li H, Sun L, et al. Histopathological and ultrastructural examinations of rabbit coronary artery vasculitis caused by bovine serum albumin: an animal model of Kawasaki disease[J]. Ultrastruct Pathol, 2013, 37(2):139-145.
[6]Pietraforte D, Gambardella L, Marchesi A, et al. Platelets in Kawasaki patients: two different populations with different mitochondrial functions[J]. Int J Cardiol, 2014, 172(2):526-528.
[7]Duong TT, Silverman ED, Bissessar MV, et al. Superantigenic activity is responsible for induction of coronary arteritis in mice: an animal model of Kawasaki disease[J]. Int Immunol,2003, 15(1):79-89.
[8]Arruda AP, Pers BM, Parlakgul G, et al. Chronic enrichment of hepatic endoplasmic reticulum-mitochondria contact leads to mitochondrial dysfunction in obesity[J]. Nat Med, 2014,20(12):1427-1435.
[9]Yoshikane Y, Koga M, Imanaka-Yoshida K, et al. JNK is critical for the development of Candida albicans-induced vascular lesions in a mouse model of Kawasaki disease[J].Cardiovasc Pathol, 2015, 24(1):33-40.
[10]斯徐伟, 奚赛飞, 徐孝平, 等. ZDF与SD大鼠动脉粥样硬化形成及其磷脂酶A2表达的比较研究[J]. 实验动物与比较医学, 2015, 35(1):10-16.
[11]Manlhiot C, Mueller B, O’Shea S, et al. Environmental epidemiology of Kawasaki disease: Linking disease etiology,pathogenesis and global distribution[J]. PLoS One, 2018, 13(2):e191087.
[12]Orenstein JM, Shulman ST, Fox LM, et al. Three linked vasculopathic processes characterize Kawasaki disease: a light and transmission electron microscopic study[J]. PLoS One, 2012, 7(6):e38998.
[13]Ishibashi K, Fukazawa R, Miura NN, et al. Diagnostic potential of antibody titres against Candida cell wall betaglucan in Kawasaki disease[J]. Clin Exp Immunol, 2014, 177(1):161-167.
[14]Gero D, Torregrossa R, Perry A, et al. The novel mitochondriatargeted hydrogen sulfide (H2S) donors AP123 and AP39 protect against hyperglycemic injury in microvascular endothelial cells in vitro[J]. Pharmacol Res, 2016, 113(Pt A):186-198.
[15]Kirsch J, Schneider H, Pagel JI, et al. Endothelial dysfunction,and a prothrombotic, proinflammatory phenotype is caused by loss of mitochondrial thioredoxin reductase in endothelium[J]. Arterioscler Thromb Vasc Biol, 2016, 36(9):1891-1899.
[16]Hamaoka-Okamoto A, Suzuki C, Yahata T, et al. The involvement of the vasa vasorum in the development of vasculitis in animal model of Kawasaki disease[J]. Pediatr Rheumatol Online J, 2014, 12(3):12.
[17]Yan ZT, Zou JW. Triptolide as an alternative to IVIG therapy for Kawasaki disease in a mouse model[J]. Balkan Med J,2013, 30(2):225-228.
