纳他霉素复合涂膜剂对板栗的保鲜效果
2018-07-06王大红张帅滢宋鹏辉孙建瑞
王大红, 张帅滢, 宋鹏辉, 张 颖, 孙建瑞
(河南科技大学食品与生物工程学院/微生物资源开发与利用实验室,河南 洛阳 471023)
板栗(Chestnut) 素有“干果之王”、“木本粮食”之称,主要分布于中国大陆、越南及台湾地区[1],栗果富含淀粉及蛋白质,具有养胃健脾,延缓人体衰老等功能[2]。板栗在贮藏和运输期间,极易生虫、失水、腐烂、发芽等,损失率约为30%[3]。在贮存期间造成板栗损失的主要原因有:一是象鼻虫的寄生,在板栗生长期间侵入板栗内部,最终导致虫害[4];二是微生物侵袭导致板栗仁腐烂,主要是真菌[5];三是水分蒸发,导致果仁干缩;四是植物呼吸导致的衰老[6]。因此,板栗不易储存,保鲜难度较大。目前,板栗的保鲜主要采用防腐处理、涂膜和辐射处理等方法[7-8],在防腐处理方面,采用水杨酸、焦亚硫酸钠等化学防腐剂的较多,而采用生物防腐剂的较少[9]。
纳他霉素(Natamycin)是由纳塔尔链霉菌等放线菌产生的一种能有效抑制真菌生长和真菌毒素产生的多烯类抗生素,因其高效、安全,已被世界上大多数国家批准用做食品防腐剂[10],已经广泛应用在乳制品、肉类、水果和饮料上[11]。本试验采用纳他霉素复合涂膜剂处理板栗,研究在保鲜过程中板栗的品质变化,为延长板栗的保藏期提供参考。
1 材料与方法
1.1 材料
板栗为河南省信阳市豫罗红板栗。
纳他霉素、乳酸链球菌素和ε-聚赖氨酸由浙江新银象生物工程有限公司生产;山梨酸钾,上海蓝季科技有限公司产品;普鲁兰多糖,百纳食品配料有限公司产品;水溶性大豆多糖,河南正顺生物科技有限公司产品。
1.2 仪器
恒温培养箱,上海精宏实验设备厂产品;电热恒温水浴锅,北京科伟仪器有限公司产品;高速冷冻离心机,德国Sigma公司产品;UV-2600紫外分光光度计,日本岛津公司产品。
1.3 试验方法
1.3.1 防腐剂的筛选 把板栗随机分为6组,每组3 kg,每组设3个平行试验,采用0.3 g/kg纳他霉素; 0.3 g/kg纳他霉素+0.5 g/kg山梨酸钾;0.3 g/kg纳他霉素+0.5 g/kg苯甲酸钠;0.3 g/kg纳他霉素+0.2 g/kg乳酸链球菌素;0.3 g/kg纳他霉素+0.2 g/kgε-聚赖氨酸作为单一和复合防腐剂进行喷洒处理,晾干后放入有孔氯乙烯塑料袋内, 15 ℃恒温箱中保存60 d后统计腐烂率。
1.3.2 板栗涂膜剂的筛选 选取普鲁兰多糖、水溶性大豆多糖、壳聚糖、甲基纤维素和大豆分离蛋白作为涂膜剂,按每1 kg板栗加入10 g涂膜剂的比例,分别与筛选的防腐剂混合喷洒,晾干后放入有孔氯乙烯塑料袋内,15 ℃恒温箱中保存60 d后统计质量损失率。
1.3.3 保鲜试验 将板栗随机分为12组,每组3 kg,每组设3个平行试验,将板栗采用复合防腐剂处理,然后放入有孔聚氯乙烯塑料袋内,15 ℃保存90 d,每15 d 取样测定板栗多糖、PPO、POD和PAL等相关生理指标。贮存结束后,测定板栗的质量损失率、腐烂率。
1.3.4 质量损失率的测定 质量损失率计算公式:质量损失率=(每组板栗损失的质量/保存前板栗总质量) ×100%
1.3.5 腐烂率的测定 腐烂率计算公式:腐烂率=(腐烂果数/总果数) ×100%
1.3.6 板栗中多糖含量的测定 采用蒽酮-硫酸比色法测定板栗中多糖含量[12]。
1.3.7 过氧化物酶(POD)和多酚氧化酶(PPO)活性的测定 酶液制备:板栗果肉切碎,取2 g放入研钵中,加20 ml的0.05 mol/L磷酸缓冲液(pH=6.8),在冰浴中研磨成浆,以10 000 r/min冷冻离心15 min,上清液即为待测酶液。
过氧化物酶活性的测定:采用愈创木酚法[13]。将0.2 ml 酶液加入1 ml 0.05 mol/L愈创木酚溶液,30 ℃水浴5 min,加入1 ml 2% H2O2溶液,以经过沸水处理的酶液为对照。加入酶液,每隔0.5 min在波长为470 nm处测定吸光度,吸光度每1 min增大0.001为1个POD活力单位,以此计算板栗中POD酶活性。
多酚氧化酶活性的测定:采用邻苯二酚法[14]。将0.2 ml 酶液加入2 ml 0.5 mol/L邻苯二酚溶液,30 ℃水浴5 min,以经过沸水处理的酶液为对照。加入酶液,每隔0.5 min测定波长为410 nm的吸光度,吸光度每1 min增大0.001为1个PPO活力单位,以此计算板栗中PPO酶活性。
1.3.8 苯丙氨酸解氨酶(PAL)活性的测定 酶粗提液的制备:板栗果肉1 g,加20 ml 5 mmol/L的巯基乙醇的硼酸缓冲液、0.5 g聚乙烯吡咯烷酮,在冰浴中研磨成浆,10 000 r/min冷冻离心15 min,上清液稀释4倍即为反应酶液。
酶活性测定[15]:1 ml酶液加1 ml 0.02 mol/L 苯丙氨酸和2 ml蒸馏水,反应在30 ℃水浴中进行,每隔0.5 h测定波长为290 nm的吸光度,对照组以蒸馏水代替苯丙氨酸。吸光度每1 h增大0.01为1个PAL酶活单位。
1.4 数据处理
每组试验重复3次,结果取平均值,采用Excel 2007软件对数据进行处理并绘图,试验数据以“平均值±标准差”表示,采用SPSS 19.0 软件进行差异显著性分析。
2 结果与分析
2.1 板栗防腐剂的筛选与优化
根据《食品添加剂使用标准》(GB2760-2014)规定,纳他霉素、乳酸链球菌素、ε-聚赖氨酸、山梨酸钾和苯甲酸钠最大使用量分别为0.3 g/kg、0.5 g/kg、0.3 g/kg、1.0 g/kg和1.0 g/kg。考虑到防腐剂可能渗透到板栗果仁中,本研究使用的防腐剂浓度不超过国家规定的最大使用量,分别选择纳他霉素;纳他霉素+山梨酸钾;纳他霉素和苯甲酸钠;纳他霉素+乳酸链球菌素;纳他霉素+ε-聚赖氨酸作为单一和复合防腐剂,板栗处理后放置60 d测定腐烂率。从图1中可以看出,对照组的板栗腐烂率为42.4%,第2~6组的腐烂率比对照组都低,与对照组差异显著(P<0.05);其中第3组(纳他霉素+山梨酸钾)的腐烂率最低,板栗腐烂率为8.8%,远低于对照组,与对照组差异极显著(P<0.01),防腐效果最佳。
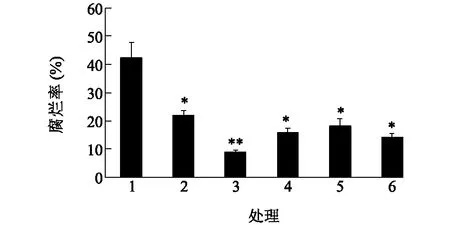
1:对照;2:0.3 g/kg纳他霉素;3:0.3 g/kg纳他霉素+0.5 g/kg山梨酸钾;4:0.3 g/kg纳他霉素+0.5 g/kg苯甲酸钠;5:0.3 g/kg纳他霉素+0.2 g/kg乳酸链球菌素;6:0.3 g/kg纳他霉素+0.2 g/kg ε-聚赖氨酸。*表示与对照差异显著;**表示与对照差异极显著。图1 不同防腐剂对板栗腐烂率的影响Fig.1 Effect of different preservatives on the rot rate of chestnuts
根据图1结果,采用0.05 g/kg、0.10 g/kg、0.20 g/kg、0.30 g/kg和0.40 g/kg的纳他霉素与0.50 g/kg山梨酸钾组成不同质量比的复合防腐剂,优化纳他霉素的添加浓度。结果如图2所示,随着纳他霉素浓度的提高,板栗腐烂率降低,0.2 g/kg纳他霉素和0.50 g/kg山梨酸钾组合具有较好的防腐能力,板栗的腐烂率为9%,与第一组(0.05 g/kg纳他霉素+0.50 g/kg山梨酸钾)差异显著(P<0.05);随着纳他霉素质量比的增加, 0.4 g/kg纳他霉素+0.50 g/kg山梨酸钾组与第一组差异极显著(P<0.01),但是与0.20 g/kg纳他霉素+0.50 g/kg山梨酸钾组差异不明显,同时,0.2 g/kg纳他霉素低于食品安全国家标准规定的纳他霉素使用质量比(0.3 g/kg)。
2.2 板栗涂膜剂的筛选
涂膜剂可以降低板栗贮藏期间的呼吸强度,从而延长板栗的贮藏时间。根据《食品添加剂使用标准》(GB2760-2014)规定,普鲁兰多糖、水溶性大豆多糖等大多数涂膜剂使用量不超过10 g/kg。考虑到选用的涂膜剂为高分子化合物,很难渗透入板栗果仁,并参考在其他农产品贮藏中的应用情况[16],本研究中每种涂膜剂的使用质量比为1%(即10 g/kg),分别与筛选的防腐剂组成复合防腐剂,研究不同涂膜剂对板栗质量损失率的影响。从图3中可以看出,普鲁兰多糖、水溶性大豆多糖显示出较好的保鲜效果。普鲁兰多糖涂膜保鲜效果最好,板栗的质量损失率为7%,与对照组差异显著(P<0.05);其次为水溶性大豆多糖,损失率为9%,与对照组差异不显著(P>0.05),而其他3种涂膜剂效果不好。因此,选用0.2 g/kg纳他霉素+0.5 g/kg山梨酸钾+ 1%普鲁兰多糖(B组)和0.2 g/kg纳他霉素+0.5 g/kg山梨酸钾+ 1%水溶性大豆多糖 (C组)作为2种复合涂膜剂,进行后续研究。

*表示与对照差异显著(P<0.05)。图3 不同涂膜剂对板栗质量损失率的影响Fig.3 Effects of different coating compounds on mass loss weight of chestnuts
2.3 纳他霉素复合涂膜剂对板栗生理生化的影响
2.3.1 复合涂膜剂对板栗腐烂率和质量损失率的影响 板栗采用复合涂膜剂后,15 ℃贮藏90 d,测定板栗腐烂率和质量损失率,结果见图4,对照组(A组)的板栗因受微生物侵染,腐烂率达到64%,质量损失率达到22%;而B组和C组对微生物均具有不同程度的防治效果,腐烂率分别为8.0%和12.0%,质量损失率分别为5.3%和7.0%,与对照组差异极显著(P<0.01)。结果表明,使用复合涂膜剂后可显著提高板栗的保鲜效果。

A组:对照;B组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%普鲁兰多糖;C组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+1%水溶性大豆多糖。**表示与对照差异极显著(P<0.01)。图4 不同处理对板栗腐烂率和质量损失率的影响Fig.4 Effects of different treatments on the rot rate and mass loss weight of chestnuts during storage
2.3.2 复合涂膜剂对板栗淀粉含量的影响 板栗在贮藏期间,淀粉水解为单糖供给植物呼吸而被消耗,其含量会逐渐降低,其消耗的速度与水解酶的活性以及板栗生理代谢旺盛程度有关。从图5可看出,对照组(A组)中板栗淀粉含量在贮藏初期(30 d内)下降较快,下降了约12个百分点,而B组和C组下降约4个百分点和9个百分点,B组与对照组差异极显著(P<0.01),C组与对照组差异不显著(P>0.05);中期(30~45 d)比较平稳,后期(45 d以后)快速降低。A组至第90 d时淀粉含量由初始的48.4%降低至15.4%,B组和C组下降速度明显慢于对照组,淀粉含量分别为31.8%和27.6%,B组与对照组差异极显著(P<0.01),C组与对照组差异显著(P<0.05)。结果表明,复合涂膜剂的处理对减缓板栗淀粉水解均有效果,且B组好于C组。

A组:对照;B组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%普鲁兰多糖;C组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+1%水溶性大豆多糖。图5 板栗贮藏期间板栗淀粉含量的变化Fig.5 Changes of starch content of chestnuts during storage
2.3.3 复合涂膜剂对板栗PPO酶活性的影响 褐变是板栗在贮藏过程中质量降低的原因之一,发生褐变的主要原因是板栗中的PPO作用于多酚类底物氧化所引起的一种病理反应。多酚氧化酶是引起果蔬酶促褐变的酶,在有氧的条件下,PPO能催化酚类物质氧化为醌,醌通过聚合反应产生有色物质导致组织褐变。本研究检测了板栗保鲜过程中PPO的变化水平,由图6可知,B组在前15 d内上升较快,明显高于A组和C组,与对照组差异显著(P<0.05),说明普鲁兰多糖作为涂膜剂在保鲜前期抑制板栗褐变效果不佳;到第45 d时,对照A组PPO水平显著上升,达到17.67 U/(min·g),而B组上升幅度不大,与对照组差异显著(P<0.05);45 d后,3个处理的PPO水平开始下降,B组和C组显著下降,至90 d,PPO活性顺序为:A>C>B,C与对照组差异显著(P<0.05),B与对照组差异极显著(P<0.01)。贮藏至第90 d,对照组的PPO比2个试验组都高约5个酶活单位,说明纳他霉素复合涂膜剂有一定的防止板栗果实褐变的能力。
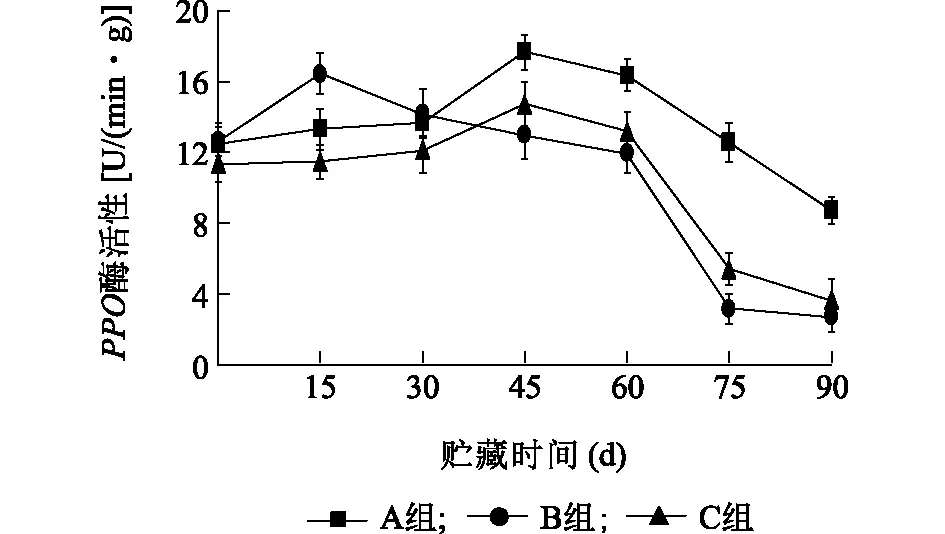
A组:对照;B组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%普鲁兰多糖;C组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%水溶性大豆多糖。图6 不同处理对板栗PPO的影响Fig.6 Effects of different treatments on PPO activity of chestnut
2.3.4 复合涂膜剂对板栗POD酶活性的影响POD可清除植物组织中低浓度的H2O2,从而使植物组织免受H2O2的毒害作用。由图7可知,随着板栗贮藏时间的加长,对照组(A组)和处理组(B组和C组)均出现先升高后降低的现象。对照组的POD值,45 d时达到最大值[392 U/(min·g)],原因可能是对照组的板栗被一些微生物感染,使板栗果实中的H2O2含量升高,植物组织的防御反应会促使相应的酶活性升高;同时,感染的微生物也会引起POD酶活性的变化,胡青平等[17]报道烟草感染青枯菌后,根、茎、叶内的POD活性均比对照高,其中叶内比对照增高了29.67%。而B组和C组在45 d 时POD活性为248 U/(min·g)和269 U/(min·g),B与对照组差异极显著(P<0.01),C与对照组差异显著(P<0.05)。随后A组逐渐下降,至90 d时下降到260 U/(min·g)。B组和C组的POD含量上升缓慢,75 d达到最大值,分别为320 U/(min·g)和316 U/(min·g),POD活性顺序为:B>C>A,B组和C组与对照组差异不显著(P>0.05)。
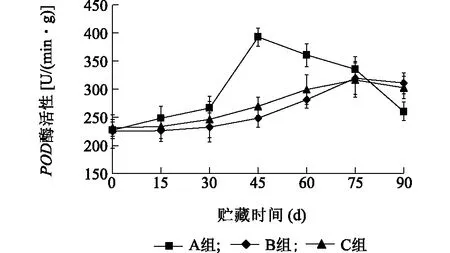
A组:对照;B组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%普鲁兰多糖;C组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%水溶性大豆多糖。图7 不同处理对板栗POD的影响Fig.7 Effect of different treatments on POD activity of chestnut
2.3.5 复合涂膜剂对板栗PAL酶活性的影响 植物组织在遇到不良环境时,PAL活性升高,PAL的活性可以作为植物抗逆环境的一个重要生理指标。从图8可以看出,在板栗保存的前15 d,3组的苯丙氨酸解氨酶活性相差不大。15 d之后各组PAL活性升高,其中A组上升比较缓慢,到60 d时达到最大值[3.8 U/(h·g)],之后便快速下降;而B组C组板栗PAL酶活性上升较快,到90 d时,分别达到7.9 U/(h·g)和8.7 U/(h·g),两者相差不大,两处理组与对照差异极显著(P<0.01)。说明复合涂膜剂能够提高PAL活性,从而增强板栗果实的抗病性,对板栗的保鲜具有积极作用。
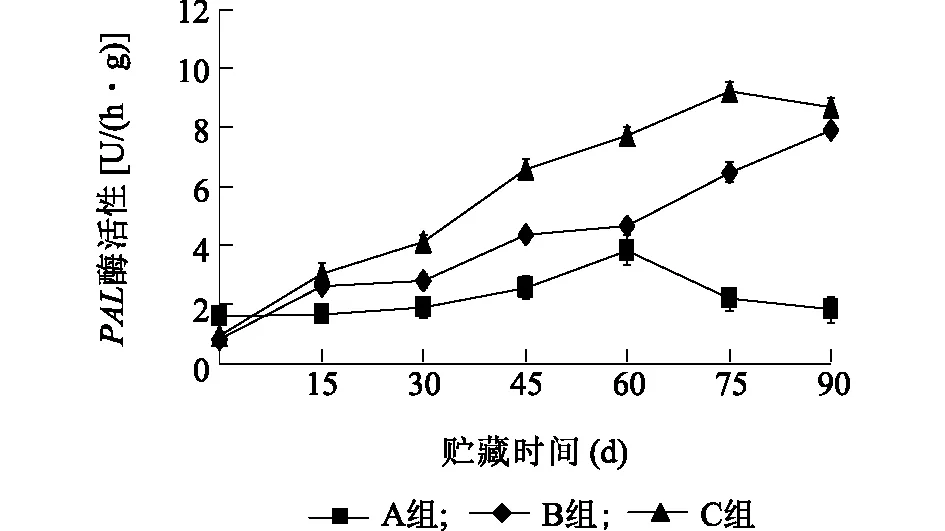
A组:对照;B组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%普鲁兰多糖;C组:纳他霉素(0.2 g/kg)+山梨酸钾(0.5 g/kg)+ 1%水溶性大豆多糖。图8 不同处理对板栗PAL的影响Fig.8 Effects of different treatments on PAL activity of chestnut
3 讨 论
纳他霉素主要破坏膜的通透性,从而引起菌体内氨基酸和电解质等物质渗漏,导致细胞死亡,但仅限于抑制酵母和霉菌的作用,阻止丝状真菌中黄曲霉毒素的形成,不能防治细菌的浸染[18]。普鲁兰多糖和水溶性大豆多糖具有成膜性好、无毒可食等优良特性。因此纳他霉素复合防腐剂配以普鲁兰多糖或水溶性大豆多糖成膜剂作为天然保鲜剂,对板栗的保鲜贮藏起到了良好的促进作用,在葡萄、樱桃等保鲜中应用较多[6]。
本研究中采用复合防腐剂配以普鲁兰多糖或水溶性大豆多糖成膜剂处理板栗,其果实腐烂率、质量损失率和淀粉含量等都有较大的改善,表明纳他霉素复合涂膜保鲜剂主要通过抑制腐烂微生物的繁殖,防止板栗果实水分的散失,能有效抑制板栗的腐烂,从而达到良好的保鲜效果。复合防腐剂配以普鲁兰多糖或水溶性大豆多糖均能有效降低板栗果实中PPO活性;而POD活性在前期都逐渐升高,中后期对照组POD活性迅速下降,后期处理组的POD活性高于对照;处理组PAL活性始终高于对照组,尤其在储存的中后期特别明显,这说明纳他霉素复合涂膜剂对减少板栗腐烂和诱导PAL活性的上升有一定的关系。根据板栗腐烂率、板栗淀粉含量和相关酶活性的变化,普鲁兰多糖作为板栗涂膜剂比水溶性大豆多糖效果好。纳他霉素复合普鲁兰多糖涂膜剂主要通过提高板栗的抗病性,增强杀菌能力,避免水分蒸发,从而有效提高了板栗的保鲜效果。
参考文献:
[1] 王继芝.迁西板栗天然复合保鲜剂保鲜技术研究[J].河北工业科技,2014,31(6):494-497.
[2] 王海霞.板栗贮藏期实腐病及其病理和防腐保鲜研究[D].呼和浩特:内蒙古农业大学,2007.
[3] 朱 勇,杜宏彬.板栗种子保活和保鲜贮藏[J].农业开发与装备,2014(7):128-129.
[4] 王晓勤,温晓蕾,路常宽.我国板栗害虫防治研究进展[J].河北科技师范学院学报, 2010, 24(1):39-44.
[5] 刘月梅,白小安.板栗贮藏的保鲜机理与影响因素[J].河北农业科学,2008,12(1):116-117.
[6] 杨小胡,梁丽松,王贵禧,等.次氯酸钠水浴处理对板栗呼吸和几种酶活性的影响[J].林业科学,2007, 43(2):37-42.
[7] 刘 超,汪晓鸣,张福生.辐照对板栗冷藏后期生理的影响[J].核农学报,2007,21(3):281-282.
[8] 顾仁勇,李志平,银永忠.微波结合纳他霉素-魔芋胶涂膜处理对板栗的保鲜效果[J].食品科学,2013, 34(24):309-312.
[9] 池 明,鲁周民,刘驰旻,等.水杨酸处理对板栗冷藏品质及呼吸强度的影响[J].食品工业科技,2010(1):347-349,353.
[10] CLARA F,ARTIN M,MIGUEL A,et al.Cerqueira functional characterisation and antimicrobial efficiency assessment of smart nanohydrogels containing natamycin incorporated into polysaccharide-based films[J]. Food and Bioprocess Technology,2015,8(7):1430-1441.
[11] HANUSOV K,STASTNA M,VOTAVOVA L,et al. Polymer films releasing nisin and/or natamycin from polyvinyldichloride lacquer coating:nisin and natamycin migration,efficiency in cheese packaging[J]. Journal of Food Engineering,2010,99(4):491-496.
[12] 汤灿辉,彭新君,文礼章,等.蒽酮-硫酸比色法测定三叶虫茶中总糖的含量[J].湖南中医药大学学报,2008,28(5):38-40.
[13] 姜爱丽,胡文忠,李 慧,等.纳他霉素处理对采后甜樱桃生理代谢及品质的影响[J].农业工程学报,2009,25(12):351-356.
[14] JIANG A,TIAN S,XU Y. Effect of CA with high-O2or high-CO2concentrations on postharvest physiology and storability of sweet cherry[J]. Acta Botanic Sinica,2002,44(8):925-930.
[15] ASSIS J,MALDONADO R,MUNOZ T,et al. Effect of high carbon dioxide concentration onPALactivity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology,2001,23(1):33-39.
[16] 刘美迎,周会玲,吴主莲,等.纳他霉素复合涂膜剂对葡萄保鲜效果的影响[J].农业工程学报,2012,28(10):259-263.
[17] 胡青平,徐建国,薄芳芳,等. 烟草感染青枯菌前后POD及同工酶的变化[J].中国农学通报,2007,23(6):497-500.
[18] 阎永贞,那 可,魏晓东,等.纳塔尔链霉菌产纳他霉素发酵条件的优化[J].中国抗生素杂志,2013,38(6):424-429.
