樱桃砧木PcWRKY1基因的克隆与表达分析
2018-07-06宗晓娟朱东姿魏海蓉王甲威张力思刘庆忠
徐 丽, 陈 新, 宗晓娟, 朱东姿, 魏海蓉, 王甲威, 谭 钺, 张力思, 刘庆忠
(山东省果树研究所/山东省果树生物技术重点实验室,山东 泰安 271000)
干旱和盐碱等非生物胁迫是影响植物生长发育的主要限制因素[1-3]。为适应这些非生物胁迫,植物在分子水平上进化形成了相应的机制,诱导胁迫相关转录因子的表达。因为转录因子能通过参与不同的复杂的信号通路,调控植物的生理生化活动来抵御逆境。WRKY是目前研究较为广泛的一类植物特有的转录因子,存在1个或2个高度保守的WRKYGQK结构域及紧随其后的一段锌指结构[4]。研究结果表明拟南芥和水稻中分别有74和126个WRKY基因家族成员,而在绿藻中仅有一个成员[5]。Zhou等[6]把大豆GmWRKY13和GmWRKY54分别转到拟南芥中,过量表达GmWRKY54的植株对干旱和盐害都具有一定的忍耐性,而过量表达GmWRKY13的植株对盐害和甘露醇胁迫敏感。过表达AtWRKY25和AtWRKY33能够通过影响SOS(Salt overly sensitive)通路来提高拟南芥对高盐环境的耐受性[7]。Song等[8]用PEG,NaCl和ABA处理转OsWRKY08基因的拟南芥,发现OsWRKY08基因表达量增加,改善了转基因拟南芥渗透调节能力。相似的ZmWRKY33受高盐、干旱、低温和ABA诱导表达,且转基因拟南芥的耐盐性提高[9]。Sun等[10]的研究结果表明二穗短柄草BdWRKY36能提高转基因烟草耐受干旱的能力。棉花的GhWRKY17在受干旱、高盐处理的诱导后大量表达[11]。目前已从拟南芥[12][Arabidopsisthaliana(L.) Heynh.]、水稻[13](OryzasativaL.)、油菜[14](BrassicanapusL.)、大豆[15][Glycinemax(Linn.) Merr.]等植物中克隆到大量的WRKY转录因子。而樱桃中还未见相关WRKY转录因子的研究报道。
由于樱桃喜温、不耐寒、不耐盐碱,所以其分布和栽培区域受到限制,因此种植樱桃除选择抗逆性强的品种,还要选择合适的具有抗性的砧木。樱桃砧木在樱桃生产中起着非常重要的作用,因此改善砧木抗逆性迫在眉睫。通过常规育种获得新品种周期较长,而通过基因工程获得抗逆新品种日益受到重视,其中关键基因的挖掘是前提。本课题组利用RNA-Seq技术获得了樱桃转录组数据,本研究以此转录组数据为基础,以甜樱桃砧木Gisela 6叶片为材料,采用RT-PCR方法,筛选并克隆了樱桃砧木WRKY转录因子,进行了生物信息学和胁迫诱导表达模式分析,为樱桃抗逆品种选育提供理论依据和技术支持,也为樱桃的分子育种提供基因资源。
1 材料与方法
1.1 材料与处理
供试材料为Gisela 6(PrunuscerasusXPrunuscanescens)组培苗。组培苗在MS+0.5 mg/L 6-BA,附加蔗糖20.0 mg/L、琼脂6.0 mg/L,pH为5.6的继代培养基上培养。对培养3周的组培苗分别转移到添加甘露醇(200 mmol/L)和NaCl(200 mmol/L)的培养基上,每个处理重复3次,每个重复9瓶,分别于0 h、2 h、4 h、6 h、12 h、24 h、48和72 h取组培苗叶片。采集后立即投入液氮冷冻,保存于-80 ℃冰箱备用。
1.2 RNA提取和cDNA合成
采用RN38-EASYspin Plus植物RNA快速提取试剂盒(北京,艾德莱)提取总RNA。反转录参照Fermentas公司说明书进行,以Oligo(dT)18为引物合成cDNA第一链。
1.3 PcWRKY1基因的克隆
以获得的樱桃转录组数据为基础,设计1对引物PcWRKY1-F(5′-ATGATTTCTCTAGGGGAACCTGG-3′)和PcWRKY1-R (5′-TTAGACAGGTTCTGCTTTTGGATTT-3′)。以反转录cDNA为模板进行PCR扩增,PCR反应条件: 94 ℃ 预变性5 min;94 ℃变性30 s,56 ℃退火40 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,目的片段切胶回收和连接pEASY-Blunt载体(北京,全式金),转化大肠杆菌DH5α,菌落PCR检测后挑取5个阳性菌落送交上海生工生物公司测序。
1.4 樱桃PcWRKY1基因的生物信息学分析
用NCBI提供的在线ORF Finder( http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找基因的开放阅读框(ORF),用BLAST ( http://blast.ncbi.nlm.nih.gov) 进行核苷酸及氨基酸序列的同源序列搜索,用DNAMAN软件构建系统进化树。用ProtParam (http://us.expasy.org/tools/ProtParam.html) 预测编码蛋白质的分子量、等电点等理化特性,通过ProtScale软件分析(http://www.expasy.org/cgibin/protscale.pl)氨基酸序列的疏/亲水性。
1.5 PcWRKY1基因非生物胁迫表达分析
提取不同处理材料的总RNA,按照试剂盒说明书反转录合成第一链cDNA(Fermentas)。利用Real-time qRT-PCR分析樱桃砧木PcWRKY1基因分别在200 mmol甘露醇和200 mmol NaCl胁迫下的表达情况。以稀释后的cDNA为模板,甜樱桃β-actin基因(Accession no. FJ560908)为内参,利用ABI7500型荧光定量PCR仪,参照康为公司UltraSYBR mixture with Rox试剂盒说明书进行。PCR反应条件:95 ℃变性10 min;95 ℃变性15 s,55 ℃退火1 min,72 ℃延伸40 s,40个循环。荧光定量PCR的引物序列为qF(5′-CTAATGATGATGGATACAAT-3′)和qR(5′-TCTTCTTAACAGGACAAT-3′),每个样品重复3次,相对基因表达根据2-△△Ct方法计算。
2 结 果
2.1 PcWRKY1基因克隆与序列分析
以甜樱桃砧木叶片RNA反转录合成的cDNA为模板,以PcWRKY1-F和PcWRKY1-R为引物扩增获得约1 500 bp的片段(图1),测序结果表明目的片段为1 461 bp。利用NCBI中的ORF Finder分析发现PcWRKY1基因起始密码子为ATG,终止密码子为TAA,编码486个氨基酸。氨基酸序列分析发现该序列含有2个WRKY保守结构域和2个C2H2不同的锌指基序(图2),一个是C-X4-C-X22-H-X1-H,另一个是C-X4-C-X23-H-X1-H,表明其属于WRKY家族第Ⅰ类成员。ProtParam软件分析结果显示其分子量为52 940,等电点为5.84,不稳定系数为43.68,属于不稳定蛋白质。亲水性平均数为-0.897,预测该蛋白质为亲水性蛋白。利用NCBI网站BLAST程序进行序列比对,该cDNA序列与其他植物的WRKY基因具有较高的相似性,与碧桃(XM_007215222.1)、梅(XM_008231659.2)、苹果(XM_008381756.2)和白梨(XM_009366930.2)WRKY基因的核苷酸序列相似性分别为98%、98%、85%和85%。这表明分离得到的cDNA序列是甜樱桃砧木的WRKY基因,将其命名为PcWRKY1,GenBank登录号为KY399985。
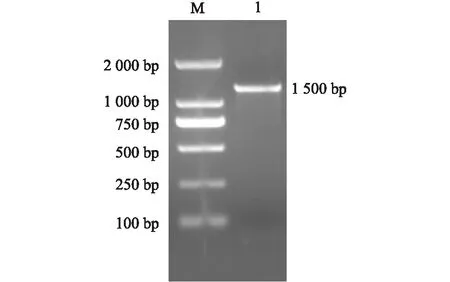
M:DL2000 marker;1:PcWRKY1基因全长PCR扩增产物。图1 PcWRKY1基因PCR扩增产物电泳分析Fig.1 Electrophoresis of amplified product of PcWRKY1 gene
2.2 PcWRKY1系统进化分析
将推导的PcWRKY1氨基酸序列经BLAST比对,搜索与PcWRKY1同源性较高的植物氨基酸序列。结果显示PcWRKY1氨基酸序列与碧桃、梅、白梨和苹果等WRKY基因编码的氨基酸一致性分别为98%、98%、76%和72%。为了进一步分析PcWRKY1与其它WRKY基因的亲缘关系,下载10个其他植物WRKY基因编码的氨基酸序列构建系统进化树(图3),结果表明PcWRKY1与来自蔷薇科的碧桃和梅亲缘关系最近,与白梨和苹果次之。
2.3 PcWRKY1的非生物胁迫表达分析
研究结果表明,WRKY基因能受很多信号分子诱导,为进一步研究PcWRKY1在非生物胁迫诱导下的表达情况,用干旱和盐对甜樱桃砧木进行处理。以甜樱桃β-actin基因为内参,利用qRT-PCR方法对甜樱桃砧木叶片PcWRKY1基因在干旱(200 mmol甘露醇)和盐(200 mmol NaCl)胁迫下的表达情况进行初步研究,干旱处理2 h和4 h时PcWRKY1基因的表达量基本相同,6 h时表达量达到最大值,之后表达量呈下降趋势,但在整个胁迫过程中表达量均高于对照时期(0 h),说明PcWRKY1基因可能在干旱胁迫中起作用(图4)。而NaCl处理2 h时PcWRKY1基因表达量开始升高,随着处理时间延长表达量逐渐增强, 在处理6 h时PcWRKY1基因表达量达到最大值,随后表达量开始下降,但在整个胁迫过程中表达量均高于对照时期(0 h),表明PcWRKY1基因可能在响应盐胁迫中起作用(图5)。

灰色区域为WRKY转录因子的特征序列WRKYGQK;方框内是起始密码子(ATG)和终止密码子(TAA);下划线部分是锌指结构域C2H2,其中C和H残基用方框标出。图2 PcWRKY1基因的碱基序列及预测的氨基酸序列Fig.2 Nucleotide sequence and the predicted amino acid sequence of PcWRKY1

图3 甜樱桃砧木PcWRKY1氨基酸序列与不同物种WRKY氨基酸序列的系统进化分析Fig.3 Phylogenetic analysis of the amino acid sequence of PcWRKY1 in cherry rootstock and the amino acid sequence of WRKY from different species

图4 200 mmol甘露醇处理下PcWRKY1基因的表达Fig.4 Expression of PcWRKY1 gene under the treatment of 200 mmol mannitol

图5 200 mmol NaCl处理下PcWRKY1基因的表达Fig.5 Expression of PcWRKY1 gene under the treatment of 200 mmol NaCl
3 讨 论
WRKY转录因子广泛参与植物的生长、发育、衰老等进程,对各种生物胁迫和非生物胁迫都有一定响应。但是关于WRKY转录因子的研究多集中于拟南芥和烟草等模式植物中,而有关樱桃转录因子的相关研究还未见报道。本研究从甜樱桃砧木中分离到1个WRKY基因,生物信息学分析结果表明,PcWRKY1编码486个氨基酸,推测相对分子量为52 940。根据WRKY结构域的数量和锌指结构域的特征,WRKY家族被划分成3类[16],第I类包含2个WRKY结构域,第II类包含1个WRKY结构域,其锌指结构均为C2H2(C-X4~5-C-X22~23-H-X1-H)型,第III类与第II类相同,含有1个WRKY结构域,但其锌指结构为C2HC (C-X7-C-X23-H-X1-C)型。PcWRKY1含有2个高度保守的的WRKY结构域,锌指结构为C2H2型,属于WRKY家族第I类成员。系统进化分析结果显示,PcWRKY1与来自蔷薇科的碧桃和梅的WRKY同源性最高,与蔷薇科植物聚在一起,表明该蛋白质在植物进化过程中比较保守,也暗示了其在功能上的保守性。
干旱和盐都会导致植物缺水,缺水可影响植物的新陈代谢、生长发育、胞膜透性和蛋白质含量等。转录因子在植物耐受干旱和盐胁迫过程中发挥着重要的作用。其中WRKY基因家族成员被证实能响应植物对干旱和盐的胁迫[17-18]。共表达拟南芥AtWRKY28和AtbHLH17能够显著提升多种非生物胁迫的耐受性,包括干旱、高盐和氧化胁迫[19]。过表达水稻OsWRKY45提高了水稻的耐盐、耐旱性,同时还增强了植株的免疫力[20]。过表达棉花hWRKY39-1能够提高转基因烟草对盐的耐受性[21]。本研究通过荧光定量PCR对樱桃砧木在200 mmol甘露醇和200 mmol NaCl胁迫下PcWRKY1的表达模式进行了分析。结果显示,PcWRKY1在干旱胁迫后表达量明显上升,6 h时表达量达到最高。在盐胁迫中PcWRKY1的表达情况与干旱胁迫相似,被诱导2 h后表达量开始升高,并且随着时间延长在72 h内一直处于高表达水平。研究结果表明第Ⅰ类WRKY蛋白在起源上属于较为原始的一个类群,也最为保守,可参与对病原菌和非生物逆境的抗性[22]。序列分析结果表明PcWRKY1属于第I类WRKY基因家族成员,结合荧光定量分析结果,推测PcWRKY1可能同时响应干旱胁迫和盐胁迫。为了进一步研究该基因的功能,作者已经将该基因构建了植物表达载体,进行烟草转化试验,进一步分析该基因的抗逆性。
参考文献:
[1] 穆蓁蓁,克热木·伊力,王一静.高温干旱对库尔勒香梨叶片生理指标的影响[J].江苏农业科学,2016,44(2):209-212.
[2] 刘三梅,杨清辉,李秀年,等. 不同生育时期干旱胁迫对甘蔗形态指标 及生理特性的影响[J].南方农业学报,2016,47(8):1273-1278.
[3] 张 战,张丽丽,倪善君,等.滨海盐碱土对水稻苗期生长及生理特性的影响[J].江苏农业科学,2016,44(6):111-114.
[4] AGARWAL P, REDDY M P, CHIKARA J. WRKY: its structure, evolutionary relationship, DNA-binding selectivity, role in stress tolerance and development of plants[J]. Mol Biol Rep,2011,38 (6):3883-3896.
[5] WEN F, ZHU H, LI P, et al. Genome-wide evolutionary characterization and expression analyses ofWRKYfamily genes inBrachypodiumdistachyon[J]. DNA Res, 2014, 21:327-339.
[6] ZHOU Q Y, TIAN A G, ZOU H F, et al.SoybeanWRKY-type transcription factor genes,GmWRKY13,GmWRKY21, andGmWRKY54, confer differential tolerance to abiotic stresses in transgenicArabidopsisplants[J].Plant Biotechnol J, 2008, 6(5): 486-503.
[7] JIANG Y, DEYHOLOS M K. Functional characterization ofArabidopsisNaCl-inducibleWRKY25 andWRKY33 transcription factors in abiotic stresses[J]. Plant Mol Biol, 2009, 69(1/2):91-105.
[8] SONG Y, JING S J, YU D Q . Overexpression of the stress inducedOsWRKY08 improves the osmotic stress tolerance in Arabidopsis[J].Chin Sci Bull, 2009, 54: 4671-4678.
[9] LI H, GAO Y, XU H,et al.ZmWRKY33, a WRKY maize transcription factor conferring enhanced salt stress tolerances inArabidopsis[J]. Plant Growth Regul, 2013, 70:207-216.
[10] SUN J, HU W, ZHOU R, et al. TheBrachypodiumdistachyonBdWRKY36 gene confers tolerance to drought stress in transgenic tobacco plants[J]. Plant Cell Rep, 2015, 34(1):23-35.
[11] YAN H R, JIA H, CHEN X B, et al. The cotton WRKY transcription factor GhWRKY17 functions in drought and salt stress in transgenicNicotianabenthamianathrough ABA signalling and the modulation of reactive oxygen species production[J]. Plant Cell Physiol, 2014, 55(12):2060-2076.
[12] EULGEM T, SOMSSICH I E. Networks of WRKY transcription factors in defense signaling[J]. Curr Opin Plant Biol, 2007, 10(4): 366-371.
[13] ROSS C A, LIU Y, SHEN Q J. TheWRKYgene family in rice (Oryzasativa)[J]. J Integr Plant Biol, 2007, 49(6): 827-842
[14] YANG B, JIANG Y, RAHMAN M, et al. Identification and expression analysis ofWRKYtranscription factor genes in canola (BrassicanapusL.) in response to fungal pathogens and hormone treatments[J]. BMC Plant Biol, 2009, 9(1): 68.
[15] SCHMUTZ J, CANNON S B, SCHLUETER J, et al. Genome sequence of the palaeopolyploid soybean[J]. Nature, 2010, 463(7278): 178-183
[16] EULGEM T, RUSHTON P J, ROBATZEK S, et al. The WRKY superfamily of plant transcriptional factors[J]. Trends Plant Sci, 2000, 5:199-206.
[17] GOLLDACK D, LUKING I, YANG O. Plant tolerance to drought and salinity: stress regulating transcription factors and their functional significance in the cellular transcriptional network[J]. Plant Cell Rep, 2011, 30 (8): 1383-1391.
[18] TRIPATHI P, RABARA R C, RUSHTON P J. A systems biology perspective on the role of WRKY transcription factors in drought responses in plants[J]. Planta, 2014, 239 (2): 255-266.
[19] BABITHA K C, RAMU S V, PRUTHVI V, et al. Co-expression ofAtbHLH17 andAtWRKY28 confers resistance to abiotic stress inArabidopsis[J]. Transgenic Res, 2013, 22 (2): 327-341.
[20] TAO Z, KOU Y, LIU H, et al.OsWRKY45 alleles play different roles in abscisic acid signalling and salt stress tolerance but similar roles in drought and cold tolerance in rice[J]. J Exp Bot, 2011, 62 (14): 4863-4874.
[21] SHI W, HAO L, LI J, et al. TheGossypiumhirsutumWRKYgeneGhWRKY39-1 promotes pathogen infection defense responses and mediates salt stress tolerance in transgenicNicotianabenthamiana[J]. Plant Cell Rep, 2014, 33 (3): 483-498.
[22] ÜLKERB, SOMSSICH I E. WRKY transcription factors: from DNA binding towards biological function[J]. Curr Opin Plant Biol, 2004, 7(5):491-498.
