头花蓼水浸提液的化感自毒作用
2018-07-06胡茂飞赵许朋
刘 勇, 刘 燕, 胡茂飞, 赵许朋, 杨 丹
(1.贵阳学院生物与环境工程学院,贵州 贵阳 550005; 2.中国科学院地球化学研究所环境地球化学国家重点实验室,贵州 贵阳 550002; 3.中国科学院大学,北京 100049)
作物连作障碍是影响农业可持续发展的重要因素[1-2]。土壤理化性质恶化、作物根结线虫、传染性病害以及作物根系分泌物和残茬分解物的化感自毒作用等均能导致连作障碍[3-7]。其中化感自毒作用(Allelopathic autotoxicity)即作物根系分泌物、茎、叶等淋溶物和残茬腐解物(一些次生代谢产物)对自身细胞膜透性、酶活性及光合作用等产生影响,进而危害植物生长发育,而中药材的有效成分绝大部分是次生代谢产物,因此中药材育种、栽培等过程通过提高次生代谢产物含量,更易产生化感自毒作用[8-9],研究结果表明三七、当归、人参、黄芪、黄连等均存在化感自毒现象,严重制约了其可持续发展[10-13]。针对上述问题,中药材连作障碍的表现性状、内在机制及应对策略正成为该领域备受关注的重要方向[14-16]。
头花蓼(PolygonumcapitatumBuch.-Ham. exD. Don)又名四季红、石莽草等,为蓼科蓼属多年生草本植物,是中国西南地区著名的“特色苗药”,对治疗泌尿系统疾病颇有疗效,其中没食子酸、黄酮类是其主要药用成分[17-19]。头花蓼种植面积随着市场需求增加日趋扩大,其中贵州省目前种植面积达 1.33×103hm2以上。然而长期以来头花蓼连作障碍问题突出,主要表现为出苗率低下、长势较弱且不整齐、有效成分含量明显降低等,严重影响其产量和药用品质,成为制约该产业健康发展的瓶颈。目前关于头花蓼连作障碍的报道集中在化学成分分析、连作后土壤养分变化分析以及不同施肥方式的调控措施,对水浸提物化感自毒的研究还不多见[20-21]。本研究通过人工制备头花蓼根、茎、叶水浸提液,研究头花蓼水浸提液对其种子发芽及幼苗生长的影响,为探明其连作障碍成因积累基础数据,为提出治理对策提供依据。
1 材料与方法
1.1 头花蓼根、茎、叶水浸提液制备
2016年3月于贵州省威门药业头花蓼种植基地采集生长旺盛的头花蓼植株、种子。植株清洗晾干,分根、茎、叶剪碎研磨,分别准确称量100 g于烧杯,加入100 ml无菌蒸馏水,室温下浸提48 h,每12 h摇晃1次,抽滤获得1 000 mg/ml原液,稀释分别得到5 mg/ml、 10 mg/ml 、50 mg/ml 、100 mg/ml、250 mg/ml、500 mg/ml的根、茎、叶水浸提液,冷藏备用。
1.2 种子发芽试验
取3 000粒头花蓼种子置于烧杯,35 ℃温水浸泡24 h,挑选籽粒饱满的种子放于垫有2层滤纸的培养皿(均灭菌),每皿40颗,滴加不同浸提液5 ml至滤纸湿润饱和,3次重复。光照12 h/黑暗12 h条件于培养箱(22 ℃)培养,每2 d加蒸馏水后1 d加对应水浸提液补充皿内水分,以蒸馏水(0 mg/ml)为对照,连续培养15 d,每日记录种子发芽情况,测量胚根(芽)长。
1.3 幼苗生长试验
种子发芽试验结束后,每皿选取发芽良好的种子,去掉皿盖继续培养幼苗10 d,操作方法同方法1.2,测量幼苗根长和芽长。
1.4 数据统计分析方法
发芽率=(发芽种子数/总供试种子数)×100%[13];
发芽速率=[N1+(N2-N1)/2+…+(Nt-Nt-1)/t]×100%,其中Nt为t日内种子发芽率[22];
发芽抑制率=(1-发芽种子数/对照组发芽种子数)×100%,负值表示有促进作用,正值表示有抑制作用[23];
发芽势=(发芽高峰期种子数/供试种子数)×100%,表征种子发芽快慢及活力强弱[13];
发芽指数(GI)=∑[(Gt/Dt)],Gt为第td萌发种子数,Dt为相应种子萌发天数[24];
种子活力指数(VI)=∑[(Gt/Dt)]×Sx,其中,Sx为种苗平均总长度[25];
化感指数(RI)=(1-C/T)×100%,其中,C为对照组各指标平均值,T为浸提液培养时各指标平均值。RI>0表示有促进作用,RI<0表示有抑制作用[12];
综合化感指数(M):各处理的化感效应指数RI之和求平均值为M值,M>0表示有促进作用,M<0表示有抑制作用,绝对值大小表征作用强弱[26]。
2 结果与分析
2.1 头花蓼种子发芽表观特征
头花蓼根、茎、叶水浸提液处理后其种子发芽数差异明显,并出现种子胚根(芽)腐烂发霉、倾倒、叶片色泽暗淡等症状。其中,根水浸提液下种子胚芽均呈不同程度倾倒,当质量浓度为 250~500 mg/ml时,部分种子腐烂、发霉。茎水浸提液质量浓度≥100 mg/ml时,叶片色泽暗淡,部分胚芽倾倒,质量浓度至250 mg/ml时胚(根)芽腐烂逐渐明显。叶水浸提液≥100 mg/ml时部分种子发霉、胚(根)芽腐烂逐渐明显。3种不同水浸提液质量浓度均为5 mg/ml时其种子发芽数、日均发芽数分别高达 25.0~27.0颗、1.6~1.7颗,但水浸提液质量浓度升高至500 mg/ml时,种子发芽数、日均发芽数分别急剧降至 3.0~5.0颗、0.2~0.3颗。3种不同水浸提液下种子发芽后叶片数虽未变化,但其胚根和胚芽长度均受到明显抑制,随着浓度升高长度分别仅为对照组的 1/3~1/2和 1/3~3/4(表1)。

表1 头花蓼不同部位水浸提液对其种子发芽表观特征影响
同一列数据后不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。
2.2 头花蓼种子发芽率及发芽速率
头花蓼根、茎、叶水浸提液下其种子发芽率分别介于 8.3%~66.7%、9.2%~63.3%、11.7%~66.7%(P<0.05),3种不同水浸提液质量浓度为5 mg/ml时种子发芽率均达最高值,随着质量浓度升高均逐渐降至约10%(图1)。头花蓼根水浸提液质量浓度为10 mg/ml时种子发芽速率达最高值0.2,叶水浸提液质量浓度为5 mg/ml时种子发芽速率达最高值0.1,茎水浸提液下种子发芽速率均低于对照组,随着3种不同水浸提液质量浓度升高种子发芽速率均逐渐降至仅约为对照组的1/12(图2)。
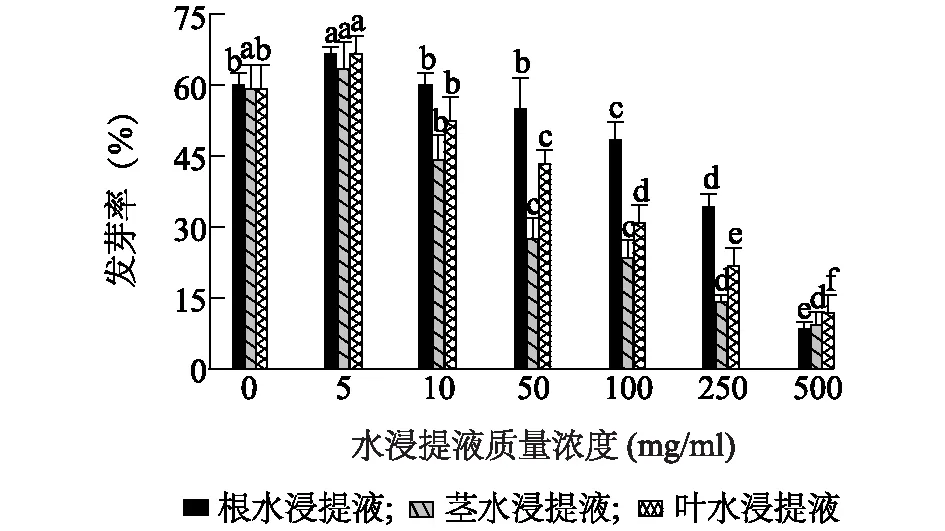
不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。图1 头花蓼不同部位水浸提液对其种子发芽率的影响Fig.1 The effects of water extracts from different parts of P. capitatum on its seed germination rate
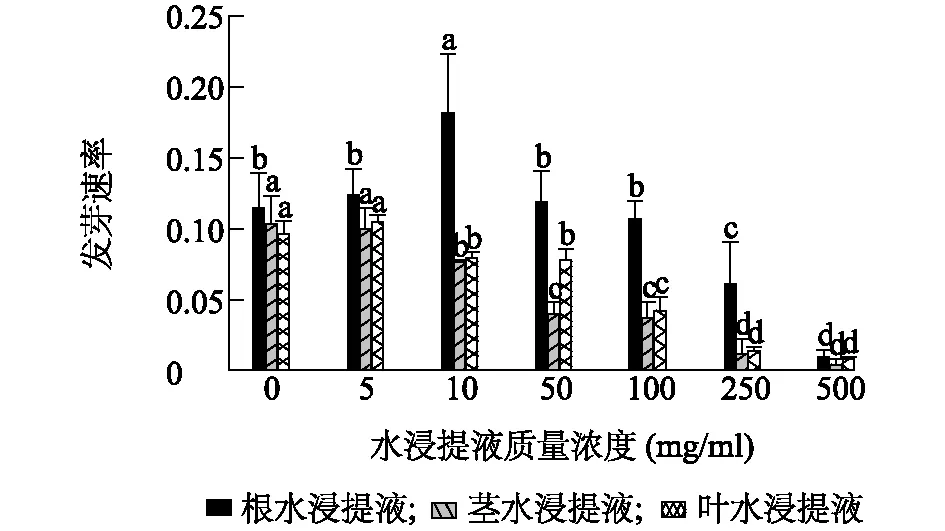
不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。图2 头花蓼不同部位水浸提液对其种子发芽速率的影响Fig.2 The effects of water extracts from different parts of P. capitatum on its seed germination speed
2.3 头花蓼种子发芽势、发芽抑制率、发芽指数及活力指数
发芽势表征种子发芽期间活力强弱,发芽势越大,种子活力越强,发芽越整齐[16]。由表2可知,头花蓼根水浸提液质量浓度10 mg/ml时种子发芽势增大至22.5%,500 mg/ml时发芽势骤减至0.8%,茎、叶水浸提液下随着质量浓度升高种子发芽势均逐渐降至0。当根、茎、叶水浸提液质量浓度5 mg/ml时,发芽抑制率均为负值,分别低至-11.2%、-7.7%、-13.1%,随着质量浓度升高均为正值且不断增大,500 mg/ml时分别高达86.2%、84.2%、80.4%。
种子发芽指数和活力指数用来综合评估种子活力大小、发芽速度、发芽整齐度和幼苗健壮的潜势[24-25]。由图3、图4可知,头花蓼根、茎、叶水浸提液质量浓度不同时其种子发芽指数、活力指数变化规律相似,根水浸提液质量浓度为10 mg/ml时种子发芽指数及活力指数为最大值30.7、126.3,随着质量浓度升高至500 mg/ml时分别降至1.9、5.0。茎、叶水浸提液质量浓度为5 mg/ml时种子发芽指数值分别高达23.1、23.0,活力指数值分别高达103.8、84.3,但随着质量浓度升高均逐渐减小,至500 mg/ml时,茎水浸提液处理的发芽指数及活力指数分别低至0.5、1.1,叶水浸提液处理的发芽指数及活力指数分别低至1.8、3.1。
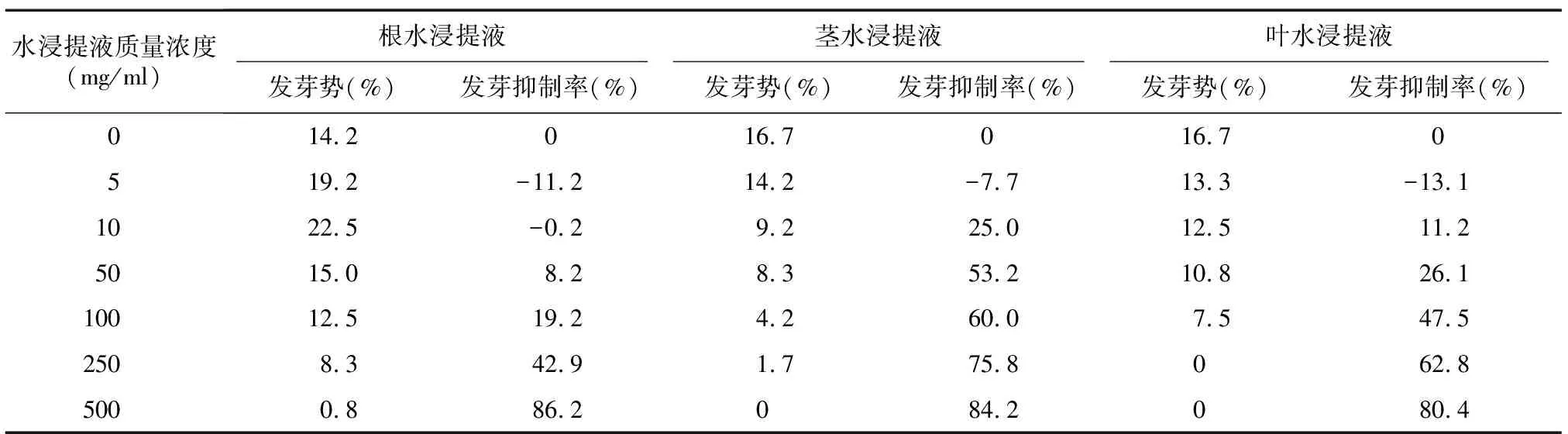
表2 头花蓼不同部位水浸提液对其种子发芽势、发芽抑制率影响
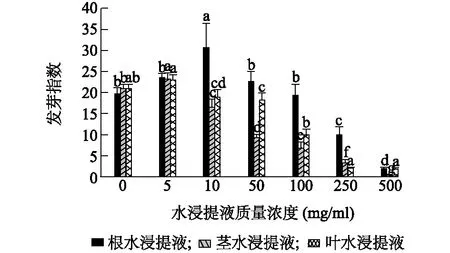
不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。图3 头花蓼不同部位水浸提液对其种子发芽指数的影响Fig.3 The effects of water extracts from different parts of P. capitatum on its seed germination index

不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。图4 头花蓼不同部位水浸提液对其种子活力指数的影响Fig.4 The effects of water extracts from different parts of P. capitatum on its seed vigor index
2.4 头花蓼种子发芽各指标化感指数(RI)及综合化感指数(M)
由表3可知,当根水浸提液质量浓度低于50 mg/ml,茎、叶水浸提液质量浓度低于5 mg/ml时各指标RI值总体为正,表明对种子发芽率、发芽速率和发芽指数均具有促进作用,其他质量浓度时均为负值且随着浓度升高至250 mg/ml时对种子发芽速率、发芽指数抑制作用最强,500 mg/ml处对种子发芽率抑制作用最强。观察综合化感指数M值,除500 mg/ml时根水浸提液对种子发芽抑制最明显外,其余质量浓度时茎、叶水浸提液抑制作用显著强于根水浸提液。
2.5 头花蓼不同部位水浸提液对其幼苗生长的影响
头花蓼幼苗培养中出现不同程度幼苗变纤细、倾倒,根、芽发霉腐烂,叶片色泽暗淡等症状。其中,根水浸提液下幼苗较空白更纤细,质量浓度至250 mg/ml时幼苗出现倾倒、发霉和腐烂等现象。茎、叶水浸提液质量浓度≥100 mg/ml时,幼苗叶片色泽暗淡,部分幼苗倾倒,幼苗根芽腐烂逐渐明显。由表4可知,头花蓼根水浸提液低于100 mg/ml、茎水浸提液低于50 mg/ml、叶水浸提液低于10 mg/ml时对幼苗根长影响均较小,而随着质量浓度升高产生抑制作用, 500 mg/ml时幼苗根长分别减至对照的2/3、2/3、1/3。根、叶水浸提液对幼苗芽长均具有抑制作用,500 mg/ml时幼苗芽长分别为2.3 cm、1.9 cm,茎水浸提液为10mg/ml时幼苗芽长达最高值3.4 cm,浓度进一步升高时对幼苗芽长无显著影响但芽长均值降低至2.2 cm,幼苗芽长整齐度下降。由表5可知,头花蓼根水浸提液为5mg/ml 时幼苗根芽比高达0.8,显著高于对照组,500 mg/ml时胚根芽比仅为0.3,显著低于对照组,其他质量浓度均无显著差异。茎水浸提液对种子及幼苗(胚)根芽比无显著影响。叶水浸提液为5 mg/ml时胚根芽比高达1.0,显著高于对照组,500 mg/ml时幼苗胚根芽比仅为0.4,显著低于对照组。
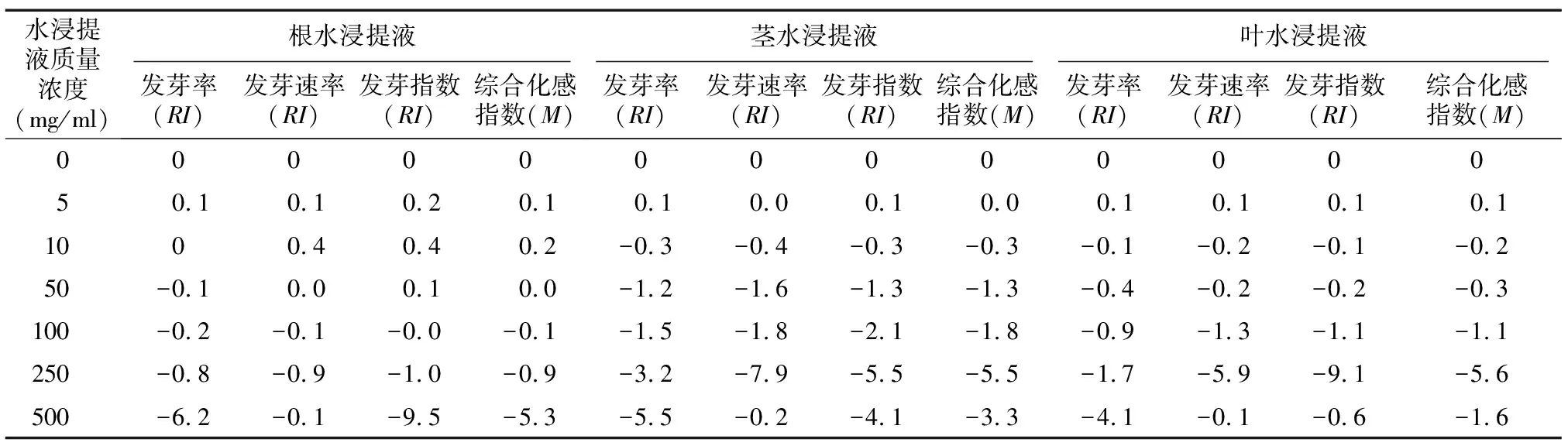
表3 头花蓼不同部位水浸提液对其种子发芽化感指数(RI)的影响

表4 头花蓼不同部位水浸提液对其幼苗生长的影响
同一列数据后不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。

表5 头花蓼不同部位水浸提液对其种子发芽及幼苗生长的影响
同一列数据后不同小写字母表示差异显著(P<0.05);相同小写字母表示差异不显著(P>0.05)。
3 讨 论
中药材化感自毒现象较为普遍[27-29]。中药材栽培中不仅要求高产量,同时更注重品质,因此提高中药材次生代谢产物(往往是药用成分)含量是其栽培的目标。这些次生代谢产物往往属于易挥发性或水溶性的酚类、萜类等物质,通过自身挥发和雨水淋溶等途径向根际环境释放[30]。栽培中选择不断提高中药材次生代谢产物含量,在逆境下更易向根际环境释放和积累次生代谢产物,进而转为影响中药材栽培的化感物质,如造成中药材根际环境病虫害逐年增加,根际土壤生态结构逐渐改变,破坏中药材细胞膜结构和抑制酶活性等,这是中药材相比其他作物更易产生化感自毒作用而导致连作障碍的主要原因[31]。同时,中药材化感物质成分复杂且多种化感物质共同作用往往表现为低浓度时促进中药材生理代谢,很可能成为诱导种子发芽和促进幼苗生长的活性物质,但高浓度时产生抑制作用,这与高浓度化感物质造成中药材栽培环境胁迫,反过来环境胁迫时又促使中药材释放和积累更多化感物质,加剧了中药材化感自毒作用的产生有关[32]。
本研究中头花蓼根、茎、叶水浸提液对其种子发芽或幼苗生长影响具有一定“低促高抑”特征,但抑制影响更为明显。3种不同水浸提液浓度高于10 mg/ml时逐渐出现种子及幼苗发霉腐烂、叶片色泽暗淡、幼苗变纤细(或倾倒)以及出苗不整齐等自毒症状,500 mg/ml时,种子发芽率降至10%左右,发芽速率仅为对照组的1/12,发芽抑制率达80.4%以上,发芽势降至0.8%以下,发芽指数和活力指数仅为0.5、1.1。各指标化感指数及综合指数均表明头花蓼不同部位水浸提液对种子发芽或幼苗生长抑制作用总体表现为茎水浸提液>叶水浸提液>根水浸提液。综上,头花蓼根、茎、叶不同部位水浸提液具有明显的化感自毒作用,很可能是其连作障碍的重要因素,但水浸提液化学成分中起主导作用的关键物质有待进一步研究。针对实际生产中头花蓼连作栽培时在“环境胁迫”下逐年累积化感物质,连作障碍现象明显,建议采取以下措施:(1)尽可能清理出收获后土壤中头花蓼植株、根等残留物,避免中药材自身各类化感物质产生;(2)采用深耕翻土与烈日暴晒等相结合,可有效杀死有害微生物和减少化感物质累积;(3)建立科学的多群体轮作、间作或套作制度进行生态调节,这也是生产实践中减缓作物连作障碍影响的有效方式。
致谢: 特别感谢贵州威门药业股份有限公司为本研究开展提供便利!
参考文献:
[1] 张子龙,王文全. 植物连作障碍的形成机制及其调控技术研究进展[J]. 生物学杂志,2010,27(5): 69-72.
[2] 王 飞,李世贵,徐凤花,等. 连作障碍发生机制研究进展[J]. 中国土壤与肥料,2013 (5): 7-14.
[3] 马海燕,徐 瑾,郑成淑,等. 非洲菊连作对土壤理化性状与生物性状的影响[J]. 中国农业科学,2011,44(18): 3733-3740.
[4] 魏 巍,许艳丽,朱 琳,等. 长期连作对大豆根围土壤镰孢菌种群的影响[J]. 应用生态学报,2014,25(2): 497-504.
[5] 何天久,吴巧玉,曾宪浩,等. 马铃薯连作障碍形成机制与调控措施研究进展[J]. 江苏农业科学,2016,44(4):1-4.
[6] EVELIN H,KAPOOR R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressedTrigonellafoenum-graecumplants[J]. Mycorrhiza,2014,24: 197-208.
[7] 张文明,岳慧珍,张春红,等. 连作障碍不同生育期根系分泌物的成分检测及其自毒作用[J]. 中国生态农业学报,2015,23(2): 215-224.
[8] 雷锋杰,张爱华,张秋菊,等. 人参、西洋参化感作用研究进展[J]. 中国中药杂志,2010,35(17): 2221-2226.
[9] YI J H,JIA Z H,LIN Q,et al. Allelopathic effects of decaying tobacco leaves on tobacco seedlings[J]. Allelopathy Journal,2012,29(1): 51-61.
[10] 张新慧,郎多勇,陈 靖,等. 蒙古黄芪植株水浸液的自毒作用研究[J]. 中药材,2014,37(2): 187-191.
[11] 银福军,瞿显友,曾 纬,等. 黄连不同部位水浸液自毒作用研究[J]. 中药材,2009,32(3): 329-330.
[12] 张 新,郎多勇,张恩和. 当归根际土壤水浸液的自毒作用研究及化感物质的鉴定[J]. 中草药,2010,41(12): 2063-2066.
[13] 张子龙,拱健婷,程新宇,等. 三七须根粉碎物土壤添加的自毒效应研究[J]. 中国农学通报,2015,31(7): 143-148.
[14] SIRIKANTARAMAS S,YAMAZAKI M,SAITO K. Mechanisms of resistance to self-produced toxic secondary metabolites in plants[J]. Phytochemistry Reviews,2008,7(3): 467-477.
[15] 张重义,林文雄. 药用植物的化感自毒作用与连作障碍[J]. 中国生态农业学报,2009,17(1): 189-196.
[16] MAZZOLENI S,BONANOMI G,INCERTI G,et al. Inhibitory and toxic effects of extracellular self-DNA in litter: a mechanism for negative plant-soil feedbacks?[J]. New Phytologist,2015,205(3): 1195-1210.
[17] 张丽娟,王永林,王 珍,等. 头花蓼活性组分化学成分研究[J]. 中药材,2012,35(9): 1425-1428.
[18] 朱晓雨,张 犁,姜 莹,等. 头花蓼水提液对感染性结石模型大鼠尿液酸化作用的实验观察[J]. 新中医,2014,46(4): 200-202.
[19] 潘 梅,唐靖雯,陈 真,等. 热淋清颗粒的一般药理学研究[J]. 药学研究,2015,34(4): 187-189.
[20] 周 涛,金艳蕾,吴 钰,等. 贵州头花蓼遗传多样性的ISSR分析[J]. 中国中药杂志,2010,35(12): 1511-1517.
[21] 何佳芳,唐 兵,赵 欢,等. 几种肥料对头花蓼连作障碍的调控[J]. 西南农业学报,2016,29(12): 2902-2906.
[22] CHIAPUSIO G, SNCHEZ A M, REIGOSA M J, et al. Do germination indices adequately reflect allelochemical effects on the germination process?[J]. Journal of Chemical Ecology, 1997, 23(11): 2445-2453.
[23] 杨 骁. 加拿大蓬水浸液对植物种子萌发的影响[J]. 安徽农业科学,2012,40(4): 1983-1986.
[24] 杜 玮,何池全,陈玉丽,等. 入侵植物互花米草水浸液对莴苣的化感作用[J]. 环境科学学报,2009,29(4): 869-875.
[25] 赵欣欣,宋丽荣,权薇竹,等. 高温高湿老化处理对不同豆类种子活力及生长能力的影响[J]. 作物杂志,2017(5): 168-172.
[26] 朱 慧,马瑞君,吴双桃,等. 当归根际土对其种子萌发和幼苗生长的影响[J]. 生态学杂志,2009,28(5): 833-838.
[27] 邱立友,戚元成,王明道,等. 植物次生代谢物的自毒作用及其与连作障碍的关系[J]. 土壤,2010,42(1): 1-7.
[28] 吴红淼,吴林坤,王娟英,等. 根际调控在缓解连作障碍和提高土壤质量中的作用和机理[J]. 生态科学,2016,35(5): 225-232.
[29] 李明杰,冯法节,张 宝,等. 多元组学背景下地黄连作障碍形成的分子机制研究进展[J]. 中国中药杂志,2017,42(3): 413-419.
[30] 张秋菊,张爱华,孙晶波,等. 植物体中萜类物质化感作用的研究进展[J]. 生态环境学报,2012,21(1): 187-193.
[31] 陈爱国,李明杰,张 宝,等. 连作介导的药用植物及其根际微生态灾变机制研究展望[J]. 中国现代中药,2016,18(2): 239.
[32] 张 琳,王 晓,史国玉,等. 中药连作障碍形成及其时空效应理论探讨[J]. 现代中药研究与实践,2014,28(5): 80-85.
