70例儿童良性癫疒间伴中央颞区棘波患儿ELP4基因rs964112和rs986527 SNP的检测分析
2018-07-06邢梦楠徐向平
邢梦楠 徐向平
儿童良性癫疒间伴中央颞区棘波(benign partial epilepsy of childhood with centro-temporal spikes,BECT),又称为良性Rolandic癫疒间,是儿童最常见的原发性部分性癫疒间[1-2],具有特征性的临床表现和中央-颞区棘波(centro -temporal spikes,CTS)的脑电图改变。迄今病因不明确,常有良性惊厥家族史,提示与遗传有关。近年来,有关BECT的遗传学研究是人们关注的热点。研究报道,ELP4基因中的两个单核苷酸多态性 (single nucleotide polymorphism, SNP)位点rs964112和rs986527与BECT患儿脑电图的CTS放电相连锁[3]。由于CTS是BECT唯一的内源性表型,因此,BECT亦极有可能与这两个SNP位点相关,本研究将直接探讨BECT与这两个SNP位点的关系。
资料与方法
一、一般资料和诊断标准
BECT癫疒间患儿70例,非BECT的癫疒间患儿100例均来自2012年6月至2016年12月在哈尔滨医科大学附属第一医院儿内科门诊及病房就诊的患儿。将受检患儿分为两组:(1)BECT组。BECT癫疒间患儿70例,其中男性38例(54.4%),女性32例(45.6%),年龄3.5~14岁,平均年龄(8.5±2.5)岁。(2)对照组。非BECT的癫疒间患儿100例,其中男性56例(56%),女性44例(44%),年龄2~16岁,平均年龄(7.1±4.2)岁。
BECT的诊断采用国际抗癫疒间联合会(ILAE)2010年诊断标准[1]:起病年龄2~14岁;发病前精神运动发育正常,神经系统检查无异常;睡眠期为主的部分运动性发作,常伴有躯体感觉症状;脑电图为Rolandic区痫样放电,背景活动正常。排除标准:排除脑电图可见CTS放电的其他疾病,如获得性癫疒间性失语综合征(Landau-Kleffner syndrome,LKS)、癫疒间伴慢波睡眠期持续棘慢波(epilepsy with continuous spike-and-wave during slow wave sleep ,CSWS)等[4-5]。
二、方法
1.血样采取:坐位抽取左肘前静脉取血2 ml,以EDTA抗凝,-20℃冰箱进行保存,用于基因检测。
2. rs964112和rs986527 SNP检测:(1)血液样本DNA的提取。应用北京天根生物技术有限公司TianggenTM血液基因组DNA提取试剂盒,根据操作步骤完成DNA 的裂解、抽提、结合、洗脱、检测及定量,-80℃冰箱备用;(2)引物设计。Agena公司在线引物设计软件Assay Design Suite v2.0自动设计SNP基因分型的PCR引物和延伸引物,SNP位点引物设计序列详见表1。

表1 引物设计序列
3. MassARRAY基因分型实验步骤如下:(1)Nanodrop DNA质检;(2)PCR扩增;(3)PCR产物碱性磷酸酶处理;(4)单碱基延伸;(5)树脂纯化;(6)芯片点样;(7)质谱检测;(8)数据分析。
4.统计学处理:应用SPSS19.0统计软件进行分析,计算Hardy-Weinberg平衡,原始资料采用χ2检验、独立样本t检验比较rs964112和rs986527基因型与各变量之间的关系。应用多因素logistic回归校正BECT组与对照组间年龄及性别分布,探索性别、基因型与BECT发病风险之间的关系。计算比值比(Odds Ratio,OR)及其95%可信区间(Confidence Interval,CI),P<0.05为差异有统计学意义。
结 果
一、BECT组与对照组Hardy-Weinberg平衡检验
两组间的rs964112和rs986527的基因型分布均符合Hardy-Weinberg平衡检验,样本基因处于遗传平衡状态,差异无统计学意义(P=0.762)。见表2。
表2rs964112及rs986527基因位点Hardy-Weinberg平衡检验
Table2Hardy-Weinberg equilibrium test for rs964112 and rs986527 locus
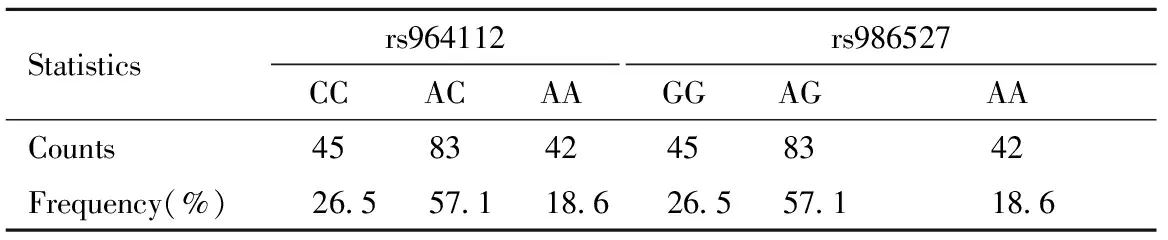
Statisticsrs964112CCACAArs986527GGAGAACounts458342458342Frequency(%)26.557.118.626.557.118.6
二、rs964112及rs986527基因型相互匹配
实验中发现rs964112和rs986527的基因型呈一一对应的关系。同一样本中rs964112的基因型为CC,则rs986527的基因型为GG;若rs964112的基因型为AC,则rs986527的基因型为AG;若rs964112的基因型为AA,则rs986527的基因型为AA。
三、BECT的危险因素
1.单因素分析:整合BECT组与对照组,性别之间rs964112及rs986527基因型进行比较,差异无统计学意义,即rs964112及rs986527位点与性别无关;BECT组与对照组rs964112及rs986527基因型比较,差异无统计学意义。见表3~表4。
2.多因素分析:BECT的发生与年龄有关,与rs964112基因型及rs986527基因型无相关性。见表5。
表3不同性别间和BECT组与对照组之间rs964112基因型与等位基因比较
Table3Comparison of rs964112 genotypes and alleles, by gender and BECT
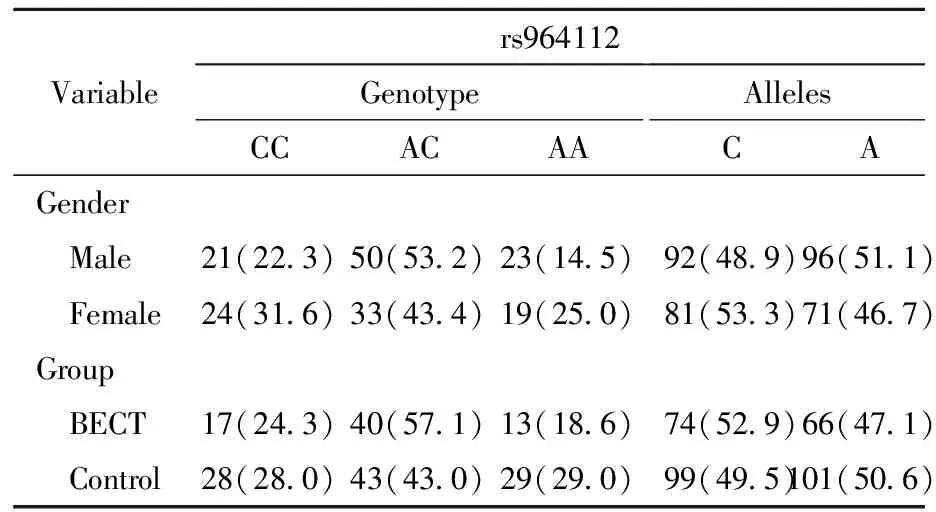
Variablers964112GenotypeCCACAAAllelesCAGender Male21(22.3)50(53.2)23(14.5)92(48.9)96(51.1) Female24(31.6)33(43.4)19(25.0)81(53.3)71(46.7)Group BECT17(24.3)40(57.1)13(18.6)74(52.9)66(47.1) Control28(28.0)43(43.0)29(29.0)99(49.5)101(50.6)
表4不同性别间和BECT组与对照组之间rs986527基因型与等位基因比较
Table4Comparison of rs986527 genotypes and alleles, by gender and BECT
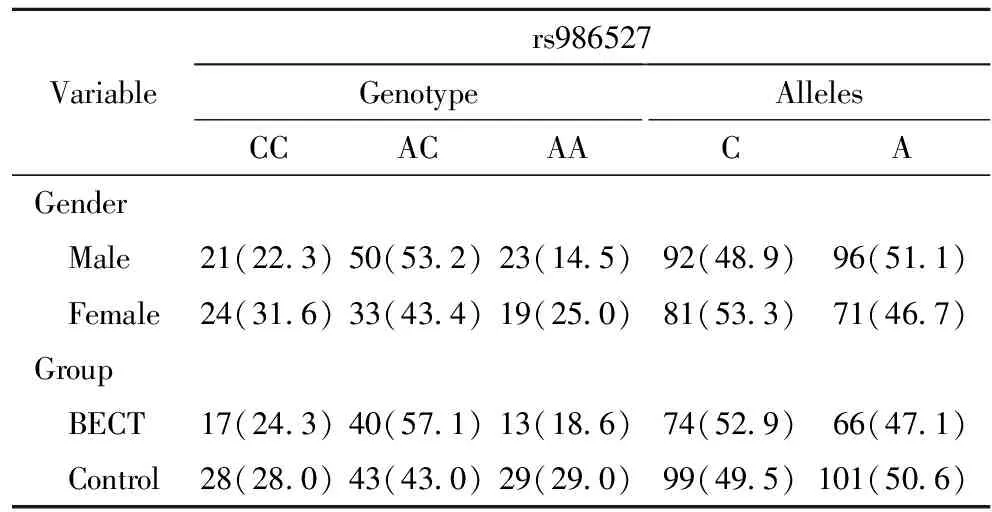
Variablers986527GenotypeCCACAAAllelesCAGender Male21(22.3)50(53.2)23(14.5)92(48.9)96(51.1) Female24(31.6)33(43.4)19(25.0)81(53.3)71(46.7)Group BECT17(24.3)40(57.1)13(18.6)74(52.9)66(47.1) Control28(28.0)43(43.0)29(29.0)99(49.5)101(50.6)
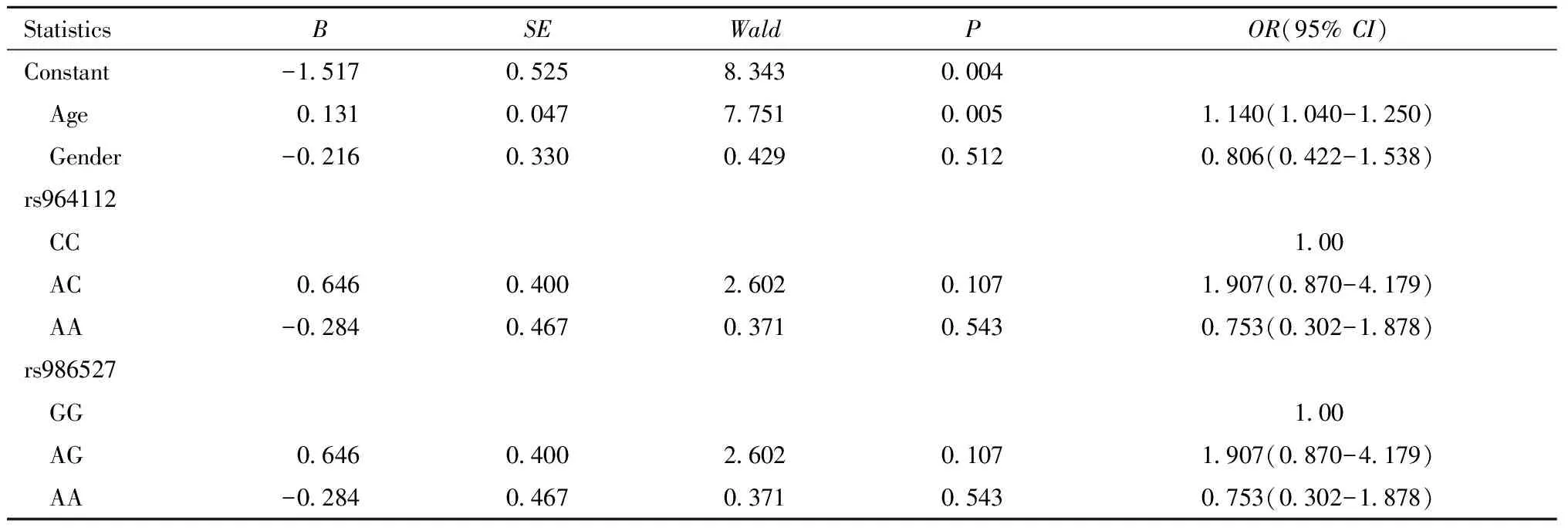
表5 rs964112及rs986527基因型的Logistic回归分析结果
讨 论
BECT是小儿最常见的癫疒间综合征之一,特征性的脑电图为CTS放电,CTS因此成为BECT的内源性表型。BECT患儿中发现的突变基因有脆性X位点、AChRα4亚基基因、ELP4基因[3]、KCNQ2基因和KCNQ3基因[6-7]、RBFOX1和RBFOX3基因[8]、DEPDC5基因[9]、BDNF基因[10]、GABAA-R基因[11]、GRIN2A基因[12]。检索相关数据库及主要文献报道综合分析后发现,脆性X位点[13]、KCNQ2突变[14]均被后人否定。1973年Gottesman等[15]提出内源性表型的概念,当复杂的遗传疾病涉及到的基因较多,遗传分析会变得复杂,内源性表型相当于把复杂的临床性状分解成多个单一的性状,再分别寻找单一性状相关的基因,这为确认遗传导致临床表型的上下游性状或寻找疾病的多面性提供了新的手段及方法。同时,亦需要认识到BECT与CTS放电的关系。CTS虽然是BECT诊断的必要条件,但CTS放电也常会出现在其他的癫疒间中,比如热性惊厥、LKS、CSWS和一些小儿良性的部分性癫疒间[16],上述的癫疒间综合征经常被认为是非典型的BECT。BECT被认为与癫疒间失语谱系相似具有强大的遗传倾向[17-18],CTS的遗传学并不等同于BECT的遗传学。多项研究结果显示,CTS携带者仅10%左右出现癫疒间发作,其较低的外显率已经表明BECT不仅通过CTS这一脑电图进行遗传,而且可能受到多种因素共同影响[16-18]。
迄今为止,BECT的病因不清,研究发现BECT中CTS放电可能与ELP4基因相关,ELP4作为Elongator复合体的一部分,可以通过α-微管蛋白乙酰化改变诸多蛋白质的表达,对神经细胞的增殖、轴索的生长、神经元的迁移起着重要作用[3, 19]。当ELP4基因发生突变时,以上功能可出现部分缺失,使包括语言功能在内的神经网络功能暂时中断,并可导致神经系统兴奋、抑制环路失衡[20],上述机制可以解释CTS以及语言障碍、注意力不集中等轻微的生长发育障碍,而这些都在BECT患儿中经常出现。Strug等[21]的实验在大宗家系的基础上展开,经过家系连锁分析发现BECT患儿脑电图中CTS放电与ELP4基因rs964112和rs986527两个SNP位点相关联。同时Strug等[21]报道了rs964112互补链的的等位基因为T和G,G等位基因提高了脑电图CTS放电的风险(OR=1.88,P=0.0002);rs986527互补链的等位基因为T和C,C等位基因提高了脑电图CTS放电的风险(OR=1.88,P=0.0002),同时发现两处SNP位点极其相似。
本实验检测了ELP4基因中rs964112和rs986527两个SNP位点,研究BECT与rs964112和rs986527两个SNP位点的关联性。本结果显示,rs964112基因型为AA、AC和CC,与Strug等[21]实验中测定的rs964112基因位点的互补链基因型TT、TG和GG相互对应; 本实验中rs986527基因型为AA、AG和GG,与Strug等[21]实验中测定rs986527基因位点的互补链基因型TT、TC和CC相对应,说明就基因型而言并未在种族间发现明显的遗传异质性。本实验发现,rs964112和rs986527基因型在BECT组和对照组的单因素及多因素分析中差异均不具有统计学意义。
近年来,探讨ELP4基因与BECT关系的研究较多,尚未发现ELP4与BECT明确相关。2014年Reinthaler等[22]首先检测了BECT中10个SNP位点(包括rs986527),并未发现与BECT有明确的关联性。随后Reinthaler等[23]进行了204名BECT患儿的ELP4全基因扫描,仅发现四处错位突变,但是经过计算机分析预测这四处错位突变差异并没有统计学意义,错位突变出现的频率与公共数据库中健康人的突变频率并没有显著差异。随后一项针对希腊人的研究[19]选取了60名BECT患儿作为实验组、60名健康人群作为对照组,分别检测了ELP4中两个SNP位点rs964112和rs11031434,并未发现这两个SNP位点与BECT的相关性。
本研究实验结果与上述研究相同,均提示ELP4的两个SNP位点rs964112和rs986527与BECT发生无关联性,但遗传因素可受到多种基因共同作用,相互关联、相互修饰,最终影响到BECT的形成。今后研究中应继续寻找与BECT发病有关联基因,扩大研究基因范围,以明确影响BECT发生遗传基因型,为BECT诊断、治疗及预防提供基因方面理论依据。在人类癫疒间病中,多基因遗传模式并不少见,单基因对BECT的影响是有限的,未来以多基因的交互作用为方向来研究则更为容易揭示BECT的遗传本质。
1 Berg AT,Berkovic SF,Brodie MJ,et al.Revised terminology and concepts for organization of seizures and epilepsies:report of the ILAE Commission on Classification and Terminology,2005-2009.Epilepsia,2010,51:676-685.
2 Gobbi G,Boni A,Filippini M.The spectrum of idiopathic Rolandic epilepsy syndromes and idiopathic occipital epilepsies:from the benign to the disabling.Epilepsia,2006,47:62-66.
3 Pal DK,Greenberg DA.Major Susceptibility Genes for Common Idiopathic Epilepsies:ELP4 in Rolandic Epilepsy and BRD2 in Juvenile Myoclonic Epilepsy.Jasper′s Basic Mechanisms of the Epilepsies [Internet].4th edition.Bethesda (MD):National Center for Biotechnology Information (US),2012.
4 Reutlinger C,Helbig I,Gawelczyk B,et al.Deletions in 16p13 including GRIN2A in patients with intellectual disability,various dysmorphic features,and seizure disorders of the rolandic region.Epilepsia,2010,51:1870-1873.
5 Lemke JR,Lal D,Reinthaler EM,et al.Mutations in GRIN2A cause idiopathic focal epilepsy with rolandic spikes.Nat Genet,2013,45:1067-1072.
6 Ishii A,Miyajima T,Kurahashi H,et al.KCNQ2 abnormality in BECTS:benign childhood epilepsy with centrotemporal spikes following benign neonatal seizures resulting from a mutation of KCNQ2 .Epilepsy Res,2012,102:122-125.
7 Neubauer BA,Waldegger S,Heinzinger J,et al.KCNQ2 and KCNQ3 mutations contribute to different idiopathic epilepsy syndromes.Neurology,2008,71:177-183.
8 Lal D,Reinthaler EM,Altmüller J,et al.RBFOX1 and RBFOX3 mutations in rolandic epilepsy.PLoS One,2013,8:e73323.
9 Lal D,Reinthaler EM,Schubert J,et al.DEPDC5 mutations in genetic focal epilepsies of childhood.Ann Neurol,2014,75:788-792.
10 Koyama R,Yamada MK,Fujisawa S,et al.Brain-derived neurotrophic factor induces hyperexcitable reentrant circuits in the dentate gyrus .J Neurosci,2004,24:7215-7224.
11 Reinthaler EM,Dejanovic B,Lal D,et al.Rare variants in GABAA receptor genes in Rolandic epilepsy and related syndromes.Ann Neurol,2015,77:972-986.
12 Reutlinger C,Helbig I B,Subero J I,et al.Deletions in 16p13 including GRIN2A in patients with intellectual disability,various dysmorphic features,and seizure disorders of the rolandic region.Epilepsia,2010,51:1870-1873.
13 Bali B,Kull LL,Strug LJ,et al.Autosomal dominant inheritance of centrotemporal sharp waves in rolandic epilepsy families.Epilepsia,2007,48:2266-2272.
14 Neubauer BA,Moises HW,Lässker U,et al.Benign childhood epilepsy with centrotemporal spikes and electroencephalography trait are not linked to EBN1 and EBN2 of benign neonatal familial convulsions.Epilepsia,1997,38:782-787.
15 Gottesman II,Shields J.Schizophrenia and genetics:A twin study vantage point.1972,Am J Hum Genet,1976,28(6):630-631
16 Vears DF,Tsai MH,Sadleir LG,et al.Clinical genetic studies in benign childhood epilepsy with centrotemporal spikes.Epilepsia,2012,53:319-324.
17 Guerrini R,Pellacani S.Benign childhood focal epilepsies.Epilepsia,2012,53:9-18.
18 Fejerman N.Atypical rolandic epilepsy.Epilepsia,2009,50:9-12.
19 Gkampeta A,Fidani L,Clarimón J,et al.Association of brain-derived neurotrophic factor (BDNF) and elongator protein complex 4 (ELP4) polymorphisms with benign epilepsy with centrotemporal spikes in a Greek population.Epilepsy Res,2014,108:1734-1739.
20 Pal DK,Greenberg DA.Major Susceptibility Genes for Common Idiopathic Epilepsies:ELP4 in Rolandic Epilepsy and BRD2 in Juvenile Myoclonic Epilepsy.Jasper′s Basic Mechanisms of the Epilepsies [Internet].4th edition.Bethesda (MD):National Center for Biotechnology Information (US),2012.
21 Strug LJ,Clarke T,Chiang T,et al.Centrotemporal sharp wave EEG trait in rolandic epilepsy maps to Elongator Protein Complex 4 (ELP4).Eur J Hum Genet,2009,17:1171-1181.
22 Reinthaler EM,Lal D,Jurkowski W,et al.Analysis of ELP4,SRPX2,and interacting genes in typical and atypical rolandic epilepsy.Epilepsia,2014,55:e89-e93.
23 Reinthaler EM,Lal D,Lebon S,et al.16p11.2 600 kb Duplications confer risk for typical and atypical Rolandic epilepsy.Hum Mol Genet,2014,23:6069-6080.
