花青素对大豆蛋白质二级结构影响的多重光谱分析
2018-07-05王中江齐宝坤隋晓楠江连洲
朱 颖 王中江 李 杨 齐宝坤 隋晓楠 江连洲
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
大豆分离蛋白(SPI)作为一种营养价值丰富的食用蛋白资源,由于其较高的蛋白含量以及优良的功能特性,目前已经被广泛地应用于食品加工中[1]。为拓宽其应用前景与开发价值,大豆分离蛋白的天然改性已经成为学者们的研究热点[2-3]。花青素作为一种黄酮类含量丰富、广泛应用于食品中的植物色素[4],由于其可清除DPPH自由基,具有很强的抗氧化作用[5],因而可以延缓衰老。此外花青素还具有抑菌、预防癌症、抗心血管疾病等多种功能[6-8]。由于花青素是一种小分子活性物质,并且具有较强的蛋白亲和性,因此可以通过渗入到蛋白微原纤间,与多肽链形成多种交联点[9]。在食品的生产加工过程中,蛋白质不可避免地会受到这类小分子的影响,研究表明蛋白可与多酚类发生交互作用[10],由于蛋白、多酚结构的差异性,蛋白与多酚交互作用可形成氢键、疏水作用、范德华力、离子作用力及共价键等[11-12]。
目前已有文献对多酚类物质与蛋白质的相互作用进行了部分研究。KANAKIS等[13]研究发现茶多酚可以与牛奶蛋白通过疏水作用发生反应,并且茶多酚的加入会改变牛奶蛋白的结构构象,使牛奶蛋白结构更加稳定。WANG等[14]研究发现橘皮苷对牛血清白蛋白的猝灭机制为静态猝灭,并且通过疏水相互作用与牛血清白蛋白发生作用。HE等[15]研究发现锦葵色素-3-葡萄糖苷可诱导β-乳球蛋白通过疏水作用与其发生交联,这些相互作用会影响蛋白质的二级结构,同时提高锦葵色素-3-葡萄糖苷的稳定性。刘勤勤等[16]研究发现大豆分离蛋白与茶多酚通过范德华力和氢键发生相互作用,且茶多酚的加入导致大豆分离蛋白的二级结构发生改变。但相关研究尚未涉及大豆分离蛋白与花青素的交互作用。
黑米花青素的主要成分为矢车菊素-3-葡萄糖苷和芍药色素-3-葡萄糖苷[17],本文利用多重光谱技术研究大豆分离蛋白(SPI)与纯化黑米花青素(AN)的相互作用,通过荧光光谱研究黑米花青素对大豆分离蛋白的猝灭类型,判断花青素与大豆分离蛋白是否存在相互作用,并计算花青素与大豆分离蛋白的结合常数、结合位点数以及相应的热力学参数,探讨花青素与大豆分离蛋白间的相互作用机制。使用同步荧光光谱、紫外光谱研究花青素对大豆分离蛋白构象变化的影响,探究花青素对大豆分离蛋白中酪氨酸、色氨酸所处微环境的极性的影响。使用多重光谱探究花青素对大豆分离蛋白二级结构组成的影响,进一步验证花青素与大豆分离蛋白间相互作用的存在,为开发新的大豆蛋白产品提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆(GlycinemaxL.),东北大豆;黑米(OryzasativaL.,indica Black rice)花青素质量分数为35%;盐酸、氢氧化钠、磷酸二氢钠,北京新光化工试剂厂;正己烷、乙酸乙酯、甲醇,天津北科化学品有限责任公司;其他化学试剂均为分析纯试剂。
1.2 仪器与设备
F-4500型荧光分光光度计,日本HITACHI 公司;Nicolet 6700型傅里叶变换红外光谱仪,美国Thermo Nicolet公司;Jasco J-815型圆二色光谱仪,日本分光公司;Cary 50 型紫外光谱仪,美国Varian公司。
1.3 实验方法
1.3.1大豆分离蛋白制备
参考MEINLSCHMIDT等[18]的方法。将新鲜大豆碾碎成粉后,与正己烷按照液料比3 mL/g混合,室温(20℃)下搅拌2 h进行3次脱脂。将脱脂豆粉与去离子水按照液料比10 mL/g混合后,用NaOH(2 mol/L)将溶液的pH 值调节至8.5,室温下搅拌2 h后,溶液9 000g离心20 min,取上清液用HCl(2 mol/L)将溶液pH值调节至4.5。溶液静置2 h后6 000g离心20 min得到蛋白沉淀,最后将蛋白沉淀溶于去离子水,用NaOH(2 mol/L)将蛋白质pH值调节至7.0。将蛋白溶液冷冻干燥后得粉末状大豆分离蛋白。
1.3.2花青素提纯
参照SUI等[19]的方法,将富含花青素的黑米提取物粉末溶于去离子水,使用固相萃取技术去除黑米提取物中的杂质。具体纯化步骤为:首先用2倍体积的酸化水去除不溶性成分,如糖、酸等,然后用 2倍体积的乙酸乙酯去除多酚类化合物,如酚酸、黄酮等,最后用甲醇洗脱吸附在吸附柱上的花青素。使用旋转蒸发器在 40℃的条件下除去甲醇,即可得纯化后的花青素(AN),在-20℃条件下贮存,直至使用。在 280 nm处使用高效液相色谱法(HPLC-DAD)检测花青素的纯度。
1.3.3大豆蛋白-花青素溶液制备
将大豆分离蛋白(SPI)粉末用 0.01 mol/L 磷酸盐缓冲液(pH值 7.4)配置成 0.01 g/mL 的大豆分离蛋白溶液,为SPI对照样品。按照大豆蛋白与纯化后花青素的质量比100∶1、80∶1、60∶1、40∶1、20∶1将纯化后的花青素(质量分数约为20%)加入到大豆分离蛋白溶液中,室温下磁力搅拌90 min制成大豆分离蛋白-花青素复合体系,分别表示为SPI-AN-1~SPI-AN-5。
1.3.4荧光光谱测定
向10 mL大豆分离蛋白溶液(1.0×10-6mol/L)中分别逐滴加入100 μL 2.0×10-6、4.0×10-6、6.0×10-6、8.0×10-6、1.0×10-5mol/L浓度的花青素溶液,漩涡震荡后,分别在25、33、41℃恒温水浴锅中保温5 min。选择激发波长为280 nm、激发狭缝为5 nm、扫描速率为12 000 nm/min,连续扫描,记录发射波长为300~500 nm。样品的同步荧光光谱测定条件如下:室温条件下,分别固定Δλ=15 nm和Δλ=60 nm,Δλ表示两波长差,进行同步荧光光谱扫描。
1.3.5紫外-可见光谱分析
移取3 mL的大豆分离蛋白溶液于石英比色池中,扫描250~350 nm波长范围内的吸收光谱。扫描完毕后,将SPI-AN-1~ SPI-AN-5分别于石英比色池中扫描吸收光谱。以相同质量浓度的大豆分离蛋白溶液作空白,记录大豆分离蛋白溶液的紫外-可见吸收光谱。
1.3.6傅里叶变换红外光谱分析
将大豆分离蛋白溶液和大豆分离蛋白溶液与花青素的混合溶液SPI-AN-1~SPI-AN-5冷冻干燥,按样品粉末与溴化钾粉末质量比1∶100的比例混合,研细均匀后,置于模具中压片,在32 cm-1分辨率条件下扫描32 次,4 000~400 cm-1波数范围内扫描红外光谱。
1.3.7圆二色谱分析
将样品在190~250 nm远紫外区进行扫描,扫描速度为60 nm/min,光谱分辨率为0.2 nm,响应时间为0.25 s,狭缝宽度为1 nm。采用Origin 8.0 作图,并使用CDpro 软件拟合蛋白质二级结构的组成与含量。
1.3.8数据统计与分析
每组数据均重复3 次,利用Origin 8.5 软件处理数据作图。利用SPSS V17.0 软件对数据进行ANOVA 差异显著性分析及相关性分析。
2 结果与讨论
首先采用荧光光谱法,测定大豆分离蛋白和花青素间的相互作用方式,再通过同步荧光光谱法、紫外-可见光谱探究花青素对大豆分离蛋白氨基酸残基微环境的影响,进而得出花青素对大豆分离蛋白构象的影响,最后通过傅里叶变换红外光谱法和圆二色谱法分析花青素对复合物中大豆分离蛋白二级结构组成的变化。荧光光谱分析可以明确花青素与大豆分离蛋白的作用方式,同步荧光光谱和紫外-可见光谱的测定是通过测量发射波长偏移来直观反映花青素对大豆分离蛋白构象的影响。红外光谱法和圆二色谱法可直接测量计算出蛋白质各类型二级结构的含量,可以定量测定加入花青素前后大豆蛋白二级结构含量的变化,直观地分析花青素对互作体系中蛋白质二级结构的影响,进一步验证花青素与大豆分离蛋白的相互作用。
2.1 荧光分析
2.1.1花青素对大豆分离蛋白内源荧光光谱的影响
蛋白质的内源荧光主要依赖于色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),在激发波长为280 nm时,只考虑色氨酸和酪氨酸,苯丙氨酸可以忽略[13]。图1表示在25℃、pH值7.4的条件下,固定激发波长为280 nm,扫描300~500 nm波长范围内随花青素的增加内源荧光发射光谱的变化。从图1可以看出,固定SPI 溶液浓度,随着花青素的不断加入,SPI荧光强度逐渐降低,说明花青素对SPI的内源荧光产生了猝灭作用。同时发现SPI的最大荧光发射波长发生了红移,SPI从342 nm红移至352.8 nm,红移了10.8 nm,这说明花青素与大豆分离蛋白发生了结合,从而改变了 SPI的结构构象,Trp和 Tyr的微环境发生改变,由疏水环境变为亲水环境,肽链结构舒展[14]。

图1 花青素对SPI荧光光谱的影响Fig.1 Effect of AN on fluorescence spectrum of SPI solutions
2.1.2表观结合常数和结合位点数
荧光猝灭一般可分为动态猝灭和静态猝灭两种作用机制。可以应用Stern-Volmer 方程判断猝灭类型[20],公式为
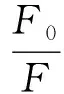
(1)
式中F0、F——未加入和加入猝灭剂花青素时SPI溶液的荧光强度
Q——花青素的浓度,mol/L
Kq——双分子猝灭速率常数,L/(mol·s)
Ksv——动态猝灭常数,L/mol
τ0——猝灭剂不存在时荧光体的寿命,生物大分子的平均寿命约为10-8s[21]
根据Stern-Volmer方程,以Q为自变量,F0/F为因变量,作图2,根据图中直线的斜率可以计算出花青素-SPI复合物的Ksv和Kq,结果见表1。对于动态猝灭,随着温度的升高,猝灭常数增大,即Stern-Volmer曲线斜率增大。如果是静态猝灭则相反。通过图2和表 1可以看出,随着温度的升高,大豆分离蛋白的Stern-Volmer曲线斜率逐渐变小,说明花青素对SPI的荧光猝灭机制是静态猝灭。猝灭剂对于生物大分子最大猝灭速率常数一般为2×1010L/(mol·s),而花青素对SPI的荧光猝灭速率数量级均为1012,这进一步表明花青素对SPI的作用机制为静态猝灭。

图2 不同温度条件下花青素猝灭SPI的Stern-Volmer图Fig.2 Stern-Volmer plot for quenching on SPI by AN at different temperatures

温度/KKsv/(L·mol-1)Kq/(L·(mol·s)-1)R22988.11×1048.11×10120.99453067.89×1047.89×10120.99053146.89×1046.89×10120.9883
对于静态猝灭过程,结合位点数n满足公式
(2)
式中Ks——表观结合常数,L/mol
以lg((F0-F)/F)对lgQ作图得图3,根据直线斜率和截距可以得到花青素与热处理SPI间的表观结合常数Ks和结合位点数n(表2)。从表2可以看出,花青素与SPI间的表观结合常数Ks数量级为104,说明花青素与大豆分离蛋白发生了紧密的结合,且均形成了结合位点数接近于1的复合物。

图3 不同温度条件下花青素猝灭热处理SPI的双对数图Fig.3 Double logarithmic curves of SPI quenched by AN at different temperatures
2.1.3热力学参数和作用力
生物小分子和蛋白质之间的相互作用力包括氢键、静电作用、范德华力和疏水作用力4种。研究表明,蛋白质和配体之间的作用力可根据热力学参数来进行表征:当焓变ΔH>0、熵变ΔS<0时,分子间作用力主要是静电引力和疏水作用力;当ΔH>0、

表2 不同温度SPI-AN复合物的结合位点数、表观结合常数及其决定系数Tab.2 Apparent binding constants, binding sites numbers and correlation coefficients of SPI-AN complex at different temperatures
ΔS>0时,分子间作用力主要是疏水作用力;当ΔH<0、ΔS<0时,分子间作用力主要是范德华力、氢键或质子化等作用;当ΔH<0、ΔS>0时,分子间作用力主要是静电引力[22-23]。假设在测定温度范围内焓变变化不大,则计算公式为
(3)
ΔG=-RTlnK
(4)
ΔG=ΔH-TΔS
(5)
式中K——在相应温度下体系的结合常数
R——理想气体常数[24]
ΔG——吉布斯自由能
通过计算得大豆蛋白与花青素相互作用的焓变ΔH、熵变ΔS和吉布斯自由能ΔG,如表3所示。

表3 不同温度下SPI-AN结合的热力学参数Tab.3 Thermodynamic parameters of SPI-AN binding at different temperatures
由表3可知,ΔG<0,说明花青素与大豆蛋白的结合可以自发进行。该反应的ΔH>0,表明花青素与大豆分离蛋白之间的相互作用为吸热反应,升温有利于反应的进行,这与表观结合常数Ks随着温度的升高而逐渐升高相吻合。由体系的ΔH>0和ΔS>0可说明花青素与大豆分离蛋白之间的作用力主要是疏水作用力。
2.2 花青素对大豆分离蛋白构象的影响
2.2.1同步荧光光谱分析
同步荧光光谱法用于反映对应氨基酸附近环境的极性情况,广泛应用于小分子和生物大分子相互作用的研究领域中。同步荧光光谱法是一种广泛应用的通过测量发射波长偏移来研究氨基酸残基微环境的方法,能够反映花青素对大豆分离蛋白构象的影响。固定激发和发射单色器的波长差(Δλ),以固定的Δλ得到同步荧光光谱,从而获得关于生色团分子周围环境的信息。当Δλ=15 nm时,只显示酪氨酸残基的特征荧光光谱;当Δλ=60 nm时,只显示色氨酸残基的特征荧光光谱,由此可判断大豆分离蛋白中酪氨酸残基和色氨酸残基微环境的极性变化[25]。
由图4可知,随着花青素浓度的增加,大豆分离蛋白中酪氨酸残基(Δλ=15 nm)和色氨酸残基(Δλ=60 nm)的特征荧光吸收峰不断猝灭,Δλ=15 nm和Δλ=60 nm的最大发射峰均有红移,表明加入花青素后,大豆分离蛋白中色氨酸和酪氨酸附近的微环境有所改变,极性增加。色氨酸最大发射峰红移5 nm(从286 nm红移至291 nm)(图4b),酪氨酸最大发射峰红移2 nm(从293 nm红移至295 nm(图4a),说明花青素与大豆分离蛋白作用的结合位点更接近于色氨酸残基[26]。酪氨酸、色氨酸残基所处微环境的改变可能部分归因于蛋白质结构发生部分变化,因此花青素造成蛋白构象的变化。刘勤勤等[16]研究茶多酚与大豆蛋白的相互作用发现茶多酚的加入导致大豆蛋白结构发生变化,与本实验研究结果一致。

图4 SPI-AN复合体系的同步荧光光谱Fig.4 Synchronous fluorescence spectra of SPI-AN complex system
2.2.2紫外-可见吸收光谱分析
紫外-可见光谱广泛应用于小分子与生物大分子作用的研究中。一般来说,峰的强度变化是两者相互作用强弱的标志,而峰位的改变通常认为是由蛋白质大分子疏水氨基酸残基微环境变化引起构象变化导致的。大多数蛋白质分子由于色氨酸(Trp)和酪氨酸(Tyr)等氨基酸中芳香杂环对光的吸收,故在270 nm波长附近有一个吸收峰。蛋白质分子中芳香族氨基酸残基所处微环境发生改变,会引起蛋白质吸收波长变化,因而可以利用蛋白质的紫外-可见吸收光谱初步探讨蛋白质结构的变化[27-28]。
图5显示了不同浓度花青素对大豆分离蛋白紫外-可见吸收光谱的影响。从图中可以看出,随着花青素浓度增加,大豆分离蛋白的紫外-可见吸收光谱峰值依次升高,并且发生蓝移,最大吸收峰波长由277 nm蓝移至271 nm,说明花青素诱导大豆分离蛋白分子肽链伸展,使得深埋在大豆分离蛋白分子内部酪氨酸残基和色氨酸残基中的芳香杂环疏水基团裸露出来,造成了大豆分离蛋白构象发生改变,进而增强了吸光度。这种构象的改变更有利于大豆分离蛋白分子中色氨酸残基和酪氨酸残基中芳香杂环的π-π*跃迁。
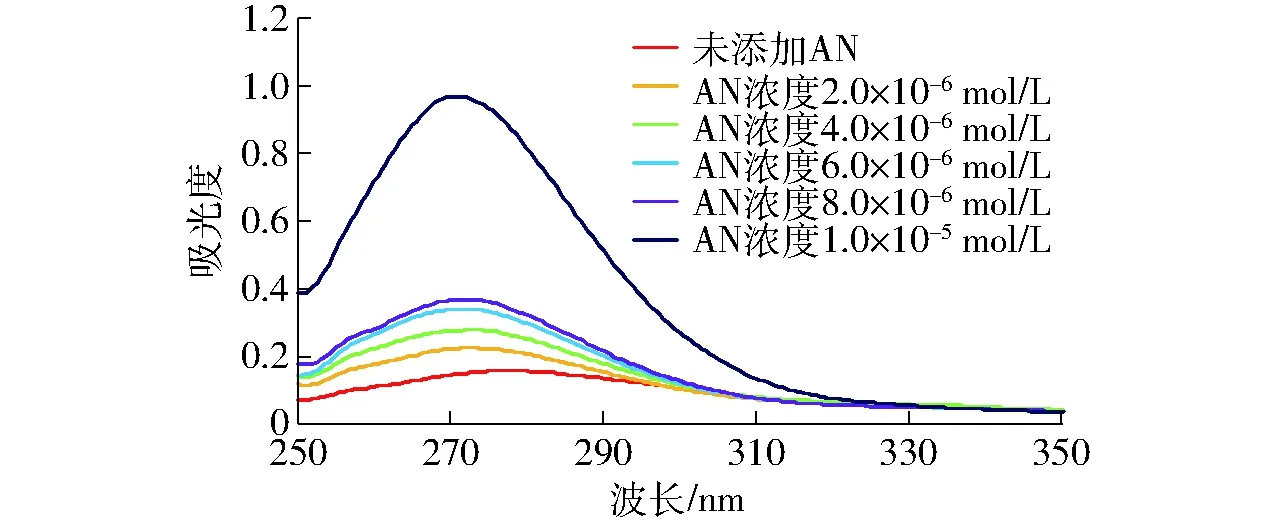
图5 不同浓度花青素对SPI溶液紫外-可见吸收光谱的影响Fig.5 Effect of AN concentration on UV-Vis absorption spectrum of SPI
2.2.3红外光谱分析


图6 SPI和SPI-AN的傅里叶变换红外光谱图Fig.6 Fourier transform infrared spectroscopy of SPI and SPI-AN
2.2.4圆二色谱分析
圆二色谱是一种测量蛋白二级结构快速、准确且灵敏的技术,可以在水溶性蛋白溶液中直接测量计算出蛋白质各类型二级结构的相对含量[35]。通过CD 谱图法可以定量测定加入花青素前后大豆分离蛋白质二级结构含量的变化,进一步验证花青素与大豆分离蛋白的相互作用[36]。大豆蛋白质在加入花青素前后的CD 谱图通过CDpro 软件拟合出的二级结构含量如表4所示。
经过不同浓度的花青素复合后,蛋白质中二级结构含量均发生了明显的变化。如表4所示,所有样品均表现出α-螺旋相对含量降低,β-折叠相对含量升高的现象,样品中蛋白质二级结构以β-结构为主。与HE等[15]的研究一致,可能是花青素结合到大豆蛋白α-螺旋结构中的疏水性氨基酸区域,从而使蛋白质分子展开改变其空间构象。LIU等[37]研究乳铁蛋白与绿原酸、没食子酸相互作用,结果表明在乳铁蛋白-绿原酸和乳铁蛋白-没食子酸复合物的二级结构中蛋白质的α螺旋结构相对含量均降低,β折叠相对含量均增加,与本文研究结果一致。

表4 圆二色谱测定加入花青素后复合物中SPI的二级结构相对含量Tab.4 Secondary structure relative content of SPI in AN complex estimated from circular dichroism spectra %
注:同一列数据后不同字母表示样品间差异显著(P<0.05)。
总体来说,圆二色谱结果证明了花青素与大豆蛋白的相互作用导致大豆蛋白二级结构的变化[38],结果与红外光谱一致。
3 结论
(1)花青素对大豆分离蛋白的荧光猝灭机制属于静态猝灭,大豆蛋白与花青素之间的作用力主要是疏水作用力,通过疏水相互作用大豆蛋白和花青素可以形成结合位点数接近于1的复合物。
(2)同步荧光光谱和紫外-可见光谱结果说明花青素的加入导致大豆蛋白中酪氨酸、色氨酸残基所处微环境的改变,从而引起大豆蛋白结构发生部分变化,且花青素与大豆分离蛋白作用的结合位点更接近于色氨酸残基。
(3)红外光谱和圆二色谱结果说明花青素引起大豆蛋白二级结构发生改变,进一步说明大豆蛋白和花青素发生了相互作用。
(4)花青素和大豆蛋白间主要作用力是疏水相互作用,花青素的加入导致大豆蛋白中酪氨酸、色氨酸残基所处微环境的改变,使大豆分离蛋白的分子构象发生改变,从而引起大豆蛋白二级结构发生变化。
1 GRAHAM D E, PHILLIPS M C. Proteins at liquid interfaces: Ⅲ. Molecular structures of adsorbed films[J]. Journal of Colloid and Interface Science, 1979, 70(3): 427-439.
2 王中江,江连洲,魏冬旭,等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学,2012,33(11):47-51.
WANG Zhongjiang,JIANG Lianzhou,WEI Dongxu, et al. Effect of pH on conformation and surface hydrophobicity of soybean protein isolate[J].Food Science, 2012,33(11):47-51.(in Chinese)
3 KATO A, OSAKA Y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation [J]. Agricultural and Biological Chemistry, 1983, 47(1): 33-37.
4 刘秀英, 申健, 常庆瑞,等. 基于可见/近红外光谱的牡丹叶片花青素含量预测[J/OL]. 农业机械学报, 2015, 46(9):319-324.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20150947&flag=1.DOI:10.6041/j.issn.1000-1298.2015.09.047.
LIU Xiuying, SHEN Jian, CHANG Qingrui, et al. Prediction of anthocyanin content in peony leaves based on visible /near-infrared spectra[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(9):319-324.(in Chinese)
5 NIZAMUTDINOVA I T, KIM Y M, CHUNG J I, et al. Anthocyanins from black soybean seed coats preferentially inhibit TNF-α-mediated induction of VCAM-1 over ICAM-1 through the regulation of GATAs and IRF-1[J]. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7324-7330.
6 COLLINS B, HOFFMAN J, MARTINEZ K, et al. A polyphenol-rich fraction obtained from table grapes decreases adiposity, insulin resistance and markers of inflammation and impacts gut microbiota in high-fat-fed mice[J]. The Journal of Nutritional Biochemistry, 2016, 31: 150-165.
7 JENNINGS A, WELCH A A, FAIRWEATHER-TAIT S J, et al. Higher anthocyanin intake is associated with lower arterial stiffness and central blood pressure in women[J]. The American Journal of Clinical Nutrition, 2012, 96(4): 781-788.
8 KONCZAK I, ZHANG W. Anthocyanins—more than nature’s colours[J]. Journal of Biomedicine and Biotechnology, 2004(5): 239-240.
9 MULAUDZI R B, NDHLALA A R, KULKARNI M G, et al. Pharmacological properties and protein binding capacity of phenolic extracts of some Venda medicinal plants used against cough and fever[J]. Journal of Ethnopharmacology, 2012, 143(1): 185-193.
10 JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids and proteins[J]. Food Chemistry, 2015, 175: 556-567.
11 RYAN L, SUTHERLAND S. Comparison of the effects of different types of soya milk on the total antioxidant capacity of black tea infusions[J]. Food Research International, 2011, 44(9): 3115-3117.
12 LABUCKAS D O, MAESTRI D M, PERELLO M, et al. Phenolics from walnut (JuglansregiaL.) kernels: antioxidant activity and interactions with proteins[J]. Food Chemistry, 2008, 107(2): 607-612.
13 KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3): 1046-1055.
14 WANG Y Q, ZHANG H M, ZHANG G C, et al. Interaction of the flavonoid hesperidin with bovine serum albumin: a fluorescence quenching study[J]. Journal of Luminescence, 2007, 126(1): 211-218.
15 HE Z, ZHU H, XU M, et al. Complexation of bovine β-lactoglobulin with malvidin-3-O-glucoside and its effect on the stability of grape skin anthocyanin extracts[J]. Food Chemistry, 2016, 209: 234-240.
16 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J]. 食品科学, 2015, 36(17): 43-47.
LIU Qinqin, ZHU Kexue, GUO Xiaona, et al. Spectroscopic analysis of interaction between tea polyphenol and soy protein isolate[J]. Food Science, 2015, 36(17): 43-47.(in Chinese)
17 HU C, ZAWISTOWSKI J, LING W, et al. Black rice (OryzasativaL. indica) pigmented fraction suppresses both reactive oxygen species and nitric oxide in chemical and biological model systems[J]. Journal of Agricultural & Food Chemistry, 2003, 51(18):5271-5277.
18 MEINLSCHMIDT P, SCHWEIGGERT-WEISZ U, BRODE V, et al. Enzyme assisted degradation of potential soy protein allergens with special emphasis on the technofunctionality and the avoidance of a bitter taste formation[J]. LWT—Food Science and Technology, 2016, 68: 707-716.
19 SUI X, BARY S, ZHOU W. Changes in the color, chemical stability and antioxidant capacity of thermally treated anthocyanin aqueous solution over storage[J]. Food Chemistry, 2016, 192: 516-524.
20 RAWEL H M, MEIDTNER K, KROLL J. Binding of selected phenolic compounds to proteins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4228-4235.
21 LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727.
22 ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102.
23 YAMASAKI K, MARUYAMA T, YOSHIMOTO K, et al. Interactive binding to the two principal ligand binding sites of human serum albumin: effect of the neutral-to-base transition[J]. Biochimica et Biophysica Acta (BBA)—Protein Structure and Molecular Enzymology, 1999, 1432(2): 313-323.
24 柳全文, 徐慧, 李桂华, 等. 咖啡酸与牛血清白蛋白相互作用的荧光光谱法研究[J]. 食品科学, 2010, 31(1): 24-28.
LIU Quanwen, XU Hui, LI Guihua, et al. Insight into interaction of caffeic acid with bovine serum albumin[J].Food Science, 2010, 31(1): 24-28.(in Chinese)
25 GUO M, LÜ W J, LI M H, et al. Study on the binding interaction between carnitine optical isomer and bovine serum albumin[J]. European Journal of Medicinal Chemistry, 2008, 43(10): 2140-2148.
26 卢雁, 高胜华, 王运来, 等. 光谱法研究吡嗪酰胺与人血清白蛋白的作用机制[J]. 科学通报, 2009, 54(14): 2071-2075.
LU Yan, GAO Shenghua, WANG Yunlai, et al. Study on interaction mechanism between pyrazinamide and human serum albumin by spectroscopic methods[J]. Chinese Science Bulletin, 2009, 54(14): 2071-2075.(in Chinese)
27 盛良全, 闫向阳, 徐华杰, 等. 烟碱与牛血清白蛋白相互作用的光谱研究[J]. 光谱学与光谱分析, 2007, 27(2): 306-308.
SHENG Liangquan, YAN Xiangyang, XU Huajie,et al. Study on the interaction between BSA and Nicotine[J]. Spectroscopy and Spectral Analysis, 2007, 27(2): 306-308.(in Chinese)
28 KROLL N G, RAWEL H M, ROHN S. Review: reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Food Science and Technology Research, 2003,9(3): 205-218.
29 李杨, 王中江, 王瑞, 等. 不同热处理条件下大豆分离蛋白的红外光谱分析[J]. 食品工业科技, 2016(8): 104-109.
LI Yang, WANG Zhongjiang, WANG Rui, et al. Fourier transform infrared spectroscopic analysis of soybean isolate protein at different heat treatment conditions[J]. Science and Technology of Food Industry, 2016(8): 104-109.(in Chinese)
30 LIU Yuan, XIE Mengxia, KANG Juan, et al. Studies on the interaction of total saponins of panax notoginseng and human serum albumin by Fourier transform infrared spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2003, 59(12): 2747-2758.
31 NANDA R K, SARKAR N, BANERJEE R. Probing the interaction of ellagic acid with human serum albumin: a fluorescence spectroscopic study[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2007, 192(2): 152-158.
32 PU H L, JIANG H, CHEN R R, et al. Studies on the interaction between vincamine and human serum albumin: a spectroscopic approach [J]. Luminescence, 2014, 29(5): 471-479.
33 HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk alpha- and beta-caseins with tea polyphenols [J]. Food Chemistry, 2011, 126(2): 630-639.
34 SHEN F, NIU F, LI J, et al. Interactions between tea polyphenol and two kinds of typical egg white proteins—ovalbumin and lysozyme: effect on the gastrointestinal digestion of both proteins in vitro[J]. Food Research International, 2014, 59: 100-107.
35 罗东辉. 均质改性大豆蛋白功能特性研究[D]. 广州:华南理工大学, 2010.
LUO Donghui. Functional properties of modified soy protein by homogenization[D]. Guangzhou: South China University of Technology,2010.(in Chinese)
36 KAMAULDAOVA E. Interactions of human serum albumin with retinoic acid, retinal and retinyl acetate [J]. Biochemical Pharmacology, 2007, 73(6): 901-910.
37 LIU F, WANG D, SUN C, et al. Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions: multilayer coatings formed using protein and protein-polyphenol conjugates[J]. Food Chemistry, 2016, 205: 129-139.
38 SRIVASTAVA A K, ICONOMIDOU V A, CHRYSSIKOS G D, et al. Secondary structure of chorion proteins of the LepidopteraPericalliariciniandAriadnemerioneby ATR FT-IR and micro-Raman spectroscopy[J]. International Journal of Biological Macromolecules, 2011, 49(3): 317-322.
