卡介菌-多糖核酸不同干预方式对哮喘小鼠气道反应性和气道炎症的影响
2018-07-05姜华赖克方沈璐席寅南岩东金发光
姜华 赖克方 沈璐 席寅 南岩东 金发光
支气管哮喘是一种以气道高反应性、可逆的气流受阻、气道嗜酸性粒细胞等浸润、气道黏液高分泌及血清高IgE为特征的气道慢性炎症性疾病,Th1/Th2失衡学说解释了哮喘的部分发病机制[1-3]。此后有研究证实调节性T细胞也参与了哮喘的免疫紊乱[4]。卡介苗(bacillus calmette-guerin, BCG)具有很强的Th1细胞作用,多个研究证实在造模前给予BCG干预可明显降低哮喘小鼠的气道反应性、气道炎症[5-8]。卡介菌多糖核酸(BCG polysaccharide nucleotide, BCG-PSN)是BCG经过灭活后制成的一种免疫制剂,具有多种免疫活性[9-10]。目前临床BCG-PSN的用药途径为肌肉注射,其缺点是用药周期长,临床应用受限,且需在相关动物研究为造模前给药。因此本研究主要探讨BCG-PSN不同方式干预对已造模成功的哮喘小鼠气道炎症和气道反应性的影响。
材料和方法
一、材料及试剂
Balb/c小鼠(购自广东省实验动物中心)5~6周龄,体质量16~18 g,雌性。饲养在广州呼吸疾病研究所SPF级动物房。卵白蛋白(OVA,Sigma公司),佐剂Al(OH)3(Sigma公司)。卡介菌-多糖核酸购自医院药房(国药准字92S020100,湖南斯奇生物制药有限公司生产)。小鼠无创肺功能仪(美国Buxco公司)。
二、试验方法
1. 动物致敏、激发: 以OVA首次致敏为0 d,在0、7、14 d OVA(0.01%OVA,0.2 ml/只)腹腔注射致敏,28、29、30 d(早期),42、43、44 d(晚期) OVA(0.4%OVA,50 μl/只)滴鼻激发,一次/d。正常组在每次给药时间点给予相应剂量的生理盐水。动物造模干预流程,见图1。
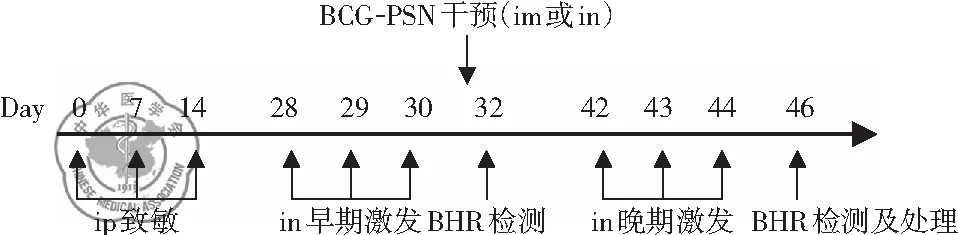
图1 研究中动物致敏、激发、BCG-PSN干预流程;注:ip腹腔注射致敏20 μg OVA(0.01% OVA,0.2 ml/只);in麻醉滴鼻激发200 μg OVA(0.4% OVA,50 μl/只)im 肌肉注射
2. BCG干预: 剂量为20 μg/只,体积为60 μl,均为末次激发后(30 d)进行干预,根据干预方式分为肌肉注射组(im)和麻醉滴鼻组(in)。
3. 麻醉滴鼻给药方式药物分布检测: 取10只正常小鼠,分别用1%戊巴比妥钠50 mg/kg腹腔麻醉,将5%伊文思蓝溶液50 μl(用NS配制)经鼻滴入,滴完后转动小鼠体位数次以促进激发液在肺内均匀分布。处死小鼠,分别留取鼻、气管、食管、肺脏(包括支气管)、脾脏(阴性对照),分别加入1 ml甲酰胺溶液,65 ℃水浴24 h,配制伊文思蓝标准浓度溶液(156、78、39、19. 5、9.7、4.8、2.4、0 μ/ml),用酶标仪在600 nm处检测标准液及各器官组织的吸光度OD值。根据标准曲线换算成各器官伊文思蓝浓度。
4. 气道反应性: 分别在实验流程的32、46 d,小鼠进行无创肺功能检测,通过乙酰甲胆碱(Mch)激发测定各浓度时的Penh值,Mch激发浓度包括3.12、6.25、12.5、25、50 mg/ml。以生理盐水(normal saline, NS)时的Penh值为基值,将各个浓度Penh的百分比(Penh/NS%),作为气道反应性统计指标[11-12]。本研究评价气道反应性包括以下二个方面:①与哮喘组相比可以显著降低气道反应性(P<0.05)的激发浓度;②气道反应性升高为基值2倍时的Mch激发浓度即PC100,值越小,气道敏感性越高。
5. 支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)分析:在实验流程第46 d,小鼠行无创肺功能检测后,以100 mg/kg戊巴比妥钠腹腔注射麻醉,摘眼球放血,仰卧位,行气管插管,以0.8 ml PBS灌洗3次,回收率在80%以上。4 ℃以离心半径8 cm,1 500 r/min,离心10 min,沉淀涂片并行HE染色,连续计数200个细胞并计其中Eos的个数,计算Eos百分比。
6. 肺组织学病理: 分离肺脏,通过气管插管灌注10%中性甲醛使肺膨胀进行内固定,取出肺脏浸入10%中性甲醛中外固定,切取左肺叶,经不同梯度浓度乙醇、二甲苯处理后,石蜡包埋,切片,HE染色并镜检。
三、统计学方法
所有数据用均数±标准差表示,各组间比较采用spss13.0进行单因素方差分析,方差齐用最小显著差异法(least significant difference, LSD),当方差不齐时用Tamhane′s T2法或采用秩和检验,P<0.05表示差异有统计学意义。在造模过程中死亡及感染的动物不列入统计。
结 果
一、麻醉滴鼻给药方式的药物分布
结果显示伊文思蓝经麻醉状态滴鼻后进入体内,主要沉积于支气管及肺部,的浓度为(43.11±7.68)μg/ml,与脾脏中药物浓度(2.57±0.65)μg/ml,差异具有统计学意义(P<0.01),其次是鼻,其浓度为(8.44±2.82)μg/ml,与脾脏相比(P<0.05),但明显低于支气管及肺组织中药物浓度,主气管(2.39±0.73)μg/ml与食管(1.96±0.43)μg/ml 中的分布几乎可以忽略不计,见图2。
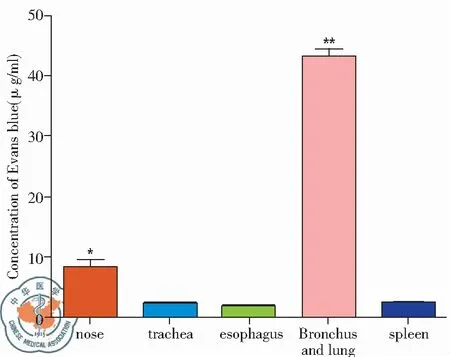
图2 5%伊文思蓝麻醉滴鼻给药后各个器官分布的浓度(μg/ml);注:* vs. spleen P<0.05, ** vs. spleen P<0.01
二、气道反应性
1. Penh/NS%: 对于早期激发,BCG-PSN im组与in组在Mch激发浓度(3.12~50 mg/ml)与哮喘组相比,Penh/NS%均明显降低,且在12.5、50 mg/ml时in组显著低于im组,差异有统计学意义(P<0.05);而对于晚期激发:im组完全不能降低气道反应性,而in组则在Mch激发浓度为12.5、25、50 mg/ml时,Penh/NS%与哮喘组相比明显减低,且在激发浓度为25、50 mg/ml时明显低于im组,差异有统计学意义(P<0.05),见表1、2。
2. PC100: BCG-PSN im组早期PC100为(9.48±3.06)mg/ml、与哮喘组(4.79±1.51)mg/ml相比P<0.05,晚期PC100(4.96±1.88)mg/ml,哮喘组为(5.55±3.11)mg/ml,两组相比差异无统计学意义,BCG-PSN in组早期、晚期PC100分别为(12.39±4.89)mg/ml、(9.19±2.35)mg/ml,与哮喘组相比,均有统计学意义(P<0.05),且晚期激发PC100 in组明显高于im组,见图3。
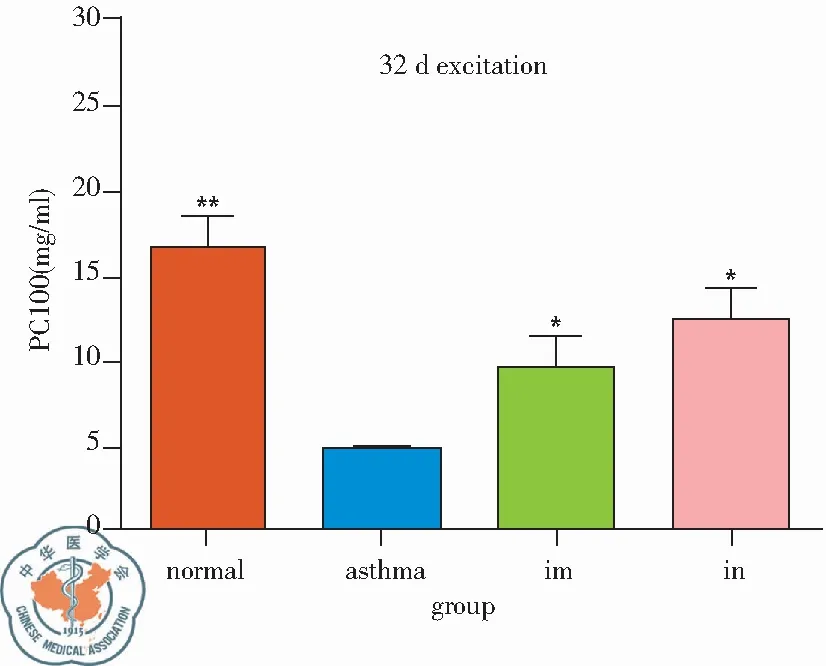
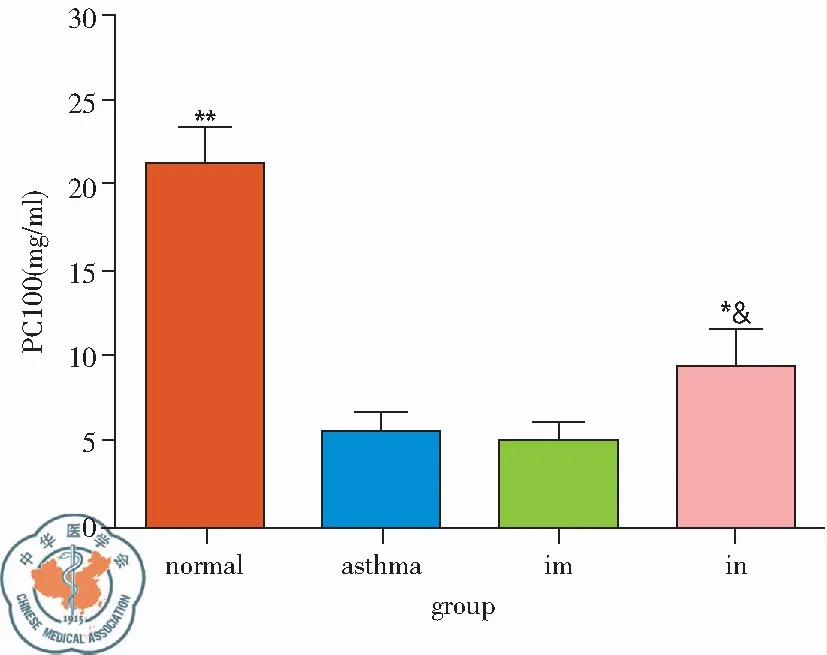
图3 BCG-PSN不同干预方式对哮喘小鼠气道反应性(PC100)的影响;注:im 肌肉注射组,in 麻醉滴鼻组 *vs. asthmaP<0.05; **vs. asthmaP<0.01;& 两种干预方式相比P<0.05
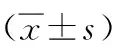
表1 BCG-PSN干预对哮喘小鼠在Mch各浓度早期激发气道阻力(Penh/NS)%的影响
注:与哮喘组比较,aP<0.05,bP<0.01;两种干预方式比较cP<0.05
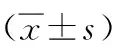
表2 BCG-PSN干预对哮喘小鼠在Mch各浓度晚期激发气道阻力(Penh/NS)%的影响
注:与哮喘组比较,aP<0.05,bP<0.01;两种干预方式比较cP<0.05
三、气道炎症
哮喘组BALF中Eos%为(40.73±6.01)%,明显高于正常组,BCG-PSN im组Eos% 为(35.65±4.27)%,与哮喘组相比无明显差异(P>0.05),BCG-PSN in组(30.98±5.45)%显著低于哮喘组,差异有统计学差异(P<0.05),见图4。
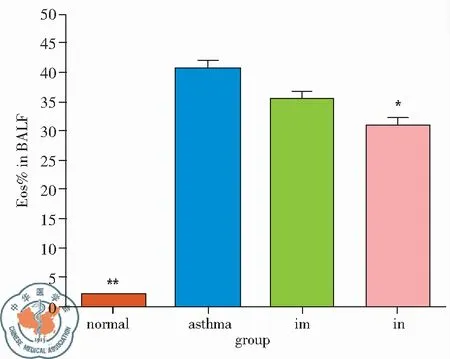
图4 各组对哮喘小鼠BALF中Eos%的影响;注:im 肌肉注射组,in 麻醉滴鼻组 *vs. asthmaP<0.05; **vs. asthmaP<0.01
四、肺组织病理变化
正常组小鼠肺组织光镜下肺泡壁结构完整,肺泡腔内无渗出液,肺泡上皮细胞排列有序,极少有嗜酸性粒细胞及淋巴细胞浸润。哮喘组肺泡腔内可见巨噬细胞浸润,气管壁及血管周围可见大量的Eos及淋巴细胞浸润。BCG-PSN干预组与哮喘组相比血管周围及气管壁Eos、淋巴细胞浸润均明显减少,见图5。
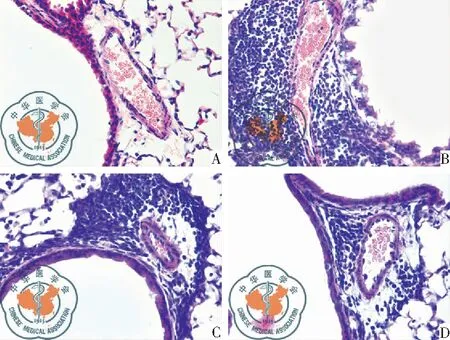
图5 肺组织病理图;注:A:正常组小鼠肺组织学病理(HE×400);B:哮喘组小鼠肺组织学病理(HE×400);C:im组小鼠肺组织学病理(HE×400);D:in组小鼠肺组织学病理(HE×400)
讨 论
大量动物实验证实BCG可以显著抑制哮喘小鼠的气道反应性和减轻其气道炎症,具体机制包括BCG-PSN多糖及核酸的作用,BCG是经热酚法去除蛋白后提取的卡介菌多糖核酸,配以灭菌生理盐水制成的以多糖成分为主的一种非特异免疫调节剂[5-8,13]。前期实验也证实在致敏前腹腔注射给予卡介菌多糖核酸可对哮喘小鼠产生预防作用[14]。因此本研究旨在探讨BCG-PSN不同方式干预对已造模成功的哮喘小鼠气道炎症和气道反应性的影响。
本文结果发现,小鼠经过致敏、激发后具备哮喘动物模型的基本条件:气道呈高反应性和气道炎症,此时给予BCG-PSN干预,肌肉注射和鼻内吸入两种干预方式均可降低早期激发的小鼠气道反应性,后者还可显著降低晚期激发气道反应性。本研究还证实对于气道炎症,肌肉注射干预不能有效的减轻气道炎症,而鼻内干预则可显著地抑制气道炎症。与之前的研究采取的干预时机即造模前干预不同,本研究证实对已造模成功的哮喘小鼠进行BCG-PSN干预,仍然可以显著降低哮喘小鼠的气道反应性和气道炎症[5-8]。Shirota等[15]在气道内予OVA激发时同时给予CpG-ODN(BCG核酸中的成分),发现CpG-ODN能显著抑制OVA介导的气道炎症和气道高反应性,也从动物实验证实了BCG组分鼻内干预对哮喘小鼠的治疗作用。有研究通过临床观察研究发现BCG-PSN可通过增加血清中IL-4及IFN-r调节Th1/Th2失衡,从而提高临床哮喘儿童治疗效果[9]。BCG-PSN对哮喘患者具有一定的治疗及免疫调节作用,褚明慧[16]、李靖[17]通过研究证实BCG-PSN对咳嗽变异性哮喘患儿、哮喘合并过敏性鼻炎的儿童及成人均有一定的疗效,也证实了BCG-PSN对哮喘具有治疗作用。
目前临床BCG-PSN用药途径为肌肉注射,且需多次干预,疗程为2~3个月,给临床使用带来了诸多限制,因此在保留其药理作用的前提下是否存在更为方便的干预方式,则一直未有研究报道。早在2002年有学者就探讨过麻醉后滴鼻这种干预方式,认为BCG经麻醉滴鼻干预可以降低小鼠气道反应性并减轻气道炎症,并发现麻醉后滴鼻干预效果优于腹腔注射[18-19]。Samary等[20]通过与皮下注射相比,发现鼻内给予BCG干预也可通过增加CD4+CD25+T细胞关键因子foxp3的表达及刺激IL-10的分泌从而降低哮喘小鼠气道高反应性,但干预时机为造模前。以上多个研究均证实了鼻内吸入干预是BCG或BCG-DNA的有效的干预方式。本研究发现,对于已造模成功的哮喘小鼠模型,肌肉注射对哮喘小鼠的治疗作用仅体现在早期气道反应性的抑制,而对晚期气道反应性无抑制作用,而麻醉后滴鼻干预对早期激发和晚期激发的气道反应性均有明显抑制,说明麻醉滴鼻比肌肉注射效果更加明显,作用时间更为持久。此外对于气道炎症,肌肉注射组并未降低气道炎症,而麻醉滴鼻组明显减轻了气道嗜酸性粒细胞的浸润,与罗光燕等[21]的研究相比,多次给予BCG-PSN干预既可明显降低气道反应性,又可减轻气道炎症,结果优于临床上BCG-PSN肌肉注射需要多次给药,且总的治疗周期长的缺点。
对于鼻内干预方式,Choi等[22]发现BCG鼻内干预对哮喘小鼠气道反应性指标PC100无明显影响,但该研究是在小鼠清醒的情况下鼻内干预,笔者也曾尝试在小鼠清醒状态下滴鼻,观察到小鼠存在吞咽、打喷嚏动作,可能使部分药物进入了食管、胃等消化道,并且部分药物被喷出。曾有研究证实在清醒状态下小鼠进行滴鼻,发现药物主要分布于鼻部,而下气道的药物分布极少,这些可能都是部分研究中鼻内干预效果欠佳的原因[23-24]。而本研究采取麻醉后滴鼻,利用小鼠自然呼吸使药物进入呼吸道,并通过伊文思蓝证实药物多数分布于支气管与肺中,少数分布于鼻,保证了药物充分作用于哮喘小鼠的呼吸道,可能也是鼻内干预优于肌肉注射干预的原因。此外Gauvreau等[25]发现哮喘患者吸入CpG(未甲基化的胞嘧啶鸟嘌呤二核苷酸)治疗后,患者痰和外周血单个核细胞的IFN-γ水平明显增高,证实临床上核酸组分吸入干预的可行性,为BCG-PSN经鼻临床应用提供了依据。
本研究初步证实了BCG-PSN不仅对哮喘小鼠具有预防作用,而且对已造模成功的哮喘小鼠具有治疗作用。麻醉滴鼻相当于气道吸入对哮喘小鼠的作用效果,且与肌肉注射给药相当甚至更优。但是临床BCG-PSN通过气道给药仍需要更进一步的对其剂型、颗粒大小以及具体吸入方式进行研究。
参 考 文 献
1 王长征. 支气管哮喘的动脉血气和酸碱平衡[J/CD]. 中华肺部疾病杂志(电子版), 2010, 3(3): 215-221.
2 Lee SH, Park JS, Park CS. The search for genetic variants and epigenetics related to asthma[J]. Allergy Asthma Immunol Res, 2011, 3(4): 236-244.
3 Akinbami LJ, Moorman JE, Liu X. Asthma prevalence, health care use, and mortality: United states,2005-2009[J]. Natl Health Stat Report, 2011, 12(32): 1-14.
4 Kinoshita T, Baatjes A, Smith SG, et al. Natural regulatory T cells in isolated early responders compared with dual responders with allergic asthma[J]. J Allergy Clin Immunol, 2014, 133(3): 696-703.
5 Qu SY, Ou-Yang HF, He YL, et al. Der p2 recombinant bacille Calmette-Guerin priming of bone marrow-derived dendritic cells suppresses Der p2-induced T helper17 function in a mouse model of asthma[J]. Respirology, 2014, 19(1), 122-131.
6 Gouveia ACC, Braga FG, Mota M, et al. Enhanced expression of PD-L1 and IFN-γ on dendritic cells is associated with BCG-induced Th2 inhibition[J]. Cytokine, 2017, 99: 163-172.
7 Spitz C, Winkels H, Bürger C, et al. Regulatory T cells in atherosclerosis: critical immune regulatory function and therapeutic potential[J]. Cell Mol Life Sci, 2016, 73(5): 901-922.
8 Gong P, Li Y, Tan YP, et al. Pretreatment With Inactivated Bacillus Calmette-Guerin Increases CD4+CD25+Regulatory T Cell Function and Decreases Functional and Structural Effects of Asthma Induction in a Rat Asthma Model[J]. Artif Organs, 2016, 40(4): 360-367.
9 Wang HL, Ma N. Effect of BCG-PSN adjuvant therapy on Th1/Th2 immune response in bronchial asthma children[J]. Int J Clin Exp Med, 2016, 9(2): 2555-2560.
10 石涛, 冯学斌, 赵志旭, 等. 卡介苗多糖核酸对哮喘大鼠淋巴液和血液CD4+CD25+Foxp3+调节性T细胞的影响[J]. 中国免疫学杂志, 2010, 26(10): 932-936.
11 Han ER, Choi IS, Choi HG, et al. Therapeutic effects of mycobacterial secretory proteins against established asthma in BALB/c mice[J]. Allergy Asthma Immunol Res, 2012, 4(4): 214-221.
12 李斌恺, 赖克方, 洪燕华, 等. 支气管哮喘小鼠气道反应性无创检测方法的建立[J/CD]. 中华哮喘杂志(电子版), 2008, 2(3): 165-169.
13 Zhang G, Wang P, Qiu Z, et al. Distant lymph nodes serve as pools of Th1 cells induced by neonatal BCG vaccination for the prevention of asthma in mice[J]. Allergy, 2013, 68(3): 330-338.
14 姜华, 赖克方, 沈璐, 等. 卡介菌多糖核酸对哮喘小鼠气道炎症和气道反应性的影响[J]. 国际呼吸杂志, 2010, 30(7): 409-413.
15 Shirota H, Sano K, Kikuchi T, et al. Regulation of T-helper type 2 cell and airway eosinophilia by transmucosal coadministration of antigen and oligodeoxynucleotides containing CpG motifs[J]. Am J Respir Cell Mol Biol, 2000, 22(2): 176-182.
16 褚明慧. 孟鲁司特钠联合卡介菌多糖核酸治疗小儿变异性哮喘的效果观察[J]. 中国当代医药, 2016, 23(5): 23-25.
17 Li J, Luo DF, Li SY, et al. Efficacy of intramuscular BCG polysaccharide nucleotide on mild to moderate bronchial asthma accompanied with allergic rhinitis: a randomized, double blind, placebo-controlled study[J]. Chin Med J (Engl), 2005, 118(19): 1595-1603.
18 Hopfenspirger MT, Agrawal DK. Airway hyperresponsiveness, late allergic response, and eosinophilia are reversed with mycobacterial antigens in ovalbumin-presensitized mice[J]. J Immunol, 2002, 168(5): 2516-2522.
19 Major T, Wohlleben G, Reibetanz B, et al. Application of heat killed Mycobacterium bovis-BCG into the lung inhibits the development of allergen-induced Th2 responses[J].Vaccine, 2002, 20(11-12): 1532-1540.
20 Samary Cdos S, Antunes MA, Silva JD, et al. Impact of Bacillus Calmette-Guérin Moreau vaccine on lung remodeling in experimental asthma[J]. Respir Physiol Neurobiol, 2013, 189(3): 614-623.
21 罗光燕, 蓝楠, 王孝芸, 等. 卡介菌核酸多糖注射液对哮喘小鼠气道炎症和肺部抗菌肽表达影响与机制研究[J/CD]. 中华临床医师杂志(电子版), 2013, 21(7): 9633-9637.
22 Choi IS, Lin XH, Koh YA, et al. Inoculation route-dependent and allergen-specific suppressive effects of bacille Calmette-Guerin vaccination on asthmatic reactions in BALB/c mice[J]. Lung, 2007, 185(3): 179-186.
23 McCusker C, Chicoine M, Hamid Q, et al. Site-specific sensitization in a murine model of allergic rhinitis: role of the upper airway in lower airways disease[J]. J Allergy Clin Immunol, 2002, 110(6): 891-898.
24 Cho YS, Kwon B, Lee TH, et al. 4-1 BB stimulation inhibits allergen-specific immunoglobulin E production and airway hyper-reactivity but partially suppresses bronchial eosinophilic inflammation in a mouse asthma model[J]. Clin Exp Allergy, 2006, 36(3): 377-385.
25 Gauvreau GM, Hessel EM, Boulet LP, et al. Immunostimulatory sequences regulate interferon-inducible genes but not allergic airway responses[J]. Am J Respir Crit Care Med, 2006, 174(1): 15-20.
