猪繁殖与呼吸综合征病毒类NADC30毒株FJZ03的致病性分析
2018-07-04刘建奎范佳霖魏春华刘佳悦马露露虞慧芸戴爱玲杨小燕龙岩学院生命科学学院福建省家畜传染病防治与生物技术重点实验室福建省生猪疫病防控工程技术研究中心龙岩364000
刘建奎,范佳霖,魏春华,李 艳,刘佳悦,马露露,虞慧芸,戴爱玲,杨小燕(龙岩学院生命科学学院,福建省家畜传染病防治与生物技术重点实验室福建省生猪疫病防控工程技术研究中心,龙岩 364000)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS),是由猪繁殖与呼吸综合征病毒(PRRS virus, PRRSV)引起的一种全球性的猪的重要传染性疾病,以引起母猪繁殖障碍、生长猪特别是仔猪的呼吸道疾病和持续性感染等为主要特征,给世界养猪业造成巨大的经济损失[1-2]。PRRS于1996年在我国大陆首次暴发,并迅速蔓延,成为我国规模化养猪场主要疫病之一。2006年,在我国暴发的高致病性PRRSV(highly pathogenic PRRS virus,HP-PRRSV),给我国的养猪业造成了严重的经济损失,2013年国内出现了新流行毒株,该毒株与2008年美国分离到的NADC30毒株亲缘关系较近,称之为类NADC30 PRRSV(NADC30-like PRRSV),随后迅速蔓延至全国多个省市,给猪场防控PRRS带来了严峻挑战[3-10]。
类NADC30 PRRSV于2013年开始在福建省流行,给当地的养猪业造成了重大的经济损失[11-13]。临床调查发现该类毒株主要引起母猪流产和仔猪呼吸道疾病,传播速度非常快,猪场一旦感染,迅速波及全场,即使在疫苗免疫的猪场也不能幸免。基因组序列分析表明,该类毒株与经典毒株VR2332和CH-1a相比其在Nsp2基因存在131 aa的不连续缺失[6-7,11-13]。流行病学调查结果表明2014年之后类NADC30 PRRSV成为福建省猪场的优势毒株,因此有必要深入研究类NADC30 PRRSV的生物学特性和致病性,为今后对该类毒株的防控提供科学依据。本研究选取可以用MARC-145细胞分离且与NADC30相似性最高(97.1%)的2013年分离株FJZ03进行致病性研究,通过观察记录感染仔猪的临床症状和体温变化,检测其排毒情况、病毒血症及组织病理变化等情况,研究该毒株对仔猪的致病性。
1 材料与方法
1.1 试剂
PRRSV抗体检测试剂盒为IDEXX Herd Check®PRRS ELISA X3试剂盒;RNA提取试剂盒、DNA胶回收试剂盒购自天根生化科技有限公司;PrimeScriptTMOne Step RT-PCR Kit Ver.2 购自大连宝生物公司;IFN-β、TNF-α、IL-8、IL-10、IL-1β 及IL-12p70 ELISA定量试剂盒购自R&D公司(R&D Systems,MN, USA)。
1.2 细胞、毒株
MARC-145细胞、类NADC30毒株FJZ03和高致病性毒株FJLYDX由龙岩学院生命科学学院重点实验室分离并保存。FJZ03毒株(GenBank收录号为KP860909)于2013年分离自福建省某规模化猪场,该猪场妊娠母猪流产较严重(30%左右),仔猪呼吸道症状比较明显,零星死亡。
1.3 动物试验
将15头30日龄PRRSV和PCV2抗原和抗体均为阴性的健康仔猪,随机均分为3组,分别为FJZ03组、FJLYDX组和对照组。攻毒组(FJZ03组和FJLYDX组)按每头猪2 mL(2×104TCID50)的剂量进行滴鼻接种。对照组每头猪接种2 mL不含血清的DMEM细胞培养液。
1.4 临床症状
接种后每天观察每头猪的临床症状,测量体温(上午和下午各测量一次),并在攻毒前(0 d)和攻毒后14 d对猪进行称重。临床症状评分标准参考冷雪[14]的方法,从动物行为(精神状态、食欲、神经症状)、呼吸症状和皮肤颜色等方面进行评分。
1.5 血清和鼻拭子、咽喉分泌物样本采集
分别在攻毒后0、1、2、3、4、7、11和14 d经前腔静脉采血,分离血清,-80 ℃冰箱保存。在采血的同时用棉签采集鼻拭子和咽喉分泌物进行PRRSV核酸的RT-PCR检测。按照天根生化科技有限公司RNA提取试剂盒说明书进行样品的RNA提取,参照 TaKaRa 试剂盒说明书采用一步法进行 RT-PCR。参考Zhao等[15]用于扩增PRRSVORF7基因的引物,P1: 5′-TCCACTACGGTCAACGGCACA-3′;P2:5′-TTTTTTAATTDCGGCCGCATGG-3′。
1.6 肺组织病理学观察
攻毒后14 d剖杀所有猪,无菌采集肺并用10%中性福尔马林固定,按常规方法制作病理切片,观察组织病理学变化。
1.7 病毒滴度和抗体检测
参考Guo等[16]的方法测定PRRSV滴度。参照IDEXX猪繁殖与呼吸综合征抗体检测试剂盒说明书检测血清中PRRSV抗体。
1.8 细胞因子检测
采集攻毒后0、4、7、11和14 d的血清和攻毒后14 d的支气管肺泡灌洗液用于测定IL-1β、IL-8、IL-10、IL-12p70、TNF-α和IFN-γ的浓度,具体操作根据检测试剂盒说明书进行。
1.9 数据分析
2 结 果
2.1 临床症状
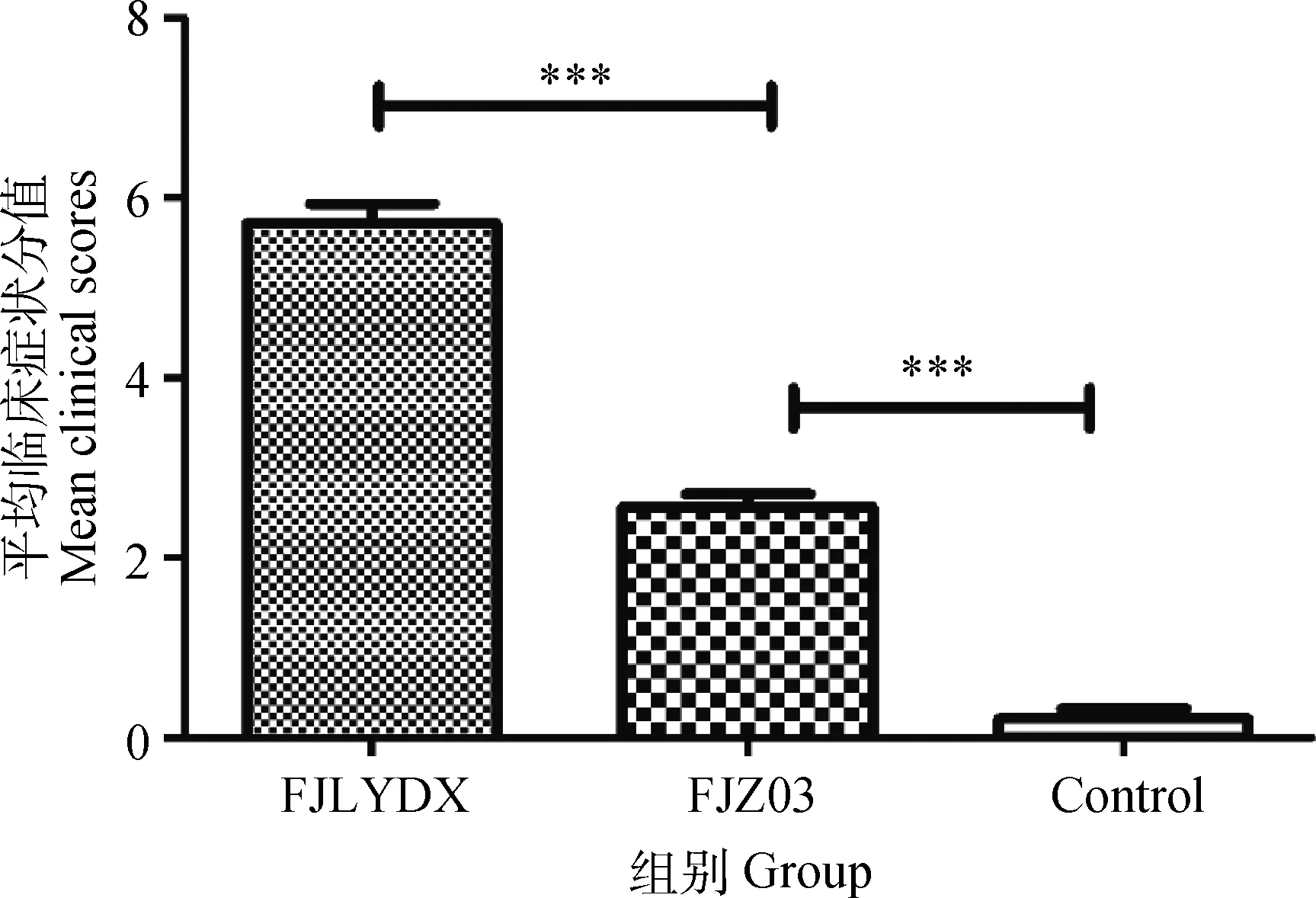
攻毒后1 d(1 DPC),FJZ03组仔猪体温升高到40 ℃以上,3 DPC时达到最高(平均体温40.5 ℃),仔猪表现出咳嗽、打喷嚏和厌食等症状,至试验结束时没有仔猪死亡(图1)。高致病性毒株FJLYDX组仔猪在2 DPC体温上升到40 ℃以上,7 DPC时达到最高为41 ℃,40 ℃以上的体温一直持续到试验结束,猪表现出精神沉郁、咳嗽、呼吸困难和厌食等典型的临床症状,10 DPC时1头仔猪死亡(图1)。整个试验过程中,对照组的仔猪体温正常(均在39.4~39.8 ℃范围内波动),无异常呼吸症状,两攻毒组仔猪临床症状分值明显高于对照组(图2)。FJZ03组、FJLYDX组与对照组仔猪体重每天平均增加0.252、0.142和0.322 kg,FJZ03组和FJLYDX组与对照组相比仔猪增重差异显著(P<0.05)。攻毒14 d后剖杀所有猪,FJZ03组的仔猪肺呈间质性肺炎的症状,多灶性弥散,肺部存在散在的出血点,具有不规则边界的褐色至红色斑点区域,FJLYDX组的仔猪肺呈典型的间质性肺炎的症状,多灶性弥散,具有不规则边界的褐色区域,对照组无异常变化(图3)。同时FJZ03组仔猪的脾与对照组相比严重萎缩(图3)。
2.2 病毒血症
提取血清中的总RNA,反转录为cDNA,以此为模板进行PCR检测,结果显示在1 DPC时FJZ03组血清中病毒核酸检出率为4/5,2 DPC时检出率为5/5,并且一直持续到试验结束。而FJLYDX组在3 DPC时才检测到血清中病毒核酸,检出率为3/5,在4~14 DPC时检出率为5/5(表1)。整个试验过程中对照组仔猪均没有检测到病毒核酸。

图1 攻毒后猪体温变化Fig.1 Comparison of rectal temperatures among FJLYDX, FJZ03 and control groups
***. P<0.01
图2 FJLYDX、FJZ03和对照组平均临床症状分值Fig.2 Mean clinical scores of piglets in different group after infection

图3 FJZ03感染猪肺、脾解剖病变Fig.3 Gross lesions of lung and spleen of infected piglets
将经双抗处理的阳性血清接种至长成单层的MARC-145细胞上,测定血清中的病毒载量。两组攻毒组仔猪的血清均可分离到病毒,FJZ03组在4 DPC 时血清中呈现较高的病毒滴度,7 DPC达到最高(105.0TCID50·mL-1),FJLYDX组在7 DPC达到最高(106.1TCID50·mL-1),较高的病毒载量一直维持到试验结束。FJZ03攻毒组和FJLYDX攻毒组病毒载量在7、11和14 DPC差异显著(P<0.05)(图4)。试验结果表明,FJZ03毒株在仔猪体内能快速复制。
2.3 攻毒试验猪的排毒情况
采用RT-PCR方法,检测攻毒仔猪鼻、咽喉分泌物中的PRRSV核酸,研究PRRSV的排毒情况。结果表明FJZ03在3 DPC时在猪的鼻、咽喉分泌物中均可检测到PRRSV核酸,而FJLYDX组在7 DPC时可以检测到PRRSV核酸(表1),表明FJZ03感染猪体后能较快地向环境中排毒,从而感染其他猪,这可以解释为什么猪场一旦感染此类毒株就能迅速波及全场。
2.4 抗体检测
用IDEXX抗体检测试剂盒检测猪血清中特异性的PRRSV N蛋白抗体,结果如图5。FJZ03组在7 DPC时有3头猪转阳,11 DPC全部转阳,而FJLYDX组在7 DPC时5头猪全部转阳(S/P>0.4),抗体水平显著高于FJZ03攻毒组(图5)。在整个试验过程对照组血清中的PRRSV N蛋白抗体均为阴性。

a、b、c不同字母间表示差异显著P<0.05Different letter superscripts denote significant differences at P<0.05
图4 病毒载量测定Fig.4 Virus titer from positive serum samples at each collection time point
表1鼻、咽喉分泌物和血清PRRSVORF7检测结果
Table1DetectionofORF7geneofPRRSVbyRT-PCR
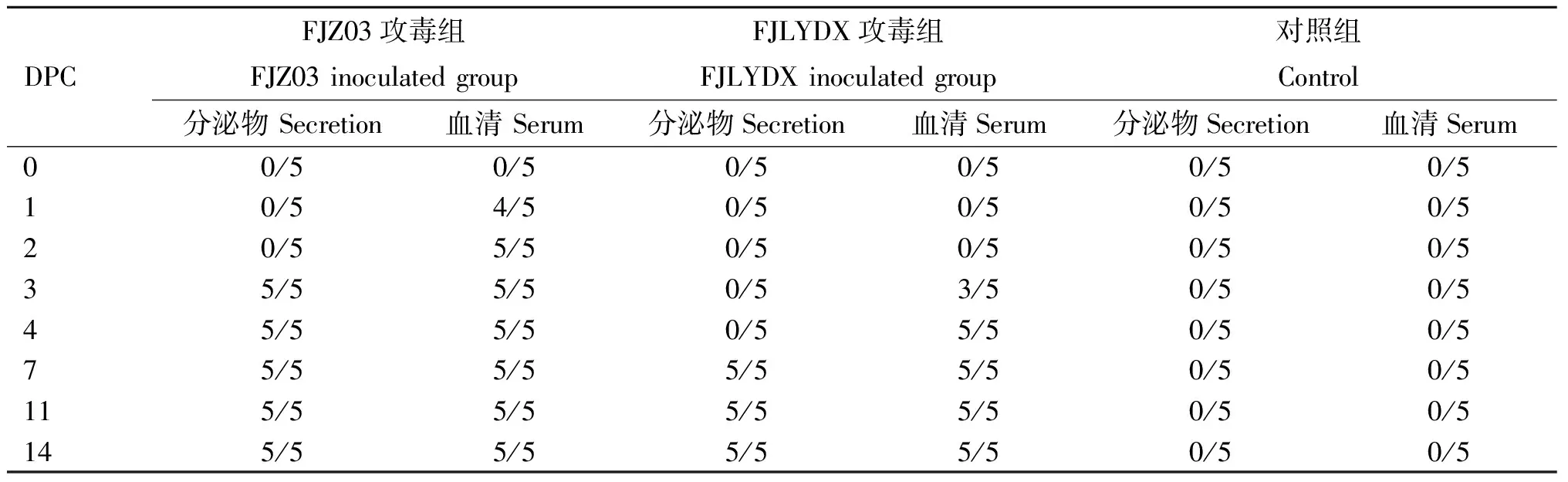
DPCFJZ03攻毒组FJZ03inoculatedgroupFJLYDX攻毒组FJLYDXinoculatedgroup对照组Control分泌物Secretion血清Serum分泌物Secretion血清Serum分泌物Secretion血清Serum00/50/50/50/50/50/510/54/50/50/50/50/520/55/50/50/50/50/535/55/50/53/50/50/545/55/50/55/50/50/575/55/55/55/50/50/5115/55/55/55/50/50/5145/55/55/55/50/50/5
2.5 肺病理组织学检查
FJZ03组肺呈间质性肺炎病变,肺泡内皮细胞增生、脱落,肺泡壁增宽,有大量炎性细胞浸润或纤维性渗出,肺泡腔被占据而缩小。肺泡毛细血管扩张,充满大量的红细胞;各级气管黏膜上皮细胞肿胀、增生,形成波浪形皱褶,且管腔内充斥着大量的淋巴细胞以及脱落的黏膜上皮细胞和细胞坏死的崩解物(图6b)。FJLYDX组肺病理组织病理变化比FJZ03组严重,各级支气管周围有大量炎性细胞浸润(图6c)。
2.6 主要细胞因子的测定
2.6.1 血清中细胞因子的变化 仔猪接种FJZ03和FJLYDX后,血清中的TNF-α浓度逐渐升高,在11 DPC达到最高,FJZ03组的TNF-α浓度略高于FJLYDX组,没有统计学意义。IL-1β浓度在11 DPC达到最高,FJLYDX组在7、11和14 DPC显著高于FJZ03组(P<0.05)。FJZ03组IL-10的浓度在4 DPC迅速升高,显著高于FJLYDX组(P<0.05),11 DPC达到最高;而FJLYDX组的IL-10的浓度在7 DPC迅速升高,11 DPC达到最高(P<0.05)。FJZ03和FJLYDX组血清中IL-12p70浓度在7、11和14 DPC时差异显著(P<0.05)。FJZ03组IFN-γ浓度在4 DPC迅速升高,显著(P<0.05)高于FJLYDX组,然后逐渐下降,显著(P<0.05)低于FJLYDX组(图7)。

a、b、c不同字母间表示差异显著P<0.05Different letter superscripts denote significant differences at P<0.05
图5 攻毒后PRRSV N蛋白抗体水平变化Fig.5 Virus-specific antibody response of piglets as measured by ELISA

a. 正常对照组肺; b. FJZ03攻毒后肺病变;c. FJLYDX攻毒后肺病变a. Normal lung from control pigs; b. Lung tissues from pigs inoculated with FJZ03; c. Lung tissues from pigs inoculated with FJLYDX
图6 攻毒后14 d猪肺的显微病理变化 (200×)Fig.6 Lung tissues collected at autopsy at 14 DPC were fixed in 10% neutral-buffered formalin and routinely processed for histological examination (200×)
2.6.2 支气管冲洗液细胞因子的变化 攻毒后14 d 剖杀所有猪,无菌摘除肺后,用50 mL不含抗生素的DMEM无菌冲洗支气管,收集冲洗液,3 000 r·min-1离心10 min,上清液用于细胞因子检测,检测结果如图8。与对照组相比,两组攻毒组IL-1β、TNF-α、IL-8、IFN-γ和IL-10的浓度都有不同程度的升高,FJZ03组的IL-10和TNF-α的浓度显著(P<0.05)高于FJLYDX组,而IL-1β、IL-8和IFN-γ显著(P<0.05)低于FJLYDX组(图8)。

a、b、c不同字母间表示差异显著P<0.05Different letter superscripts denote significant differences at P<0.05
图7 血清中细胞因子浓度变化Fig.7 Change of cytokine concentration in serum samples at specified days post exposure

**. P<0.05
图8 支气管洗液中细胞因子浓度变化Fig.8 Change of cytokine concentration in bronchoalveolar lavage fluid (BALF)
3 讨 论
研究表明PRRSV的毒力不仅与病毒滴度有关,还与病毒在动物体内复制的速度和时间有关[6, 17]。接种FJZ03仔猪体内的病毒载量迅速上升,7 DPC时达到最高,与FJLYDX攻毒组相比,FJZ03毒株能更早地诱发仔猪发热,可能与该毒株在体内能较快地复制和产生较高的病毒载量有关。FJZ03攻毒后在猪的鼻、咽喉分泌物中检测到PRRSV核酸的时间早于FJLYDX攻毒组,表明猪群感染FJZ03毒株后能迅速向环境中排毒,从而感染其他猪,导致此类毒株的迅速传播。猪感染PRRSV后体温的变化与病毒载量密切相关,提示猪在高热期是排毒的活跃期,猪场可根据猪体温的变化情况采取合理的措施,防止PRRSV在猪群传播,减少经济损失。FJZ03组仔猪体温升高在3 DPC时达到最高(平均体温40.5℃),并出现明显的呼吸症状,整个试验过程中没有出现仔猪死亡,与Zhou等[18]的研究结果相似。病理剖检显示,FJZ03攻毒组仔猪主要的病理变化为间质性肺炎,出血性坏死性肾炎,全身淋巴结出现不同程度的淋巴结炎,胸腺萎缩以及脾出血等,与HP-PRRSV引起的病理变化相似。此外,FJZ03引起猪脾萎缩,不同于其他HP-PRRSV毒株引起脾大的病理变化,具体原因有待进一步研究。序列分析表明,FJZ03与FJLYDX的N蛋白的相似性仅为90.2%。FJZ03 N蛋白序列与FJLYDX、VR2332进行比对,发现FJZ03 N蛋白存在几处独有的氨基酸突变:K7R、K10N、S34R、K48R和Q80R,这些氨基酸的突变可能会影响N蛋白的结构和抗原性,从而影响ELISA血清学检测结果[19]。
细胞因子检测结果显示,攻毒后FJZ03组细胞因子的浓度都有不同程度的升高,与FJLYDX组相比最明显的是产生较高水平的TNF-α和IL-10。研究表明,IL-10在PRRSV对宿主产生免疫抑制的过程中起着主要作用,IL-10表达与PRRSV复制呈显著正相关[20]。本研究用FJZ03毒株接种仔猪,并对其血清中IL-10浓度进行了检测,检测结果显示,猪感染FJZ03后血清呈现较高浓度的IL-10,和之前的研究结果相似[21-23]。FJZ03接种仔猪后,IL-10的大量表达可能有利于FJZ03在仔猪肺的快速复制。PRRSV诱导机体产生不同水平的TNF-α表达可能与ORF1a的变异程度有关[24]。FJZ03攻毒后血清中TNF-α在整个试验过程中维持较高的浓度,可能与FJZ03的ORF1a与HP-PRRSVs、CH-1a和VR2332毒株氨基酸相似性较低,变异程度较大以及病毒本身的固有差异有关,具体原因有待进一步研究。高水平的TNF-α表达可以诱导产生IL-10以控制炎症反应[25],FJZ03组猪体产生较高浓度TNF-α从而诱发机体产生高水平的IL-10,从而导致PRRSV在体内快速增殖。
综上所述,FJZ03对仔猪的致病能力较强,能较早地向环境中排毒,值得注意的是类NADC30 PRRSV与田间流行毒株重组的报道越来越多,因此有必要采取有效措施来防控该类毒株,除了研发新型高效安全的疫苗之外,猪场更应该加强生物安全措施。
4 结 论
本研究通过动物试验研究类NADC30 PRRSV FJZ03毒株对仔猪的致病性,结果表明该毒株能在猪体内快速复制,引起仔猪较高滴度的病毒血症,体温升高和体外排毒时间均早于FJLYDX毒株,并能引起严重的间质性肺炎,表明FJZ03对仔猪具有较强的致病性。
参考文献(References):
[1] NEUMANN E J, KLIEBENSTEIN J B, JOHNSON C D, et al. Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States[J].JAmVetMedAssoc, 2005, 227(3): 385-392.
[2] ZHOU L, YANG H C. Porcine reproductive and respiratory syndrome in China[J].VirusRes, 2010, 154(1-2): 31-37.
[3] AN T Q, TIAN Z J, XIAO Y, et al. Origin of highly pathogenic porcine reproductive and respiratory syndrome virus, China[J].EmergInfectDis, 2010, 16(2): 365-367.
[4] TIAN K G, YU X L, ZHAO T Z, et al. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoSOne, 2007, 2(6): e526.
[5] TONG G Z, ZHOU Y J, HAO X F, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J].EmergInfectDis, 2007, 13(9): 1434-1436.
[6] BROCKMEIER S L, LOVING C L, VORWALD A C, et al. Genomic sequence and virulence comparison of four type 2 porcine reproductive and respiratory syndrome virus strains[J].VirusRes, 2012, 169(1): 212-221.
[7] ZHOU L, WANG Z C, DING Y P, et al. NADC30-like strain of porcine reproductive and respiratory syndrome virus, China[J].EmergInfectDis, 2015, 21(12): 2256-2257.
[8] ZHANG Q Y, JIANG P, SONG Z B, et al. Pathogenicity and antigenicity of a novel NADC30-like strain of porcine reproductive and respiratory syndrome virus emerged in China[J].VetMicrobiol, 2016, 197: 93-101.
[9] ZHAO K, YE C, CHANG X B, et al. Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].JVirol, 2015, 89(20): 10712-10716.
[10] 魏春华, 刘建奎, 戴爱玲, 等. 福建NADC30-like PRRSV FJLY01株的全基因组分子特征分析[J]. 西北农林科技大学学报: 自然科学版, 2017, 45(3): 51-60, 67.
WEI C H, LIU J K, DAI A L, et al. Molecular characterization of NADC30-like PRRSV isolate FJLY01 from Fujian[J].JournalofNorthwestA&FUniversity:NaturalScienceEdition, 2017, 45(3): 51-60, 67. (in Chinese)
[11] LIU J K, ZHOU X, ZHAI J Q, et al. Genetic diversity and evolutionary characteristics of type 2 porcine reproductive and respiratory syndrome virus in southeastern China from 2009 to 2014[J].ArchVirol, 2017, 162(9): 2603-2615.
[12] LIU J K, ZHOU X, ZHAI J Q, et al. Emergence of a novel highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].TransboundEmergDis, 2017, 64(6): 2059-2074.
[13] LIU J K, ZHOU X, ZHAI J Q, et al. Recombination in JXA1-R vaccine and NADC30-like strain of porcine reproductive and respiratory syndrome viruses[J].VetMicrobiol, 2017, 204: 110-120.
[14] 冷 雪. 高致病性猪繁殖与呼吸综合征病毒分离鉴定、遗传变异及致病性分析[D]. 北京: 中国农业科学院, 2012.
LENG X. Isolation, identification, genetic mutation and pathogenicity analysis of highly pathogenic porcine reproductive and respiratory syndrome virus[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese)
[15] ZHAO H J, HAN Q G, ZHANG L, et al. Emergence of mosaic recombinant strains potentially associated with vaccine JXA1-R and predominant circulating strains of porcine reproductive and respiratory syndrome virus in different provinces of China[J].VirolJ, 2017, 14: 67
[16] GUO B Q, LAGER K M, SCHLINK S N, et al. Chinese and Vietnamese strains of HP-PRRSV cause different pathogenic outcomes in United States high health swine[J].Virology, 2013, 446(1-2): 238-250.
[17] HAN K, SEO H W, OH Y, et al. Comparison of the virulence of European and North American genotypes of porcine reproductive and respiratory syndrome virus in experimentally infected pigs[J].VetJ, 2013, 195(3): 313-318.
[18] ZHOU L, YANG B N, XU L, et al. Efficacy evaluation of three modified-live virus vaccines against a strain of porcine reproductive and respiratory syndrome virus NADC30-like[J].VetMicrobiol, 2017, 207: 108-116.
[19] JOHNSON W, ROOF M, VAUGHN E, et al. Pathogenic and humoral immune responses to porcine reproductive and respiratory syndrome virus (PRRSV) are related to viral load in acute infection[J].VetImmunolImmunopathol, 2004, 102(3): 233-247.
[20] WONGYANIN P, BURANAPRADITKUN S, CHOKESHAI-USAHA K, et al. Induction of inducible CD4+CD25+Foxp3+regulatory T lymphocytes by porcine reproductive and respiratory syndrome virus (PRRSV)[J].VetImmunolImmunopathol, 2010, 133(2-4): 170-182.
[22] CHARERNTANTANAKUL W, KASINRERK W. Interleukin-10 antisense oligodeoxynucleotide suppresses IL-10 expression and effects on proinflammatory cytokine responses to porcine reproductive and respiratory syndrome virus[J].ViralImmunol, 2010, 23(4): 425-435.
[23] SURADHAT S, THANAWONGNUWECH R, POOVORAWAN Y. Upregulation of IL-10 gene expression in porcine peripheral blood mononuclear cells by porcine reproductive and respiratory syndrome virus[J].JGenVirol, 2003, 84(2): 453-459.
[24] GUDMUNDSDOTTIR I, RISATTI G R. Infection of porcine alveolar macrophages with recombinant chimeric porcine reproductive and respiratory syndrome virus: effects on cellular gene transcription and virus growth[J].VirusRes, 2009, 145(1): 145-150.
[25] CYKTOR J C, TURNER J. Interleukin-10 and immunity against prokaryotic and eukaryotic intracellular pathogens[J].InfectImmun, 2011, 79(8): 2964-2973.
