干扰和稳定表达GP5对猪繁殖与呼吸综合征病毒感染早期复制的影响
2018-07-04宋林林贾存瑜韩熙梦周恩民西北农林科技大学动物医学院杨凌712100农业部兽用药物与诊断技术陕西科学观测实验站杨凌712100
宋林林,贾存瑜,韩熙梦,周恩民*,穆 杨*(1.西北农林科技大学动物医学院,杨凌 712100;2.农业部兽用药物与诊断技术陕西科学观测实验站,杨凌 712100)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS)是世界上对养猪业生产影响最严重的疾病之一,该病于1987年在美国首次被发现。30年多来,科研人员就PRRS的病原、起源、演化、机体免疫应答等方面进行了大量研究,并取得了一系列的研究成果[1-4],免疫接种、提高饲养管理水平、抗病育种、捕杀感染猪等措施在防控PRRS方面都发挥了积极的作用[4-6],但目前仍然没有一种可完全有效根除该病的方法。ORF5 编码的GP5蛋白是PRRSV最主要的结构蛋白与免疫保护性抗原,针对GP5 的研究可以为PRRSV致病机制的剖析积累资料。
RNA干扰(RNA interference, RNAi)指在进化过程中由高度保守的双链RNA诱发的同源mRNA高效特异降解现象。小干扰RNA(small interfering RNA, siRNA)是一段长20~25个核苷酸的双链RNA,主要参与RNAi现象,可专一性调节基因的表达。利用RNAi 降低病毒对细胞和易感动物的感染已经用于多种病毒的研究,如口蹄疫病毒[7]、伪狂犬病病毒[8]、PRRSV[9-10]等。构建稳定表达某一病毒蛋白的细胞系是研究病毒蛋白功能的一种常用方法[11]。本研究构建稳定表达PRRSV GP5的Marc-145细胞系,同时设计合成针对PRRSV ORF5 的特异性siRNA转染Marc-145细胞后用病毒感染细胞,研究稳定表达GP5和敲低GP5表达对PRRSV复制的影响及机制,以期为GP5功能及PRRSV致病机制的研究积累资料。
1 材料与方法
1.1 试验材料
1.1.1 细胞、病毒、质粒和载体 Marc-145细胞系购自中国典型培养物保藏中心;PRRSV SD16株(GenBank Access No. JX087437.1)、pMD18-T-GP5质粒由西北农林科技大学重大动物疫病病原感染和致病机制团队保存;E.coliDH5α感受态细胞、pMD18-T载体为TaKaRa公司产品;piggyBacTMTransposon vector system 购自SBI公司。
1.1.2 siRNA Scrambled siRNA、siRNA GP5-404、siRNA GP5-471、siRNA GP5-525(表1)由上海吉玛制药技术有限公司设计合成。
1.1.3 主要试剂 RNAiso plus、PrimeScriptTMRT reagent Kit、PrimeSTAR HS DNA Polymerase、ExTaqVersion 2.0 plus dye购自宝生物工程(大连)有限公司,EasyPure Plasmid MiniPrep Kit、EasyPure Quick Gel Extraction Kit购自Transgen Biotech.,T4 DNA连接酶、BamH Ⅰ、EcoR Ⅰ为New England Biolabs产品,FastStart Universal SYBR Green Master为Roche公司产品,PageRuler预染蛋白marker(10-170 ku)、BCA protein assay kit、LipofectamineTM3000为Thermo Scientific公司产品;嘌呤霉素(puromycin)为Merck公司产品;抗PRRSV N蛋白单抗6D10、抗PRRSV 猪血清、抗GP5鼠血清由西北农林科技大学重大动物疫病病原感染和致病机制团队制备、保存;抗 α-tubulin (Catalog# T6074)抗体购自Sigma-Aldrich;HRP-标记的羊抗鼠IgG(Catalog# 115-035-003)、Texas Red-标记的羊抗猪IgG(Catalog# 114-075-003)为Jackson ImmunoResearch公司产品;Cell counting kit-8(cck-8)和NP40裂解液购自碧云天生物技术公司;猴源干扰素α(IFN-α)、IFN-β、IFN-γ ELISA检测试剂盒购自Cusabio公司。
表1siRNA名称与对应的序列
Table1NamesandsequencesofsiRNA

siRNA名称NameofsiRNA靶标Target链Strand序列(5′→3′)SequencesscrambledsiRNANoSenseUUCUUCGAACGUGUCACGUTTAntisenseACGUGACACGUUCGGAGAATTsiRNAGP5⁃404PRRSVSenseGCUACUCUUGUACCAGAUATTSD16ORF5AntisenseUAUCUGGUACAAGAGUAGCTTsiRNAGP5⁃471PRRSVSenseGCCCGUCAUUGUGGAGAAATTSD16ORF5AntisenseUUUCUCCACAAUGACGGGCTTsiRNAGP5⁃525PRRSVSenseCCUCAAGAGAGUUGUGCUUTTSD16ORF5AntisenseAAGCACAACUCUCUUGAGGTT
1.2 试验方法
1.2.1 稳定表达PRRSV GP5细胞的构建与鉴定 以 pMD18-T-GP5为模板,用引物GP5-F和GP5-R(表2)进行扩增,回收目的条带后利用EcoR Ⅰ和BamHⅠ酶切位点将目的片段定向插入PiggyBacTMVector System的 PB Transposon vector,鉴定正确的重组载体命名为pPB-GP5。将状态良好的Marc-145细胞按2×105个细胞·孔-1接种于6孔细胞板,培养至80%左右融合度时按文献方法用donor质粒(pPB-GP5或空载体质粒PB Transposon vector)和helper质粒(PiggyBac Transposase vector)进行质粒转染、筛选、亚克隆、保存及鉴定[12-13],将鉴定正确的表达GP5和标签蛋白GFP的细胞命名为Marc-145-GP5,将仅表达标签蛋白GFP的细胞命名为Marc-145-GFP。
1.2.2 细胞增殖测定 调整细胞浓度,以每孔2×103个细胞接种96孔板培养,按cck-8试剂盒说明分别于培养的1、2、3、4、5、6和 7 d 测定细胞增殖情况,每个时间点设置6个重复孔,同时设Marc-145和Marc-145-GFP对照,并按照公式
PDT=[log 2/(logNt-logN0)]×t,
(Nt=培养th时的细胞数,N0=初期接种的细胞数)计算细胞群体倍增时间(population doubling time, PDT)[13-15]。
1.2.3 PRRSV GP5表达对病毒复制的影响 将Marc-145、Marc-145-GP5和Marc-145-GFP按每孔1×105接种于6孔细胞板,培养至80%融合度时按0.1 MOI接种PRRSV SD16株,接毒后12、24、36、48 h分别收集细胞和培养液上清,每个时间点设3个重复。收集的细胞一部分提取总RNA,采用RT-qPCR检测N基因mRNA表达水平;另一部分按NP40裂解液说明裂解细胞准备样品进行12%分离胶 SDS-PAGE,以6D10 (3 ng·μL-1) 为一抗,HRP-标记的羊抗鼠 IgG(80 ng·μL-1)为二抗进行Western blot检测,确定病毒复制情况。收集的上清一部分用不含血清的DMEM作10倍倍比稀释,按Reed-Muench法用Marc-145细胞测定病毒滴度(TCID50·mL-1),另一部分用于干扰素表达水平检测。
1.2.4 IFN表达水平检测 分别取此前收集的培养24和48 h的上清,用猴源IFN-α、IFN-β和IFN-γ ELISA 试剂盒检测各样品中各IFN蛋白的表达情况。
1.2.5 siRNA转染及其对病毒复制影响的检测 将状态良好的Marc-145细胞按5×104·孔-1铺于24孔细胞板,培养至70%左右融合度时参照试剂说明用LipofectamineTM3000将特异性siRNA和Scrambled siRNA分别转染细胞,同时设立空白对照。分别在转染后6和12 h按 0.1 MOI 接种PRRSV SD16,感染后24 h 收集细胞,一部分提取基因组RNA,采用RT-qPCR 检测GP5 mRNA的表达水平[16],另一部分按NP40裂解液说明裂解细胞准备样品进行12%分离胶SDS-PAGE,以抗N蛋白单抗6D10(3 ng·μL-1)为一抗,HRP-标记的羊抗鼠 IgG(80 ng·μL-1)为二抗进行Western blot检测[12],确定病毒的复制情况。
表2引物及其序列
Table2Primersandtheirsequences
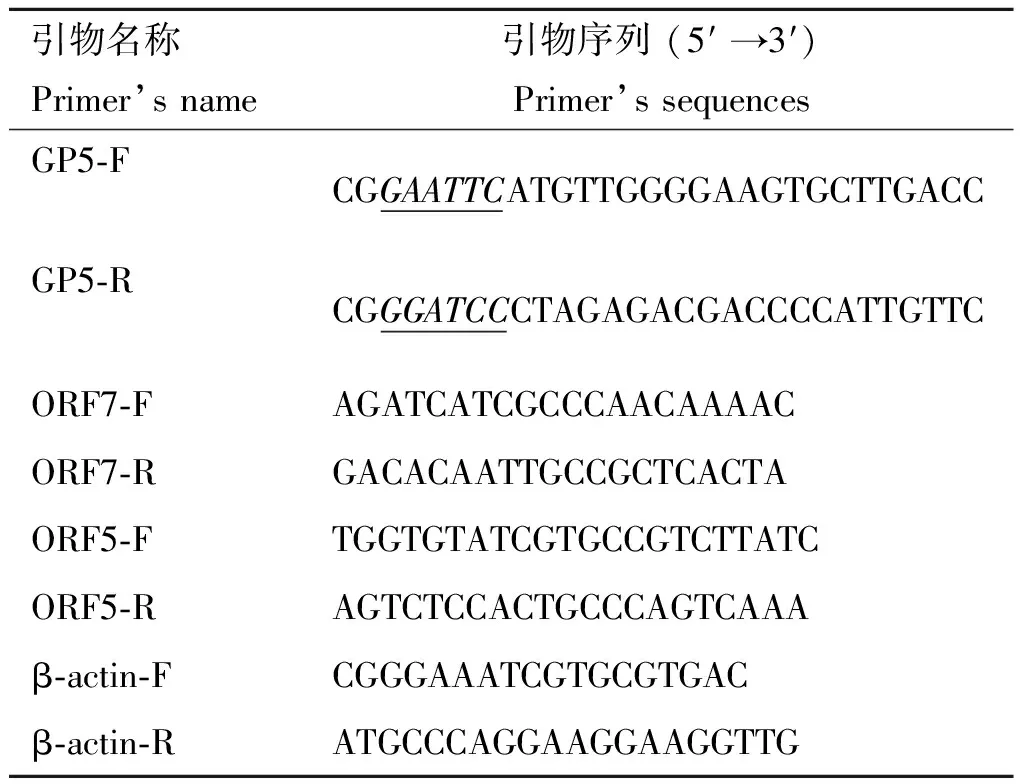
引物名称Primer’sname引物序列(5′→3′)Primer’ssequencesGP5⁃FCGGAATTCATGTTGGGGAAGTGCTTGACCGP5⁃RCGGGATCCCTAGAGACGACCCCATTGTTCORF7⁃FAGATCATCGCCCAACAAAACORF7⁃RGACACAATTGCCGCTCACTAORF5⁃FTGGTGTATCGTGCCGTCTTATCORF5⁃RAGTCTCCACTGCCCAGTCAAAβ⁃actin⁃FCGGGAAATCGTGCGTGACβ⁃actin⁃RATGCCCAGGAAGGAAGGTTG
下划线标记分别是EcoRⅠ和BamHⅠ酶切位点
Underlined letters are restriction enzyme digestion sites ofEcoRⅠ andBamHⅠ, respectively

2 结 果
2.1 稳定表达PRRSV GP5 细胞的筛选与鉴定
转染后经嘌呤霉素筛选和3次亚克隆获得了全部表达绿色荧光的细胞克隆,为了确定外源基因在细胞中的表达,提取Marc-145-GP5、Marc-145-GFP 和 Marc-145细胞总RNA 利用引物GP5-F和GP5-R采用RT-PCR进行检测,从 Marc-145-GP5细胞样品中可以扩增到GP5基因,而从Marc-145-GFP和 Marc-145样品中没有扩增条带(图1A),Western blot检测结果也显示,在 Marc-145-GP5细胞中可检测到 GP5蛋白的表达, 但Marc-145-GFP 和 Marc-145细胞中没有,而内参蛋白α-tubulin在3种细胞中的表达基本一致(图1B);IFA结合激光共聚焦显微镜观察可以看到,从Marc-145-GFP细胞样品可以观察到绿色的GFP荧光,而Marc-145-GP5细胞中既有绿色的GFP荧光也有红色的GP5荧光,而且GP5主要表达在细胞质中, Marc-145细胞中两种荧光都没有(图1C);说明ORF5已插入到 Marc-145 细胞基因组中。
2.2 GP5表达不影响Marc-145细胞增殖
为确定表达GP5是否会对Marc-145细胞增殖产生影响,利用显微镜观察细胞形态显示,Marc-145-GP5 和Marc-145-GFP 与Marc-145细胞一样培养约2 d可形成单层,且形态与Marc-145细胞基本一致(图2A);利用cck-8试剂盒检测细胞增殖活性,结果显示从细胞接种到细胞进入生长的平台期,其增殖曲线与Marc-145的基本一致(图2B),计算培养48、72、96和120 h的PDT,结果显示3种细胞的没有明显差异(图2C)。Marc-145-GP5 和 Marc-145-GFP 培养50代以上仍然增殖活跃,说明GP5表达不影响Marc-145的增殖。
2.3 GP5稳定表达促进PRRSV在Macr-145细胞中的复制
为确定GP5的稳定表达对PRRSV复制的影响,将Marc-145-GP5、Marc-145-GFP和Marc-145 接种24孔板,培养至细胞达80% 左右融合度时接种0.1 MOI PRRSV SD16,每天观察出现的细胞病变(cytopathic effect,CPE),发现接毒后36 h Marc-145-GP5细胞上出现了典型的CPE,且比Marc-145细胞和Marc-145-GFP 细胞上的明显(图3)。采用RT-qPCR检测接毒后不同时间细胞中的PRRSVN基因拷贝数发现,接毒后12、24和36 h Marc-145-GP5中N基因拷贝数显著或极显著高于Marc-145细胞和Marc-145-GFP细胞中的,到48 h时,N基因拷贝数显著下降(图4A),N基因拷贝数的峰值出现在病毒感染后36 h,但上清液中病毒滴度到感染后48 h一直处于比较高的水平(图4B),感染后48 h N蛋白的免疫印迹检测进一步说明GP5的稳定表达在PRRSV感染早期可以促进病毒的复制(图4C)。
2.4 IFN表达检测
为了探究GP5稳定表达促进PRRSV SD16复制的可能原因,收集培养24和48 h或病毒感染24 和48 h的培养上清,用ELISA试剂盒检测样品中IFN-α、IFN-β和 IFN-γ的蛋白含量。结果显示,与Marc-145细胞和Marc-145-GFP细胞相比,Marc-145-GP5 细胞表达的IFN-α、IFN-β和IFN-γ的量均明显降低(图5),0.1 MOI PRRSV 感染后24 h,Marc-145-GP5细胞上清中IFN-β的量为273.92±43.48 pg·mL-1,而Marc-145-GFP细胞和Marc-145细胞的分别为(873.37±67.14)pg·mL-1和(1 119.07±56.90)pg·mL-1(图5B)。因此IFN表达下调可能是GP5稳定表达促进PRRSV复制的原因之一,是否还有其他因素参与,有待进一步研究。

A. RT-PCR 鉴定;B. Western blot 鉴定;C. 激光共聚焦显微镜分析GP5的表达与定位A. Identification with RT-PCR;B. Western blot analysis of GP5 expression in Marc-145-GP5, Marc-145-GFP, and parental Marc-145 cells after culture 48 h using anti-GP5 or α-tubulin primary antibodies (control);C. Cellular localization of GP5 in Marc-145-GP5 cells following immunohistochemical detection
图1 稳定表达GP5细胞的鉴定Fig.1 Validation of GP5 in Marc-145 cells

A. 显微镜观察(200×);B. 细胞增殖曲线,n=6;C. 根据公式:PDT=[log 2/(log Nt -logN0)]×t (Nt=培养t h时的细胞数,N0=接种的细胞数)计算的对数生长期3种细胞的PDTA. Cell morphology observed under 200×magnification;B. Cell growth curves were plotted using average cell numbers across 7 days of culture time,n=6;C. The PDT of Marc-145-GP5, Marc-145-GFP, and Marc-145 cells were determined at 48, 72, 96, 120 h after seeding according the formula: PDT =[log 2/(log Nt -logN0)]×t(Nt=number of cells after t hours of culturing, N0=number of cells seeded) 图2 GP5表达不影响Marc-145细胞的增殖Fig.2 Expression of PRRSV GP5 does not influence Marc-145 cell growth characteristics

图3 PRRSV接种后36 h 细胞上出现的CPE(200×)Fig.3 CPE were observed at 36 h after PRRSV SD16 infection (Magnification 200×)

A. RT-qPCR检测接毒后不同时间的N基因拷贝数;B. 病毒滴度检测结果;C. Western blot检测接毒后48 h N蛋白的表达(左)以及灰度分析结果(右),*. P<0.05;**. P<0.01;***. P<0.001A. N gene copies of PRRSV SD16 were quantified by RT-qPCR;B. Viral titers in supernatant were titrated on Marc-145 cells with 10-fold serial dilutions;C. N protein expression at 48 h post infection was detected by Western blot (left) and N protein expression levels were quantitatively analyzed and were compared with α-tubulin expression by use of Image J (right). *. P<0.05;**. P<0.01;***. P<0.001
图4 GP5 稳定表达促进PRRSV感染早期病毒的复制Fig.4 PRRSV replication was promoted in Marc-145-GP5 cells
2.5 针对 PRRSV ORF5编码区的特异性siRNA能抑制病毒在Marc-145细胞上的增殖
为了进一步确定GP5对病毒复制的影响,针对ORF5的编码区设计合成siRNA,转染Marc-145细胞后再接种病毒,检测发现,转染siRNA后6和12 h接种PRRSV, 3对特异性 siRNAs (siRNA GP5-404、siRNA GP5-471 和siRNA GP5-525)均能显著抑制GP5 mRNA的表达,而且转染siRNA后12 h接种病毒的抑制效果更明显(图6A和图6B);其中100 nmol·L-1的 siRNA GP5-471的抑制效果最好,与scrambled siRNA 处理的对照组相比,GP5 mRNA 表达水平降低超过70% (1.026±0.050vs0.291±0.044,P=9.809×10-5)(图6C);对N蛋白的免疫印迹检测和相对表达分析显示干扰GP5的表达显著抑制病毒的复制(图6D和图6E)。
3 讨 论
本研究构建并筛选到稳定表达PRRSV GP5的Marc-145细胞系,RT-PCR、Western blot 和免疫组化结合激光共聚焦显微镜观察均证实GP5在细胞中获得稳定表达(图1)。虽然在采用Western blot检测GP5表达时出现两条印迹条带,但这与报道的GP5存在不同糖基化形式一致[17]。形态观察和采用cck-8试剂盒检测发现GP5稳定表达不影响Marc-145-GP5细胞的增殖(图2)。Wang等[18]指出,稳定表达某一病毒蛋白可能会改变细胞中病毒的产量甚至改变病毒的嗜性。本研究在获得稳定表达GP5细胞系的基础上,用PRRSV SD16 株感染 Marc-145-GP5 细胞,感染后不同时间观察细胞上出现的CPE并检测细胞中N基因拷贝数和上清液中的病毒滴度,发现在感染的早期(48 h内)Marc-145-GP5细胞组的CPE比对照细胞组的明显(图3),其N基因拷贝数和病毒滴度在感染后36 h也持续显著高于对照细胞组,虽然到病毒感染后48 h,Marc-145-GP5细胞组的N基因拷贝数比对照细胞组的低,但病毒滴度仍然高于对照组的(图4),到感染后60和72 h,Marc-145-GP5细胞组的N基因拷贝数和病毒滴度就与对照组没有差异了(数据未显示)。对感染后 48 h N蛋白表达水平的免疫印迹检测进一步说明稳定表达GP5在PRRSV感染的早期可以促进病毒的复制,这一结果与在Marc-145细胞中稳定表达Nsp2可以促进病毒复制的结果一致[18]。但在笔者团队前期构建的另一个稳定表达GP5的细胞系Marc-145-GP5Flag中,GP5表达通过诱导IFN-β的生成抑制病毒的复制[19]。为了探究出现这种现象的原因,本研究采用ELISA试剂盒检测正常培养 24和48 h 以及病毒感染 24和48 h上清中的IFN-α、IFN-β和 IFN-γ水平发现,与Marc-145-GFP 和 Marc-145 细胞组相比,无论病毒感染与否,Marc-145-GP5细胞组的IFN-α、IFN-β和IFN-γ表达水平在 24和 48 h 都是下调的(图5)。那么,都是稳定表达 GP5的细胞系,为什么会出现相反的结果呢?仔细分析发现,研究团队前期构建Marc-145-GP5Flag细胞系采用的是慢病毒载体系统,在GP5的羧基端融合了Flag标签,而本研究构建细胞系采用的是piggyBacTMTransposon载体系统,此载体系统的优点是筛选细胞系时借助的GFP标签在目的蛋白被表达后与目的蛋白是分离的,因此标签蛋白不会对目的蛋白功能的发挥产生影响。而且笔者推测,在Marc-145-GP5细胞中,稳定表达的GP5可能参与了感染早期病毒粒子的组装,因此导致病毒粒子的生成加快,至于这种推测是否成立以及为什么不同的载体系统构建的细胞系会获得不同的结果,具体原因还有待进一步研究。
研究表明,PRRSV感染在体内外均可诱导细胞凋亡[20-21],发挥功能的主要是GP5氨基端的119个氨基酸残基形成的功能域[22]。然而,Lee等[23]指出前者报道的GP5诱导的细胞凋亡可能是非典型的,是由融合在GP5氨基端的His标签或抗原标签引起的,这些额外的标签扰乱了GP5氨基端信号肽的功能,导致被修饰的GP5出现胞内功能紊乱(intracellular trafficking of the modified protein),而且研究者使用的牛痘病毒可能也是造成这种非典型细胞凋亡的原因之一。本研究使用 piggyBacTMTransposon 载体系统构建稳定表达 GP5的细胞系,piggyBacTMTransposon 载体系统是一种非病毒DNA传递系统,包含PB Transposon vector 和 PiggyBac Transposase vector,Transposase指导 PB Transposon结合到基因组的TTAA 位点,且在转染细胞中GFP标签蛋白和目的蛋白是分离的[24-26]。这种情况下,标签蛋白的可能影响就被去除了,而且笔者已经证实 PRRSV SD16 的 GP5不能引起细胞凋亡[13],引起细胞凋亡的是PRRSV的Nsp4和Nsp10[27]。

*. P<0.05;**. P<0.01;***. P<0.001
图5 ELISA 方法检测IFN-α、IFN-β、IFN-γ蛋白表达水平Fig.5 Interferon protein expression levels were detected with ELISA method

A、B. RT-qPCR 检测siRNA转染后6 h(A)和12 h(B)接种PRRSV对GP5 mRNA表达的影响;β-actin为内参基因,PRRSV对照组的GP5 mRNA表达被设定为1;C. RT-qPCR检测不同浓度siRNA GP5-471的抑制效果;D、E. Western blot检测siRNA对N蛋白表达的影响(左)及其灰度分析(右);n=3;*. P<0.05;**. P<0.01;***. P<0.001A, B. RT-qPCR results show the inhibition on GP5 mRNA expression when inoculating PRRSV at 6 h (A) and 12 h (B) after siRNA treatment. β-actin served as an internal control. Gene expression in the PRRSV control was set to 1;C. RT-qPCR results show the inhibition efficiency of 50, 100, and 200 nmol·L-1 siRNA GP5-471;D, E. Western blot data shows that siRNA targeting GP5 coding region of PRRSV SD16 inhibits N protein expression. α-tubulin was used as an internal control (Left). N protein expression levels were quantitatively analyzed and were compared with α-tubulin expression by use of Image J (Right). n=3. *. P<0.05;**. P<0.01;***. P<0.001
图6 针对GP5编码区的siRNA抑制 PRRSV在MARC-145细胞中的复制Fig.6 siRNAs targeting GP5 coding regions inhibit PRRSV SD16 replication in Marc-145 cells
研究指出,将表达IFN-α的重组腺病毒Ad5-IFN-α与 Ingelvac PRRS®ATP 同时给猪注射,可以摧毁(abolished)疫苗毒在猪体内的复制[28],在CRL-2843-CD163细胞中过表达猪 2′,5′-寡腺苷酸合成酶(OASs)可以通过促进 IFN-α和IFN-β 等细胞因子的表达抑制PRRSV复制[29]。本研究中,与Marc-145 细胞组相比,Marc-145-GP5细胞组的IFN-α、IFN-β和IFN-γ 蛋白表达水平均下调,提示在稳定表达 GP5的Marc-145-GP5 细胞中,干扰素表达下调可能是PRRSV复制被抑制的原因之一,其具体的详细机制还需要进一步研究。
GP5是PRRSV的主要结构蛋白,在感染性病毒粒子的组装、病毒侵染宿主细胞等方面发挥着重要作用。在确定了过表达GP5 可以在病毒感染早期促进病毒复制后,本研究进一步设计合成针对ORF5编码区的特异性siRNA,采用RNA干扰技术在siRNA转染Marc-145细胞后6和12 h 分别接种PRRSV SD16株,结果发现特异性siRNA能从转录水平显著干扰GP5 mRNA的表达(图6A、B、C)和N蛋白表达(图6D、E),说明抑制GP5表达在病毒感染早期可以显著抑制病毒复制,进一步表明GP5 能调控病毒复制。
本研究无论是过表达GP5还是干扰ORF5的转录,均是在体外水平进行,要确定PRRSV感染猪体后,GP5在猪体内是否也可以发挥相同的效应,还需要采用猪体试验进行进一步的研究。
4 结 论
在Marc-145细胞中稳定表达GP5可以通过下调IFN的表达在PRRSV感染早期促进病毒复制,利用特异性siRNA干扰GP5表达可以抑制PRRSV复制,GP5对PRRSV复制具有调控作用。
参考文献(References):
[1] RAHE M C,MURTAUGH M P.Mechanisms of adaptive immunity to porcine reproductive and respiratory syndrome virus[J].Viruses,2017,9(6):148.
[2] GUO Z H,CHEN X X,LI R,et al.The prevalent status and genetic diversity of porcine reproductive and respiratory syndrome virus in China:a molecular epidemiological perspective[J].VirolJ,2018,15(1):2.
[3] LUNNEY J K,FANG Y,LADINIG A,et al.Porcine reproductive and respiratory syndrome virus (PRRSV):pathogenesis and interaction with the immune system[J].AnnuRevAnimBiosci,2016,4:129-154.
[4] HAN J,ZHOU L,GE X N,et al.Pathogenesis and control of the Chinese highly pathogenic porcine reproductive and respiratory syndrome virus[J].VetMicrobiol,2017,209:30-47.
[5] DU T F,NAN Y C,XIAO S Q,et al.Antiviral strategies against PRRSV infection[J].TrendsMicrobiol,2017,25(12):968-979.
[6] NAN Y C,WU C Y,GU G Q,et al.Improved vaccine against PRRSV:current progress and future perspective[J].FrontMicrobiol,2017,8:1635.
[7] DE LOS SANTOS T,WU Q H,DE AVILA BOTTON S,et al.Short hairpin RNA targeted to the highly conserved 2B nonstructural protein coding region inhibits replication of multiple serotypes of foot-and-mouth disease virus[J].Virology,2005,335(2):222-231.
[8] DURYMANOVA ONO E A,IAMAMOTO K,CASTILHO J G,et al.Invitroandinvivoinhibition of rabies virus replication by RNA interference[J].BrazJMicrobiol,2013,44(3):879-882.
[9] LI L,LI Q Y,BAO Y H,et al.RNAi-based inhibition of porcine reproductive and respiratory syndrome virus replication in transgenic pigs[J].JBiotechnol,2014,171:17-24.
[10] CHEN Y H,WANG Y,ZENG K,et al.Knockdown expression of IL-10Rα gene inhibits PRRSV replication and elevates immune responses in PBMCs of Tibetan piginvitro[J].VetResCommun,2018,42(1):11-18,doi:10.1007/s11259-017-9703-z.
[11] CHUNG N P,MATTHEWS K,KIM H J,et al.Stable 293 T and CHO cell lines expressing cleaved,stable HIV-1 envelope glycoprotein trimers for structural and vaccine studies[J].Retrovirology,2014,11:33.
[12] 王晓红,宋林林,李亮亮,等.GP5Δ84-119稳定表达对猪繁殖与呼吸综合征病毒复制的影响[J].畜牧兽医学报,2016,47(2):315-324.
WANG X H,SONG L L,LI L L,et al.The effect of GP5Δ84-119stable expression on the replication of porcine reproductive and respiratory syndrome virus[J].ActaVeterinariaetZootechnicaSinica,2016,47(2):315-324.(in Chinese)
[13] MU Y,LI L L,ZHANG B B,et al.Glycoprotein 5 of porcine reproductive and respiratory syndrome virus strain SD16 inhibits viral replication and causes G2/M cell cycle arrest,but does not induce cellular apoptosis in Marc-145 cells[J].Virology,2015,484:136-145.
[14] HONG H X,ZHANG Y M,XU H,et al.Immortalization of swine umbilical vein endothelial cells with human telomerase reverse transcriptase[J].MolCells,2007,24(3):358-363.
[15] FENG L L,ZHANG X Y,XIA X L,et al.Generation and characterization of a porcine endometrial endothelial cell line susceptible to porcine reproductive and respiratory syndrome virus[J].VirusRes,2013,171(1):209-215.
[16] 穆 杨,李亮亮,刘园园,等.PRRSV感染对猪肺泡巨噬细胞Bax和Bcl-2 mRNA表达的影响[J].中国兽医学报,2013,33(9):1313-1318,1351.
MU Y,LI L L,LIU Y Y,et al.Bax and Bcl-2 gene expression in porcine alveolar macrophages infected by porcine reproductive and respiratory syndrome virus[J].ChineseJournalofVeterinaryScience,2013,33(9):1313-1318,1351.(in Chinese)
[17] GAGNON C A,LACHAPELLE G,LANGELIER Y,et al.Adenoviral-expressed GP5of porcine respiratory and reproductive syndrome virus differs in its cellular maturation from the authentic viral protein but maintains known biological functions[J].ArchVirol,2003,148(5):951-972.
[18] WANG F X,WEN Y J,YANG B C,et al.Role of non-structural protein 2 in the regulation of the replication of the porcine reproductive and respiratory syndrome virus in MARC-145 cells:effect of gene silencing and over expression[J].VetMicrobiol,2012,161(1-2):58-65.
[19] GAO J M,JI P C,ZHANG M D,et al.GP5 expression in Marc-145 cells inhibits porcine reproductive and respiratory syndrome virus infection by inducing beta interferon activity[J].VetMicrobiol,2014,174(3-4):409-418.
[20] SUR J H,DOSTER A R,OSORIO F A.Apoptosis induced in vivo during acute infection by porcine reproductive and respiratory syndrome virus[J].VetPathol,1998,35(6):506-514.
[21] SIRINARUMITR T,ZHANG Y,KLUGE J P,et al.A pneumo-virulent United States isolate of porcine reproductive and respiratory syndrome virus induces apoptosis in bystander cells bothinvitroandinvivo[J].JGenVirol,1998,79(Pt 12):2989-2995.
[23] LEE C,ROGAN D,ERICKSON L,et al.Characterization of the porcine reproductive and respiratory syndrome virus glycoprotein 5 (GP5) in stably expressing cells[J].VirusRes,2004,104(1):33-38.
[24] WANG X P,WEI R F,LI Q Y,et al.PK-15 cells transfected with porcine CD163 by PiggyBac transposon system are susceptible to porcine reproductive and respiratory syndrome virus[J].JVirolMethods,2013,193(2):383-390.
[25] YIN J,BI X B.Generation and characterization of virus-free reprogrammed melanoma cells by thepiggyBactransposon[J].JCancerResClinOncol,2013,139(9):1591-1599.
[26] LI R B,ZHUANG Y,HAN M,et al.piggyBacas a high-capacity transgenesis and gene-therapy vector in human cells and mice[J].DisModelMech,2013,6(3):828-833.
[27] YUAN S Z,ZHANG N,XU L,et al.Induction of apoptosis by the nonstructural protein 4 and 10 of porcine reproductive and respiratory syndrome virus[J].PLoSOne,2016,11(6):e0156518.
[28] BROCKMEIER S L,LOVING C L,EBERLE K C,et al.Interferon alpha inhibits replication of a live-attenuated porcine reproductive and respiratory syndrome virus vaccine preventing development of an adaptive immune response in swine[J].VetMicrobiol, 2017, 212:48-51.
[29] ZHAO M, WAN B, LI H, et al. Porcine 2′, 5′-oligoadenylate synthetase 2 inhibits porcine reproductive and respiratory syndrome virus replication in vitro[J].MicrobPathog, 2017, 111: 14-21.
