牛胎儿骨骼肌来源成肌细胞分化相关microRNA的筛查与鉴定
2018-07-04邢义珅王亚慧徐凌洋李俊雅张路培中国农业科学院北京畜牧兽医研究所北京100193
邢义珅,胡 鑫,任 玲,王亚慧,徐凌洋,李俊雅,张路培(中国农业科学院 北京畜牧兽医研究所,北京 100193)
肉用动物的肌肉产量主要由肌纤维数量和截面直径直接决定[1]。胎儿期是动物骨骼肌发育的关键时期,出生后个体骨骼肌的发育主要表现为肌纤维的增大,而肌纤维的数量基本上不再增加[2]。因此,研究胎儿期的骨骼肌发育,对于肉用家畜来说具有非常重要的意义。在哺乳动物的骨骼肌发育过程中,多种细胞信号分子和转录因子参与了肌细胞的增殖和分化[3]。除此之外,microRNA(miRNA)作为一类重要的非编码RNA,通过其序列、结构、丰度和转录方式的多样性,在骨骼肌发育等许多生物过程中调控基因表达[4]。
miRNA是一类在真核生物中广泛表达的内源性小分子单链RNA,成熟后长度在22个核苷酸左右[5]。miRNA通过与靶向mRNA的3′UTR区域进行特异性的碱基互补配对,引起靶向mRNA的降解或转录活性稳定下降,抑制其翻译,从而在转录后层面抑制基因的表达[6-7]。研究发现,miRNA能够参与机体的多种生命活动,包括细胞增殖分化和凋亡、新陈代谢、疾病发生、干细胞自我更新以及肿瘤发生等[8-12]。随着研究的深入,人们对miRNA调控骨骼肌发育的理解也越来越透彻,现在已经发现众多的miRNA广泛地作用于控制细胞成肌分化的相关基因,对成肌分化产生重要影响[13]。miR-1抑制HDAC4的表达,促进非洲爪蛙肌细胞分化[4];miR-27b可以抑制Pax3的表达,从而抑制小鼠胎儿细胞进入骨骼肌发育的过程[14];miR-206能够作用于多个与肌肉分化相关的基因来影响动物肌肉的发育[15-16];miR-125b能够作用于IGF-II,抑制成肌细胞的分化[17]等。
关于牛肌肉发育的miRNA已经有一些报道[18],但大都停留在成体水平,关于胎儿骨骼肌分化相关miRNA动态变化的研究鲜有文献报道。本研究采用高通量测序技术,对牛胎儿来源的骨骼肌细胞分化始末差异表达miRNA进行筛查与鉴定,挖掘与牛胎儿期肌肉发育相关的miRNA,同时,采用荧光定量PCR技术验证测序结果的可靠性,为后续研究牛胎儿骨骼肌发育提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1 成肌细胞 试验细胞来源于3头4月龄的牛胎儿背最长肌组织。试验动物相关操作符合实验动物管理条例(国家科学技术委员会,2017第3次修订),母牛屠宰后取出子宫,迅速带回中国农业科学院北京畜牧兽医研究所分子生物学实验室,用于分离培养成肌细胞。
1.1.2 主要试剂和仪器 Ⅳ型胶原酶购自Sigma公司;低糖DMEM、胎牛血清、马血清、青链霉素双抗和胰酶购自Gibco公司;TRIzol Reagent购自Invitrogen 公司; miRcute miRNA First-Strand cDNA Synthesis Kit和miRcute Plus miRNA qPCR Detection Kit购自天根生化科技(北京)有限公司。荧光定量PCR仪为ABI Q7。
1.2 试验方法
1.2.1 细胞分离和培养 用75%的乙醇对子宫进行消毒处理,用手术剪剪开子宫取出牛胎儿。用手术刀剥开胎儿背部皮肤,取背最长肌组织置于PBS中。
取约200 mg肌肉组织置于1.8 mL离心管中,用眼科剪将其剪成1 mm3大小的肉糜,加入1 mg·mL-1的IV型胶原酶(溶于低糖DMEM培养基)1 mL,放入37 ℃恒温空气浴摇床中进行消化,每隔15 min取出离心管,用移液器进行吹打。消化45 min后取出离心管,先用孔径为100 μm的尼龙网筛过滤,再用孔径为40 μm的尼龙网筛过滤,得到含有单细胞的悬液,1 000 r·min-1离心5 min,弃去上清液后得到细胞沉淀,加生长培养基(10%胎牛血清+89% L-DMEM+1%青链霉素双抗)后接种于培养皿中。
原代成肌细胞融合度达到约70%时,用0.25%的胰酶消化传代,将细胞接种到细胞培养板中,每2 d更换1次培养基,在细胞融合度达到100%时,收取0 d的样品,同时将其它细胞更换为分化培养基(5%马血清+94% L-DMEM+1%青链霉素双抗),每2 d更换1次培养基,培养成肌细胞至分化终末,收取样品于-80 ℃冰箱内保存。
1.2.2 总RNA的提取、质量检测及测序文库的建立 依照TRIzol试剂说明书的操作步骤来提取总RNA,用分光光度计测定总RNA的浓度和纯度。取总RNA进行电泳,检验所提取总RNA的完整性。利用Aglient 2100对样品浓度精确定量。RNA样品总量、浓度、RIN值、OD260 mm/OD280 mm都符合标准后,按照Small RNA Sample pre Kit说明书步骤构建测序文库。
1.2.3 测序数据的生物信息学分析
1.2.3.1 文库上机测序和数据的预处理: 用illumina MiSeq高通量测序平台对构建好的文库进行测序,然后对测序数据进行质量评估。原始数据文件经过碱基识别分析转化为原始测序序列,分别去除低质量(质量值Q≤5的碱基数占整个read的50%以上的reads)、有5′接头污染、没有3′接头序列、没有插入片段、长度小于18 nt的reads,去除poly A的reads,最终得到clean reads。
1.2.3.2 序列分析和统计: 统计得到clean reads在长度上的分布,将clean reads与Rfam(v10.0)数据库进行比对,统计rRNA、scRNA、snRNA、snoRNA及tRNA的比例,去除5类ncRNA(non-coding RNAs)后,再与牛基因组(Bos_Taurus_Ensembl_release-80/Bos_taurus.UMD3.1)进行比对,统计比对到基因组sRNA(small RNAs)的数量。用mirDeep2(v2.0.0.5)软件检测已知miRNA。用去除了5类ncRNA的sRNAs与miRbase(v19.0)数据库进行比对,检测已知miRNA,并统计表达量。
1.2.3.3 差异表达miRNA的分析及其靶基因预测: 根据得到的成熟miRNA在各个文库中的表达量,用edgeR(v3.20.1)软件进行miRNA的差异表达分析,得到成肌细胞分化始末差异表达的miRNA。依据miRNA与其靶位点的互补性、miRNA靶位点的保守性、miRNA-mRNA双链之间的热稳定性及附近序列的二级结构等原则,综合利用miRanda(v3.3a)和RNAhybrid来预测靶基因,统计差异表达miRNA的靶基因。用topGO(v2.30.0)软件对差异表达miRNA对应的靶基因进行富集分析。
1.2.4 反转录和qPCR验证 为了验证测序结果的准确性,随机选取8个表达量较高的差异表达miRNA,分别检测其在成肌细胞分化始末的表达量。以U6作为内参,分别根据miRNA的序列设计荧光定量PCR的上游引物,下游引物由试剂盒提供(未列出),引物信息见表1。引物由上海生工生物科技有限公司合成。
按照miRcute miRNA cDNA第一链合成试剂盒(KR201)说明书进行逆转录,合成miRNA对应的cDNA第一链。荧光定量PCR按照miRcute增强型miRNA荧光定量检测试剂盒(FP411)说明书进行。反应体系为20 μL:2×miRcute增强型miRNA定量预混试剂(含SYBR和ROX)10 μL,反向引物(10 μmol·L-1)0.4 μL,正向引物 (10 μL)0.4 μL,cDNA 2 μL,无核酶ddH2O补至20 μL。PCR反应条件:95 ℃预变性15 min;94 ℃变性20 s,60 ℃退火延伸34 s,共40个循环。
表1RT-PCR正向引物序列
Table1RT-PCRforwardprimersequences

引物名称Primername引物序列(5′→3′)Primersequencebta⁃miR⁃148a⁃FCGCCTCAGTGCACTACAGAACTTTGbta⁃miR⁃1⁃FCGCCGTGGAATGTAAAGAAGTATGTATbta⁃miR⁃34a⁃FCGTGGCAGTGTCTTAGCTGGTTGTbta⁃miR⁃7⁃FCGCTGGAAGACTAGTGATTTTGTTGTTbta⁃miR⁃27a⁃5p⁃FAGGGCTTAGCTGCTTGTGAGCAbta⁃miR⁃26a⁃FCGGTTCAAGTAATCCAGGATAGGCTbta⁃miR⁃199a⁃5p⁃FCGCCCAGTGTTCAGACTACCTGTTbta⁃miR⁃143⁃FGGTTGAGATGAAGCACTGTAGCTCGbta⁃U6⁃FCGCTTCACGAATTTGCGTGTCATbta⁃U6⁃RGCTTCGGCAGCACATATACTAAAAT
1.2.5 数据统计 用SPSS 19.0软件的t检验对数据进行显著性分析,试验数据用“平均值±标准误”表示,P<0.01表示差异极显著,P<0.05表示差异显著。
2 结 果
2.1 牛胎儿骨骼成肌细胞培养及总RNA提取
用胶原酶消化法从4月龄的牛胎儿骨骼肌中分离成肌细胞,可以看到单个细胞呈纤维状,形态比较一致,将细胞接种于培养皿中,约2 d后细胞融合度达到70%,传代至六孔细胞培养板中,每孔接种细胞约为1×105个,待细胞长满后(图1A)更换诱导培养基进行诱导分化,5 d后(图1B)可以看到,大量细胞融合形成长条状的肌管,肌管受到冷刺激时,可以进行有节律的舒缩运动,表明肌管成熟,成肌细胞分化至终末阶段。
提取总RNA,分光光度计检测显示,总RNA OD260 mm/OD280 mm>1.8,OD260 mm/OD230 mm>2.0,电泳结果显示总RNA完整性良好(图略),无明显降解。

图1 牛胎儿骨骼肌来源的成肌细胞分化0(A)和5 d(B)的明场照片(标尺:100 μm)Fig.1 Bright field pictures of myoblasts isolated from bovine fetal skeletal muscle differentiated on 0(A) and 5 d(B)(bar: 100 μm)
2.2 测序结果及数据处理
2.2.1 高通量测序数据 将得到的数据进行过滤,去除污染和低质量序列后,得到序列的基本信息见表2。统计6个sRNA文库中的所有序列长度分布,大部分序列集中分布在21~24 nt,形成主峰。其中,长度为22 nt的序列频率最高,其次为23 nt的序列(图2)。
Clean reads与Rfam数据库进行比对,将比对到数据库中的sRNA进行注释,结果见图3。miRNA所占的比例分别为37.39%和42.41%。
表2各文库测序基本情况
Table2Generalinformationaboutlibraries
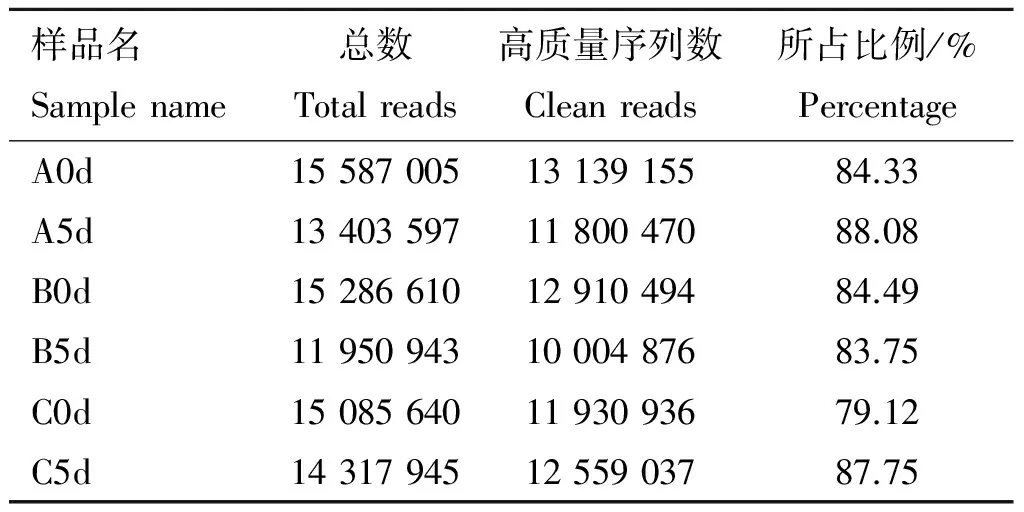
样品名Samplename总数Totalreads高质量序列数Cleanreads所占比例/%PercentageA0d155870051313915584.33A5d134035971180047088.08B0d152866101291049484.49B5d119509431000487683.75C0d150856401193093679.12C5d143179451255903787.75

图2 小RNA的长度分布Fig.2 Length distribution of sRNAs

图3 成肌细胞分化0(A)和5 d(B)的小RNA分类注释Fig.3 Annotation of sRNAs of myoblasts differentiated on 0 (A) and 5 d (B)
2.2.2 miRNA序列比对与统计 将过滤后的reads与牛的参考基因组比对,6个文库的比对结果见表3。其中,比对到基因组的序列比例都在70%以上,比对到基因组的sRNA种数都高于55%。
再将过滤后的reads与miRbase数据库比对,用mirDeep2软件进行统计,检测到成熟miRNA共619个。
表3文库中sRNA基因组比对结果
Table3GenomicalignmentofsRNAsfromlibraries

样品名Samplename序列种类UniquesRNAs总数Totaluniquereads比对上的序列数Matcheduniquereads百分比/%Percentage序列数TotalsRNAs总数Totalreads比对上的序列数Matchedreads百分比/%PercentageA0d18245411889265.169258913864328993.35A5d1457868466358.079056538780365986.17B0d19018211963162.906552517547334983.53B5d1308237195755.007025041554293178.90C0d16529810153761.434852204361402474.48C5d1426908441559.1610264886884547786.17
2.3 牛胎儿成肌细胞分化始末差异表达miRNA的分析
统计在不同样本间成熟miRNA的表达情况,用edgeR软件进行成肌细胞分化始末差异表达miRNA的分析,设定阈值P-value为0.05,Fold-change为2,得到差异表达的miRNA共 150个,表达量最高的20个见表4。
热图结果显示,成肌细胞分化0和5 d时,miRNA分别聚类到两个不同的类群,表明成肌细胞分化始末表达的miRNA有显著的差别(图4)。
2.4 差异表达miRNA靶基因预测及靶基因的GO与KEGG通路分析
综合利用miRanda和RNAhybrid两款软件进行差异表达miRNA的靶基因预测,150个差异表达miRNAs共预测到8 821个靶基因。
GO分析结果表明,差异表达miRNA的靶基因在生物学过程中主要参与了机体代谢和细胞代谢过程,占到靶基因总数的63.5%,其次是参与调控细胞生物学质量、细胞增殖分化和RNA转录等;在分子功能上,靶基因主要作用于蛋白质结合、酶催化和阴离子结合等;在细胞组成中,靶基因产物主要集中位于细胞内部,分别位于细胞质、细胞器膜和细胞核等(图5)。KEGG通路分析结果表明,差异表达miRNA的靶基因主要集中在MAPK信号通路、钙离子信号通路、TNF信号通路、HIF-1信号通路、缝隙连接和TRP通道介导的炎症调节过程等(图6)。

图4 差异表达miRNA的热图Fig.4 Heat map of differentially expressed miRNAs
2.5 qPCR对高通量测序准确性的验证
随机选取8个差异表达的miRNAs,进行荧光定量PCR验证,测序和荧光定量PCR得到的相对表达量如图7所示。可以看到,两种结果显示,miRNA的变化趋势完全一致,其中bta-miR-148a、bta-miR-143、bta-miR-1、bta-miR-34a、bta-miR-26a、bta-miR-199a-5p在分化5天的表达水平显著升高,bta-miR-7、bta-miR-27a-5p在分化5天的表达水平显著降低。熔解曲线都为单峰,引物特异性良好。
3 讨 论
当前,二代测序技术已经非常成熟,其通量高和信息量大的特点使其被广泛应用于畜禽基因组学研究中[19]。本研究利用illumina测序平台,对牛胎儿骨骼肌来源的成肌细胞miRNA进行高通量测序,鉴定已知miRNA 619个,分化始末差异表达miRNA共150个。对于高通量测序结果随机选取8个表达量相对较高的差异表达miRNAs,用加Poly A尾的方法合成cDNA,并用荧光定量PCR技术来检测miRNA的表达量,检测结果与测序结果完全一致,表明了测序结果具有较高的准确性和可靠性。这些结果将为后续研究miRNA和成肌细胞分化的工作提供试验依据。
miRNA是表观遗传学研究的重要内容之一,其通过作用于mRNA来抑制靶基因的表达[19-20]。胎儿肌肉的发育对肉牛出生后的表型会产生极为重要的影响,然而目前人们对miRNA在牛胎儿骨骼肌发育过程中的角色并不完全清楚[21]。通过对牛胎儿成肌细胞体外培养分化过程中差异表达miRNA的鉴定,能够更好的理解骨骼肌发育的机制。
miRNA广泛存在于各个物种,并且具有一定的保守性,这为验证试验得到的miRNA提供了一定的参考[22]。在鉴别出的差异表达miRNA中,有一些已经在牛或其它物种肌肉的相关研究中有过报道。miR-199a-5p可以通过靶向作用于WNT2,调节平滑肌细胞的增殖和分化,在平滑肌肥大和器官重塑上有潜在的应用价值[23]。Zuo等[24]对猪肌肉miRNA表达谱分析后发现,miR-143通过HDAC4-MEF2通路调控MYH7的表达,进而影响肌纤维的类型,miR-1可以影响肌球蛋白的含量、肌纤维的类型和肌肉性能。miR-26a在C2C12细胞系、小鼠和人的原代骨骼肌细胞成肌分化过程中表达量都呈上升趋势,这与本研究结果一致[25]。miR-26a通过作用于转录因子Smad1和Smad4,调控TGF-β/BMP信号通路,促进肌细胞分化,给乳鼠注射miR-26a的特异性拮抗物,能够抑制乳鼠骨骼肌的分化[25]。miR-148a在C2C12细胞分化过程中表达上升,其靶向作用于ROCK1基因从而促进肌原细胞分化[26]。在正常细胞内过表达miR-148a可以促进肌原细胞的分化,同时使细胞周期停滞。用干扰剂抑制miR-148a的表达时,C2C12分化被抑制,MHC和MyoG表达量显著下降[26]。
表4高表达的差异表达miRNAs
Table4ThedifferentiallyexpressedmiRNAswithhighexpressionlevel
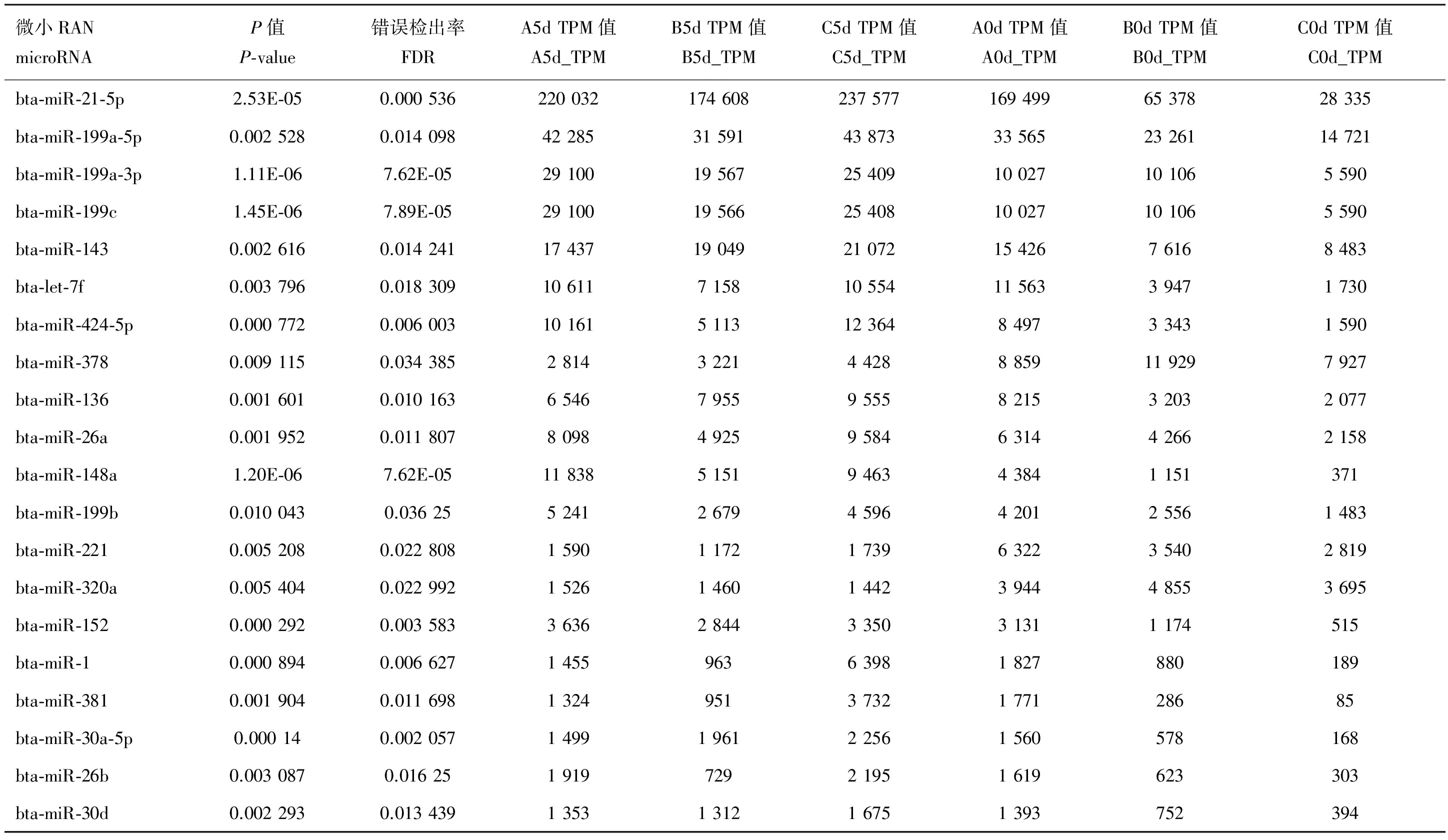
微小RANmicroRNAP值P⁃value错误检出率FDRA5dTPM值A5d_TPMB5dTPM值B5d_TPMC5dTPM值C5d_TPMA0dTPM值A0d_TPMB0dTPM值B0d_TPMC0dTPM值C0d_TPMbta⁃miR⁃21⁃5p2.53E⁃050.0005362200321746082375771694996537828335bta⁃miR⁃199a⁃5p0.0025280.014098422853159143873335652326114721bta⁃miR⁃199a⁃3p1.11E⁃067.62E⁃0529100195672540910027101065590bta⁃miR⁃199c1.45E⁃067.89E⁃0529100195662540810027101065590bta⁃miR⁃1430.0026160.0142411743719049210721542676168483bta⁃let⁃7f0.0037960.018309106117158105541156339471730bta⁃miR⁃424⁃5p0.0007720.00600310161511312364849733431590bta⁃miR⁃3780.0091150.0343852814322144288859119297927bta⁃miR⁃1360.0016010.010163654679559555821532032077bta⁃miR⁃26a0.0019520.011807809849259584631442662158bta⁃miR⁃148a1.20E⁃067.62E⁃05118385151946343841151371bta⁃miR⁃199b0.0100430.03625524126794596420125561483bta⁃miR⁃2210.0052080.022808159011721739632235402819bta⁃miR⁃320a0.0054040.022992152614601442394448553695bta⁃miR⁃1520.0002920.00358336362844335031311174515bta⁃miR⁃10.0008940.006627145596363981827880189bta⁃miR⁃3810.0019040.01169813249513732177128685bta⁃miR⁃30a⁃5p0.000140.0020571499196122561560578168bta⁃miR⁃26b0.0030870.01625191972921951619623303bta⁃miR⁃30d0.0022930.0134391353131216751393752394

图5 差异表达miRNA预测靶基因的GO分析Fig.5 Gene Ontology analysis of predicted target genes for differentially expressed miRNAs

图6 差异表达miRNA预测靶基因的KEGG通路分析Fig.6 KEGG pathway analysis of predicted target genes for differentially expressed miRNAs

不同miRNAs表达量间相比,*. P<0.05,**. P<0.01*.P<0.05,**.P<0.01 among expression levels of miRNAs
图7 miRNA的测序及qPCR检测结果Fig.7 Expression of miRNAs quantified by sequencing and qPCR
KEGG通路分析表明,本研究筛选的差异表达miRNA的靶基因富集到了多个与肌肉发育相关的通路。如p38 MAPK信号通路是参与骨骼肌发育的重要调控通路。MAPK能够激活转录因子MyoD基因和MEF2家族成员的表达,促进成肌分化[27]。钙离子信号通路对骨骼肌的生成、稳态维持和再生至关重要,钙离子有可能对肌卫星细胞产生直接作用,控制其处于静止状态或是增殖分化成为不同功能的肌肉[28]。细胞炎性因子TNF-α能够通过作用于p38 MAPK抑制骨骼肌的分化[29]。用TNF-α处理人成肌细胞,细胞miRNA的表达受到了影响,进而影响到多个细胞进程,最终对肌管形成产生抑制作用[30]。IGF-1/Akt信号通路在骨骼肌生长过程中发挥着核心作用,能够促进蛋白质合成、增加肌肉量[31]。美国康乃狄克州的研究人员发现,瞬时电位通道(TRP channels)的增多促进了心肌的纤维化,钙离子通透型的瞬时电位通道可能成为治疗心肌纤维化的新靶点[32]。瞬时电位通道可能与心肌肥大和心律失常相关[33]。将C2C12细胞培养在极低频率磁场中,细胞的间隙连接增加,C2C12融合和分化的速度加快,可能为肌肉功能紊乱找到新的治疗方法[34]。
基于上述已有研究,可以看到测序结果中的部分miRNA对成肌细胞分化的影响已经被印证,但是肌肉发育是一个复杂的过程,涉及到非常复杂的基因表达调控网络的变化,所以miRNA在其中的作用机制还有很多待挖掘的地方。并且,miRNA在物种之间存在一定的差异,牛的物种特异性的调控机制也有待进一步研究。因此,本试验结果将为以后的相关研究提供重要的参考。
4 结 论
本研究通过高通量测序和生物信息学分析,鉴定出了150个在牛胎儿骨骼肌来源的成肌细胞分化过程中差异表达的miRNAs,这些miRNAs有可能参与了牛胎儿期骨骼肌的分化。靶基因预测和功能分析表明,差异表达miRNA可能在动物肌肉发育相关的细胞信号通路中起作用,为进一步研究miRNA调控家畜骨骼肌发育奠定理论基础。
参考文献(References):
[1] LEE E A,KIM J M,LIM K S,et al.Effects of variation in porcineMYOD1 gene on muscle fiber characteristics,lean meat production,and meat quality traits[J].MeatSci,2012,92(1):36-43.
[2] KARUNARATNE J F,ASHTON C J,STICKLAND N C.Fetal programming of fat and collagen in porcine skeletal muscles[J].JAnat,2005,207(6):763-768.
[3] BUCKINGHAM M,RIGBY P W J.Gene regulatory networks and transcriptional mechanisms that control myogenesis[J].DevCell,2014,28(3):225-238.
[4] CHEN J F,MANDEL E M,THOMSON J M,et al.The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J].NatGenet,2006,38(2):228-233.
[5] BARTEL D P.microRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[6] CARTHEW R W,SONTHEIMER E J.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642-655.
[7] DALMAY T.Mechanism of miRNA-mediated repression of mRNA translation[J].EssaysBiochem,2013,54:29-38.
[8] ZHOU H B,XIAO J,WU N,et al.microRNA-223 Regulates the differentiation and function of intestinal dendritic cells and macrophages by targeting C/EBPβ[J].CellRep,2015,13(6):1149-1160.
[9] ALVAREZ-GARCIA I,MISKA E A.microRNA functions in animal development and human disease[J].Development,2005,132(21):4653-4662.
[10] PARK J K,LIU X,STRAUSS T J,et al.The miRNA pathway intrinsically controls self-renewal ofDrosophilagermlinestem cells[J].CurrBiol,2007,17(6):533-538.
[11] GOEDEKE L,WAGSCHAL A,FERNNDEZ-HERNANDO C,et al.miRNA regulation of LDL-cholesterol metabolism[J].BiochimBiophysActa,2016,1861(12):2047-2052.
[12] PIPAN V,ZORC M,KUNEJ T.microRNA polymorphisms in cancer:a literature analysis[J].Cancers(Basel),2015,7(3):1806-1814.
[13] GE Y J,CHEN J.microRNAs in skeletal myogenesis[J].CellCycle,2011,10(3):441-448.
[14] CRIST C G,MONTARRAS D,PALLAFACCHINA G,et al.Muscle stem cell behavior is modified by microRNA-27 regulation of Pax3 expression[J].ProcNatlAcadSciUSA,2009,106(32):13383-13387.
[15] GAMBARDELLA S,RINALDI F,LEPORE S M,et al.Overexpression of microRNA-206 in the skeletal muscle from myotonic dystrophy type 1 patients[J].JTranslMed,2010,8:48.
[16] MCCARTHY J J.microRNA-206:the skeletal muscle-specific myomiR[J].BiochimBiophysActa,2008,1779(11):682-691.
[17] GE Y J,SUN Y T,CHEN J.IGF-II is regulated by microRNA-125b in skeletal myogenesis[J].JCellBiol,2011,192(1):69-81.
[18] SUN J J,LI M J,LI Z J.et al.Identification and profiling of conserved and novel microRNAs from Chinese Qinchuan bovine longissimus thoracis[J].BMCGenomics,2013,14:42.
[19] MOTAMENY S,WOLTERS S,NÜRNBERG P,et al.Next generation sequencing of miRNAs-strategies,resources and methods[J].Genes(Basel),2010,1(1):70-84.
[20] DE NIGRIS F.Epigenetic regulators:polycomb-miRNA circuits in cancer[J].BiochimBiophysActa,2016,1859(5):697-704.
[21] MIRETTI S,MARTIGNANI E,TAULLI R,et al.Differential expression of microRNA-206 in skeletal muscle of female Piedmontese and Friesian cattle[J].VetJ,2011,190(3):412-413.
[22] 罗 艳,张 群,梁宇君,等.动物中microRNA的保守性和进化历程[J].中国科学:生命科学,2012,42(2):96-106.
LUO Y,ZHANG Q,LIANG Y J,et al.Conservation and evolution of microRNAs in animals[J].ScientiaSinicaVitae,2012,42(2):96-106.(in Chinese)
[23] HASHEMI GHEINANI A,BURKHARD F C,REHRAUER H,et al.microRNA MiR-199a-5p regulates smooth muscle cell proliferation and morphology by targeting WNT2 signaling pathway[J].JBiolChem,2015,290(11):7067-7086.
[24] ZUO J J,WU F,LIU Y H,et al.microRNA transcriptome profile analysis in porcine muscle and the effect of miR-143 on the MYH7 gene and protein[J].PLoSOne,2015,10(4):e0124873.
[25] DEY B K,GAGAN J,YAN Z,et al.miR-26a is required for skeletal muscle differentiation and regeneration in mice[J].GenesDev,2012,26(19):2180-2191.
[26] ZHANG J,YING Z Z,TANG Z L,et al.microRNA-148a promotes myogenic differentiation by targeting the ROCK1 gene[J].JBiolChem,2012,287(25):21093-21101.
[27] KEREN A,TAMIR Y,BENGAL E.The p38 MAPK signaling pathway:a major regulator of skeletal muscle development[J].MolCellEndocrinol,2006,252(1-2):224-230.
[28] TU M K,LEVIN J B,HAMILTON A M,et al.Calcium signaling in skeletal muscle development,maintenance and regeneration[J].CellCalcium,2016,59(2-3):91-97.
[29] CHEN S E,JIN B W,LI Y P.TNF-α regulates myogenesis and muscle regeneration by activating p38 MAPK[J].AmJPhysiolCellPhysiol,2007,292(5):C1660-C1671.
[30] MEYER S U,THIRION C,POLESSKAYA A,et al.TNF-α and IGF1 modify the microRNA signature in skeletal muscle cell differentiation[J].CellCommunSignal,2015,13:4.
[31] HITACHI K,TSUCHIDA K.Role of microRNAs in skeletal muscle hypertrophy[J].FrontPhysiol,2014,4:408.
[32] YUE Z C,ZHANG Y H,XIE J,et al.Transient receptor potential (TRP) channels and cardiac fibrosis[J].CurrTopMedChem,2013,13(3):270-282.
[33] WATANABE H,IINO K,OHBA T,et al.Possible involvement of TRP channels in cardiac hypertrophy and arrhythmia[J].CurrTopMedChem,2013,13(3):283-294.
[34] MORABITO C,STEIMBERG N,ROVETTA F,et al.Extremely low-frequency electromagnetic fields affect myogenic processes in C2C12 myoblasts:role of gap-junction-mediated intercellular communication[J].BiomedResInt,2017,2017:2460215.
