高比能量锂离子电池正极材料的研究进展
2018-07-04张卫新杨则恒王同振陈章贤
熊 凡,张卫新,杨则恒,陈 飞,王同振,陈章贤
高比能量锂离子电池正极材料的研究进展
熊 凡,张卫新,杨则恒,陈 飞,王同振,陈章贤
(合肥工业大学化学与化工学院,安徽 合肥 230009)
便携式电子设备的微型化、轻量化与电动汽车、电网储能设备的飞速发展,对高能量密度的锂离子 电池的研发和性能表现提出了越来越高的要求。锂离子电池正极材料是锂离子电池的核心,其提供锂离子并 参与电化学反应,因此改善正极材料性能是提高锂离子电池能量密度的关键。人们需要进一步研究开发成本 较低、安全性更好的高能量密度新型锂离子电池正极材料。本文主要从提升正极材料的比容量和工作电压两 方面介绍三元、富锂锰基材料和高电位镍锰酸锂等高比能量正极材料的介尺度结构设计、制备与性能调控研发进展。
锂离子电池;正极材料;能量密度;电化学性能
锂离子电池作为一种能量储存和转换的装置,与传统的铅酸电池和镍氢电池相比,具有能量密度大、能量转化效率高、工作电压高、循环寿命长和无记忆效应等诸多优点,在消费型电子产品、新能源汽车与电网储能等方面得到了越来越广泛的应 用[1]。锂离子电池的构成主要包括正极、负极、隔膜和电解液等。其电化学性能和成本很大程度上是由正极材料所决定。在满足安全、环保和寿命等基本前提下,要求下一代锂离子动力电池具有更高的能量密度和更好的倍率性能。提高电池的能量密度主要有两个途径:一是提高正、负极材料的比容量;二是提高正、负极材料之间的工作电压。
从目前锂离子电池正极材料电化学性能来看,LiCoO2电池充放电电压平稳、循环性能优异,应用广泛;但Co资源稀少、成本较高、环境污染较大和抗过充能力较差,其发展应用受到限制。LiMn2O4电池具有充放电电压高、环境友好、价格低廉和安全性能优异等优点,但存在Jahn-Teller效应导致其尖晶石结构由立方相向四方相转变,并且其电化学性能在高温(如55℃)时因为金属离子溶解而导致循环寿命较短。LiFePO4作为国内锂离子动力电池已商业化的正极材料,具有安全性能高、循环寿命长、价格低廉、环保等优点;但其橄榄石结构限制了Li+的传输扩散并且导致了其导电性较差,因此影响了材料的倍率性能,而另一方面磷酸铁锂本身过低的振实密度也会带来应用中的一系列问题[2]。常见的几类锂离子正极材料电化学性能参数如表1所示[3-4]。

表1 锂离子电池正极材料的电化学性能参数比较[3-4]

目前我国电动汽车商用锂离子动力电池主要以磷酸铁锂为正极、石墨为负极,电池的能量密度仅在120~130 W·h/kg,远远低于国家规划2025年能量型锂离子电池300 W·h/kg的能量密度目标。已商业化的低镍三元正极材料如LiNi1/3Co1/3Mn1/3O2(NCM111)和LiNi0.5Co0.2Mn0.3O2(NCM523)的比容量分别为140~145 mA·h/g和150~160 mA·h/g,也无法达到这个目标。相比而言,高镍类三元材料如LiNi0.8Co0.1Mn0.1O2(NCM811)、LiNi0.8Co0.15Al0.05O2(NCA)的理论容量约为200~220 mA·h/g,电压平台为3.7 V;富锂锰基正极材料如(1-)Li2MnO3·LiMO2(M= Ni、Co、Mn等)理论容量为250~300 mA·h/g,电压平台为4.2 V;镍锰酸锂的理论容量为146.7 mA·h/g,但是其电压平台高达4.7 V,因而也具有很高的能量密度。通过选择合适负极与这几类正极材料匹配,有望构建下一代高比能量锂离子电池,并实现产业化。
本文将重点介绍这几类高比能量锂离子电池正极材料的设计、制备与性能调控研发进展。
1 三元NCM或NCA材料
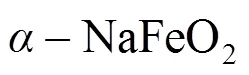

图1 (a)LiCoO2-LiNiO2-LiMnO2的电子结构示意图[7];(b)LiCoO2-LiNiO2-LiMnO2协同作用示意图[8]
层状高镍LiNiCoMn1--O2(≥0.6)材料尽管具备高能量密度优势,然而,这种正极材料依然存在自身的不足之处。由于Ni2+半径(0.069 nm)与Li+半径(0.076 nm)较为接近,在制备过程中容易导致锂镍阳离子混排,进入镍空位的锂在循环过程中难以脱嵌,导致电池的首次库仑效率不够理 想[9],并容易造成材料结构坍塌,由层状结构向尖晶石结构或NiO型岩盐相转变,从而导致容量衰减、循环性能和热稳定性降低。另外,阳离子混排使得电极材料表面锂析出,表面碱度过高[10],多余的锂形成碳酸锂或氢氧化锂在充放电过程中分解,使得电池产气鼓包,安全性能下降。此外,在充电至较高电压状态下,材料表面Ni2+被氧化至Ni4+,其与电解液之间会发生较严重的副反应形成SEI膜,导致离子和电子电导率较低,从而导致倍率性能表现不佳。针对材料的上述问题,研究者主要从两个途径出发来加以解决,一方面,对材料进行掺杂和包覆改性;另一方面,从材料的微观组成和结构设计来调节材料的电化学性能。
通过在三元材料晶格中掺杂一些金属离子,如Al[11]、Mg[12]、Mo[13]、Zr[14]、Cr[15]等,其中等价态阳离子掺杂不会改变过渡金属元素的化合价,但可以稳定材料的结构,而异价态阳离子掺杂改变了材料中金属元素的价态,会产生空穴或电子,可以提高材料的电导率。如有研究者采用燃烧合成法掺杂Zr元素制备LiNi0.6-ZrCo0.2Mn0.2O2,Zr4+取代了材料中Ni3+的位置,为异价态离子掺杂,减少了材料中Ni3+,提高了Ni2+含量,有效提高了材料的结构稳定性,实验证明掺杂量=0.04时能够有效提高材料的电导率并缩短Li+传输路径,改善材料在1~4 C的倍率性能[14]。阴离子掺杂则主要是掺入F[16],F原子与O原子同周期并且半径相近,而F与过渡金属成键键能更高,能够减缓电池在过充态的析气等安全性问题,而且可以同时稳定三元材料的结构。
表面包覆改性是在三元材料表面包覆一层厚度适宜的金属氧化物或锂盐,使得电极材料活性物质与电解液产生物理隔离,从而减少其与电解液之间的副反应,也进一步抑制过渡金属离子的溶解。包覆改性还可维持材料在多次循环充放电过程中材料结构的稳定性,提高材料的循环性能。高镍三元材料存在安全性能较差的问题,主要是由于材料表面残碱含量比较高,表面的碱性物质Li2CO3在高电压下易分解,从而带来安全性方面的隐患。如文献报道采用金属钒氧化物包覆NCM811三元材料,V2O5可明显降低高镍三元材料表面残碱含量,将NH4VO3与所制备的811三元材料混合煅烧,可以在材料表面形成LiV3O8/V2O5包覆层,在60 ℃下、2 C倍率、循环100次容量保持率为76.6%,而未包覆NCM811材料容量保持率仅为44.5%,表明材料的电化学性能和稳定性得以有效改善[17]。表面包覆锂活性物质(即可与锂发生反应)可以较好地提高循环性能和倍率性能,基于MC2O4·H2O(M= Ni、Co、Mn)纳米带脱出结晶水与Ti(OC4H9)4发生水解反应,煅烧后制备出Li2TiO3包覆三元电极材料LiMO2,Li2TiO3包覆层能够提供良好的三维Li+传输通道,改性后的带状三元电极材料具有着较为优异的倍率性能和循环保持率[18]。
针对在充电脱锂态条件下高镍三元材料表面Ni4+易与电解液发生副反应的问题,有必要在材料制备的过程中对材料中Ni、Co、Mn元素分布进行合理的调控。如SUN课题组[19]以蠕动进料方式,采用液相共沉淀法合成了三元梯度材料,其特点为材料颗粒从内核到外壳Co含量保持不变、Ni含量逐渐降低、Mn含量逐渐升高。这种梯度分布的结构减少了表面镍含量,从而减少镍与电解液因接触发生的副反应,可以有效地提高其循环性能。该课题组[20]进一步研究发现,利用氢氧化物共沉淀工艺,采用浓度梯度进料方式,合成具有双梯度分布的核壳结构的高性能的球形三元正极材料LiNi0.65Co0.13Mn0.22O2,所合成的材料在0.2 C、2.8~4.3 V首次放电比容量达到200 mA·h/g,全电池循环1500次容量保持率为88%,表现出优异的电化学性能。
本课题组设计分级共沉淀法[21](按不同金属元素配比分级进料)制备了直径约8μm的球形Ni0.5Co0.2Mn0.3(OH)2前驱体[22]。然后结合后续的混锂煅烧处理制得了Ni、Mn浓度从中心到表面呈梯度分布的球形三元正极材料(图2),其中Ni浓度从中心到表面逐渐降低,Mn浓度从中心到表面逐渐升高,Co浓度基本保持不变,球表面Ni、Co、Mn三种元素的原子比例(EDS)近似等于4.6∶2∶3.4。组成呈梯度分布的该三元材料0.2 C首次放电容量为166.3 mA·h/g,首次库仑效率达到89.3%。0.5 C循环200次容量仍保持在152.6 mA·h/g,容量保持率高达95.8%;在20 C/20 C的快速充放电倍率下,仍具有85.4 mA·h/g的较高比容量。相比于传统共沉淀法获得的非梯度分布的LiNi0.5Co0.2Mn0.3O2材料(0.5 C循环200次容量保持率仅为79.6%),具有更加优异的循环稳定性和高倍率性能。
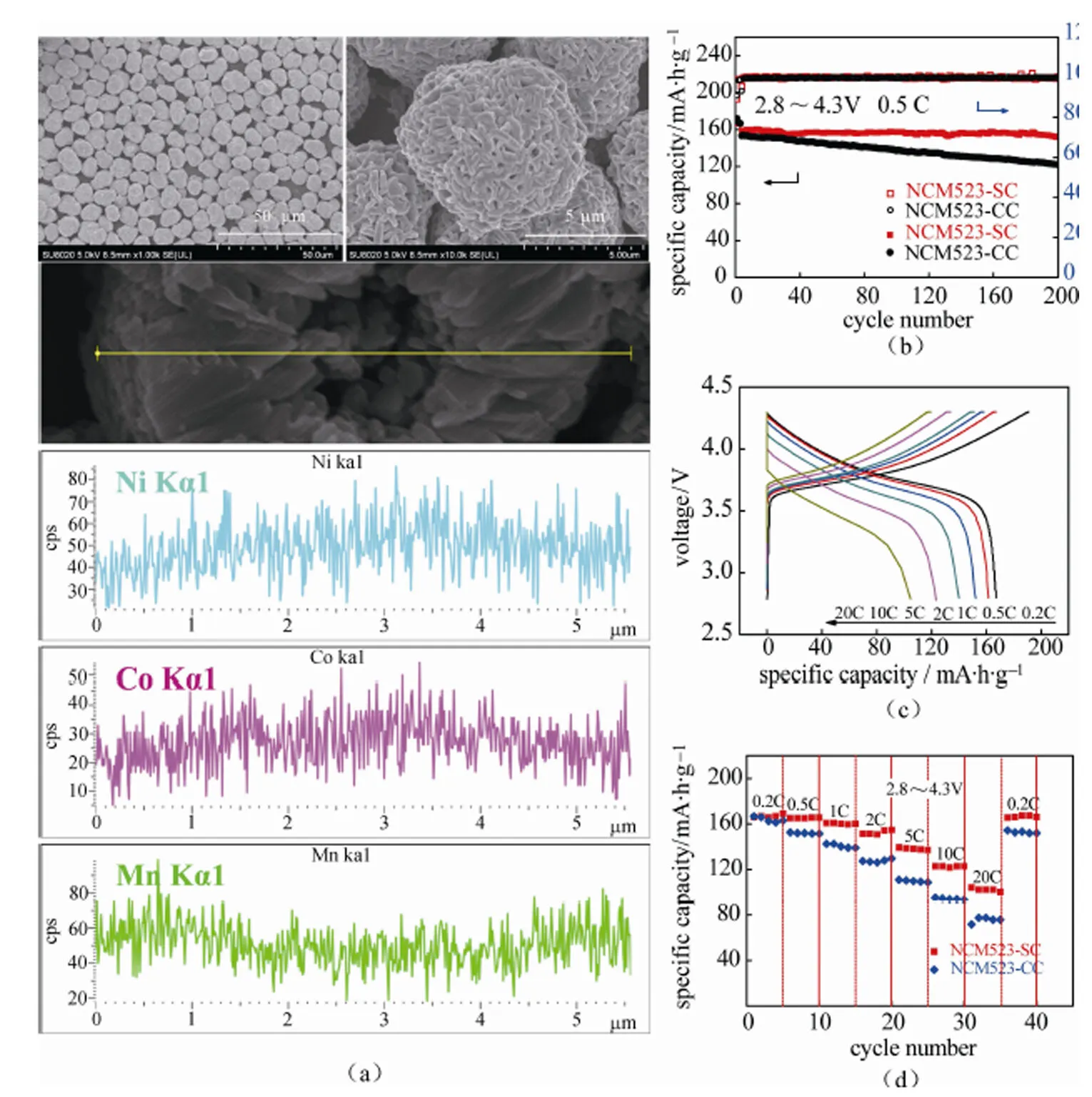
图2 (a)分级梯度三元正极材料(NCM523型)FESEM照片及径向元素线扫描图;(b)分级梯度三元正极材料(NCM523型)与常规材料在2.8~4.3 V,0.5 C下循环性能对比图;(c)分级梯度三元正极材料(NCM523型)充放电曲线;(d)分级梯度三元正极材料(NCM523型)与常规材料倍率性能对比[22]
Fig.2 (a) FESEM images and radial line-scanning EDS spectra of gradient cathode material (NCM523) ; (b) cycling performance of gradient cathode material and conventional material at 2.8~4.3 V, 0.5 C; (c) charge-discharge curves of gradient cathode material; (d) rate capability of gradient cathode material and conventional material[22]
2 富锂锰基正极材料
2001年,DAHN等[23]尝试将富锂锰基材料充电截止电压提高至4.6 V以上,发现具有较高的比容量,引发其成为人们的研究热点,2007年美国阿贡国家实验室的THACKERAY教授课题组[24]也报道了富锂锰基正极材料Li2MnO3·(1−)LiMO2,认为富锂锰基材料是层状LiMO2和Li2MnO3两种物质的复合材料。该类材料由于引入了Li2MnO3相不仅改善了高电位条件下层状LiMO2的结构稳定性,而且在充电到4.5 V以上可以进行电化学活化脱出Li+,使材料具有高比容量,并且材料中Mn元素比例的提高,降低了Co的含量,降低了成本,同时对环境友好。层状富锂锰基材料Li2MnO3·(1-)LiMO2(0≤≤1,M = Co、Mn、Ni等中的一种或多种)具有高于250 mA·h/g的可逆放电容量。其可以看作是由层状LiMO2和Li2MnO3形成的复合材料,其中,LiMO2属于六方晶系,R-3m空间群,具有二维α-NaFeO2型层状结构,Li原子和过渡金属原子分别位于3a和3b位置。Li2MnO3属于单斜晶系,C/2m空间群。FERREIRA等[25]通过大量表征和模拟技术分析了0.5Li2MnO3·0.5LiNi0.5Mn0.5O2材料的原子排布,认为该富锂锰基材料属于固溶体结构如图3所示,目前比较公认的也是这种固溶体结构。

图3 富锂锰基正极材料晶体结构示意图[26]
由图3(c)可见,在首次充电在4.4 V以下时,脱锂时伴随Co3+/Co4+、Mn3+/Mn4+、Ni2+/Ni4+氧化还原反应,当充电电压高于4.4 V时,Li2MnO3发生脱锂反应并转化为MnO2,当充电至4.8 V时出现一个脱锂伴随脱氧的平台,最终使材料放电容量较高,而放电过程中氧空位被过渡金属所占,阻碍了部分Li+无法重新嵌入,会造成材料的容量损失。综合而言,富锂锰基正极材料存在如下主要问题。①首次库仑效率低(首次不可逆容量高达40~100 mA·h/g),一般来说,未改性的富锂层状氧化物的首次库仑效率普遍低于80%;研究者们通常采用在材料表面包覆锂活性物质措施来加以改进,如MANTHIRAM课题组[27]相继采用包覆V2O5、LiV3O8、Li4Mn5O12等物质来提高富锂材料的首次库仑效率。②倍率性能差,通常1 C容量会降到200 mA·h/g以下,这是由于Li+在材料内部迁移扩散速率较低以及Li2MnO3相较低的导电性引起的。文献报道通过采用阳离子交换和热处理在富锂锰基正极表面构建一层缺锂态尖晶石结构的Li1-Mn2O4,可有效的为Li+扩散提供三维通道,稳定材料的表面结构,改善材料的倍率性能[28]。也有研究者在富锂材料表面包覆AlPO4、CoPO4和Al2O3等[29]可以有效提高其倍率性能,减少SEI膜的产生。③循环性能不够理想。由于层状富锂材料Li2MnO3·(l-) LiMO2与电解液接触,在充放电过程中(特别是充电到4.6 V或4.8 V时)会与电解液发生副反应,致使电极材料表面膜遭到LiPF6基电解质发生副反应产生的氢氟酸(HF)的破坏,造成电极材料循环性能下降。ZHENG等[30]通过包覆AlF3来减缓电极材料与电解液之间的副反应,从而改善材料的循环性能。④富锂锰基正极材料在循环过程中存在电压衰减问题。富锂锰基材料在循环一定次数以后,晶体结构会发生不可逆转变,Li2MnO3相会从层状结构向尖晶石结构转变[31],导致放电电压平台下降,引起电压衰减问题。部分研究者通过掺杂金属元素来提高层状结构的稳定性,如LI等[32]使用K+单价金属元素掺杂来抑制层状结构的不可逆转变。ATES等[33]通过掺杂Ni3+来减少在充放电过程中Mn3+的产生以提高材料结构稳定性,减缓电压衰减。
本课题组[34]基于碳酸盐共沉淀法制备富锂材料前驱体Ni0.13Co0.13Mn0.54(CO3)0.8,结合后续混锂煅烧制得富锂材料Li1.2Ni0.13Co0.13Mn0.54O2。然后对其分别开展Al掺杂、F掺杂和Al&F共掺杂研究。实验结果表明,Al&F离子共掺杂不仅可以有效抑制循环过程中由层状结构向尖晶石结构的畸变,有效抑制材料的容量衰减和电压衰减,而且可以提高材料的离子和电子传导率,进而改善其倍率性能,材料首次库仑效率提升至81.1%,0.5 C首次放电容量达到246 mA·h/g,且循环150次的放电容量仍有217 mA·h/g(容量保持率88.2%),10 C高倍率放电容量为157 mA·h/g,且容量保持率为54.8%。
目前,层状Li2MnO3·(1-)LiMO2正极材料常见的制备方法包括固相法、溶胶-凝胶法、共沉淀法、熔盐法、水热或溶剂热法等,其中,液相共沉淀法能够实现分子级别的混合,使得合成的材料具有化学计量比准确,材料形貌粒度均匀等优点,因而被广泛应用。如文献报道利用共沉淀法和阴离子电荷补偿机制可控制备了Li1.25Co0.25Mn0.50O2正极材料,该工作构筑了一种O2型具有单层Li2MnO3超结构的富锂材料,可以提供400 mA·h/g高可逆容量,其能量密度高达1360 W·h/kg[35]。另有文献报道了采用共沉淀法制备Ni0.25Mn0.75CO3球形颗粒前驱体,后续混入Li2CO3煅烧,制备富锂锰基材料Li(Ni0.2Li0.2Mn0.6)O2,研究表明通过选用尿素作为沉淀剂,改变反应时间和温度可以调控前驱体的形貌,该富锂锰基材料在2.0~4.8 V,20 mA/g电流密度下,首次放电容量可达253 mA·h/g,循环50次容量保持率为93.7%[36]。
本课题组[37]采用乙醇-水混合溶剂体系共沉淀法,在乙醇和水混合溶剂中,通过控制多元金属离子草酸盐共沉淀反应的动力学成核和生长过程,合成了一系列均匀的一维介尺度结构锰基锂离子电极材料,包括富锂锰基正极材料0.5Li2MnO3·0.5LiNi1/3Co1/3Mn1/3O2,显示了该方法的通用性。并且通过改变乙醇和水的比例可以实现调控材料的长径比,所合成的电极材料具有优异的电化学性能(图4)。所制备的一维介尺度结构富锂锰基正极材料在0.1 C首次放电容量为297.1 mA·h/g,首次库仑效率为86.4%,在1 C倍率下首次放电容量为221.9 mA·h/g,经过100次充放电循环后,放电容量为211.4 mA·h/g,其容量保持率为95%,10 C电流密度下放电依然具有160.3 mA·h/g的放电容量,表现出较高的可逆放电比容量和优异的循环性能。

3 高电位镍锰正极材料
1997年,AMINE等[38]和ZHONG等[39]开始了LiNi0.5Mn1.5O4的合成及电化学性能研究。LiNi0.5Mn1.5O4材料具有较高的工作电压(4.7 V),较高的能量密度(650 W·h/kg),与尖晶石结构的LiMn2O4相比容量提高了30%。尖晶石型镍锰酸锂最初是为了解决尖晶石锰酸锂中发生的Mn3+的溶解以及Jahn-Teller分子结构畸变效应引起性能不稳定问题,通过对尖晶石锰酸锂进行掺杂低价Ni所形成。尖晶石型镍锰酸锂降低了材料中三价锰离子的含量,从而降低了锰的溶解量,改善材料的循环稳定性能。
尖晶石型LiNi0.5Mn1.5O4有两种空间群,分别为面心立方结构Fd3m和简单立方结构P4332(图5)。其中,面心立方结构LiNi0.5Mn1.5O4,Li原子分布于四面体间隙8a处,O原子位于八面体32e位置,Mn原子和Ni原子则随机分布在八面体间隙16d处,与LiMn2O4相比有着相同的结构,如图5(a)所示;而另一类的简单立方结构P4332空间群中,Li原子分布于8c位置,O原子分布于8c和24e位置,Ni原子位于4a位置,Mn原子则处于12d位置,如图5(b)所示。
目前,LiNi0.5Mn1.5O4正极材料常见的制备方法包括固相法、溶胶-凝胶法、共沉淀法等,另外还有一些改进的沉淀方法,能够制备一些具有特殊形貌和结构的LiNi0.5Mn1.5O4材料。固相法由于原料混合的化学均匀性差,导致材料煅烧过程中产生的杂质较多,批次稳定性差。采用溶胶-凝胶法本身能耗较大,且制备方法受环境因素影响较大。共沉淀法结合后续煅烧工艺相对简单,制备的材料结晶度好,易于提高电化学性能。

图5 (a)面心立方LiNi0.5Mn1.5O4晶体结构;(b)简单立方LiNi0.5Mn1.5O4晶体结构[40]
本课题组[41]利用反应体系电导率变化及浊度变化规律,研究比较了多元金属离子碳酸盐共沉淀反应的动力学过程及其对电极材料介尺度结构的调控作用。研究表明,以NaHCO3为沉淀剂的反应是一个0级反应,反应成核速率较慢,有利于晶体的聚集生长,制得球形前驱体;而以Na2CO3为沉淀剂的反应是一个2级反应,反应成核速率较快,晶体的生长受到抑制,得到的是不规则颗粒前驱体,如图6所示。通过控制后续前驱体煅烧升温速率,最终得到单层及双层空心球状介尺度结构镍锰酸锂正极材料,其中单层空心球镍锰酸锂正极材料在30 C放电,依然具有100 mA·h/g的容量,0.5 C循环100次后的容量保持率为95%。
尽管LiNi0.5Mn1.5O4材料具有较高的能量密度,但其在实现产业化应用之前,面临着亟待解决的问题,即在材料的烧结制备过程中,煅烧温度较高,容易造成氧从晶格中逃逸,会产生LiNi1-xO等不提供放电容量的杂相,使得材料整体的比容量下降。从材料的电化学性能上来看,LiNi0.5Mn1.5O4的倍率性能和循环稳定性也有待进一步提高。在材料电解液匹配方面,目前,以钴酸锂为正极,以石墨为负极的应用型锂离子电池主要广泛使用的是LiPF6电解液,该型电池的最高工作电压也约为4.2 V,所以设计的电解液体系一般只能保证在4.5 V以下的范围内能够稳定使用,而LiNi0.5Mn1.5O4材料的最高充电截止电压可达5.2 V,因此常规电解液在此电压条件下会发生氧化分解。为了改善材料的性能,目前研究工作主要集中于:一是通过对材料本身表层元素组分调整,或进行表面包覆,降低电解液在材料表面发生氧化分解副反应,同时也可抑制材料中过渡金属离子的溶解。例如,有文献报道采用TiO2包覆改性LiNi0.5Mn1.5O4,包覆改性后材料在高温(55 ℃)下,0.1 C循环100圈容量保持率为93%,未包覆材料保持率仅为70%,同时后续电解液浸泡实验也证实改性后材料在电解液中溶解的金属离子浓度明显降低,有效地提高安全性和循环稳定性[42];二是对LiNi0.5Mn1.5O4进行体相掺杂来改善材料的电化学性能,如MANTHIRAM课题组[43]基于氢氧化物共沉淀法制备掺杂Zn的高电位LiNi0.42Mn1.5Zn0.08O4材料,Zn取代了Ni的位置,使得材料的晶胞参数发生改变,有效提高了材料的倍率性能和循环稳定性。该课题组进一步研究发现,Ga掺杂也可以有效改善材料的循环稳定性[44],主要原因是由于所掺杂的Ga元素在材料的表层含量较高,可以有效地隔绝材料中Ni4+与电解液发生副反应,进而使得循环性能得以提升。三是选择匹配高电压的电解液体系,通过在常规电解液体系中添加有效成膜剂使得在高电位材料表面形成钝化膜,部分阻止电解液与电极材料表面接触,也可以对电解液体系进行优化,如采用有机锂源替代LiPF6,更换电解液溶剂[45]等措施。

图6 (a)调控制备空心球状介尺度结构镍锰酸锂正极材料过程示意图;(b)碳酸盐前驱(上)和镍锰酸锂正极材料FESEM照片(下),插图为相应TEM照片,标尺1 μm;(c)镍锰酸锂在不同倍率下的充放电性能曲线;(d)镍锰酸锂在不同倍率下的循环性能图[41]
4 结 语
随着消费电子产品和电动汽车的蓬勃发展,锂离子电池产业必将迅速跟进,高比能量锂离子动力电池面临着新的机遇和挑战,近年来,研究人员围绕高比能量锂离子电池的正极材料在合成工艺、掺杂改性、微观结构和电解液匹配等方面开展了诸多改进工作,本文着重总结了当前锂离子电池三元正极材料LiNiCoMn1--O2(NCM)或LiNi0.8Co0.15Al0.05O2(NCA)、富锂锰基正极材料与高电位镍锰酸锂正极材料的研究进展,分析了上述几种正极材料与高电位镍锰正极材料的结构、性能和所面临的问题,并针对性地介绍了这几种材料的改进方法,可以为实际研发工作提供参考。同时,也可为高比容量锂离子电池电极材料的产业化生产提供新的思路与借鉴。未来锂离子动力电池将由锰酸锂、磷酸铁锂为主的正极材料向三元材料、富锂锰基材料和高电位镍锰酸锂材料转移,相信通过产、学、研共同努力,将会促进这类材料相关制备技术的进步与发展,推动它们广泛应用于高比能锂离子电池。
[1] 吴宇平, 万春荣. 锂离子二次电池[M]. 北京: 化学工业出版社, 2002: 336-349.
WU Y P, WAN C R. Lithium ion secondary battery[M]. Beijing: Chemical Industry Press, 2002: 336-349.
[2] YUAN L X, WANG Z H, ZHANG W X, et al. Development and challenges of LiFePO4cathode material for lithium-ion batteries[J]. Energy & Environmental Science, 2011, 4(2): 269-284.
[3] ZHONG G B, WANG Y Y, ZHANG Z C, et al. Effects of Al substitution for Ni and Mn on the electrochemical properties of LiNi0.5Mn1.5O4[J]. Electrochimica Acta, 2011, 56(18): 6554-6561.
[4] 黄震雷, 武斌, 王永庆, 等. 锂离子电池正极材料产业化技术进展[J]. 储能科学与技术, 2015, 4(6): 537-545.
HUANG Z L, WU B, WANG Y Q, et al. Technology progress of cathode materials for lithium ion batteries[J]. Energy Storage Science and Technology, 2015, 4(6): 537-545.
[5] 彭佳悦, 祖晨曦, 李泓. 锂电池基础科学问题(Ⅰ)——化学储能电池理论能量密度的估算[J]. 储能科学与技术, 2013, 2(1): 55-62.
PENG J Y,ZU C X,LI H. Fundamental scientific aspects of lithium batteries(I) ——Thermodynamic calculations of theoretical energy densities of chemical energy storage systems[J]. Energy Storage Science and Technology, 2013, 2(1): 55-62.
[6] LIU Z, YU A, LEE J Y. Synthesis and characterization of LiNi1--CoMnO2as the cathode materials of secondary lithium batteries[J]. Journal of Power Sources, 1999, 81/82(9): 416-419.
[7] MANTHIRAM A, MURUGAN A, SARKAR A. Nanostructured electrode materials for electrochemical energy storage and conversion[J]. Energy & Environmental Science, 2008, 1: 621-638.
[8] LIU W, OH P, LIU X, et al. Nickel-rich layered lithium transition-metal oxide for high-energy lithium-ion batteries[J]. Angewandte Chemie International Edition, 2015, 46(26): 4440-4457.
[9] MANTHIRAM A, KNIGHTJ C, MYUNG S, et al. Nickel-rich and lithium-rich layered oxide cathodes: Progress and perspectives[J]. Advanced Energy Materials, 2016, 6(1): 1-23.
[10] 邹邦坤, 丁楚雄, 陈春华. 锂离子电池三元正极材料的研究进展[J]. 中国科学:化学, 2014(7): 1104-1115.
ZOU B K, DING C X, CHEN C H. Research progress in ternary cathode materials Li(Ni, Co, Mn)O2for lithium ion batteries[J]. Scientia Sinica Chimica, 2014(7): 1104-1115.
[11] DUAN J, HU G, CAO Y, et al. Enhanced electrochemical performance and storage property of LiNi0.815Co0.15Al0.035O2Al gradient doping[J]. Journal of Power Sources, 2016, 326: 322-330.
[12] HUANG Z, WANG Z, ZHENG X, et al. Effect of Mg doping on the structural and electrochemical performance of LiNi0.6Co0.2Mn0.2O2cathode materials[J]. Electrochimica Acta, 2015, 182: 795-802.
[13] XUE L, LI Y, XU B, et al. Effect of Mo doping on the structure and electrochemical performances of LiNi0.6Co0.2Mn0.2O2cathode material at high cut-off voltage[J]. Journal of Alloys & Compounds, 2018, 748: 561-568.
[14] DIXIT M, SCHIPPER F, KOVACHEVA D, et al. Stabilizing nickel-rich layered cathode materials by a high-charge cation doping strategy: Zirconium-doped LiNi0.6Co0.2Mn0.2O2[J]. Journal of Materials Chemistry A, 2016, 4(41): 16073-16084.
[15] LI L, WANG Z X, LIU Q C, et al. Effects of chromium on the structural, surface chemistry and electrochemical of layered LiNi0.8−xCo0.1Mn0.1CrO2[J]. Electrochimica Acta, 2012, 77(9): 89-96.
[16] PENG Y, WANG Z, GUO H, et al. A low temperature fluorine substitution on the electrochemical performance of layered LiNi0.8Co0.1Mn0.1O2−zF, cathode materials[J]. Electrochimica Acta, 2013, 92(1): 1-8.
[17] XIONG X, WANG Z, GUO H, et al. Enhanced electrochemical properties of lithium-reactive V2O5coated on the LiNi0.8Co0.1Mn0.1O2cathode material for lithium ion batteries at 60 ℃[J]. Journal of Materials Chemistry A, 2012, 1(4): 1284-1288.
[18] JUN L, QING P, WEIYANG W, et al. Nanoscale coating of LiMO2(M = Ni, Co, Mn) nanobelts with Li+-conductive Li2TiO3: Toward better rate capabilities for Li-ion batteries[J]. Journal of the American Chemical Society, 2013, 135(5): 1649-1652.
[19] SUN Y K, CHEN Z, NOH H J, et al. Nanostructured high-energy cathode materials for advanced lithium batteries[J]. Nature Materials, 2012, 11(11): 942-947.
[20] LIM B, YOON S, PARK K, et al. Advanced concentration gradient cathode material with two-slope for high-energy and safe lithium batteries[J]. Advanced Functional Materials, 2015, 25(29): 4673-4680.
[21] YANG Z H, LU J B, BIAN D C, et al. Stepwise co-precipitation to synthesize LiNi1/3Co1/3Mn1/3O2one-dimensional hierarchical structure for lithium ion batteries[J]. Journal of Power Sources, 2014, 272: 144-151.
[22] 夏青, 赵俊豪, 王凯, 等. 基于分级共沉淀法制备锂离子电池LiNi0.5Co0.2Mn0.3O2正极材料[J]. 化工学报, 2017, 68(3): 1239-1246.
XIA Q, ZHAO J H, WANG K, et al. Synthesis and characterization of LiNi0.5Co0.2Mn0.3O2cathode materials by stepwise co-precipitation[J]. Journal of Chemical Industry and Engineering(China), 2017, 68(3): 1239-1246.
[23] LU Z H, MACNEIL D D, DAHN J R. Layered cathode materials Li[NiLi(1/3-2x/3)Mn(2/3-/3)]O2for lithium-ion batteries[J]. Electrochemical and Solid-State Letters, 2001, 7(12): A503-A506.
[24] THACKERAY M M, KANG S H, JOHNSON C S, et al. Li2MnO3-stabilized LiMO2(M = Mn, Ni, Co) electrodes for lithium-ion batteries [J]. Journal of Materials Chemistry, 2007, 17(30): 3112-3125.
[25] JARVIS K A, DENG Z, ALLARD L F, et al. Atomic structure of a lithium-rich layered oxide material for lithium-ion batteries: Evidence of a solid solution [J]. Chemistry of Materials, 2011, 23(16): 3614-3621.
[26] LEE S H, MOON J S, LEE M S, et al. Enhancing phase stability and kinetics of lithium-rich layered oxide for an ultra-high performing cathode in Li-ion batteries[J]. Journal of Power Sources, 2015, 281: 77-84.
[27] GAO J, KIM J, MANTHIRAM A. High capacity Li[Li0.2Mn0.54Ni0.13Co0.13]O2-V2O5composite cathodes with low irreversible capacity loss for lithium ion batteries[J]. Electrochemistry Communications, 2009, 11(1): 84-86.
[28] ZHENG Y, CHEN L, SU Y F, et al. An interfacial framework for breaking through the Li-ion transport barrier of Li-rich layered cathode materials[J]. Journal of Materials Chemistry A, 2017, 5(46): 24292-24298.
[29] WANG Q Y, LIU J, MURUGAN A V, et al. High capacity double-layer surface modified Li[Li0.2Mn0.54Ni0.13Co0.13]O2cathode with improved rate capability[J]. Journal of Materials Chemistry, 2009, 19(28): 4965-4972.
[30] ZHENG J, GU M, XIAO J, et al. Functioning mechanism of AlF3coating on the Li- and Mn-rich cathode materials[J]. Chemistry of Materials, 2014, 26(22): 6320-6327.
[31] HU E Y, LYU Y C, XIN H L, et al. Explore the effects of microstructural defects on voltage fade of Li- and Mn-rich cathodes[J]. Nano Letters, 2016, 16(10): 5999-6007.
[32] WU X, CHEN F, JIN Y, et al. Silver-copper nanoalloy catalyst layer for bifunctional air electrodes in alkaline media[J]. ACS Applied Materials & Interfaces, 2015, 7(32): 17782-17791.
[33] ATES M N, MUKERJEE S, ABRAHAM K M. A Li-rich layered cathode material with enhanced structural stability and rate capability for Li-ion batteries[J]. Journal of the Electrochemical Society, 2014, 161(3): A355-A363.
[34] GUO B, ZHAO J H, FAN X M, et al. Aluminum and fluorine co-doping promotes stable and safe lithium-rich layered cathode material[J]. Electrochimica Acta, 2017, 236: 171-179.
[35] ZUO Y, LI B, JIANG N, et al. A high-capacity O2-type Li-rich cathode material with a single-layer Li2MnO3superstructure[J]. Advanced Materials, 2018, 30(16): 1707255.
[36] ZHANG J W, GUO X, YAO S M, et al. Tailored synthesis of Ni0.25Mn0.75CO3spherical precursors for high capacity Li-rich cathode materialsaurea-based precipitation method[J]. Journal of Power Sources, 2013, 238: 245-250.
[37] MA G, LI S, GUO B, et al. A general and mild approach to controllable preparation of manganese-based micro- and nanostructured bars for high performance lithium-ion batteries[J]. Angewandte Chemie International Edition, 2016, 128(11): 3667-3671.
[38] AMINE K, TUKAMOTOH, YASUDA H, et al. Preparation and electrochemical investigation of LiMn2−xMeO4, (Me: Ni, Fe, and= 0.5, 1) cathode materials for secondary lithium batteries[J]. Journal of Power Sources, 1997, 68(2): 604-608.
[39] ZHONG Q, BONAKDARPOUR A, ZHANG M, et al. Synthesis and electrochemistry of LiNiMn2-O4[J]. Journal of the Electrochemical Society, 1997, 144(1): 205-213.
[40] YANG J ,HAN X, ZHANG X, et al. Spinel LiNi0.5Mn1.5O4cathode for rechargeable lithiumion batteries: Nanomicro, ordered phasedisordered phase[J]. Nano Research, 2013, 6(9): 679-687.
[41] LI S, MA G, GUO B, YANG Z H, et al. Kinetically-controlled synthesis of LiNi0.5Mn1.5O4micro/nano-structured hollow spheres as high-rate cathode materials for lithium ion batteries[J]. Industrial & Engineering Chemistry Research, 2016, 55(35): 9352-9361.
[42] WANG H, BEN L, YU H, et al. Understanding the effects of surface reconstruction on electrochemical cycling performance of spinel LiNi0.5Mn1.5O4cathode material at elevated temperatures[J]. Journal of Materials Chemistry A, 2016, 5(2): 822-834.
[43] Arunkumar T A, Manthiram A. Influence of lattice parameter differences on the electrochemical performance of the 5 V spinel LiMn1.5-Ni0.5-M+zO4(M = Li, Mg, Fe, Co, and Zn)[J]. Electrochemical & Solid State Letters, 2005, 8(8): A403-A405.
[44] SHIN D W, Manthiram A. Surface-segregated, high-voltage spinel LiMn1.5Ni0.42Ga0.08O4cathodes with superior high-temperature cyclability for lithium-ion batteries[J]. Electrochemistry Communications, 2011, 13(11): 1213-1216.
[45] Zhang Z, Hu L, Wu H, et al. Fluorinated electrolytes for 5 V lithium-ion battery chemistry[J]. Energy & Environmental Science, 2013, 6(6): 1806-1810.
Research progress on cathode materials for high energy density lithium ion batteries
XIONG Fan,ZHANG Weixin, YANG Zeheng, CHEN Fei,WANG Tongzhen,CHEN Zhangxian
(School of Chemistry and Chemical Engineering, Hefei University of Technology, Hefei 230009, Anhui, China)
With the miniaturization and lighting of the portable electronic products, and the rapid development of electric vehicles and grid energy storage devices, lithium ion batteries with higher energy density and higher performances are increasingly demanded. Cathode materials play a key role in lithium ion batteries and their improvements are crucial for enhancing energy density of lithium ion batteries. Nowadays, cathode materials of high energy density with lower production cost and high safety for lithium-ion batteries has been of great significance. This paper summarizes recent progress in cathode materials from the prospects of enhancing the specific capacity and the working voltage, and mainly focuses on design and preparation of meso-scale structured nickel-rich and lithium-rich layered oxide and spinel oxide cathode materials with tunable electrochemical performances.
lithium ion battery; cathode material; energy density; electrochemical performance
10.12028/j.issn.2095-4239.2018.0060
TQ 028.8
A
2095-4239(2018)04-0607-11
2018-04-12;
2018-05-13。
国家自然科学基金项目(91534102,21271058)。
熊凡(1990—),男,硕士研究生,主要研究方向为锂离子电池电极材料,E-mail:18326030975@163.com;
张卫新,教授,主要研究方向为锂离子电池电极材料,E-mail:wxzhang@hfut. edu.cn。
