锂硫电池硫正极技术研究进展
2018-07-04郑东东刘漫博
袁 艳,郑东东,方 钊,刘漫博,李 涛
锂硫电池硫正极技术研究进展
袁 艳1,郑东东1,方 钊1,刘漫博1,李 涛2
(1西安建筑科技大学冶金工程学院,陕西 西安 710055;2中南大学冶金与环境学院,湖南 长沙 410083)
锂硫电池具有能量密度高、原料低廉、绿色环保等优势,已成为下一代高性能二次电池的研究热点,但是活性材料利用率低、容量衰减较快、自放电严重等问题,极大地阻碍了该电池的实用化进程。正极是电池的核心部件,要实现锂硫电池的性能提升,必须对硫正极的组分结构进行合理的设计与构建。本文首先分析锂硫电池的工作原理、存在问题及解决途径,然后分别从硫正极的活性材料、集流体、表面涂层、黏结剂、添加剂等5个方面对当前的研究现状进行总结,最后对其未来的发展前景做出展望,文章指出,硫正极更应关注真实的能量密度水平,而锂硫电池的研究视野不应局限于正极材料。
锂硫电池;多硫化物;正极材料;集流体;涂层;黏结剂
化石资源短缺与环境污染加剧,使得人们日益青睐绿色、高效的二次储能装置。锂离子电池技术与应用当前已非常成熟,但由于正负极材料理论比容量的制约,能量密度一般局限在300 W·h/kg以内。为了适应电动汽车、风光储能和智能通讯等产业的发展,迫切需要开发具有更高能量密度的储能体系。
从电化学角度考虑,具备多电子反应特征的储锂材料是实现高比能目标的合理途径,以金属锂为负极、单质硫为正极组成的锂硫电池就是一个很好的例证[1]。理论上来讲,锂硫电池的能量密度高达2500 W·h/kg左右,即使实际能量密度只能发挥出理论值的20%,也远超出传统锂离子电池的水平。而且该电池是以资源丰富、成本低廉、无毒、环境友好的硫磺为主要原料,这较之使用贵重或污染性金属的其它二次电池亦具有明显优势。因此,锂硫电池已成为近年来高比能二次电池领域的一大热点,极具研究与应用价值。
1 工作原理
锂硫电池是通过硫-硫键的电化学断裂和重新键合而实现电能与化学能相互转换的一种新型二次电池体系,其工作原理如图1所示,这是一个包含多步骤的氧化还原反应,同时伴随着各种硫化物的复杂相转移过程[2]。在放电时,硫得到电子并与Li+结合生成多硫化物中间体Li2S(4≤≤8),其易溶于电解液中,将逐步脱离正极并向电解液中扩散;随着放电程度的加深,多硫化物进一步被还原,最终生成在电解液中溶解度极低的Li2S2或Li2S;而在充电过程中,放电产物Li2S2和Li2S失去电子,逐步被氧化成多硫化物中间体,并最终重新生成单质硫。基于硫的多步骤反应机理,锂硫电池的放电过程具体可拆分为4个阶段[3]。
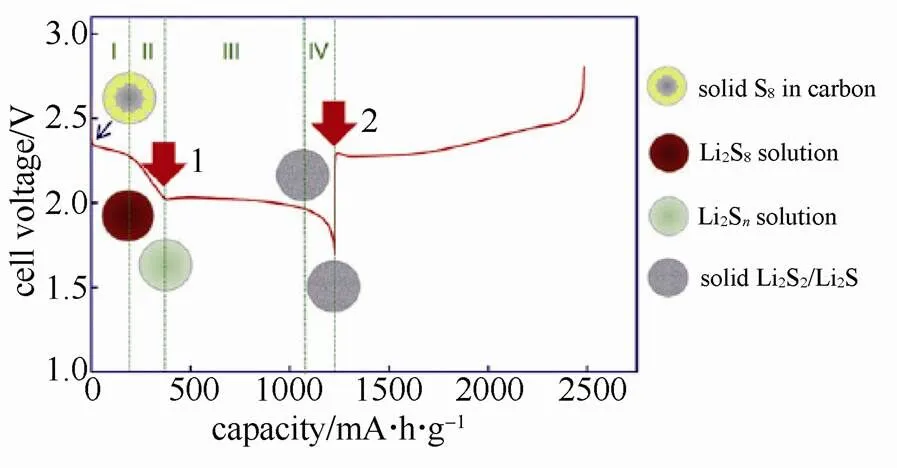
图1 锂硫电池的典型首次充放电曲线[3]
第一阶段:单质硫S8向Li2S8转变的固/液两相还原过程。对应于放电曲线在2.2~2.3 V区间的高电位平台。此时,生成的Li2S8溶解于电解液中,变成一种液态电极,从而在正极中留下大量空余的孔洞。反应式见式(1)。
S8+2Li → Li2S8(1)
第二阶段:Li2S8向短链Li2S转变的液/液单相还原过程。此时放电电压持续下降,生成的多硫化物的S—S链长度逐渐减小,但数量不断增加,导致电解液黏度增大,在第二阶段末期达到最大值。反应式见式(2)。
Li2S8+2Li → Li2S8-n+Li2S(2)
第三阶段:溶解的短链Li2S向不溶的Li2S2和Li2S转变的液/固两相还原过程。对应于放电曲线在1.9~2.1 V区间的低电位平台。反应式如式(3)和式(4)所示,此时存在二者的相互竞争过程。
2Li2S+(2+4)Li →Li2S2(3)
Li2S+ (2+2)Li →Li2S (4)
第四阶段:不溶的Li2S2向Li2S转变的固/固单相还原过程。此时的反应动力学非常缓慢,同时由于Li2S2和Li2S的绝缘性和不溶性,反应过程将产生高的极化。反应式见式(5)。
Li2S2+2Li → 2Li2S (5)
在上述4个反应阶段中,第1和第2阶段的自放电程度相对较高,因而对电池容量的贡献较少。而第三阶段贡献电池的主要容量,其中如果式(4)占主导地位,电池容量将释放更多,第4阶段相应地变得非常短甚至基本消失。
如果单质硫按上述过程100%转化为Li2S,则通过双电子得失的氧化还原反应,理论放电比容量高达1675 mA·h/g。虽然硫与锂结合形成的工作电压偏低(约2.15 V左右),但仍然可以驱使电池获得高达2500 W·h/kg的比能量值,而体积能量密度更是可达2800 W·h/L。
2 存在问题及解决途径
锂硫电池虽然极具吸引力,但是当前仍存在很多突出的问题,使得其实际可发挥的容量还不能完全达到理论预期的水平,而且循环稳定性差、寿命短,这极大阻碍了其实用化进程。问题主要表现在以下几个方面[4-6]。
(1)单质硫及其固态放电产物(Li2S2/Li2S)的电子和离子导电性差,这会增加电池的内部阻抗,产生严重的极化问题,降低电池的能量转化效率。电导性差的原因还在于一些不溶的绝缘产物会沉积在硫颗粒表面,形成的绝缘层阻碍硫被进一步还原,降低活性材料利用率。
(2)充放电过程形成的多硫化物(特别是高聚态Li2S,4≤≤8)大多易溶解于电解液中,这首先会损失掉一部分容量。溶解后的多硫化物由于浓度梯度的存在,穿过隔膜向负极扩散并与锂反应,生成的低聚态还原产物亦在浓度梯度作用下扩散回正极,被再次氧化成高聚态,多硫化物从而在正负极间不断往返形成“穿梭效应”,造成内部自放电,降低充放电效率,恶化电池性能。同时,穿梭效应导致锂负极被腐蚀,产生的不溶硫化锂产物沉积于负极表面,阻碍锂的传输,钝化甚至破坏负极结构。
(3)硫正极在摄入锂形成硫化锂时会发生体积变化,由于硫和硫化锂的密度分别为2.03 g/cm3和1.66 g/cm3,这意味着硫电极完全锂化会发生80%左右的体积膨胀,此时硫化锂可能会与导电相分离而失去活性,引起容量不可逆损失。在接下来充电过程中,这部分体积膨胀又会被复原。正极结构由此不断发生收缩和膨胀,反复的体积变化将导致结构的不稳定甚至瓦解坍塌。
正极是二次电池的关键组成部分。为了解决上述问题,实现电池性能提升,从正极的角度入手,大体来讲有以下几个努力途径[7-8]:①引入一个导电组分或者构建导电网络来增强电荷传导、降低电极极化;②设计孔隙空间容纳并吸附多硫化物,或者引入特殊的结构部件钳制多硫化物;③构建孔结构合适、力学性能良好的硫正极适应充放电过程中的体积变化;④优化电极结构,促进电解液的浸润与渗透,缩短锂离子扩散路径;⑤增加电极比表面积,为不溶产物的沉积提供充分的位置,减少沉积厚度和对电极的钝化。
近年来国内外学者们围绕硫正极开展了大量的优化工作,取得了一系列卓有成效的研究成果。以下分别从正极材料、集流体、表面涂层、黏结剂、添加剂5个方面对当前国内外的研究现状进行综述。
3 正极材料
3.1 硫/碳复合
关于正极材料,目前研究最为广泛的是用各种导电碳与硫复合,包括导电炭黑、多孔碳、碳纳米管、碳纳米纤维、石墨烯、碳气凝胶等[9-11]。将硫填充至高比表面积的碳孔中,可保证导电相与绝缘硫充分接触、促进电荷的转移传输,碳孔的吸附性一定程度上限域活性物质,碳的刚性骨架还能够制约电极充放电过程中的体积变化。图2汇总了制备硫碳复合材料的各种技术路线,包括高温熔融法、溶液法、机械混合法、气相沉积法等[12]。
多孔碳通常是无定形的,石墨化程度相对低,但是孔结构非常丰富、多样化。根据孔径尺寸,多孔碳被划分为微孔碳(小于2 nm)、介孔碳(2~ 50 nm)和大孔碳(大于50 nm),其中介孔碳在锂硫电池中研究较多。获得多孔结构一般有以下3种途径:①在炭化过程中自发形成(微孔/介孔);②物理/化学活化法形成(微孔);③软/硬模板法形成(微孔/介孔/大孔)。2009年NAZAR课题组[13]报道了以SBA-15硅分子筛模板制备了高度有序介孔炭CMK-3,将硫高温熔融渗入到CMK-3的孔道内,制成的复合材料展示了优异的电化学性能。作者还进一步采用聚合物PEG包裹上述复合材料,使得首次放电容量提高到1320 mA·h/g,在20圈的循环过程中容量保持得非常稳定。由此掀起了锂硫电池正极材料的研究热潮。该课题组还成功开发了一种具有双重孔道结构的介孔碳BMC-1[14],其中小介孔用于承载大部分的硫材料,同时协助限制多硫化物溶解,而大圆柱介孔则支持锂离子的快速传输,制备的BMC-1/S复合材料倍率性能良好。HU等[15]改变前驱体材料中的碱金属离子种类,利用炭化工艺制备出具有大量超微孔结构(<0.7 nm,比重从54.9% 到25.8%)的微孔碳材料,用其作为单质硫的载体,可以在碳酸酯类电解液中获得高的可逆容量、良好的循环稳定性和倍率特性。为了充分利用各种孔结构的优势,近年来也有不少研究瞄准开发层次孔碳。ZHAO等[16]通过喷雾热解技术制备了孔径分布较宽的多孔碳微球,该材料同时具有微、介、大孔结构,其高的比表面积增强了电极导电性、支持高硫承载,大孔和大介孔提供了良好的电解液浸润通道,有利于锂离子的传输和硫体积的扩张,而微孔和小介孔改善了硫碳之间的结合、抑制了多硫化物的溶解。复合材料在1 C充放电循环100次后容量达到904 mA·h/g。ZHANG等[17]以木薯粉为前驱体与石墨烯混合成凝胶状,再通过水热反应在凝胶孔壁形成水热碳层,然后直接对其炭化,制备出具有丰富层次孔结构的多孔碳/石墨烯气凝胶复合材料,其中气凝胶构造有利于获得高载硫电极,层次孔结构则整体提升了材料的电化学性能。
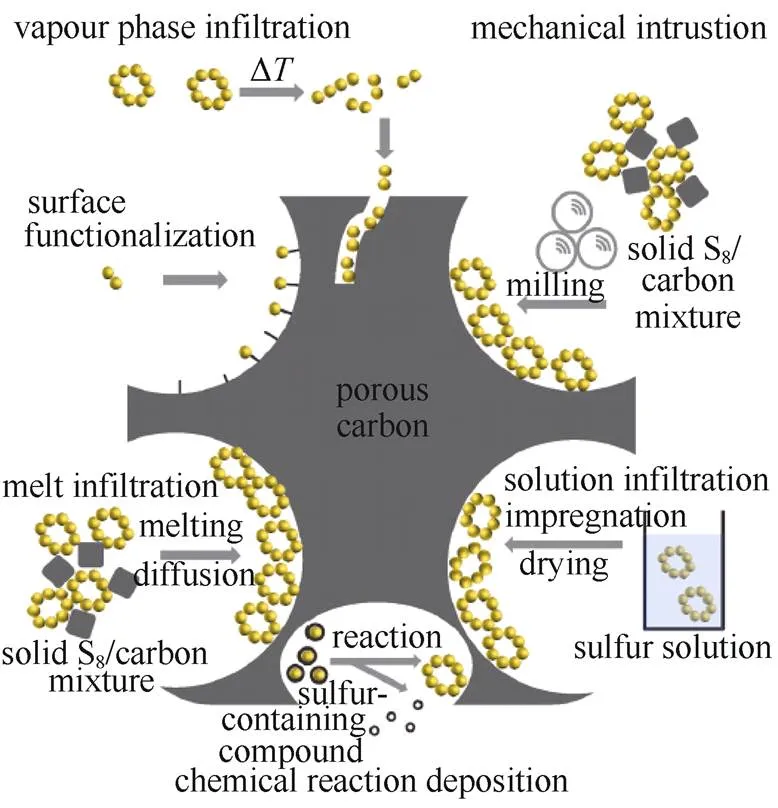
图2 硫碳复合的各种技术路线示意图[12]
一维碳纳米材料因具有较大的比表面积、优异的导电性、热稳定性和力学性能,也成为载硫材料的合适选择。XI等[18]合成了碳纳米管森林阵列,该材料可以对多硫化物产生界面吸附和体积限制,缓冲硫放电产物引起的体积扩张。通过第一性原理计算发现,减少碳纳米管阵列间距能够增强硫碳之间的结合力。由于该材料具有优异的导电性和自我黏合的能力,在硫正极制备时不需要使用传统的黏结剂和导电剂,这有利于提高基于整个电极计算的真实比容量。采用高密度碳纳米管阵列材料制作的复合电极在醚基电解液中展示了良好的性能,经200次循环后电极比容量达到503 mA·h/g,每次循环的容量衰减速率仅为0.054%。GUEON等[19]以聚合物微球为模板制备出具有球形大孔结构的CNT材料,用其作为硫载体,可以实现熔融硫在碳中的充分渗透和均匀分布,有效载硫量达到70%(质量分数),同时具有良好的电化学性能,0.2 C可逆容量高达1343 mA·h/g。近年来研究发现,采用氮等杂原子对碳纳米管或其它碳材料表面进行改性[9, 20-21],可以一定程度上改善碳材料的导电性,同时杂原子还能与硫物种之间产生化学键合或吸附作用。例如MANTHIRAM课题组[22]将羟基化的氮掺杂碳纳米管用作载硫材料(图3),通过表面氮原子/羟基与多硫化物之间的相互作用来减弱“穿梭效应”,复合电极获得优异的循环性能(长达500次循环后容量仍保持有712 mA·h/g)与倍率充放电能力(5 C放电比容量高达849 mA·h/g)。
另一种比较有代表性的是碳纳米纤维材料。JI等[23]以聚丙烯腈/聚甲基丙烯酸甲酯(PAN/PMMA)为前驱体,采用电纺丝-碳化-化学沉积法制备了硫/碳纳米纤维复合材料(S/CNF),CNF具有较高的电导率和较大的比表面积,可以提高硫电极的导电性,实现单质硫的良好分散,并有效吸附硫及抑制多硫化物的溶解,复合材料0.05 C首次放电比容量可达1400 mA·h/g,30次循环后容量保持率为85%。CUI课题组[24]设计了一款使用中空碳纤维内腔完全容硫的复合材料:硫与电解液的接触被限制在碳纤维两头的开口处,因此多硫化物的溶解被极大的限制,而Li+是通过薄碳壁嵌入的,这实现了快速的离子传输。同时碳纤维的中空结构为硫的体积膨胀提供了空间,大的比表面积也为不溶放电产物的沉积提供了位置。因此该复合材料电化学性能发挥优异,经历150次循环后仍具有730 mA·h/g的比容量值。该课题组还通过研究发现[25],硫经锂化后,与碳的化学结合力会显著减小,为此引入两性高分子PVP修饰硫和中空碳纤维的接触界面,该材料与高极性的硫化物以及非极性的碳表面均存在良好的结合作用,这有助于稳定放电产物,改善电池的循环性能。本团队使用空心碳纳米纤维复合单质硫[26],发现一部分硫颗粒位于纤维交织形成的孔洞中,还有一部分进入了纳米纤维的空心通道内。空心碳纳米纤维提供了一个高导、富孔、稳定的三维网络结构,支持电荷的快速传输和离子在电极中的充分渗透,因此综合保障了复合材料的容量、循环和倍率性能。

图3 羟基化氮掺杂碳纳米管/硫复合材料的(a)制备流程示意图和(b)倍率性能测试曲线[22]
石墨烯[27]是由单层碳原子构成的二维材料,具有电导率高、比表面积大、表面易改性等特点。石墨烯可以有效包覆硫颗粒,形成导电网络,保证离子的有效传输,同时其表面含有的一些官能团还有利于吸附多硫化物。JI等[28]首先在微乳液体系中将纳米硫化学沉积在氧化石墨烯纳米片上,然后经155 ℃低温热处理,使得一些外表面的大颗粒硫熔融扩散进入石墨烯孔洞内,同时利用该工序对石墨烯表面官能团进行化学修饰。制得的复合材料具有良好的形貌结构,数十纳米厚的硫均匀包覆在石墨片层表面,其在离子液体电解液中获得了较高的可逆容量和良好的循环性能。GAO等[29]选择Na2S2O3作为硫的前驱体和氧化石墨烯的还原剂,原位制备了核壳结构(石墨烯包裹硫)的硫碳复合材料,其中硫颗粒的尺寸由于PVP表面活性剂的作用被限制在1 μm以内。还原的氧化石墨烯围绕着硫建立了一个良好的导电网络,促进了离子的传输和电荷的传递,其作为外包裹层还能够阻止多硫化物的溶解。DING[30]将还原的氧化石墨烯水凝胶进行KOH化学活化制得具有高的比表面积、大的孔体积和可控孔径分布的石墨烯纳米片,其构建的二维多孔网络结构能够将硫均匀容嵌在纳米孔洞内,因此这些纳米孔洞扮演了电极反应的微反应器角色,抑制了多硫化物的溶解与穿梭。复合材料0.2 C可逆容量达到1379 mA·h/g,且循环性能良好。WANG等[31]采用一步掺杂-还原技术制备了氮掺杂的石墨烯纳米片,由于氮原子与多硫化物之间存在化学作用(可以减少活性物质流失、抑制穿梭效应),且石墨烯框架的导电性由于掺氮得到了增强,复合材料的可逆容量相比未掺氮时显著增加,同时循环性能相当稳定,1 C循环500次后保留的容量达到578 mA·h/g。作者还指出,富含吡啶氮的构造相比吡咯氮等更有利于电化学性能的提升。ZHAO等[32]通过模板定向化学气相沉积法制备了一种新颖的双层结构石墨烯材料,其中双层之间被大量介孔尺寸的凸节所隔开,因此很好地杜绝了石墨烯的堆叠问题,有助于获得高的比表面积和电导率。采用该材料的锂硫电池具有优异的倍率特性,5 C循环1000次后的可逆容量仍高达530 mA·h/g。
3.2 硫/聚合物复合
导电聚合物用作硫载体具有以下3个突出优 点[33]。①聚合物通常具有良好的柔弹性,非常适合应对电极的体积膨胀问题;②聚合物材料一般在较低的温度下化学法合成,制作过程无需使用模板和高温处理;③聚合物长链及自带的官能团对硫物种往往具有较强的物理吸附和化学键合作用。国内杨裕生院士和上海交通大学的王久林教授早期在此领域开展了很多开创性研究。杨院士课题组[34]偏重含硫链的导电高分子(即有机硫化物)研究,如多硫化碳炔、多硫代聚苯胺、多硫代聚苯撑等。这些材料遵循“主链导电、侧链储能”的设计思路,即以导电高分子为主链,发生氧化还原的S—S基团为侧链连接在主链的碳原子上,这有利于正极结构稳定和活性硫物质的限域。王久林教授课题组[35-36]将聚丙烯腈(PAN)与升华硫在280~300 ℃惰性气氛下处理6 h后,PAN被硫脱氢形成类似于聚乙炔那样主链导电但是闭环结构的聚合物,硫嵌入在杂环聚合物结构中,与PAN实现了分子水平的稳定接触。该复合材料在凝胶电解质中50次循环后保留的容量达到600 mA·h/g。

3.3 硫/金属化合物复合
一些金属氧化物作为载体或添加剂材料用于硫电极中,被发现具有提升电极性能的功效。通常金属氧化物扮演以下一种或几种角色:①促进硫氧 化还原反应的催化剂;②多硫化物抑制或吸附剂;③二次活性材料;④混合的电子/离子导体。报道较多的材料有TiO2、La2O3、Al2O3、V2O5等[41-43]。
SEH等[44]设计了一种具有蛋黄-壳结构的TiO2/S复合材料,其将硫填充于TiO2空心壳内,并保留壳内充分的空间应对硫体积膨胀,有利于维护氧化物外壳的结构的完整性,充分发挥其吸附作用抑制多硫化物溶解。复合材料0.5 C首次放电容量达到1030 mA·h/g,循环1000次后仍具有690 mA·h/g,伴随着高达98.4%的库仑效率。DING等[45]将单质硫均匀填充至TiO2介孔通道中制备出TiO2/S复合材料,研究发现,纳米TiO2的强化学键合作用能有效钳制多硫化物,抑制其溶解与穿梭,同时TiO2在电化学过程中嵌锂形成的LiTiO2具有混合的电子/离子导体特征,有利于促进离子传输和电荷传递,因此复合材料循环稳定性良好,1 C循环100次后的容量保持率高达89%。KIM等[46]制备了以磷酸铁锂做包覆层的S/LiFePO4复合材料,该材料提高了活性硫的利用率、降低了不溶产物引起的极化,电池初始比容量达到1200 mA·h/g,90次循环后的容量保持率为80%。在低倍率时,LiFePO4包覆层对电池容量也具有一定的贡献。除此之外,还有一些特殊的金属化合物也得到研究。HAO等[47]制备了S/TiN复合材料,极性TiN颗粒一方面可以通过化学吸附实现高效固硫,改善电池循环性能,另一方面该材料还具备良好的导电性,有利于提高活性材料利用率和电池倍率特性。ZHANG等[48]在KB/S复合材料中掺入少量碘,增强了电池倍率性能,即使在3 C条件下循环100周,保留的可逆容量仍可达479 mA·h/g。作者认为一方面是由于碘掺杂碳改善了材料导电性,另一方面碘在首次放电过程中转化为碘化锂,一部分发生溶解,提高电解液的离子电导率,其余部分被多孔碳吸附、留存在电极中,促进电极内部的离子传导。
3.4 多元复合
为了结合多孔碳、导电聚合物、金属化合物等各种材料的优势,还有一个研究方向是发展多元复合材料[49-51]。
LEE等[52]在CMK-3/S复合材料表面自生长无机金属氧化物薄膜MO(M = Si或V),该膜层一方面属于电子绝缘体,阻止多硫化物在正极表面还原成不可溶亦不可渗透的硫化物阻断层,更重要的是其可以抑制多硫化物的溶解,减少活性材料的损失。其中SiO包覆CMK-3/S复合材料相比不含包覆层时循环性能得到明显改善,但可逆放电容量有所下降,可能是由于氧化物的绝缘性(阻抗增加)所致。MIAO等[53]首先将聚乙二醇(PEG)的高分子链嫁接在乙炔黑颗粒上,然后将单质硫在乙炔黑表面沉积制成三元复合材料。这种新颖结构的复合材料有几方面好处:①装载更多的活性硫;②柔性的PEG链容纳硫的体积膨胀,且由于是插入在硫层中,增强了材料结构的稳定性;③PEG携带的亲水基团增强了导电碳和活性硫的紧密接触,减少多硫化物的溶解。测试结果显示,含硫量为66%的复合材料经过500次的循环后容量保持在577 mA·h/g左右,循环性能表现优异。HUANG等[54]依次将二氧化锰、氧化石墨烯包覆在硫颗粒表面,形成双壳结构的S/MnO2/GO复合材料。蜂窝状MnO2为多硫化物的存储和硫体积的扩张提供了丰富的空间,而外层GO则遮住了MnO2的开口结构,阻止了多硫化物从电极脱出。同时,二者都对提高硫电极电导率有所帮助。因此复合材料具备良好的循环与倍率性能。相似的,LIU等[55]制备了MnO2@CMK/S复合材料,其综合利用了多孔CMK骨架的物理阻隔作用和极性MnO2的化学吸附特性,有力抑制了多硫化物的溶解与扩散,提升了电池性能。YANG等[56]通过简单的超声混合法在CMK-3/S材料表面均匀包覆了一层PEDOT∶PSS,这个聚合物包覆层是一个良好的电子和离子导电体,能够阻止多硫化物从电极中脱出和在电解液中的溶解,抑制穿梭效应,促进更多的多硫化物向Li2S转化,提高活性材料利用率。包覆后材料的首次充放电容量达到1140 mA·h/g,相比包覆前提高了近10%;放电容量经过150次的循环后仍保持有超过600 mA·h/g的容量,而且库仑效率从包覆前的93%提高到包覆后的97%。HE等[57]首先将硫沉积在碳纳米纤维的表面,然后也利用PEDOT/PSS进行外包裹,设计出三层同轴结构的复合材料(图4)。其中,碳纤维提供了良好的导电骨架,柔性聚合物层则阻止了多硫化物向外部扩散,二者协同作用促使复合材料获得了高的可逆容量和良好的循环稳定性,200次循环后容量维持在807 mA·h/g。
4 正极集流体
集流体是用于附着活性物质并传载电流的基体,在重量上通常占到了一颗二次电池的15%~20%,而成本则占到了8%~15%,因此也是电池中的一个重要组成部分。锂硫电池正极通常使用光滑的高纯铝箔作集流体,该箔对活性物质黏附性较弱,当硫电极处于高电位时还易被氧化和腐蚀,影响活性物质的电接触并增加电池极化。为此,各种其它集流体材料得到研究和应用,包括碳纸、碳纳米管、碳纤维布、石墨纸、泡沫镍、泡沫碳等[58-60]。本团队考察了涂碳铝箔作集流体对硫正极性能的影响[61],研究表明,其可增强电极电荷传导,提高活性物质与集流体的黏结强度,抑制电解液对铝箔的腐蚀,从而提高了硫材料利用率,改善了循环性能。其中由片状炭黑与颗粒炭黑混合构建的具有“点-面”结合架构的涂碳箔,在整体性质上优于仅附着颗粒炭黑的涂碳箔。

图4(a)CF/S/PEDOT复合材料制备过程演示;(b)CF/S/ PEDOT复合电极的工作机理示意图[57]
相比传统2D型,3D多孔集流体更适用于锂硫电池的实际情况。一方面其具有容纳活性硫(适合制作高载硫电极)和吸附多硫化物的特殊功能,能够稳定活性材料、电解液和电极内的电化学反应,对于抑制穿梭效应、减少活性物质损失很有帮助。另一方面,构建的3D导电网络能够增强活性材料与集流体的电接触,形成电子快速传输通道,降低电极阻抗[62]。因此,多孔集流体应满足两个要求:①必须拥有高的电导率来实现电子快速迁移,从而提高活性材料的利用率;②必须拥有丰富的多孔空间来容纳活性材料和多硫化物。为了充分发挥多孔集流体的特点与优势,需对其多孔结构进行合理设计。整体而言,微孔/介孔/大孔并存的空间体系可能是比较合适的。其中,微孔用于钳制和吸附活性材料,小介孔在此方面进一步辅助微孔,大介孔加速电荷传递,同时与大孔一起吸附电解液,使得溶解的多硫化物能留存在电极内。大孔则一般来源于纤维交织所形成的架构,用于进一步支持电极内的电子传输通道。通过上述各孔之间的分工与合作,电化学反应能够在正极区域内稳定下来,活性材料的损失也能够被控制住[62]。

5 正极涂层
随着研究的深入,人们逐步发现,与其采用复杂手段从电极内部开展复合改性,不如从外部结构探索构建新型电极的方法。这一途径具有效果显著、普适性强、制备成本可控、工艺易于实现等优点。特别是在正极表面构筑修饰涂层,不仅能够很好的保护正极结构,而且可以物理阻挡多硫化物溶出[67-69]。
CHOI等[70]在硫正极表面喷镀了厚度约180埃的导电碳涂层,发现与不含涂层的正极相比,电池放电容量与循环能力均得到了提高,作者认为碳表面层起到了增强电极电接触和吸附多硫化物的双重作用。TANG等[71]将在燃料电池中广泛用作隔膜的Nafion材料制成溶液涂覆于硫电极表面。Nafion涂层的离子选择性(阳离子可导、阴离子不可导)允许锂离子渗透但阻止多硫化物穿过,因此可减少穿梭效应和活性物质损失。同时该涂层有利于增强电极的电化学稳定性与可逆性。电极初始容量达到1084 mA·h/g,库仑效率接近100%,循环100周后保留的容量高达879 mA·h/g。ZHANG等[72]构建了一个具有聚丙烯酸(PAA)表面涂层的硫电极。当被液态电解液活化后,这个多孔PAA涂层产生凝胶化。由于凝胶化的PAA所携带的COOH官能团可以与负电性的多硫根离子形成氢键作用,因此可以化学阻碍多硫化物往电极外扩散。电化学测试结果表明,PAA凝胶涂层延长了锂硫电池的循环寿命。SONG等[73]将EDOT单体作为添加剂加入电解液中,当预充电(小电流充电至4V)时,EDOT发生电氧化聚合,在CMK-3/S复合电极表面生成PEDOT。这一原位形成的电极表层起到了阻挡多硫化物、抑制穿梭效应的作用,同时阻止了多硫化物与电解液之间的副反应、抑制了电解液分解,因此显著提高了电池的循环稳定性。JIN等[74]在电解液中添加1%(质量分数) La(NO3)3,亲电子性的La3+与亲质子性的多硫化物发生反应[4Li2S+2La (NO3)3→La2S3+Li2S+6LiNO3],在电极表面原位形成的La2S3层一方面通过La—S和S—S键化学吸附多硫化物,另一方面还可以抑制Li2S结晶、促进电极中锂离子的传输。而另一反应副产物LiNO3则在负极表面形成SEI,进一步阻止多硫化物的穿梭。通过这一新颖的电极结构设计,锂硫电池获得了良好的循环与倍率性能。JIN等[75]将锂离子导体陶瓷粉末LAGP与导电碳混合后制成具有混合导电特性的硫正极涂层,极大抑制了多硫化物的迁移,增强了电池的循环稳定性。具有涂层保护结构的硫电极在0.5 C循环100次后仍维持了高达842 mA·h/g的容量,而采用该电极组装的软包电池倍率性能也比较优异,在10 A/g电流密度下释放的容量达到 355 mA·h/g。本团队将含有聚丙烯酰胺(PAM)和混合导电炭黑成分的商业化导电浆料涂覆于硫正极表面[76],所构筑涂层不仅可以物理阻碍多硫化物,而且PAM携带的官能团与正极中的含硫物种存在化学作用力,能够将多硫化物化学锚定在正极结构内,体现了物理阻硫与化学钳硫的双重功能。而且该涂层提供的柔性、高导表面能够适应电极的体积膨胀、减少电荷转移阻抗。电化学性能测试表明,PAM/C涂层电极较之传统的PVDF/C涂层电极在性能发挥上更具优势,0.2 C首次放电容量高达1351 mA·h/g,经300次循环后容量仍能维持约900 mA·h/g。

图5(a)电化学沉积技术在泡沫镍上制备纳米硫的过程示意图;(b)纳米硫点的高分辨率透镜照片;(c)纳米硫电极与普通硫电极的循环性能比较[65]
6 正极黏结剂
黏结剂作为电极辅助材料一部分,虽然在电极中占比不超过10%(质量分数),但对电池的各项性能存在着较大影响。在传统锂离子电池中,黏结剂最基本的功能是增强活性材料与导电剂的接触,同时将这些材料牢固粘附在集流体上。然而对于 锂硫电池而言,黏结剂还应满足以下几点要求[77]:①作为一个有效的分散剂,对单质硫和导电碳均匀分散;②低内阻;③具有缓冲硫电极体积变化、稳定电极结构的能力;④能够抑制多硫化物的溶解。此外,为了顺应锂硫电池低成本、无毒等特点,选择的黏结剂应该是成本经济、环境友好和易于加工制作的。
PVDF是在锂离子电池中得到广泛应用的一款黏结剂材料,具有良好的黏结性和电化学稳定性。然而它用在锂硫电池中不甚理想,一是由于其绝缘性增加硫电极电阻;二是高温下存在体积膨胀或者在电解液中的溶胀问题,对电极结构造成一定的破坏;再者,它经常需要与有机溶剂NMP搭配使用,后者具有毒性和环境污染性,不宜挥发,且价格较贵。为此,学者们尝试将各种新型黏结剂体系替代PVDF用于构筑硫电极,包括海藻酸钠、明胶、聚丙烯酸、淀粉等[78-81]。根据所使用的溶剂体系不同,黏结剂分为油性和水性两种,其中水性黏结剂在成本、环保与安全性等方面相比油性黏结剂更具优势。
早期解放量防化研究院在硫电极中使用明 胶[82],发现该材料一方面黏结性强,可以保证硫电极结构的循环稳定性;另一方面对硫活性材料及其还原产物可以进行有效分散,阻止循环期间的团聚;此外,明胶在常规有机电解液中几乎不会溶胀,可以确保正极材料与集流体之间的良好电接触,减少极化阻抗。采用明胶黏结剂的硫电极相比PEO黏结剂电极具有更优异的循环性能。该课题组还进一步采用冷冻干燥法制备基于明胶黏结剂的硫电极[83],在极低温度下进行真空干燥后,电极表面由于明胶冰晶的消失形成了大量孔洞,这有利于增大电极与电解液的接触面积、促进离子的迁移和扩散,同时对电极在充放电过程中的体积变化起到缓冲作用,测试表明这种多孔硫电极首次放电容量达到了1235 mA·h/g,50次循环后仍具有626 mA·h/g,循环性能明显优于普通升温干燥法制备的电极。LACEY等[84]使用PEO混合PVP的黏结体系,电池以0.2 C充放电循环50次后放电容量仍高达1000 mA·h/g,作者认为这是二者共同的作用贡献所致:PEO促进了多硫化物的快速反应、提高了电池容量,而PVP通过与多硫化物形成络合物的方式,将多硫化物钳制在正极附近,提高了电池循环的稳定性。LU等[85]使用水性黏结剂果阿胶(GG)代替PVDF,显著改善了硫电极的容量发挥和循环性能。由于GG与硫物种之间存在相互作用,因此可以一定程度上抑制穿梭效应。而且该黏结剂在电解液中溶胀/溶解性低,相比PVDF具有更高的黏度和维 氏硬度,能够适应循环过程中电极体积变化。PAN等[86]将PAA和PEDOT∶PSS的复合体系用于构筑硫电极。其中PEDOT∶PSS提供了良好的导电性,可以促进电极中的电荷传递,同时对多硫化物具有一定的吸附作用,而PAA改善了硫电极的锂离子传输性能。当PAA/PEDOT∶PSS质量比达到2∶3时,电极在0.5 C充放电循环80次后保留的容量仍达到 830 mA·h/g,优于使用单组分黏结剂的循环效果。AI等[87]系统考察了4款具有不同化学与电学性质的功能黏结剂(PFM、PVP、PEDOT、PVDF,图6),发现构筑的硫电极在形貌、组成和电化学特征等方面差异明显。使用PFM、PVP等材料时,由于所含羰基官能团与硫物种之间具有较高的结合能,能够为固态产物提供优先反应位置,因此在充电和放电态时电极中均发现更多的硫物种沉积。这有利于抑制穿梭效应、减少自放电损失和维持电极长期循环的稳定性。而使用具有导电性质的黏结剂时,为电化学反应提供了更大的表面积,也有利于固相硫物种的沉积。可见无论是黏结剂的官能团结构还是电导率,都会促使更多的硫向固相转移,进而促进电池性能提升。其中PFM由于同时具有需要的官能团结构和高的电导率,所构筑电极展示了最好的循环性能和自放电抑制能力。

图6 (a)四款不同黏结剂的化学结构式;(b)不同黏结剂制作硫正极的循环性能与自放电性能比较[87]
Fig.6 (a) Chemical structures of the four different binders; (b) cycling performance at C/10 and self-discharge performance of cathodes with different binders[87]
7 正极添加剂
一些特殊的正极添加剂也得到研究与报道。这些材料虽然用量较少,但往往效果很明显。正极添加剂通常具有以下两个功能[77]:①增加电极中离子和/或电子电导率;②吸附多硫化物,阻止其向电解液溶解与扩散。需要说明的是,为了和前述的正极复合材料区分清楚,这里所提的添加剂仅指在正极片(而非正极复合材料)制作过程中添加的少量功能材料。
CHOI等[88]在单质硫电极中添加少量碳纳米纤维作为辅助导电组分,相比未作添加的硫电极,放电容量和循环性能均得到明显改善,这是由于碳纳米纤维促进了电极导电网络的形成,同时阻止了活性硫和不溶固态产物的团聚。SONG等[89]将通过溶胶-凝胶法制备的Mg0.6Ni0.4O纳米材料添加到单质硫电极中,改善了硫电极的多孔性,便利于电解液的渗透,更重要的是它的强物理吸附作用抑制了多硫化物从电极中的脱出和溶解,因此电池的放电容量、循环性能和倍率性能均得到改善。XIE等[90]将10%左右的铁电材料BaTiO3(BTO)添加至硫电极中,由于BTO纳米颗粒自身的极性形成了内电场,充放电过程中产生的多硫化物被吸附在BTO附近,因而极大地抑制了穿梭效应,改善了电池性能。这一新颖的阻硫策略操作简便、易于实现,具有良好的应用前景。PENG等[91]采用球磨法在电极中加入少量锂盐LiTFSI,发现这可以提高电极中的锂离子电导率,扩大绝缘硫颗粒周围的离子交换区域,增强电极/电解液界面的电化学反应动力学,因此减少了活性物质的损失,提高了放电比容量。
8 结 语
锂硫电池虽然被认为是极具发展潜力的高能二次电池,但是活性物质利用率低、循环寿命短、倍率性差等问题,极大制约了其实际应用和产业发展。如何进一步提高电池容量、改善循环稳定性与功率特性,成为该电池研究开发的关键。结合当前研究现状,对于锂硫电池的下一步发展,有以下两点建议或展望。
(1)正极始终是决定电池性能的首要因素,提升电池性能理应首先从正极考虑。绝缘硫必须与导电相结合,碳材料良好的导电性、经济性与结构可设计性,使得其成为与硫搭档最为合适的选择。而针对多硫化物的溶解与穿梭问题,在正极表面设计阻挡层也被证明是非常有效的抑制手段。但是这些研究方法都需要注意的一个问题——真实能量密度的发挥水平。任何时候提起能量密度这个指标,必定是考虑整个电池体系,如果仅针对单一活性材料来谈容量突破可能具有研究价值,但并没有实用意义。因此硫正极的设计必须以尽量减少非活性组分的重量和体积为原则,包括引入各种导电相、附加涂层或辅料时。这需要对正极的结构组成不断进行改进与优化,以最大程度发挥各组分的协同作用。
(2)电池作为一个多组件构成的体系,任何一个环节都与其性能有着千丝万缕的联系。换句话说,电池性能取得突破,离不开任何一个环节的贡献。正因为如此,我们的研究目光不应局限于正极材料,而应有更多的发散关注,包括电极辅材、隔膜、电解液、负极甚至极耳、外包装等。例如多硫化物的溶解与穿梭,其实与电解液关系更大,有时从电解液入手,往往比正极改性更有效。再来看锂枝晶问题,我们更应从负极或者隔膜的角度下功夫,如采用非锂负极或者全固态电解质,这一安全隐患也许能迎刃而解。
需要承认的是,近几十年来,锂硫电池材料与制作技术已取得长足进步,综合性能相比以前也有了很大提升。在国内外研究者的长期、持续推动下,相信不久的将来,锂硫电池必将迎来历史性突破,最终成功实现商业化。
[1] SEH Z W, SUN Y, ZHANG Q, et al. Designing high-energy lithium-sulfur batteries[J]. Chemical Society Reviews, 2016, 45(20): 5605-5634.
[2] 刁岩, 谢凯, 洪晓斌,等. Li-S 电池硫正极性能衰减机理分析及研究现状概述[J]. 化学学报, 2013, 71(4): 508-518.
DIAO Yan, XIE Kai, HONG Xiaobin, et al. Analysis of the sulfur cathode capacity fading mechanism and review of the latest development for Li-S battery[J]. Acta Chimica Sinica, 2013, 71(4): 508-518.
[3] ZHANG S S. Liquid electrolyte lithium/sulfur battery: Fundamental chemistry, problems, and solutions[J]. Journal of Power Sources, 2013, 231: 153-162.
[4] OGOKE O, WU G, WANG X, et al. Effective strategies for stabilizing sulfur for advanced lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2017, 5(2): 448-469.
[5] KANG W, DENG N, JU J, et al. A review of recent developments in rechargeable lithium-sulfur batteries[J]. Nanoscale, 2016, 8(37): 16541-16588.
[6] 刘帅, 姚路, 章琴, 等. 高性能锂硫电池研究进展[J]. 物理化学学报, 2017, 33(12): 2339-2358.
LIU Shuai, YAO Lu, ZHANG Qin, et al. Advances in high-performance lithium-sulfur batteries[J]. Acta Physico-Chimica Sinica, 2017, 33(12): 2339-2358.
[7] LIANG J, SUN Z H, LI F, et al. Carbon materials for Li-S batteries: Functional evolution and performance improvement[J]. Energy Storage Materials, 2016, 2: 76-106.
[8] YANG Y, ZHENG G, CUI Y. Nanostructured sulfur cathodes[J]. Chemical Society Reviews, 2013, 42(7): 3018-3032.
[9] CAI J, WU C, ZHU Y, et al. Sulfur impregnated N, P co-doped hierarchical porous carbon as cathode for high performance Li-S batteries[J]. Journal of Power Sources, 2017, 341: 165-174.
[10] QIN F, WANG X, ZHANG K, et al. High areal capacity cathode and electrolyte reservoir render practical Li-S batteries[J]. Nano Energy, 2017, 38: 137-146.
[11] CHONG W G, HUANG J Q, XU Z L, et al. Lithium-sulfur battery cable made from ultralight, flexible graphene/carbon nanotube/sulfur composite fibers[J]. Advanced Functional Materials, 2017, 27(4): 1604815.
[12] BORCHARDT L, OSCHATZ M, KASKEL S. Carbon materials for lithium sulfur batteries-ten critical questions[J]. Chemistry-A European Journal, 2016, 22(22): 7324-7351.
[13] JI X, LEE K T NAZAR L F. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nature Materials, 2009, 8(6): 500-506.
[14] HE G, JI X, NAZAR L. High “C” rate Li-S cathodes: Sulfur imbibed bimodal porous carbons[J]. Energy & Environmental Science, 2011, 4(8): 2878-2883.
[15] HU L, LU Y, LI X, et al. Optimization of microporous carbon structures for lithium-sulfur battery applications in carbonate-based electrolyte[J]. Small, 2017, 13: 1603533.
[16] ZHAO C, LIU L, ZHAO H, et al. Sulfur-infiltrated porous carbon microspheres with controllable multi-modal pore size distribution for high energy lithium-sulfur batteries[J]. Nanoscale, 2014, 6(2): 882-888.
[17] ZHANG K, QIN F, LAI Y, et al. Efficient fabrication of hierarchically porous graphene-derived aerogel and its application in lithium sulfur battery[J]. ACS Applied Materials & Interfaces, 2016, 8(9): 6072-6081.
[18] XI K, CHEN B, LI H, et al. Soluble polysulphide sorption using carbon nanotube forest for enhancing cycle performance in a lithium-sulphur battery[J]. Nano Energy, 2015, 12: 538-546.
[19] GUEON D, HWANG J T, YANG S B, et al. Spherical macroporous carbon nanotube particles with ultrahigh sulfur loading for lithium-sulfur battery cathodes[J]. ACS Nano, 2018, 12(1): 226-233.
[20] SUN F, WANG J, CHEN H, et al. High efficiency immobilization of sulfur on nitrogen-enriched mesoporous carbons for Li-S batteries[J]. ACS Applied Materials & Interfaces, 2013, 5(12): 5630-5638.
[21] YU M, MA J, XIE M, et al. Freestanding and sandwich-structured electrode material with high areal mass loading for long-life lithium-sulfur batteries[J]. Advanced Energy Materials, 2017, 7(11): 1602347.
[22] LEE J S, MANTHIRAM A. Hydroxylated N-doped carbon nanotube-sulfur composites as cathodes for high-performance lithium-sulfur batteries[J]. Journal of Power Sources, 2017, 343: 54-59.
[23] JI L, RAO M, ALONI S, et al. Porous carbon nanofiber-sulfur composite electrodes for lithium/sulfur cells[J]. Energy & Environmental Science, 2011, 4(12): 5053-5059.
[24] ZHENG G, YANG Y, CHA J J, et al. Hollow carbon nanofiber-encapsulated sulfur cathodes for high specific capacity rechargeable lithium batteries[J]. Nano Letters, 2011, 11(10): 4462-4467.
[25] ZHENG G, ZHANG Q, CHA J J, et al. Amphiphilic surface modification of hollow carbon nanofibers for improved cycle life of lithium sulfur batteries[J]. Nano Letters, 2013, 13(3): 1265-1270.
[26] YUAN Y, LU H, FANG Z, et al. Preparation and performance of sulfur-carbon composite based on hollow carbon nanofiber for lithium-sulfur batteries[J]. Ionics, 2016, 22(9): 1509-1515.
[27] RACCICHINI R, VARZI A, PASSERINI S, et al. The role of graphene for electrochemical energy storage[J]. Nature Materials, 2015, 14: 271-279
[28] JI L, RAO M, ZHENG H, et al. Graphene oxide as a sulfur immobilizer in high performance lithium/sulfur cells[J]. Journal of the America Chemical Society, 2011, 133(46): 18522-18525.
[29] GAO X, LI J, GUAN D, et al. A scalable graphene sulfur composite synthesis for rechargeable lithium batteries with good capacity and excellent columbic efficiency[J]. ACS Applied Materials & Interfaces, 2014, 6(6): 4154-4159.
[30] DING B, YUAN C, SHEN L, et al. Chemically tailoring the nanostructure of graphenenanosheets to confine sulfur for high-performance lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2013, 1(4): 1096-1101.
[31] WANG X, ZHANG Z, QU Y, et al. Nitrogen-doped graphene/sulfur composite as cathode material for high capacity lithium-sulfur batteries[J]. Journal of Power Sources, 2014, 256: 361-368.
[32] ZHAO M Q, ZHANG Q, HUANG J Q, et al. Unstacked double-layer templated graphene for high-rate lithium-sulphur batteries[J]. Nature Communications, 2014, 5: 3410-3417.
[33] CHENG H, WANG S. Recent progress in polymer/sulphur composites as cathodes for rechargeable lithium-sulphur batteries[J]. Journal of Materials Chemistry A, 2014, 2(34): 13783-13794.
[34] 王维坤, 余仲宝, 苑克国, 等. 高比能锂硫电池关键材料的研究[J]. 化学进展, 2011, 23 (2/3): 540-547.
WANG Weikun, YU Zhongbao, YUAN Keguo, et al. Key materials of high energy lithium sulfur batteries[J]. Progress in Chemistry, 2011, 23(2/3): 540-547.
[35] WANG J, YANG J, XIE J, et al. A novel conductive polymer-sulfur composite cathode material for rechargeable lithium batteries[J]. Advanced Materials, 2002, 14(13/14): 963-965.
[36] WANG J, YANG J, WAN C, et al. Sulfur composite cathode materials for rechargeable lithium batteries[J]. Advanced Functional Materials, 2003, 13(6): 487-492.
[37] ZHOU W, YU Y, CHEN H, et al. Yolk-shell structure of polyaniline-coated sulfur for lithium-sulfur batteries[J]. Journal of the America Chemical Society, 2013, 135(44): 16736-16743.
[38] LI W, ZHANG Q, ZHENG G, et al. Understanding the role of different conductive polymers in improving the nanostructured sulfur cathode performance[J]. Nano Letters, 2013, 13(11): 5534-5540.
[39] LIM S, THANKAMONY R L, YIM T, et al. Surface modification of sulfur electrodes by chemically anchored cross-linked polymer coating for lithium-sulfur batteries[J]. ACS Applied Materials & Interfaces, 2015, 7(3): 1401-1405.
[40] SUN Z, XIAO M, WANG S, et al. Electrostatic shield effect: An effective way to suppress dissolution of polysulfide anions in lithium-sulfur battery[J]. Journal of Materials Chemistry A, 2014, 2(38): 15938-15944.
[41] JI X, EVERS S, BLACK R, et al. Stabilizing lithium-sulphur cathodes using polysulphide reservoirs[J]. Nature Communications, 2011, 2: 325-341.
[42] LI J, DING B, XU G, et al. Enhanced cycling performance and electrochemical reversibility of a novel sulfur-impregnated mesoporous hollow TiO2sphere cathode for advanced Li-S batteries[J]. Nanoscale, 2013, 5: 5743-5746.
[43] ZHANG X, XIE H, KIM C S, et al. Advances in lithium-sulfur batteries[J]. Materials Science and Engineering, 2017, 121: 1-29.
[44] WEI S Z, LI W, CHA J J, et al. Sulphur-TiO2yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries[J]. Nature Communications, 2013, 4: 1331-1336.
[45] DING B, SHEN L, XU G, et al. Encapsulating sulfur into mesoporous TiO2host as a high performance cathode for lithium-sulfur battery[J]. Electrochimica Acta, 2013, 107: 78-84.
[46] KIM C S, GUERFI A, HOVINGTON P, et al. Facile dry synthesis of sulfur-LiFePO4core-shell composite for the scalable fabrication of lithium/sulfur batteries[J]. Electrochemistry Communications, 2013, 32: 35-38.
[47] HAO Z, YUAN L, CHEN C, et al. TiN as a simple and efficient polysulfide immobilizer for lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2016, 4(45): 17711-17717.
[48] ZHANG H, ZUO P, HUA J, et al. Improved rate performance of lithium sulfur batteries by-anchoring of lithium iodide in carbon/sulfur cathode[J]. Electrochimica Acta, 2017, 238: 257-262.
[49] SU D, CORTIE M, FAN H, et al. Prussian blue nanocubes with an open framework structure coated with pedot as high-capacity cathodes for lithium-sulfur batteries[J]. Advanced Materials, 2017, 29: 1700587.
[50] SUN Z, ZHANG J, YIN L, et al. Conductive porous vanadium nitride/graphene composite as chemical anchor of polysulfides for lithium-sulfur batteries[J]. Nature Communications, 2017, 8: 14627-14634.
[51] ZHENG C, NIU S, LV W, et al. Propelling polysulfides transformation for high-rate and long-life lithium-sulfur batteries[J]. Nano Energy, 2017, 33: 306-312.
[52] LEE K T, BLACK R, YIM T, et al. Surface-initiated growth of thin oxide coatings for Li-sulfur battery cathodes[J]. Advanced Energy Materials, 2012, 2(12): 1490-1496.
[53] MIAO L X, WANG W K, WANG A B, et al. A high sulfur content composite with core–shell structure as cathode material for Li-S batteries[J]. Journal of Materials Chemistry A, 2013, 1(38): 11659-11664.
[54] HUANG X, SHI K, YANG J, et al. MnO2-GO double-shelled sulfur (S@MnO2@GO) as a cathode for Li-S batteries with improved rate capability and cyclic performance[J]. Journal of Power Sources, 2017, 356: 72-79.
[55] LIU J, WANG C, LIU B, et al. Rational synthesis of MnO2@CMK/S composite as cathode materials for lithium-sulfur batteries[J]. Materials Letters, 2017, 195: 236-239.
[56] YANG Y, YU G, CHA J J, et al. Improving the performance of lithium-sulfur batteries by conductive polymer coating[J]. ACS Nano, 2011, 5(11): 9187-9193.
[57] HE F, YE J, CAO Y, et al. Coaxial three-layered carbon/sulfur/polymer nanofibers with high sulfur content and high utilization for lithium-sulfur batteries[J]. ACS Applied Materials & Interfaces, 2017, 9(13): 11626-11633.
[58] ZHOU G, PEI S, LI L, et al. A graphene–pure-sulfur sandwich structure for ultrafast, long-life lithium-sulfur batteries[J]. Advanced Materials, 2014, 26: 625-631.
[59] FANG R, ZHAO S, PEI S, et al. Toward more reliable lithium-sulfur batteries: An all-graphene cathode structure[J]. ACS Nano, 2016, 10(9): 8676-8682.
[60] XI K, KIDAMBI P R, CHEN R, et al. Binder free three-dimensional sulphur/few-layer graphene foam cathode with enhanced high-rate capability for rechargeable lithium sulphur batteries[J]. Nanoscale, 2014, 6(11): 5746-5753.
[61] LI T, HONG B, CAO H, et al. Carbon-coated aluminum foil as current collector for improving the performance of lithium sulfur batteries[J]. International Journal of Electrochemical Science, 2017,12(4): 3099-3108.
[62] MANTHIRAM A, FU Y, CHUNG S H, et al. Rechargeable lithium-sulfur batteries[J]. Chemical Reviews, 2014, 114(23): 11751-11787.
[63] CHUNG S H, MANTHIRAM A. Low-cost, porous carbon current collector with high sulfur loading for lithium-sulfur batteries[J]. Electrochemistry Communications, 2014, 38: 91-95.
[64] WALUŚ S, BARCHASZ C, BOUCHET R, et al. Investigation of non-woven carbon paper as a current collector for sulfur positive electrode-understanding of the mechanism and potential applications for Li/S batteries[J]. Electrochimica Acta, 2016, 211: 697-703.
[65] ZHAO Q, HU X, ZHANG K, et al. Sulfur nanodots electrodeposited on Ni foam as high-performance cathode for Li-S batteries[J]. Nano Letters, 2015, 15(1): 721-726.
[66] LIU L J, CHEN Y, ZHANG Z F, et al. Electrochemical reaction of sulfur cathodes with Ni foam current collector in Li-S batteries[J]. Journal of Power Sources, 2016, 325: 301-305.
[67] OH S J, LEE J K, YOON W Y. Preventing the dissolution of lithium polysulfides in lithium-sulfur cells by using Nafion-coated cathodes[J]. Chemsuschem, 2015, 7(9): 2562-2566
[68] ZHANG M, MENG Q, AHMAD A, et al. Poly(3,4- ethylenedioxythiophene)-coated sulfur for flexible and binder-free cathodes of lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2017, 5(33): 17647-17652.
[69] FANG J, QIN F, LI J, et al. Improved performance of sulfur cathode by an easy and scale-up coating strategy[J]. Journal of Power Sources, 2015, 297: 265-270.
[70] CHOI Y J, CHUNG Y D, BAEK C Y, et al. Effects of carbon coating on the electrochemical properties of sulfur cathode for lithium/sulfur cell[J]. Journal of Power Sources, 2008, 184(2): 548-552.
[71] TANG Q, SHAN Z, WANG L, et al. Nafion coated sulfur-carbon electrode for high performance lithium-sulfur batteries[J]. Journal of Power Sources, 2014, 246: 253-259.
[72] ZHANG S S, TRAN D T, ZHANG Z. Poly(acrylic acid) gel as a polysulphide blocking layer for high-performance lithium/sulphur battery[J]. Journal of Materials Chemistry A, 2014, 2(43): 18288-18292.
[73] SONG J, NOH H, LEE J, et al.coating of poly (3,4- ethylenedioxythiophene) on sulfur cathode for high performance lithium-sulfur batteries[J]. Journal of Power Sources, 2016, 332: 72-78.
[74] JIN L, LI G, LIU B, et al. A novel strategy for high-stability lithium sulfur batteries byformation of polysulfide adsorptive- blocking layer[J]. Journal of Power Sources, 2017, 355: 147-153.
[75] JIN J, WEN Z, WANG Q, et al. Protected sulfur cathode with mixed conductive coating layer for lithium sulfur battery[J]. JOM, 2016, 68(10): 2601-2606.
[76] LI T, YUAN Y, HONG B, et al. Hybrid polyacrylamide/carbon coating on sulfur cathode for advanced lithium sulfur battery[J]. Electrochimica Acta, 2017, 244: 192-198.
[77] CHEN L, SHAW L L. Recent advances in lithium-sulfur batteries[J]. Journal of Power Sources, 2014, 267: 770-783.
[78] XU G, YAN Q, KUSHIMA A, et al. Conductive graphene oxide-polyacrylic acid (GOPAA) binder for lithium-sulfur battery[J]. Nano Energy, 2017, 31: 568-574.
[79] LING M, ZHANG L, ZHENG T, et al. Nucleophilic substitution between polysulfides and binders unexpectedly stabilizing lithium sulfur battery[J]. Nano Energy, 2017, 38: 82-90.
[80] DUAN X, HAN Y, LI Y, et al. Improved capacity retention of low cost sulfur cathodes enabled by a novel starch binder derived from food[J]. RSC Advances, 2014, 4(105): 60995-61000.
[81] ZHONG Y J, LIU Z, ZHENG X, et al. Rate performance enhanced Li/S batteries with a Li ion conductive gel-binder[J]. Solid State Ionics, 2016, 289: 23-27.
[82] SUN J, HUANG Y, WANG W, et al. Application of gelatin as a binder for the sulfur cathode in lithium-sulfur batteries[J]. Electrochimica Acta, 2008, 53(24): 7084-7088.
[83] SUN J, HUANG Y, WANG W, et al. Preparation and electrochemical characterization of the porous sulfur cathode using a gelatin binder[J]. Electrochemistry Communications, 2008, 10(6): 930-933.
[84] LACEY M J, JESCHULL F, EDSTR M K, et al. Functional, water-soluble binders for improved capacity and stability of lithium-sulfur batteries[J]. Journal of Power Sources, 2014, 264: 8-14.
[85] LU Y Q, LI J T, PENG X X, et al. Achieving high capacity retention in lithium-sulfur batteries with an aqueous binder[J]. Electrochemistry Communications, 2016, 72: 79-82.
[86] PAN J, XU G, DING B, et al. PAA/PEDOT:PSS as a multifunctional, water-soluble binder to improve the capacity and stability of lithium-sulfur batteries[J]. RSC Advances, 2016, 6(47): 40650-40655.
[87] AI G, DAI Y, YE Y, et al. Investigation of surface effects through the application of the functional binders in lithium sulfur batteries[J]. Nano Energy, 2015, 16: 28-37.
[88] CHOI Y J, KIM K W, AHN H J, et al. Improvement of cycle property of sulfur electrode for lithium/sulfur battery[J]. Journal of Alloys and Compounds, 2008, 449(1/2): 313-316.
[89] SONG M S, HAN S C, KIM H S, et al. Effects of nanosized adsorbing material on electrochemical properties of sulfur cathodes for Li-S secondary batteries[J]. Journal of the Electrochemical Society, 2004, 151(6): A791-A795.
[90] XIE K, YOU Y, YUAN K, et al. Ferroelectric-enhanced polysulfide trapping for lithium-sulfur battery improvement[J]. Advanced Materials, 2017, doi: 10.1002/adma.201604724.
[91] PENG Z, LI R, GAO J, et al. Effective sulfur-salt composite cathode containing lithium bis(trifluoromethane) sulfonamide for lithium sulfur batteries[J]. Electrochimica Acta, 2016, 220: 130-136.
Research progress on sulfur cathode of lithium sulfur battery
YUAN Yan1, ZHENG Dongdong1, FANG Zhao1, LIU Manbo1, LI Tao2
(1School of Metallurgical Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, Shaanxi, China;2School of Metallurgy and Environment, Central South University, Changsha 410083, Hunan, China)
Lithium sulfur (Li-S) battery has become a hotspot of next-generation high-performance secondary batteries in recent years, by virtue of the advantages of high energy density, low cost, favorable environmental friendliness. However, low utilization of active materials, rapid capacity decay and serious self-discharge greatly hindered its practical application. Since cathode is a key component of rechargeable battery, it is very necessary to design and construct rationally the constitution and structure of sulfur cathode for improving the cell performances. In this paper, basic principles, existent problems and solving approaches of Li-S battery were analyzed at first. Then, the research progresses on active material, current collector, coating layer, binder and additive of sulfur cathode were reviewed. Finally, the further developing prospects of the battery were discussed. It is pointed out that more attention should be paid to real energy density of sulfur cathode, and research scope of Li-S battery should not be limited to cathode material.
lithium sulfur battery; polysulfide; cathode material; current collector; coating; binder
10.12028/j.issn.2095-4239.2018.0029
O 646;TM 911
A
2095-4239(2018)04-0618-13
2018-02-11;
2018-03-18。
国家自然科学基金项目(51704222和51574191),陕西省自然科学基础研究计划青年人才项目(2016JQ5040),陕西省教育厅专项科研计划项目(17JK0427)。
袁艳(1982—),女,博士,讲师,研究方向为新能源材料与器件,E-mail:lingyi21@126.com。
