脂多糖刺激下骨髓间充质干细胞分泌的外泌体对Ly6C单核巨噬细胞亚群的影响
2018-07-04傅小媚林潮金秦爱萍杨翔宇李晓红余细勇
霍 然,傅小媚,邓 赛,林潮金,王 萍,秦爱萍,杨翔宇,李晓红,余细勇
( 1. 南方医科大学药学院,广东 广州 510515;2. 广东省人民医院医学研究中心,广东省医学科学院,广东 广州 510080;3. 广州医科大学药学院分子临床药理学重点实验室,广东 广州 511436)
单核巨噬细胞(monocytes/macrophages, MC/MΦ)作为机体固有免疫细胞,在炎症及免疫反应中扮演重要角色。小鼠中存在2个单核细胞亚群,可以通过淋巴细胞抗原6C(lymphocyte antigen 6C, Ly6C)的表达不同来区分。Ly6C高表达的单核细胞(Ly6Chigh单核细胞)具有促炎和抗菌功能,同时高表达C-C趋化因子受体2和低表达CX3C趋化因子受体1(CCR2highCX3CR1low),这些Ly6Chigh单核细胞能够运输抗原到淋巴结,并积聚在炎症部位,分泌促炎因子如白介素-6(interleukin-6,IL-6)等。Ly6C低表达的单核细胞(Ly6Clow单核细胞)也称为巡逻单核细胞,通过不断沿着血管腔爬行来检查脉管系统,表达高水平的抑炎因子如IL-10等,参与机体免疫调节,并参与早期炎症反应和组织修复[1]。Ly6C低表达的单核细胞同时表达高水平的CX3CR1和低水平的CCR2(CX3CR1highCCR2low)。在心脏和肾脏的炎症疾病初期,骨髓和脾脏产生的Ly6Chigh单核巨噬细胞增多,疾病后期Ly6Clow单核巨噬细胞数量增多,提示Ly6C单核巨噬细胞亚群可能是一群特异性的效应细胞[2-3]。有研究表明,间充质干细胞(mesenchymal stem cells, MSCs)可以通过旁分泌作用调节巨噬细胞极化,影响巨噬细胞功能,治疗小鼠缺血性心肌病[4],其中一种重要的旁分泌因子——外泌体可能起到不可忽视的作用。但是在炎症中,MSCs产生的外泌体对Ly6C单核巨噬细胞亚群的影响尚不清楚。本研究拟用脂多糖(lipopolysaccharide, LPS)模拟体内炎症环境,探讨骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)分泌的外泌体对Ly6C单核巨噬细胞亚群比例的影响,旨在阐明MSCs一种新的免疫调节机制,为MSCs临床治疗提供理论依据。
1 材料与方法
1.1实验动物6~8周龄的C57BL/6J小鼠,♀♂不限,由中山大学实验动物中心提供。生产许可证号:SCXK(粤)2016-0029,使用许可证号:SYXK(粤)2015-0107。
1.2试剂与仪器CD11b磁珠分选试剂盒(MiltenyiBiotec);Exo-Quick外泌体提取试剂盒、小鼠IL-6 ELISA 试剂盒、无外泌体胎牛血清(System Bioscience);胎牛血清(Gibco);DMEM低糖培养基(Thermo Fisher);LPS(Sigma);抗小鼠CD45-PerCP-Cy5.5、CD11b-FITC、Ly6C-PE、Ly6G-PE-Cy7、F4/80-APC、抗人CD34-FITC、CD73-PE、CD44-FITC、CD29-PE、CD31-FITC、CD45-FITC流式抗体(BD Biosciences)。AmnisImageStreamXMarkII型流式细胞仪(Merck公司);NanosightNS500纳米粒子分析仪(Malveron公司)。
1.3BMSCs的分离、培养与鉴定经医学伦理委员会批准,从广东省人民医院血液科的4名骨髓捐赠者的骨髓中,通过梯度离心法获得BMSCs原代细胞,用10% DMEM低糖培养基,于25 mL培养瓶和35 mm培养皿中进行培养,待细胞密度达到90%后,胰酶消化传代,用第3或第4代细胞进行鉴定。
取106个第3或第4代BMSCs于EP管中,用100 μL PBS重悬,1管为阴性对照,3管为PE、FITC、PerCP-Cy5.5的同型对照,其余各管分别加入CD34-FITC、CD73-PE、CD44-FITC、CD29-PE、CD31-FITC、CD45-PerCP-Cy5.5流式抗体,避光室温孵育30 min。PBS洗2遍后,用40 μL PBS重悬,上机检测。成脂诱导按照分化培养基说明书进行诱导及染色,于显微镜下观察结果。
1.4外泌体的提取与鉴定将BMSCs培养在直径为10 cm的培养皿中,至第3代,细胞密度为80%(1×107)时,换用10 mL 含10%无外泌体胎牛血清的培养基培养,处理组加入LPS(0.5 mg·L-1),对照组不加LPS,48 h后收上清,提取正常BMSCs来源的外泌体(normal BMSCs-derived exosomes, Nor-exo)和LPS刺激后BMSCs来源的外泌体(LPS-treated BMSCs-derived exosomes, LPS-exo)。按5 ∶1(细胞上清:提取液)的比例加入2 mL提取试剂,4℃放置12 h以上,1 500×g离心30 min,除去上清,留1 mL左右液体,1 500×g离心5 min,除去残留的液体,用适量的100~200 μL PBS重悬,取10 μL检测浓度,约为2×1014particles·L-1,其余-80℃长期保存。
利用Western blot对外泌体特征标记物CD63 进行鉴定。加入5×loading buffer,95 ℃加热5 min使蛋白变性,制胶,上样,电泳,然后转膜、封闭,5% BSA 稀释一抗CD63(1 ∶200),4 ℃孵育过夜,TBST 洗涤3次,用HRP标记的抗兔二抗(1 ∶2 000)室温孵育1 h,TBST洗涤3次,加入ECL发光液,用自动显影机曝光。利用Nanosight分析粒径,用适量PBS稀释外泌体至1 mL,放入样品槽自动上样,测量粒径、浓度等参数,记录并生成报告。
1.5单核细胞的分离和培养选取6~8周的C57BL/6J小鼠,麻醉后处死,无菌剥取胫骨和股骨,剪去骨两端,用PBS冲洗骨髓腔至白色,并用巴氏管吹打散红色组织,40 μm滤网过滤,300×g离心10 min,收集细胞,裂解红细胞后,按照CD11b磁珠分选试剂盒说明书操作,放在6孔板中,用10% DMEM培养基,培养,分别加入等量的LPS-exo和Nor-exo (1×1014particles·L-1),培养24 h,再加入LPS(0.5 mg·L-1)刺激48 h,收集细胞,用流式检测Ly6C细胞亚群的变化。
1.6流式细胞术检测Ly6C细胞亚群的比例每组细胞收集至圆底试管中,1 200 r·min-1离心5 min, 100 μL PBS重悬,每管加入CD45-PerCP-Cy5.5、CD11b-FITC、Ly6C-PE、Ly6G-PE-Cy7、F4/80-APC各1.5 μL,混匀后室温避光孵育 30 min,1 mL PBS洗涤1~2次,离心,弃上清,4%多聚甲醛或者PBS 40 μL重悬,转移至EP管,用Amnis流式细胞仪检测。流式细胞术逻辑设门策略:先选取单核巨噬细胞群,第2门选取CD45+CD11b+双阳性细胞,第3个门选中Ly6G-CD11b+细胞,再观察第3个门中的细胞F4/80和Ly6C的表达情况,根据Ly6C-PE荧光强度分为 Ly6Chigh和Ly6Clow两群。应用Flow Jo_vX.0.7软件分析检测数据。
1.7ELISA检测炎症因子的含量培养72 h 后,收集细胞上清,冻存于-80 ℃,检测前4℃、6 000 r·min-1离心5 min,上清按照试剂盒说明书检测细胞因子IL-6的含量[5]。
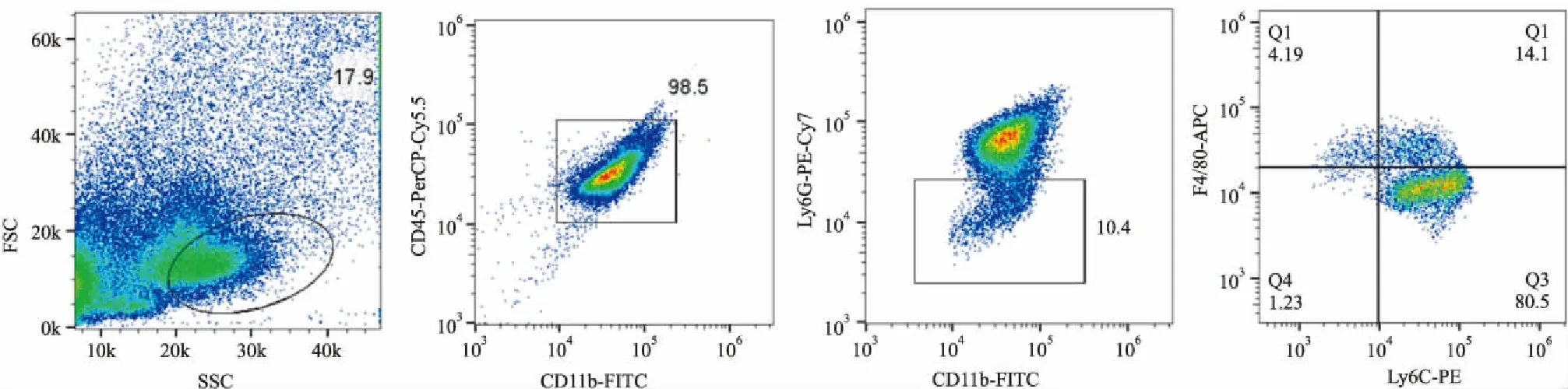
Fig 1 Mouse bone marrow monocytes/macrophages subsets identified by flow cytometry and gating strategy

2 结果
2.1BMSCs细胞形态及鉴定将梯度离心法获得的BMSCs原代细胞培养,培养7 d后,细胞呈长梭状,聚集呈旋涡状,生长较快(Fig 2A)。成脂诱导分化后,用油红O染色,可见细胞内有橘红色脂滴(Fig 2B)。流式细胞术鉴定结果显示:间充质干细胞表面标志物CD29、CD44、CD73的阳性率分别为92.5%、93%、88%,而造血系表面标志物CD31、CD34、CD45的阳性率仅为0.34%、0.25%、0.34%(Fig 2C)。结果证实成功分离BMSCs,可用作后续实验。
2.2外泌体的特性分析经Nanosight检测粒径分布和浓度,LPS刺激后,细胞产生外泌体的数量多于正常情况下细胞分泌的外泌体,且差异有显著性[(3.58×1012±6.12×107)vs(7.75×1011±2.06×107)particles·L-1,P<0.01],但是直径没有明显改变[(82.40±3.70)nmvs(91.90±15.90)nm,Fig 3A]。大部分纳米粒子直径为82.4 nm,处于外泌体直径的范围(30~100 nm)[6](Fig 3B)。Western blot 结果显示,对照组和LPS处理组细胞分泌的外泌体均表达CD63特征蛋白(Fig 3C)。以上数据均显示成功提取出外泌体。

Fig 2 Identification and characterization of human BMSCs
A: The phase morphology of BMSCs (scale bar=200 μm); B: Oil-red staining analyzed adipogenic differentiation of BMSCs; C: Flow cytometry identified surface marker of BMSCs.

Fig 3 Identification and characterization of exosomes secreted by BMSCs

2.3外泌体对炎症环境中小鼠Ly6C单核巨噬细胞的影响与正常组相比,LPS刺激下,Ly6Chigh单核细胞比例减少[(76.50±2.19)%vs(81.40±1.27)%,P<0.01],Ly6Chigh巨噬细胞比例增加[(18.90 ± 1.30)%vs(13.35 ± 1.06)%,P<0.01],差异均具有统计学意义。在LPS刺激条件下,与未加外泌体组相比,提前加入外泌体处理后,Ly6Chigh单核细胞的比例上升(P<0.01),Ly6Chigh巨噬细胞比例降低(P<0.01),LPS-exo处理组的作用更加明显(P<0.05),见Fig 4。各组间Ly6Clow单核细胞亚群比例没有明显差异。提示BMSCs在LPS刺激下产生的外泌体可以明显改变Ly6Chigh单核巨噬细胞亚群比例,在体外可以增加Ly6Chigh单核细胞数量,减少Ly6Chigh巨噬细胞比例。
2.4ELISA的检测结果与正常组相比,LPS刺激条件下的促炎因子IL-6水平明显增加(P<0.05),说明LPS刺激模型建立成功。提前加入外泌体处理后,与LPS单独刺激组相比,IL-6水平明显增加,差异均具有统计学意义(P<0.05),见Fig 5。提示外泌体有可能在体外促进Ly6Chigh单核细胞释放促炎因子IL-6。
3 讨论
单核巨噬细胞是机体重要的免疫细胞,具有抗感染、抗肿瘤、免疫调节等重要作用。正常情况下,50%的小鼠单核细胞属于Ly6ChighCCR2highCX3CR1low亚群,对应于人类的 CD14+CD16-单核细胞,这些炎性或经典单核细胞具有相对较短的循环寿命,优先积聚在炎性部位分化为巨噬细胞,释放IL-6、IL-1β等促炎因子,产生促炎作用。另一种是Ly6ClowCCR2lowCX3CR1high亚型,对应于人类的 CD14+CD16+单核细胞,正常情况下数量较少,后期积聚在炎性部位,分化为巨噬细胞产生抗炎作用,并释放IL-10等抗炎因子。越来越多研究显示,Ly6C单核巨噬细胞亚群的变化与炎症反应和疾病发展的不同阶段关系密切。在心肌梗死初期,Ly6Chigh单核细胞占到所有单核细胞的78%,Ly6Clow单核细胞在梗死后5~7 d比例上升至80%左右,在心肌梗死后期发挥积极的抑制炎症和瘢痕修复的作用[7]。在肾脏炎症模型中,发现来源于骨髓的Ly6Chigh单核细胞选择性募集到肾脏,并分化为抗纤维化的Ly6Clow亚型[3]。因此,Ly6C亚群的适当平衡在调节炎症中起着重要的作用。但是影响不同亚群改变的因素目前还不清楚。
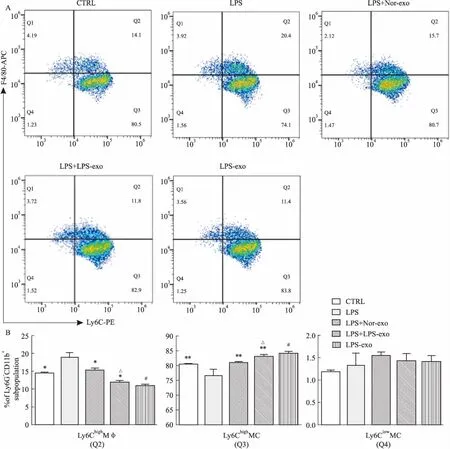
Fig 4 Effects of exosomes on Ly6C monocyte/macrophage under LPS stimulation

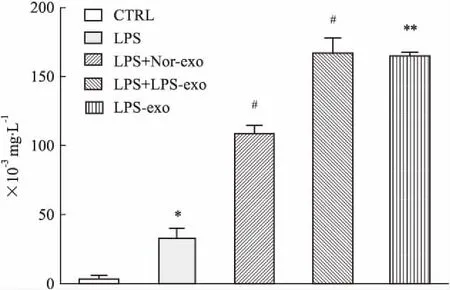
Fig 5 Concentration of cytokine IL-6
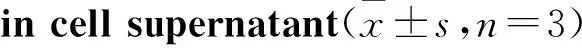
*P<0.05,**P<0.01vscontrol group;#P<0.05vsLPS group
MSCs具有自我更新、自我复制等特点,在炎症和免疫调节等方面具有广阔的临床应用前景。在败血症模型中,MSCs可分泌生长因子,增加M2巨噬细胞的百分比,改善器官功能[8],LPS预处理可以提高MSCs的移植存活率,刺激VEGF表达,活化PI3K/Akt通路,促进血管形成和心脏功能恢复[9]。机制可能主要通过旁分泌,减少炎症和促进组织修复,外泌体作为旁分泌重要因子,是一种细胞分泌的活性囊泡,在正常或病理条件下,可以携带多种脂质、蛋白质、mRNA和非编码RNA,介导细胞、组织和器官之间的信息交流。外泌体中的mRNA和microRNA会受病理生理刺激和疾病影响而改变,从而把这种信息带给受体细胞,引起受体细胞功能的变化。表明外泌体不仅可以高效地传递细胞之间的信息,还可以反映出其来源细胞的状态[10-12]。本实验中,LPS刺激后,BMSCs分泌的外泌体数量增多,但是粒径大小没有明显改变,内容物如mRNA和microRNA可能会与正常情况下有所不同,有可能导致LPS-exo对单核细胞亚群比例的改变比Nor-exo明显。这些结果说明,LPS预处理是一种提高BMSCs生物学和功能特性的新策略,但是LPS预处理BMSCs产生的外泌体具体是哪些mRNA和microRNA发生了改变,以及BMSCs外泌体在体内是否可以通过影响Ly6C细胞比例,从而加速组织修复和体内平衡,目前还有待探究。
本研究用正常情况下和LPS刺激下BMSCs产生的外泌体,与小鼠骨髓来源的单核细胞共培养,采用6种不同荧光素的抗体对于小鼠骨髓细胞进行免疫分型,准确显示Ly6C稀有单核细胞亚群的比例情况。结果显示,在LPS诱导前,用BMSCs来源的外泌体处理后,Ly6Chigh单核细胞明显增多,Ly6Chigh巨噬细胞比例相应减少,促炎因子IL-6也明显增高,而Ly6Clow亚群没有明显的变化。且单独用LPS-exo刺激也增加Ly6Chigh单核细胞比例,减少Ly6Chigh巨噬细胞比例。提示BMSCs来源的外泌体对于小鼠骨髓Ly6Chigh单核巨噬细胞亚群比例确实有一定的改变,而且LPS预处理BMSCs后产生的外泌体在体外提高了促炎型Ly6Chigh单核细胞比例,其分泌的促炎因子IL-6也明显增多,产生更强的促炎作用。未刺激BMSCs来源的外泌体也使Ly6Chigh单核细胞比例有一定程度的增加,但效果没有LPS刺激组明显。目前,大多研究认为MSCs具有抗炎和免疫抑制的特性,但是也有研究证明,MSCs可以诱导炎症反应[13]。体外用LPS预处理脂肪间充质干细胞,增加其促炎介质IL-6和TNF-α的释放,但把处理后的细胞上清注射到体内可以增强肝脏的再生[14]。MSCs不同的免疫功能可能与其来源、TLR配体的种类和表达量都有密切的关系。为了解决MSCs有关促炎和抗炎性质的冲突数据,Bunnell等[15]提供了一种新的MSCs分类假设,根据不同的TLR信号通路,分为MSC1和MSC2两种表型。TLR4激动剂(LPS)促使MSCs偏向促炎特性,TLR3激动剂(poly[I:C])促使MSCs偏向免疫抑制特性。我们的结果符合这一假设,LPS作为TLR4激动剂,促使MSCs向促炎表型分化,产生的外泌体使单核细胞增多,促炎因子IL-6的表达增加。然而,外泌体是通过促进Ly6Chigh单核细胞增殖,还是减少单核细胞向巨噬细胞的分化,来达到比例的改变及促炎因子的释放增多,还有待我们进一步研究。其在体内是否可以通过改变Ly6C单核细胞比例,调节免疫功能,减轻炎症疾病的发展,也是我们下一步工作的重点。这一结果为MSCs的旁分泌在免疫调节中作用提供了新的依据,若可以阐明在疾病治疗中的作用机制,将会为干细胞临床治疗做出重要的贡献,为外泌体的治疗作用提供新的靶点和基础实验支持。
(致谢: 本实验主要在广州医科大学药学院分子临床药理学重点实验室完成的,感谢导师及课题组各位成员对该实验的指导与帮助。)
[1] Das A, Sinha M, Datta S, et al. Monocyte and macrophage plasticity in tissue repair and regeneration[J].AmJPathol, 2015,185(10):2596-606.
[2] Hilgendorf I, Gerhardt L M, Tan T C, et al. Ly-6Chigh monocytes depend on Nr4a1 to balance both inflammatory and reparative phases in the infarcted myocardium[J].CircRes, 2014,114(10):1611-22.
[3] Lin S L, Castao A P, Nowlin B T, et al. Bone marrow Ly6Chighmonocytes are selectively recruited to injured kidney and differentiate into functionally distinct populations[J].JImmunol, 2009,183(10):6733-43.
[4] Dayan V, Yannarelli G, Billia F, et al. Mesenchymal stromal cells mediate a switch to alternatively activated monocytes/macrophages after acute myocardial infarction[J].BasicResCardiol, 2011,106(6):1299-310.
[5] 江新湄,林秋雄,何国东,等.青钱柳降糖组方对2型糖尿病大鼠的治疗作用[J]. 中国病理生理杂志, 2017,33(10):1794-1800.
[5] Jiang X M, Lin Q X, He G D, et al. Therapeutic effect of QQL prescription on type 2 diabetic rats[J].ChinJPathol, 2017,33(10):1794-1800.
[6] Ibrahim A,Marbán E.Exosomes:fundamental biology and roles in cardiovascular physiology[J].AnnuRevPhysiol,2016,78:67-83.
[7] Nahrendorf M, Swirski F K, Aikawa E, et al. The healing myocardium sequentially mobilizes two monocyte subsets with divergent and complementary functions[J].JExpMed, 2007,204(12):3037-47.
[8] Lombardo E, van der Poll T, de la Rosa O, et al. Mesenchymal stem cells as a therapeutic tool to treat sepsis[J].WorldJStemCells, 2015,7(2): 368.
[9] Yao Y, Zhang F, Wang L, et al. Lipopolysaccharide preconditioning enhances the efficacy of mesenchymal stem cells transplantation in a rat model of acute myocardial infarction[J].JBiomedSci, 2009,16:74.
[10] 杨翔宇,李晓红,肖 静,等.干扰素γ刺激hUC-MSCs分泌外泌体促进调节性T细胞生成[J]. 中国药理学通报, 2017,33(1):45-51.
[10] Yang X Y, Li X H, Xiao J, et al. Exosomes secreted from IFN-γ prestimulated hUC-MSCs induce regulatory T cells[J].ChinPharmacolBull, 2017,33(1):45-51.
[11] 李 超,戴 敏.不同细胞来源的外泌体在动脉粥样硬化中的研究进展[J]. 中国药理学通报, 2017,33(1):27-32.
[11] Li C, Dai M. Research progress of different cells derived exosomes in atherosclerosis[J].ChinPharmacolBull, 2017,33(1):27-32.
[12] 肖 静,潘 宇,李晓红,等.心脏干细胞分泌的exosome对氧化应激下心肌细胞的保护作用研究[J]. 中国药理学通报, 2015,31(12):1656-60.
[12] Xiao J, Pan Y, Li X H, et al. CPC derived exosome protects cardiomyocytes from oxidative stress[J].ChinPharmacolBull, 2015,31(12):1656-60.
[13] Kilroy G E, Foster S J, Wu X, et al. Cytokine profile of human adipose‐derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors[J].JCellPhysiol, 2007,212(3):702-9.
[14] Lee S C,Jeong H J,Lee S K,et al.Lipopolysaccharide preconditioning of adipose-derived stem cells improves liver-regenerating activity of the secretome[J].StemCellResTher,2015,6(1):75.
[15] Bunnell B A, Betancourt A M, Sullivan D E. New concepts on the immune modulation mediated by mesenchymal stem cells[J].StemCellResTher, 2010,1(5):34.
