大花还亮草中的黄酮类化合物
2018-07-04付茂洁艾洪莲
何 隽,邵 倩,付茂洁,艾洪莲
(中南民族大学 药学院,武汉 430074)
毛茛科(Ranunculaceae)翠雀属(Delphinium)植物主要分布于北温带,全球约有300种以上,我国约有113种,除台湾省和海南岛以外的其他各省均有分布[1]. 该属植物有20余种为药用植物,具有镇痛、镇静、祛风湿、治疗跌打损伤、止咳平喘、解热等功效[2]. 翠雀属植物含有与乌头碱结构类似的二萜生物碱,该类成分是翠雀属植物特征性化学成分,也被公认为该属植物的有效成分和毒性成分[3-5].
大花还亮草(D.anthriscifoliumvar.majus)为还亮草的变种,多年生草本植物,主要分布在贵州(剑河)、四川东部、陕西南部、湖北、安徽(霍山),全草可供药用,有清热解毒、祛痰止咳的作用. 文献资料显示,大花还亮草中含有多种翠雀碱[6-8],但还未见其非碱成分的报道. 通过对该种植物的化学成分研究,发现了6个黄酮类化学成分,通过波谱学数据及理化性质确定结构分别为:3,4,2′,4′-tetramethoxy dihydrochalcone (1),4,2′,4′,6′-tetramethoxy dihydrochalcone (2),3,4,2′,4′,6′-pentamethoxy dihydrochalcone (3),6′-hydroxy-3,4,2′,4′,6′-tetramethoxy dihydrochalcone (4),(-)-3′,4′,7-trimethoxyflavanone (5),(-)-3′,4′,5,7-tetramethoxyflavanone (6)(图1).
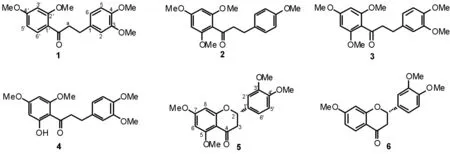
图1 大花还亮草中的黄酮类化合物Fig.1 Flavonoids isolated from Delphinium anthriscifolium var. majus
1 实验部分
1.1 样品、试剂和仪器
大花还亮草(D.anthriscifoliumvar.majus)2016年采于湖北省神龙架,由中南民族大学艾洪莲博士鉴定,标本保存于中南民族大学药学院(标本号:SNU20160712).
1H和13C NMR由Bruker AM-600测定,内标为TMS,化学位移(δ)的单位是ppm,偶合常数(J)的单位为Hz;ESI-MS由API QSTAR Pulsar测定.
分离材料:柱层析硅胶(80~100及200~300 目)、薄层层析硅胶(GF254)和硅胶H由青岛海洋化工厂生产;Sephadex LH-20(瑞士Amersham Biosciences公司);反相硅胶Chromatores(日本Fuji公司);Agilent 1260HPLC,色谱柱为Agilent Zorbax SB-C18柱(4.6 mm × 150 mm),粒径5 μm;半制备型色谱柱为Agilent Zorbax SB-C18柱(9.4 mm×150 mm),粒径5 μm. 显色方法为254、365 nm紫外灯下观察荧光,10%硫酸乙醇溶液加热显色.
1.2 提取和分离
大花还亮草2.5 kg晾干后粉碎,用10 L甲醇室温浸提3次,每次24 h,浓缩物用乙酸乙酯萃取,萃取液减压浓缩后得浸膏70 g. 用100 g硅胶(80~100目)拌样以500 g硅胶(80~100目)进行柱层析,石油醚-丙酮梯度洗脱,用TLC进行检测,合并相同馏分,得到6个馏分.
第3馏分(7 g),10 g(200~300目)硅胶拌样后以50 g(200~300目)硅胶柱层析,氯仿:丙酮(1:0~0:1)洗脱,得4个组分:3-1;3-2;3-3;3-4. 3-1进硅胶柱层析(200~300目)得到3-1-1和3-1-2两部分. 其中3-1-1再经硅胶柱层析(硅胶H)纯化,得到化合物3(7 mg);3-1-2用半制备型HPLC纯化(65%乙腈/水),得到化合物1(12 mg,13.5 min)和2(15 mg,16.2 min). 3-2段进行Saphadex LH-20(甲醇)层析,得到4个组分:3-2-1;3-2-2;3-2-3;3-2-4. 3-2-4用半制备型HPLC纯化(65%甲醇/水),得到化合物5(5 mg,13.4 min)和6(6 mg,15.5 min).
第4馏分(9.8 g),15 g(200~300目)硅胶拌样后以80 g(200~300目)硅胶柱层析,氯仿:丙酮(98:2)洗脱,得到化合物4(4.5 g).
2 结构鉴定
化合物1 C19H22O5黄色粉末;1H NMR(600 MHz,CDCl3)δ: 7.81(d,J=8.8 Hz,1H),6.78(d,J=9.9 Hz,1H),6.53(d,J=8.7 Hz,1H),6.45(s,1H),3.25(t,J=7.7 Hz,2H),2.95(t,J=7.7 Hz,2H);13C NMR(150 MHz,CDCl3)δ: 199.6(s),164.4(s),160.8(s),148.7(s),147.1(s),134.7(s),132.8(d),121.1(s),120.2(d),111.9(d),111.2(d),105.1(d),98.4(d),55.9(q),55.8(q),55.6(q),55.5(q),45.6(t),30.3(t); ESI-MS m/z: 331[M + H]+. 以上波谱数据与参考文献[9]一致,鉴定为3,4,2′,4′-tetramethoxy dihydrochalcone.
化合物2 C19H22O5; 黄色粉末;1H NMR(600 MHz,CDCl3)δ: 7.13(d,J=8.5 Hz,2H),6.81(d,J=8.5 Hz,2H),6.09(s,2H),3.82(s,3H),3.78(s,3H),3.75(s,6H),3.03(m,2H),2.94(m,2H);13C NMR(150 MHz,CDCl3)δ: 203.8(s),162.3(s),158.2(s),157.8(s),133.7(s),129.3(d),113.7(d),113.3(d),90.5(d),55.8(q),55.5(q),55.3(q),46.1(t),29.1(t); ESI-MS m/z: 331[M + H]+. 以上波谱数据与参考文献[10]一致,鉴定为4,2′,4′,6′-tetramethoxy dihydrochalcone.
化合物3 C20H24O6; 黄色粉末;1H NMR(600 MHz,CDCl3)δ: 6.78(dJ=8.2 Hz,1H),6.75(overlapped,2H),6.09(s,2H),3.86(s,3H),3.85(s,3H),3.82(s,3H),3.75(s,6H),3.05(dd,J=8.7,6.8 Hz,2H),2.95(dd,J=8.6,6.8 Hz,2H);13C NMR(150 MHz,CDCl3)δ: 203.7(s),162.3(s),158.2(s),148.7(s),147.1(s),134.3(s),120.2(d),113.3(s),111.8(d),111.1(d),90.5(d),55.9(q),55.8(q),55.5(q),46.6(t),29.6(t); ESI-MS m/z: 361[M + H]+. 以上波谱数据与参考文献[10]一致,因此鉴定为3,4,2′,4′,6′-pentamethoxy dihydrochalcone.
化合物4 C19H22O6; 黄色粉末;1H NMR(600 MHz,CDCl3)δ: 14.04(s,1H),7.26(s,1H),6.82(dJ=8.2 Hz,1H),6.79(overlapped,2H),6.08(d,J=2.4 Hz,1H),5.93(d,J=2.4 Hz,1H),3.88(s,3H),3.87(s,3H),3.84(s,3H),3.82(s,3H),3.30(t,J=7.7 Hz,2H),2.95(t,J=7.7 Hz,2H);13C NMR(150 MHz,CDCl3)δ: 204.6(s),167.7(s),166.0(s),162.7(s),148.7(s),147.2(s),134.3(s),120.1(d),111.8(d),111.1(d),105.7(s),93.6(d),90.8(d),55.9(q),55.8(q),55.6(q),55.5(q),46.0(t),30.3(t); ESI-MS m/z: 347[M + H]+. 以上波谱数据与参考文献[11]一致,鉴定为6′-hydroxy-3,4,2′,4′,6′-tetramethoxy-dihydrochalcone.
化合物5 C19H20O6; 黄色粉末;1H NMR(600 MHz,CDCl3)δ: 7.00(overlapped,2H),6.90(d,J=7.9 Hz,1H),6.16(d,J=2.4 Hz,1H),6.10(d,J=2.4 Hz,1H),5.36(dd,J=13.3,2.8 Hz,1H),3.93(s,3H),3.91(s,6H),3.83(s,3H),3.05(dd,J=16.5,13.3 Hz,1H),2.78(dd,J=16.5,2.8 Hz,1H);13C NMR(150 MHz,CDCl3)δ: 189.5(s),166.0(s),165.0(s),162.3(s),149.3(s),149.2(s),131.1(s),118.8(d),111.0(d),109.3(d),105.6(s),93.5(d),93.2(d),79.2(d),56.2(q),56.0(q),55.9(q),55.6(q),45.5(t); ESI-MS m/z: 345[M + H]+. 以上波谱数据与参考文献[12]一致,故鉴定为(-)-3′,4′,5,7-tetramethoxyflavanone.
化合物6 C18H18O5; 黄色粉末;1H NMR(600 MHz,CDCl3)δ: 7.88(d,J=8.7 Hz,1H),7.01(overlapped,2H),6.91(d,J=8.1 Hz,1H),6.63(dd,J=8.8,2.4 Hz,1H),6.51(d,J=2.4 Hz,1H),5.42(dd,J=13.4,2.8 Hz,1H),3.93(s,3H),3.91(s,3H),3.84(s,3H),3.07(dd,J=16.9,13.4 Hz,1H),2.82(dd,J=16.9,2.8 Hz,1H);13C NMR(150 MHz,CDCl3)δ: 190.8(s),166.2(s),163.5(s),149.4(s),149.2(s),131.2(s),128.8(d),118.9(d),114.8(s),111.1(d),110.3(d),109.3(d),100.9(d),80.0(d),56.0(q),55.9(q),55.7(q),44.3(t); ESI-MS m/z: 315[M + H]+. 以上波谱数据与参考文献[13]一致,故鉴定为(-)-3′,4′,7-trimethoxyflavanone.
3 结语
翠雀属植物的特征性化学成分为二萜生物碱,也被公认为该属植物的有效成分和毒性成分. 文献调研发现很少该属植物的非碱成分报道[14]. 采用现代色谱技术从大花还亮草(D.anthriscifoliumvar. majus)的地上部分中分离纯化获得到6个黄酮类化学成分,其中化合物1~6均为首次从该植物中分离得到. 本研究成果丰富了翠雀属植物的化学成分的结构类型,可为进一步开发这一属植物提供新的物质基础.
参 考 文 献
[1] 中国植物志编委会. 中国植物志:第6卷[M]. 北京:科学出版社,2001: 133.
[2] 肖培根. 中国毛茛科植物群的亲缘关系、化学成分和疗效间相关性的初步探索[J]. 植物分类学报,1980,18(2): 142-153.
[3] 王锋鹏. 乌头属和翠雀属植物中生物碱化学研究概况[J]. 药学学报,1981,16(12): 943-959.
[4] Lin C Z,Zhao Z X,Xie S M,et al. Diterpenoid alkaloids and flavonoids fromDelphiniumtrichophorum[J]. Phytochemistry,2014,97(1): 88-95.
[5] Cook D,Welch K D,Green B T,et al. The relative toxicity ofDelphiniumstachydeumin mice and cattle[J]. Toxicon,2015, 99(1): 36-43.
[6] Shan L H,Zhang J F,Gao F,et al. C18-Diterpenoid alkaloids fromDelphiniumanthriscifoliumvar.majus[J]. J Asian Nat Prod Res,2018,20(15):423-430.
[7] Wang S,Zhou X L,Gong X M,et al. Norditerpenoid alkaloids fromDelphiniumanthriscifolium[J]. J Asian Nat Prod Res,2015,18(2): 141-146.
[8] Shan L H,Zhang J F,Gao F,et al. Diterpenoid alkaloids fromDelphiniumanthriscifoliumvar.majus[J]. Sci Rep, 2017,7(1),6063.
[9] Perkin W H, Weizmann C. Some derivatives of catechol, pyrogallol, benzophenone, and of substances allied to the natural coloring matters[J]. J Chem Soc Trans,1906,89: 1649-1665.
[10] Wang J,Wang N L,Yao X S,et al. Structures and anti-histamine activity of chalcones & aurones compounds fromBidensparvifloraWilld[J].Asian J Trad Med,2007,2(1): 23-29.
[11] Pinkey P, Jain P K,Grover S K. Phase-transfer cataly- zed hydroxymethylation of 2′-hydroxydihydrochalcones: a new synthesis of homoisoflavanones[J]. Indian Journal of Chemistry,Section B: Organic Chemistry Including Medicinal Chemistry,1986,25B(4): 365-367.
[12] Reddy N P,Reddy B A K,Gunasekar D,et al. Flavonoids fromLimnophilaindica[J]. Phytochemistry,2007,68(5): 636-639.
[13] Munikishore R,Padmaja A,Guvvuru D,et al. Two new flavonoids fromAgeratumconyzoides[J]. Indian J Chem,2013,52(11): 1479-1482.
[14] Fuente G de la,Ruiz-Mesía L. Norditerpenoid alkaloids fromDelphiniumperegrinumvar.elongatum[J]. Phytochemistry,1995,39(6): 1459-1465.
