菟丝子总提物对雷公藤多苷POF大鼠模型影响的探讨
2018-07-03管雁丞何中平黄长盛周汝云黎德育深圳市中医院妇产科广东深圳58034深圳市南山区人民医院中医风湿科广东深圳50000
★ 管雁丞 何中平 黄长盛 周汝云 黎德育(.深圳市中医院妇产科 广东 深圳58034;.深圳市南山区人民医院中医风湿科 广东 深圳 50000)
卵巢早衰(premature ovarian failure,POF)是指女性40岁前,卵巢储备功能衰退,以高促性腺激素、低雌激素水平为主要临床表现的妇科内分泌疾病。发病率为1%~3%[1],约10%的育龄期女性不孕症由 POF 所导致[2],严重危害了妇女的身心健康。随着自身免疫性疾病等发病率逐年增加,接受免疫抑制剂治疗的患者越来越多。临床研究证实,多种免疫抑制剂可引起POF,故本实验立足于雷公藤多苷致卵巢早衰大鼠模型,采用减味寿胎丸(去阿胶)主药-菟丝子总提物进行干预,初步探讨减味寿胎丸的主要作用成分及其机制。具体如下。
1 材料与方法
1.1 实验动物 SPF级雌性SD大鼠,重230~250g,周龄约8周,共44只,由广东省动物实验中心提供(动物合格证号:SYXK(粤)2014-0140)。饲养于深圳大学SPF级动物房。
1.2 实验药品 雷公藤多苷悬浮液:将雷公藤多苷片(黄石飞云制药有限公司,产品批号:20151203,国药准字:Z42021212)配置成浓度为15mg/mL的悬浮液。
补佳乐水溶液:将戊酸雌二醇片(1mg/片,DELPHARM Lille S.A.S产,生产批号:278A,国药准字:J20130009。)配置成浓度为0.02mg/mL的悬浮液。
菟丝子总提物:取干燥菟丝子药材(康美药业)1000g,总提物为醇提物与水提物所得浸膏合并所得。根据人鼠体表面积换算公式,折算系数为6.25,采用6倍等效剂量。大鼠日用量(g)=6×成人日用量(30g)/60kg×6.25/1000×提取率(0.18)×大鼠体重(g)。用生理盐水溶解菟丝子干浸膏,调整浓度为0.15g/mL。
1.3 实验方法 大鼠进入SPF级动物房适应性喂养1周后,连续10d每日取大鼠阴道脱落细胞涂片观察动情周期,选取有正常动情周期大鼠共44只纳入实验,随机分为4组:对照组、模型组、补佳乐组、菟丝子总提物组(简称TSZ组),每组各11只。对照组予等剂量纯净水,余下各组给予雷公藤多苷混悬液75mg/(kg·d)灌胃,日1次,连续30d。30d后,空白对照组、模型组继续予等量纯净水灌胃;补佳乐组以补佳乐水溶液灌胃,给药量0.1mg/kg/d;TSZ组:予菟丝子总提物水溶液灌胃,给药量(g)=3.375×大鼠体重(g),日1次,连续30d。
1.4 观察指标
1.4.1 动情周期的观察 每日上午九时开始进行阴道涂片观察动情周期变化。具体步骤:将生理盐水蘸湿的无菌棉签轻轻插入大鼠阴道内,轻柔旋转一圈后取出,迅速将分泌物涂布于玻片,然后置于10×10倍光学显微镜下观察。正常大鼠动情周期为4~5d,且按动情前期、动情期、动情后期、动情间期变化,周而复始,具有规律性。动情周期各阶段判定标准依据参考文献[3],具体见表1。

表1 动情周期各阶段判定标准
1.4.2 血清激素及细胞因子水平检测 给药结束后1~5d内选择非动情期大鼠,腹主动脉取血、处死,离心取血清后,采用ELISA法检测血清E2、FSH、LH、AMH水平。
1.4.3 卵泡计数及卵巢组织形态学观察 取出同侧卵巢后,快速置于4%多聚甲醛中固定24h,常规石蜡包埋,从最大剖面以4μm厚度连续切片6张,HE染色,在光学显微镜下(10×10倍)观察卵巢组织形态改变,根据卵泡结构及大小对卵泡分级,分级标准依据参考文献[4],计数最大剖面的生长卵泡、黄体及闭锁卵泡。(深圳市第六人民医院病理科协助)
2 统计学处理
3 实验结果
3.1 大鼠动情周期的观察 为方便统计研究,以两个动情周期即10d,作为观察点,即以D1-D10、D11-D20、D21-D30动情周期变化来对比研究。实验发现造模约10d开始,部分大鼠动情周期逐渐紊乱,无规律性,或者部分大鼠动情周期延长至6~9d。造模第30d,大鼠均动情周期紊乱或延长(造模期间,有2只大鼠因操作失误死亡)。干预期间,TSZ组动情周期基本恢复规律,与补佳乐组相仿,具体见表2。
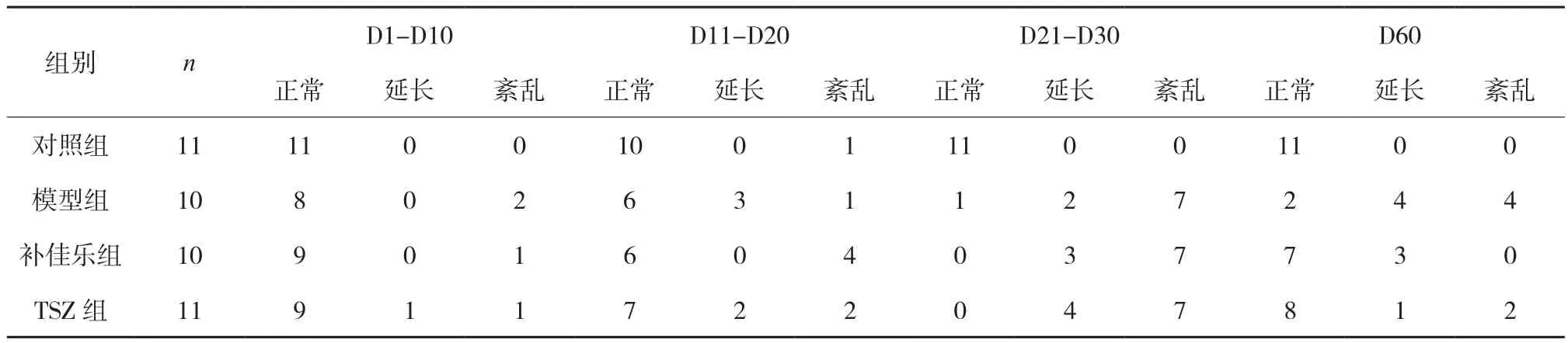
表2 大鼠动情周期的变化 只
3.2 大鼠血清激素水平及细胞因子的比较 与对照组比较,模型组E2水平明显降低,FSH、LH、AMH水平明显升高(P<0.01);与模型组,两治疗组E2水平升高,FSH、LH、AMH升高(P<0.01或0.05);与对照组比较,两治疗组无显著性差异,两治疗组组间比较无显著性差异(P>0.05),见表3。

表3 血清激素水平及细胞因子的比较
3.3 大鼠卵泡计数的比较 与对照组比较,模型组生长卵泡及黄体数量明显减少,闭锁卵泡明显增多(P<0.01);与模型组比较,两治疗组生长卵泡及黄体增多(P<0.01或 0.05),闭锁卵泡减少(P<0.05);与对照组比较,两治疗组无显著性差异,两治疗组组间比较无显著性差异(P>0.05),见表4。
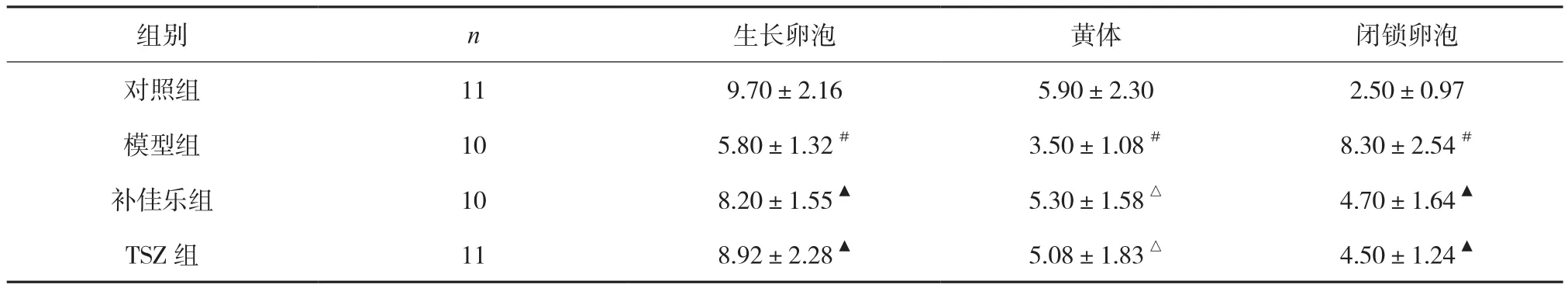
表4 大鼠卵泡计数的比较 个
3.4 卵巢病理切片 对照组镜下可见卵巢血运丰富,各级卵泡生长活跃,黄体发育良好。模型组肉眼可见大鼠卵巢萎缩苍白,部分卵巢组织纤维化明显。镜下见生长卵泡明显减少,成熟卵泡基本未见,闭锁卵泡明显增多,部分可见空囊泡,黄体数量少,间质可见纤维组织增生。治疗组大鼠卵巢镜下各级卵泡较模型组明显增多,可见成熟卵泡,黄体数量增加,可见少量闭锁卵泡,间质未见明显纤维组织增生。见下图1-4(HE染色,10×10)。

图1 正常组

图2 模型组

图3 补佳乐组

图4 TSZ组
4 讨论
雷公藤类药物为临床常用抗免疫风湿类药物,临床有研究认为生殖系统损伤的发生与其日用量关系密切[5]。另亦与它的累积剂量有明显关系。雷公藤多苷累积剂量>8000mg时,闭经发生率为95%[6]。亦有报道,雷公藤的自身免疫治疗剂量明显高于其有效抗生育阈剂量[7],表明雷公藤在发挥免疫抑制作用的同时,不可避免地影响到生殖功能。
近年来,雷公藤致卵巢早衰模型的研究颇多。用药剂量10mg/kg至75mg/kg不等,大多研究集中于40mg/kg至75mg/kg。大鼠的动情周期为4~5d,文献研究报道,用药时间为10d至10周不等。高慧等[8]以雌性大鼠为研究载体,分别用雷公藤5mg/(kg·28d)、10mg/(kg·28d)、20mg/(kg·28d)、50mg/(kg·14d)、50mg/(kg·28d)、75mg/(kg·14d)、75mg/(kg·28d) 、100mg/(kg·14d)、100mg/(kg·28d)进行对比研究,结果发现,以50mg/(kg·14d)成模最理想,75mg/(kg·14d)模者次之,75mg/(kg·28d)较75mg/(kg·15d)卵巢功能损伤程度重;吴克明等[9]以雌性小鼠为研究载体,通过研究发现40mg/kg·10w为最佳造模剂量,同时观察到停药4周,小鼠卵巢功能即可恢复。
笔者通过大量前期研究,并重复实验研究比对了3月龄、6月龄及11~12月龄三个不同月龄段大鼠卵巢功能损伤程度,发现75mg/(kg·30d)的造模方法可更稳定、可靠地致卵巢储备功能下降[10];3月龄及6月龄大鼠卵巢功能损伤程度大致相仿,且有进一步加重的趋势,而11~12月龄初老大鼠在生理上接近卵巢功能衰退期,造模后,卵巢储备功能明显下降。故本实验选用75mg/(kg·30d),性活跃期大鼠的造模方法重复实验。
根据临床症状,该病应属于祖国医学“闭经”“年未老经水断”“不孕”等范畴。中医认为此类药物应属于邪毒,直接损伤胞宫,导致冲任失调或直接损伤冲任二脉,通过生殖轴影响肾与天癸;雷公藤致卵巢早衰的主要病因为肾阴阳两虚,治疗应以补肾为主,且平调肾阴肾阳最佳。据近年来文献报道,药源性卵巢早衰的临床观察及实验研究均使用补肾法,常选用左归丸、右归丸、归肾丸等补肾名方,均有显效。此类方剂药味较多,不便于临床新药开发。
本课题组前期研究中,采用药少而力专的减味寿胎丸进行研究,实验表明,减味寿胎丸能成功拮抗、修复雷公藤诱导的卵巢损伤。菟丝子是该方君药,性味甘平,平补肾阴肾阳,益精养血。近年研究发现,菟丝子主要有效成分菟丝子黄酮具有类雌激素活性,一方面能调控凋亡相关基因,抑制颗粒细胞凋亡;一方面能调控颗粒细胞分泌性激素和细胞因子的能力,以延缓卵泡闭锁[11]。槲皮素属于菟丝子黄酮主要药用成分之一,实验证明其具有类雌激素作用,可以抑制生殖细胞凋亡,促进卵泡发育[12]。故本研究运用菟丝子单味药进行药源性卵巢早衰大鼠的干预性研究,以期初步探讨减味寿胎丸的主要药物成分及其作用机制,以指导临床用药。
本研究发现,造模第30d大鼠基本出现动情周期紊乱、延长,造模成功;干预实验中,菟丝子总提物能显著提高血清E2,降低血清FSH及LH;能显著升高AMH;能增加生长卵泡数量,延缓或减少卵泡闭锁,减轻大鼠卵巢间质纤维样改变,改善大鼠卵巢损伤,避免卵巢萎缩,增加卵巢指数。
由此可见,菟丝子总提物可能具有类激素样作用,直接提高了卵巢对促性腺激素的反应性,使E2升高,FSH、FSH/LH降低,从而改善卵巢功能;AMH明显升高,亦说明卵巢储备能力提高;并延缓了POF的病理进程。
5 结论
菟丝子作为减味寿胎丸主药,其总提物可显著提高卵巢储备能力,修复卵巢组织损伤,可指导临床用药,并为新药开发指明方向。
[1]Haller-Kikkatalo K, Uibo R, Kurg A, et al. The prevalence and phenotypic characteristics of spontaneous premature ovarian failure: a general population registry-based study [J]. Hum Reprod, 2015, 30(5):1 229-1 238.
[2]Coulam C B, Adamson S C, Annegers J F. Incidence of premature ovarian failure [J]. Obstet Gynecol, 1986, 67(4):604-606.
[3]魏涨.医学实验学[M].重庆:四川科学技术出版社, 1998:164-165.
[4]Myers M, Britt K L, Wreford N G, et al. Methods for quantifying follicular numbers within the mouse ovary [J]. Reproduction, 2004, 127(5):569-580.
[5]邱颖文,吴松武,吴贤仁.雷公藤多苷的不良反应[J].西北药学杂志,2004, 19(5):220-222.
[6]谷春霞. 雷公藤多苷片所致闭经原因探讨:附83例分析[J].中国医学科学院学报, 1989, 11(2):151.
[7]Flaws JA, Doerr JK, Sipes IG, et al. Destruction of preantral follicles in adul trats by 4-vinyl-1-cyclohexene diepoxide [J]. Reprod Toxicol,1994, 8(6):509-514.
[8]高慧,杨涓,韩冰,等.药物型卵巢早衰动物模型的研究[J].国医论坛, 2007, 22(3):22-26.
[9]吴克明,张黎鹏,王家葵,等.雷公藤多甙致雌性小鼠生殖损伤模型治疗时机研究[J].成都中医药大学学报, 2008, 31(2):27-28.
[10]管雁丞,罗颂平,倪张俊. 天癸失序药源性卵巢功能损伤大鼠模型差异性研究[J].中华中医药杂志, 2015, 30(7):2 374- 2 377.
[11]Yang L, Chen Q, Wang F, et al. Antiosteoporotic compounds from seeds of Cuscuta chinensis [J]. J Ethnopharmacol, 2011, 135(2):553-560.
[12]舒翔, 胡晓鹃, 周圣煜, 等. 槲皮素对幼鼠卵巢发育以及血液中激素水平的影响[J]. 药学学报, 2011, 46(9):1 051-1 057.
