Twist1蛋白在溃疡性结肠炎及其相关性结直肠癌的表达及意义
2018-07-03欧阳满照唐立姚学清陆岩伍锦浩张伟杰廖天佑罗振涛
欧阳满照, 唐立, 姚学清, 陆岩, 伍锦浩,张伟杰, 廖天佑, 罗振涛
(1.南方医科大学顺德医院胃肠外科,佛山顺德528308;2.广东省人民医院 普通外科,广东广州510080)
溃疡性结肠炎(ulcerative colitis,UC)所致的溃疡性结肠炎相关性结直肠癌(ulcerative colitisassociated colorectal cancer,ucCRC)是 UC严重并发症之一,占UC患者死亡原因的10%~15%[1].有研究发现Twist1在部分慢性炎症性疾病中有较高的表达[2],但Twist1在ucCRC中的表达情况尚未见明确报道.同时,也有研究表明Twist1具有癌基因特性,能编码凋亡抑制蛋白,从而抑制肿瘤细胞凋亡[3-5],但 Twist1是否参与“UC→ucCRC”的癌变过程及其机制仍不完全明确.本研究通过收集肠镜检查的患者肠道标本并构建UC细胞模型,通过分组并检测Twist1的表达情况,初步探讨Twist1蛋白在“UC→ucCRC”的癌变过程中的可能机制.
1 资料与方法
1.1 资料
1.1.1 一般资料
收集南方医科大学附属顺德医院(原南方医科大学顺德第一人民医院)病理科2015年1月至2017年12月存档的蜡块标本,共分为3组:正常对照组(13例),取自正常人志愿者,经肠镜及病理检查确认无UC及ucCRC;UC组(35例),临床与病理皆确诊为UC;ucCRC组(11例),均有UC病史,临床与病理皆确诊为结直肠癌.本研究通过医院伦理委员会审批,患者及其家属术前均签署知情同意书.
1.1.2 细胞选取
人高分化结肠腺癌Caco2细胞株购自上海ATCC细胞库.
1.1.3 主要试剂和仪器
DMEM细胞培养基(美国Gibco公司);BCA蛋白浓度测定试剂盒(中国碧云天公司);葡萄糖硫酸钠(dextran sulfate sodium salt,DSS)(美国 MP Biomedicals公司),Twist1单克隆抗体(美国Santa公司);Bcl-2多克隆抗体(美国Bioworld公司);超敏SP法免疫组化试剂盒(北京中杉金桥生物技术有限公司);RM2235切片机(德国Leica公司);正置显微镜(日本Olympus公司).
1.2 方法
1.2.1 肠道组织中Twist1表达检测
应用免疫组化检测Twist1表达.将收集的标本蜡块经切片机4μm连续切片,制片后经二甲苯脱蜡,梯度酒精水化,然后根据免疫组化按超敏SP法(链霉菌抗生物素蛋白-过氧化物酶连结法)免疫组化试剂盒说明书操作,用枸橼酸盐缓冲液加热修复抗原,质量分数为3%过氧化氢消除内源性过氧化物酶活性,Twist1单克隆抗体按1∶200稀释并4℃条件下孵育过夜,二抗孵育2 h,二氨基联苯胺(diamino benzidine,DAB)显色,苏木素复染,中性树脂封片.
1.2.2 细胞培养
将Caco2细胞用含质量分数为15%胎牛血清的DMEM培养基中培养,置于含体积分数为5%CO2的37℃细胞培养箱中常规培养.用含质量分数为0.02%乙二胺四乙酸(EDTA)的质量分数为0.25%胰酶消化细胞,并进行传代,传至3、4代左右,选取生长状态良好,增殖旺盛的细胞用于实验研究.
1.2.3 UC细胞模型构建及分组
取指数生长期的Caco2细胞,分为正常对照组、DSS作用2 d组、DSS作用4 d组,每24 h对进行换液:正常对照组选取DMEM+质量分数10%胎牛血清(FBS)的培养基换液,DSS作用2 d组、DSS作用4 d组选取3 mL的DMEM+质量分数10%FBS+质量分数2%DSS培养基(DSS直接按比例溶于培养基中,溶解后用孔径10 nm的滤头过滤)换液.
1.2.4 Twist1和 Bcl-2表达检测
采用Western Blot法对各组 Twist1、Bcl-2蛋白表达进行检测.Western及IP细胞裂解液(RIPA)裂解细胞提取蛋白,调整浓度后进行上样、电泳、转膜、封闭、Twist1、Bcl-2、β-actin(1∶1 000)抗体4℃摇床孵育过夜,二抗37℃条件下孵育2 h,通过动物成像仪扫描成像.用ImageJ图像分析软件对条带密度扫描,以测量出的灰度值比值为蛋白的相对表达含量.
1.2.5 结果判定
实验中Twist1蛋白的表达为细胞质内棕色或棕褐色沉着表现.采集每张切片上的5个高倍视野(400倍),每个高倍视野计数200个细胞,然后根据实验所得数据计算每张切片所选5个视野的平均阳性细胞百分率.平均阳性细胞百分率≤10%为0分,11%~25%为1分,26%~50%为2分,≥51%为3分.染色强度计分:若不染色则为0分,若为淡黄色则为1分,若为棕黄色则为2分,若为棕褐色则为3分.最后将每张切片的平均阳性细胞百分率分值与相应的平均染色强度分值相乘得到其染色分数:≤3分为阴性,4分为弱阳性,6分为阳性,9分为强阳性.将弱阳性、阳性和强阳性定义为阳性,阴性定义为阴性[6].
1.3 统计学分析
所有统计分析均采用SPSS 13.0统计软件处理.计数资料比较采用Radit分析和χ2检验分析,多组间比较采用单因素方差分析,方差齐性,采用LSD-t法进行两两比较;方差不齐,采用Dunnett’s T3法进行两两比较,P<0.05为有统计学差异.
2 结果
2.1 各组肠道组织中Twist1蛋白的表达情况
Twist1蛋白可在肠道上皮细胞的细胞质及细胞核表达,且以细胞质为主.检测结果显示:Twist1在正常对照组、UC组和ucCRC组中均有表达.但正常对照组中Twist1表达比较较弱,阳性表达率为7.7%(1/13),与其他两组比较,有统计学差异(P<0.05).而 ucCRC组中的 Twist1蛋白的阳性表达率为90.1%(10/11),较UC组的阳性表达率82.9%(29/35)有所升高(P<0.05,图 1).
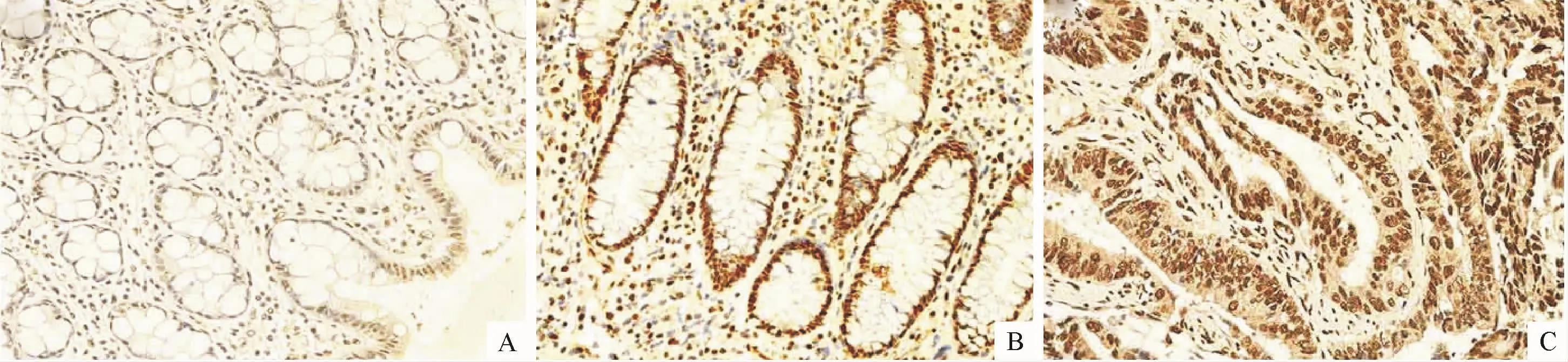
图1 各组肠道组织中Twist1蛋白的免疫组化检测(SP×400)Fig.1 Immunohistochemical detection of Twist1 protein in intestinal tissues of each group(SP×400)
2.2 各组Twist1蛋白表达与患者临床病理因素关系
UC组和ucCRC组中Twist1蛋白的表达阳性率较正常对照组明显升高(P<0.05).其中,Twist1蛋白在溃疡性结肠炎组织中的表达水平与患者的年龄、性别无明显关系(P>0.05).同时,Twist1蛋白在溃疡性结肠炎相关性结直肠癌组织的表达水平与患者的年龄、性别、肿瘤发生部位无明显关系(P>0.05,表1、表2及表3).

表1 Twist1在正常对照组、UC组和ucCRC组之间的表达Table 1 Expression of Twist1 in normal,UC,and ucCRC groups

表2 35例UC患者临床病理因素与Twist1蛋白阳性表达率之间的关系Table 2 Relationship between clinicopathologic factors and positive expression of Twist1 protein in 35 UC patients n(%)

表3 11例ucCRC患者临床病理因素与Twist1蛋白阳性表达率之间的关系Table 3 Relationship between clinicopathological factors and positive expression of Twist1 protein in 11 patients with ucCRC
2.3 UC模型细胞中各组Twist1蛋白的表达情况
Western blot结果显示:与正常对照组比较,DSS作用2 d组和DSS作用4 d组的Twist1表达水平较正常对照组明显增高,有统计学差异(P<0.05),同时DSS作用4 d组的Twist1表达量也较DSS作用 2 d组增高(P<0.05).此外,与正常对照组比较,DSS作用2 d组和DSS作用4 d组的Bcl-2表达量也明显增高(P<0.05),但两组之间Bcl-2蛋白表达无明显差异(P>0.05,图2、图3).

图2 各组UC模型细胞中Twist1蛋白Western blot电泳图Fig.2 Western blot analysis of Twist1 protein in UCmodel cells in each group

图3 各组UC模型细胞中Twist1蛋白表达情况柱状图Fig.3 Twist1 protein expression histogram in each group of UCmodel cells
3 讨论
溃疡性结肠炎是指发生在结直肠的慢性非特异性炎症,其病程漫长,常反复发作,迁延难愈,且易诱发溃疡性结肠炎相关性结直肠癌[7].其癌变机制可能与UC中上皮-间充质转化(epithelialmensenchymal transition,EMT)的发 生 有 关[9].Twist1作为EMT的重要转录因子,已明确其在部分慢性炎症中由较高的表达[2],同时Twist1也与细胞凋亡存在密切关系.然而目前关于Twist1在UC和ucCRC中的表达情况在国内外尚未见报道,且Twist1是否在“UC→ucCRC”的转变过程中起重要作用仍未清楚.本实验通过构建UC细胞模型以及收集人体UC和ucCRC肠道标本并检测Twist1的表达情况,初步探讨Twist1蛋白在“UC→ucCRC”的癌变过程中的可能机制.
3.1 Twist1在UC、ucCRC组织中的表达
Twist1是 Twist家族下的重要成员,学者Niesner[2]研究发现 Twist1可由具有被反复刺激特征的效应记忆Th细胞所表达,这种记忆Th细胞是慢性炎症的特征性细胞,因此,Twist1可能在溃疡性结肠炎等慢性炎症性疾病中有较高的表达.同时,近年研究表明活动性UC中有EMT的发生[8],也有研究指出EMT与结直肠肿瘤的发生发展密切相关,更有部分学者认为EMT是联系免疫炎症反应与肿瘤发生发展的桥梁,是“炎-癌”链中的重要事件.而Twist1作为EMT的重要转录因子,除在慢性炎症疾病中有表达之外,有理由认为其在结直肠癌肿瘤中也呈高表达.本次研究结果显示,Twist1蛋白在UC组织、ucCRC组织中均有高表达,且阳性表达率均显著高于正常结直肠组织.因此,推测Twist1可能在UC发展和UC恶化过程中起到某种重要的联系或促进作用.
3.2 Twsit1在UC细胞模型的表达
使用质量分数2%DSS诱导人高分化结肠腺癌Caco-2细胞转化为肠炎模型细胞研究UC及ucCRC已被广泛应用[9-10].本研究通过参考上述造模方法,应用质量分数2%DSS作用于Caco-2细胞,成功诱导UC细胞模型的建立,并从细胞实验角度进一步验证Twsit1的表达情况.应用2%DSS分别刺激Caco-2细胞2 d和4 d后,Twist1的表达均较正常对照组明显升高.也从体外实验进一步验证了Twist1在UC及ucCRC中也呈高表达.
3.3 Bcl-2蛋白在UC细胞模型中的表达情况
有研究指出Twist1基因具有癌基因的特性,能够编码凋亡抑制蛋白,影响肿瘤细胞的凋亡.目前Bcl-2是肿瘤治疗的一个已知靶标,可让癌细胞通过抗细胞凋亡而逃避细胞死亡,其作用机理可能与抑制Caspase-3的活化或类似蛋白酶的活性进而抑制细胞凋亡的发生[11].本研究结果表明,在Twist1蛋白表达量提高的UC模型细胞中,抑制细胞凋亡的Bcl-2表达也明显提高,提示着Twist1与细胞凋亡存在密切关系.因此,Twist1可能通过抑制细胞凋亡的信号通路使UC细胞逃避死亡,从而进一步促进UC细胞的癌变.
综上,Twist1蛋白在 UC、ucCRC组织和 UC模型细胞中均有高表达,Twist1在“UC→ucCRC”的癌变过程中起重要的联系或促进作用,有可能是今后临床上预防 ucCRC的发生发展、筛选ucCRC患者肿瘤标记物、提供药物治疗新靶点及预后评估的重要基因蛋白,但目前具体分子机制及其与其他相关基因的关系如何,有待进一步研究.
[1]EUGA N C.Ulcerative colitis practice guidelines in adults[J]. Clinics& Research in Hepatology&Gastroenterology,2012,36(2):107-109.
[2]NIESN U, ALBRECHT I, JANKE M, et al.Autoregulation of Th1-mediated inflammation by twist1[J].Journal of Experimental Medicine,2008,205(8):1889-1901.
[3]FUNATO N,TWIGG SR F,HIGASHIHORIN,et al.Functional analysis of natural mutations in two TWIST protein motifs[J].Human Mutation,2005,25(6):550-556.
[4]HORIKAWA T,YANG J,KONDO S,et al.Twist and epithelial-mesenchymal transition are induced by the EBV oncoprotein latentmembrane protein 1 and are associated with metastatic nasopharyngeal carcinoma[J].Cancer Res,2007,67(5):1970-1978.
[5]YANG J,MANISA,DONAHER J L,et al.Twist,a master regulator ofmorphogenesis,plays an essential role in tumor metastasis[J].Cell,2004,117(7):927-939.
[6]李坤,陈建明,蒋耀光,等.Twist在食管鳞癌中的表达及其对预后的影响[J].重庆医学,2008,37(8):837-839.LIK,CHEN JM,JIANG Y G,et al.Up-regulation of Twist predicts poor clinical outcome of patients with oesophagealsquamons cell carcinoma[J]. Chongqin Medicne,2008,37(8):837-839.
[7]YASHIRO M. Ulcerative colitis-associated colorectal cancer[J].World Journal of Gastroenterology,2014,20(44):16389-16397.
[8]ZHAO X, FAN J, ZHI F, et al. Mobilization of epithelial mesenchymal transition genes distinguishes active from inactive lesional tissue in patients with ulcerative colitis[J].Human Molecular Genetics,2015,24(16):4615-4624.
[9]NIGHOT P,YOUNG K,NIGHOT M,et al.Chloride channel ClC-2 is a key factor in the development of DSS-induced murine colitis[J]. Inflammatory Bowel Diseases,2013,19(13):2867-2877.
[10]ZHANG R,XU J,ZHAO J,et al.Genistein improves inflammatory response and colonic function through NF-κB signal in DSS-induced colonic injury[J].Oncotarget,2017,8(37):61385-61392.
[11]SHIMIZU S,EGUCHI Y,KAMIIKE W,et al.Bcl-2 expression prevents activation of the ICE protease cascade[J].Oncogene,1996,12(11):2251-2257.
