抑制芽孢杆菌乳酸菌的筛选鉴定及其抗菌物质的分离纯化
2018-07-02赵圣明曹雪珂赵岩岩马汉军何鸿举
赵圣明,曹雪珂,赵岩岩,马汉军,何鸿举
(河南科技学院食品学院,河南新乡 453003)
芽孢杆菌属是存在于乳制品、罐装食品、肉制品和面制品中的一类常见细菌,常引起食品腐败甚至是食源性疾病的发生[1-5]。因其产生的芽孢具有高度的抗逆性,在巴氏杀菌条件下不能够完全被杀死,当环境适宜时,芽孢重新萌发,微生物迅速繁殖,因此引起包装食品腐败变质的微生物主要是芽孢杆菌属。研究表明枯草芽孢杆菌和巨大芽孢杆菌等能够引起年糕的粘液化[6];嗜热脂肪地芽孢杆菌存在于蔬菜及肉类罐头中导致平酸败坏[7,8];凝结芽孢杆菌导致桶装番茄酱胀罐等[9]。此外还有一些食品中的芽孢杆菌属和梭菌属具有致病性,如存在于豆类食品、肉制品、焙烤食品中的蜡样芽孢杆菌能够产生肠毒素导致人呕吐腹泻[10];罐装食品中污染的肉毒梭菌能够产生世界上最强的毒素之一肉毒杆菌毒素,可麻痹人体神经甚至导致死亡[11]。因此,如何抑制食品中芽孢杆菌将逐渐成为食品保鲜研究领域的一个热点。
乳酸菌在正常的生长代谢条件下可以生成多种具有抑菌作用的物质如有机酸、双乙酰、3-羟基丁酮、过氧化氢、罗伊氏素和细菌素等[12]。乳酸菌在自然界中分布非常广泛,一般营养丰富的自然环境中,如乳制品、发酵肉制品、发酵蔬菜、发酵果汁、青贮饲料、腐烂的植物、水果、下水道以及人类和动物的消化道、口腔等都能分离获得乳酸菌[13-16]。以前的许多研究都报道了从这些环境中分离得到了具有特异性抑菌作用的乳酸菌菌株,例如杜静芳等从鲤鱼肠道中分离获得1株对阪崎肠杆菌具有显著抑菌效果的植物乳杆菌LY-4[17];Rafael等从涂抹干酪中分离获得1株对单增李斯特菌具有显著抑制效果的米酒乳杆菌2a[18];Zhu等从新鲜牛乳中分离获得一株对金黄色葡萄球菌具有显著抑制效果的植物乳杆菌ZJ008[19];王刚等从泡菜、发酵奶酒和婴儿粪便中分离获得11株对空肠弯曲杆菌具有显著抑制效果的乳酸菌菌株,其中1株唾液乳杆菌ZX5的抑菌效果最强[20]。吉林省东部地区与朝鲜接壤,居住着大量的朝鲜族居民,以传统方法腌制的辣白菜等自然发酵泡菜是朝鲜族的特色发酵食品,同时也是朝鲜族居民一日三餐不可缺少的佐餐食品。但是目前为止还未有关于朝鲜族辣白菜中产广谱抑制芽孢杆菌细菌素的乳酸菌被报道,因此从朝鲜族传统食品辣白菜中分离得到具有抑制芽孢杆菌乳酸菌菌株具有重要的科学意义。
1 材料与方法
1.1 材料与仪器
吉林省朝鲜族农家自制辣白菜 样品取回后贮藏于4 ℃冰箱备用;蜡样芽孢杆菌(AS 1.1846)、枯草芽孢杆菌(ATCC 9943)、凝结芽孢杆菌(CICC 20138)、巨大芽孢杆菌(CICC 10448)、短小芽孢杆菌(CICC 63202)、嗜热脂肪地芽孢杆菌(CICC 20139)、多粘类芽孢杆菌(CGMCC4314)、生孢梭菌(CICC 10385)、产气荚膜梭菌(CICC 22949)、艰难梭菌(CICC 22951) 为本实验室保存;革兰氏染色试剂盒 杭州百思生物技术有限公司;细菌基因组提取试剂盒购自美国 OMEGA公司;pMD19-T连接试剂盒、Taq Mix 南京诺唯赞生物公司;DNA凝胶回收试剂盒、柱式质粒提取试剂盒 大连TaKaRa公司;DNA标准分子量Marker 南京金斯瑞生物公司;Sephadex LH-20 美国Phamarcia公司;其他试剂 均为国产分析纯。
Sartious AY-120电子精密天平 北京赛多利斯天平有限公司;TOMY-SX-700全自动高压灭菌锅 日本Tomy公司;SW-CJ-IBU超净工作台 苏州苏净集团;Centrifuge 5804R冷冻高速离心机 德国Eppendorf公司;PTC-100TMPCR仪 美国MJ Research公司;PowPacTMHC164-5052高电流电泳仪 美国Bio-Rad公司;pH计Orion 3 STAR 美国Thermo公司;JS-380C全自动数码凝胶成像分析仪 上海培清科技有限公司;Agilent 1100 series高效液相色谱仪 美国Agilent公司;Eclipse 80i光学显微镜 日本Nikon公司;HYL-A多功能摇床 太仓强乐实验仪器有限公司;电脑自动部分收集器DBS-100 上海沪西分析仪器公司;Thermo-Fisher LTQ Orbitrap高分辨质谱仪 美国Thermo公司。
1.2 实验方法
1.2.1 培养基的配制 乳酸菌分离培养基(MRS培养基):牛肉膏10 g,蛋白胨10 g,乙酸钠5 g,磷酸氢二钾2 g,柠檬酸氢铵2 g,七水硫酸镁0.58 g,四水硫酸锰0.25 g,葡萄糖20 g,吐温-80 1 mL,蒸馏水1 L,pH6.2~6.4,115 ℃、20 min灭菌备用,固体培养基另加1.5%~2%的琼脂。指示菌培养基:LB培养基:酵母粉5 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 L,pH7.0,121 ℃、20 min灭菌备用,固体培养基另加1.5%~2%的琼脂;厌氧梭菌培养基:牛肉膏10 g,蛋白胨5 g,酵母粉3 g,葡萄糖5 g,淀粉1 g,氯化钠5 g,醋酸钠3 g,L-半胱氨酸盐酸盐0.5 g,蒸馏水1 L,pH6.8,121 ℃、20 min灭菌备用,固体培养基另加1.5~2%的琼脂。乳酸菌鉴定用培养基:乳酸菌菌株鉴定所用到的培养基包括PYG培养基,精氨酸产氨培养基,产硫化氢培养基等均参照凌代文《乳酸菌分类鉴定及实验方法》配制[21]。
1.2.2 样品的采集 使用灭菌的镊子采集少量辣白菜样品置于无菌采样袋中,迅速放于4 ℃冰箱保存备用。
1.2.3 辣白菜样品中乳酸菌菌株的分离 称取10 g辣白菜样品放入250 mL盛有90 mL灭菌生理盐水及玻璃珠的三角瓶中,37 ℃、180 r/min条件下振荡培养2 h,使辣白菜中的乳酸菌充分溶解到生理盐水中。然后将样品进行10倍的梯度稀释,最后选择10-3、10-4、10-5的稀释梯度各取0.1 mL涂布到含有0.3%碳酸钙的MRS固体培养基中,37 ℃的培养箱中倒置培养48 h。之后选取具有钙溶圈明显的单菌落分别划线于固体MRS培养基平板上,培养24 h后,进一步通过过氧化氢酶测试以及革兰氏染色,选取过氧化氢酶测试呈阴性,革兰氏染色阳性的单菌落,-80 ℃条件下保存备用[22]。
1.2.4 产抑制芽孢杆菌活性物质菌株的初筛 将分离得到的乳酸菌菌株分别划线于MRS固体培养基平板上,37 ℃培养48 h后,以无菌打孔器于生长菌落旁取出5 mm直径的琼脂块,分别贴放琼脂块于含有蜡样芽孢杆菌和短小芽孢杆菌的指示平板表面,37 ℃培养12 h后测定抑菌圈直径大小[23]。
1.2.5 产抑制芽孢杆菌活性物质菌株的复筛 将初筛得到的具有抗菌活性菌株按1%体积比接种于MRS液体培养基中,37 ℃静止培养48 h后,4 ℃条件下90000×g离心30 min获得发酵上清液,上清液经0.45 μm孔径的细菌滤器过滤并排除过氧化氢抑制和有机酸抑制后,采用琼脂孔扩散法[24]测定其抗菌活性。
1.2.6 菌株鉴定 菌株的形态特征、培养特征及生理生化鉴定 对获得的活性菌株进行生理生化鉴定,具体方法参考《伯杰氏系统细菌学手册》[25]和《乳酸细菌分类鉴定及实验方法》[21]。
基于16S rDNA基因的分子生物学鉴定 选取目标乳酸菌菌株对数期菌体选用OMEGA公司的细菌基因组提取试剂盒提取菌株总DNA。选用原核生物16S rDNA扩增的通用引物,正向引物:fD1 5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物:rP1 5′-GGTTACCTTGTTACG ACTT-3′[26]。PCR扩增反应体系:正向和反向引物各1 μL,PCR Taq mix 12.5 μL,DNA模板1 μL,超纯水9.5 μL,总反应体系25 μL。PCR反应循环:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,30个循环;72 ℃延伸10 min。PCR扩增产物1%琼脂糖凝胶电泳验证后,割胶回收送生工生物工程(上海)股份有限公司进行测序。测序得到的16S rDNA基因序列登陆GenBank数据库进行BLAST同源性比较,应用MEGA 5.05软件以neighbor-joining method构建系统发育树。
1.2.7 乳酸菌产抑制芽孢杆菌活性物质的粗提取 将筛选得到的乳酸菌接种到MRS液体培养基中,37℃静止发酵36 h后得到发酵液,然后4 ℃、12000 r/min离心10 min,取上清,分别选用不同的有机溶剂(正丁醇、正己烷、乙酸乙酯、三氯甲烷、丙酮)对发酵上清液中的抑菌活性物质进行萃取。有机溶剂与发酵上清液的体积比为3∶1,经4 h的振荡萃取后,静置过夜,分离获得有机相,经50 ℃真空旋蒸,将旋干后得到的产物用甲醇复溶后,用1 mol/L NaOH调pH到6.5,经5.0 g/L的过氧化氢酶37 ℃处理2 h后即获得抑菌活性物质的粗提物。以蜡样芽孢杆菌为指示菌,检测其抑菌活性[27]。
1.2.8 乳酸菌产抑制芽孢杆菌活性物质的分离纯化 采用Sephadex LH-20凝胶层析对抑菌活性物质的粗提物进行层析纯化。纯化条件为:将2 mL细粗提液上样于Sephadex LH-20柱表面,采用色谱级甲醇和纯水(体积比为80∶20)进行洗脱,洗脱流速为3 mL/min,利用电脑自动收集器收集组分。以蜡样芽孢杆菌为指示菌,通过检测其抑菌活性,收集得到的抑菌活性组分经浓缩后利用半制备型反向高效液相色谱进行进一步纯化。样品经0.22 μm微孔滤膜过滤后,利用Waters制备液相色谱XBridgeTMprep C18柱进行分离纯化。纯化条件为:洗脱液为含0.1%体积的三氟乙酸的水和乙腈溶液(水和乙腈体积比为95∶5)等浓度洗脱,时间50 min;进样量1.5 mL;流速5 mL/min;检测波长210 nm。收集半制备液相色谱洗脱组分做抑菌实验,将抑菌活性组分浓缩后利用反高效液相色谱Acchrom XCharge C18柱(4.6 mm×250 mm)进行最后一步分离纯化,纯化条件:洗脱液为含0.1%体积的三氟乙酸的水和乙腈溶液(水和乙腈体积比为95∶5)等浓度洗脱,时间:50 min;进样量:20 μL;流速:0.3 mL/min;检测波长:210 nm。收集具有抑菌活性的液相色谱洗脱组分储存于-20 ℃备用。
1.2.9 抑制芽孢杆菌活性物质的高分辨质谱分析 采用高分辨电喷雾电离质谱(HR-ESI-MS)反向C18质谱柱(2.1 mm×100 mm×3 μm)测定抑菌活性组分的分子质量。检测条件:流动相A为纯水,流动相B为乙腈+2‰甲酸,梯度变化条件:0%~10 min,A 95%~95%,B 5%~5%;10~18 min,A 95%~5%,B 5%~95%;18~22 min,A 5%~5%,B 95%~95%。时间22 min;进样量20 μL;流速0.2 mL/min;检测波长210 nm。
质谱检测条件:离子源:电喷雾电离(ESI);离子源温度:110 ℃;雾化气:氦气;溶剂温度:250 ℃;传输电压:70 V;喷雾压力:40 psi;电离模式:正离子模式;正离子毛细管电压:3500 V;正离子锥孔电压:25 V;毛细管温度:300 ℃;APCI汽化温度:45 ℃;选择离子扫描范围m/z在500~2000。
1.2.10 抑制芽孢杆菌活性物质蛋白酶稳定性研究 分别配制胃蛋白酶、碱性蛋白酶、木瓜蛋白酶、α-胰凝乳蛋白酶各酶溶液的浓度为5 mg/mL,取0.1 mL酶溶液分别加入0.4 mL经半制备型反向高效液相色谱分离纯化获得的抑菌活性组分,调节至各个酶的最适合pH(胃蛋白酶2.0,碱性蛋白酶9.5,木瓜蛋白酶6.5,α-胰凝乳蛋白酶7.5),摇匀,37℃水浴处理3 h后,以0.1 mol/L的NaOH调节pH至4.0,然后分别测定其对蜡样芽孢杆菌的抑菌活性,以未加蛋白酶处理,pH调至4.0的样品为对照。
1.2.11 抑制芽孢杆菌活性物质抑菌活性测定 采用经半制备型反向高效液相色谱分离纯化获得的抑菌活性组分,利用琼脂孔扩散法测定其对芽孢杆菌的抑菌活性,指示菌株包括蜡样芽孢杆菌、枯草芽孢杆菌、凝结芽孢杆菌、巨大芽孢杆菌、短小芽孢杆菌、嗜热脂肪地芽孢杆菌、多粘类芽孢杆菌、生孢梭菌、产气荚膜梭菌、艰难梭菌。
1.2.12 数据处理 实验数据处理采用SPSS 20.0软件,所有实验重复3次,结果以平均值±标准差表示,显著性分析采用Duncan检验。
2 结果与分析
2.1 产抑制芽孢杆菌活性物质菌株的筛选
以吉林省朝鲜族特色食品辣白菜为筛选样品一共获得产酸的革兰氏阳性菌株376株。采用琼脂块法初筛共获得34株对蜡样芽孢杆菌和短小芽孢杆菌具有较好抑菌活性的菌株。采用三角瓶发酵琼脂孔扩散方法进行复筛,排除酸和过氧化氢的影响,最终筛选出5株对枯草芽孢杆菌、凝结芽孢杆菌、巨大芽孢杆菌、嗜热脂肪地芽孢杆菌、多粘类芽孢杆菌、生孢梭菌、产气荚膜梭菌、艰难梭菌抑菌效果较好的菌株,菌株编号分别为SL-21、JS-8、JLK-36、JLK-53、JLY-7,见表1。其中编号为JLY-7的菌株分离自吉林省延吉市的农家自制辣白菜,比较5株菌中JLY-7具有最好的抑菌活性,因此本实验选取该菌株继续下一步实验。

表1 菌株发酵液对指示菌的抑菌作用Table 1 Antibacterial activity of cell-free supernatant of strains
2.2 菌株的形态特征及生理生化鉴定
菌株JLY-7在MRS固体培养基上培养24 h后菌落圆润,边缘整齐无锯齿状,呈乳白色,表面光滑不透明,具有乳酸菌典型的生长特征。经革兰氏染色和显微镜观察菌体确定该菌是革兰氏阳性菌,菌体形状呈短杆状,无鞭毛和芽孢。
菌株生理生化结果如表2所示,不能发酵葡萄糖产气,不能液化明胶,不能还原硝酸盐,不能水解精氨酸产氨,接触酶实验呈阴性,糖发酵实验结果表明该菌株能发酵利用除了鼠李糖指纹所有选用的糖类(表2)。这与已报道的植物杆菌SD-7的生理生化结果一致[28]。根据《伯杰氏细菌鉴定手册》的描述,将该菌株JLY-7初步鉴定为植物乳杆菌。

表2 生理生化鉴定结果Table 2 Physiological and biochemical identification results of strain JLY-7
2.3 菌株的分子生物学鉴定
利用OMEGA细菌基因组提取试剂盒提取菌株JLY-7的基因组DNA,电泳检测结果见图1(A)。以菌株的基因组作为扩增模板,利用细菌16S rDNA通用引物扩增得到约1.6 kbp的扩增产物,结果见图1(B)。将扩增产物回收后,送上海生工生物工程公司测序得到1583 bp碱基序列。将菌株JLY-7的16S rDNA基因序列经校对和拼接后在NCBI网站上利用BLAST程序与GenBank数据库中的核酸数据进行同源性搜索比对,结果发现菌株JLY-7与植物乳杆菌的相似性达到了99%。选取与菌株JLY-7的序列相似较高的菌株16S rDNA基因序列构建系统发育树,结果见图2。结合形态学特征、生理生化实验以及16S rDNA系统发育树结果最终确定菌株JLY-7在细菌分类学上属于植物乳杆菌(Lactobacillusplantarum)。近年来研究发现,发酵食品是筛选功能活性乳酸菌的一个优良资源,已经有许多产抑菌物质的植物乳杆菌被分离到,例如:LactobacillusplantarumC19[30]、LactobacillusplantarumZJ008[31]、Lactobacillusplantarum163[22]和LactobacillusplantarumZJ5[32]等,本研究从朝鲜族辣白菜中筛选得到的植物乳杆菌JLY-7具有良好的抑制芽孢杆菌活性,对该菌株的抑菌物质进一步研究具有一定的科学价值。

图1 菌株JLY-7基因组DNA 和16S rDNA的PCR扩增电泳图Fig.1 The electrophoresis map of the genomic DNA and PCR product of 16S rDNA of strain JLY-7注:M:DNA标准分子量,(A)1,2:基因组DNA,(B)1,2:16S rDNA。

图2 基于16S rDNA基因序列的植物乳杆菌JLY-7菌株的系统发育树Fig.2 Phylogenetic tree derived from the 16S rDNA sequence of Lactobacillus plantarum JLY-7注:所有菌株均为乳酸菌,分支节点的数值代表在1000重复数据的bootstrap值,线段0.005代表序列的差异度。
2.4 抑制芽孢杆菌活性物质的粗提取
将发酵液经过高速冷冻离心后收集无细胞上清液,经正丁醇、正己烷、乙酸乙酯、三氯甲烷和四氯化碳分别萃取后的抑菌活性结果见表3。这几种有机溶剂均出现了明显分层现象,其中正丁醇的萃取效果最好,有机相中萃取物具有显著的抑菌效果,水相中抑菌活性物质残留较少。正己烷和乙酸乙酯的萃取物具有较好的抑菌活性,但是水相中残留的抑菌活性物质相对较多。三氯甲烷和四氯化碳有机相萃取物无抑菌活性,而水相中具有抑菌活性,说明三氯甲烷和四氯化碳对抗菌物质不具有萃取能力。乳酸菌产抗菌物质主要是细菌素类的短肽分子,同时具有疏水性和亲水性,而本研究使用的有机溶剂中,正丁醇的疏水性和极性要高于其他有机溶剂,且正丁醇对抗菌物质的萃取效果最好,说明该抗菌物质的极性较大,更易溶于强极性溶剂。高鹏等[27]从多种有机溶剂中筛选出正丁醇和乙酸乙酯作为萃取剂对LactobacillusplantarumHLJ-174 产的抗菌物质进行粗提取,发现正丁醇的萃取效果要好于乙酸乙酯,本研究与之的研究结果相一致。因此本研究选用正丁醇对植物乳杆菌JLY-7发酵液中的抗菌物质进行粗提取。

表3 植物乳杆菌JLY-7发酵 上清液有机溶剂萃取后抑菌活性Table 3 Antibacterial activity of cell-free culture supernatant of Lactobacillus plantarum JLY-7 treated by organic solvent
2.5 抑制芽孢杆菌活性物质的凝胶层析纯化
经过正丁醇萃取得到的抗菌物质粗提物采用Sephadex LH-20凝胶层析进行纯化,以蜡样芽孢杆菌作为抑菌测试菌株,通过琼脂孔扩散法对层析收集的样品进行抑菌活性检测,结果见图3。由图3可知,在收集管中的第34管至第48管之间得到一个具有抑菌活性的的洗脱组分,将其收集浓缩后用于下一步的分离纯化。

图3 植物乳杆菌JLY-7所产抗菌物质的 Sephadex LH-20洗脱曲线Fig.3 Elution curve of antimicrobial substance from Lactobacillus plantarum JLY-7 on Sephadex LH-20 gel
2.6 抑制芽孢杆菌活性物质的半制备型反向高效液相色谱纯化
经过Sephadex LH-20凝胶层析纯化后的组分经浓缩后采用半制备型反向高效液相色谱进一步纯化得到7个明显的洗脱峰,结果见图4。将洗脱峰分别收集后以蜡样芽孢杆菌作为抑菌测试菌株进行抑菌活性检测,其中只有出峰时间在6.25 min的2号洗脱峰具有明显的抑菌活性,将其收集后浓缩用于下一步纯化。

图4 Sephadex LH-20层析后抗菌物质的半制备型HPLC图Fig.4 Semi preparative HPLC analysis of antimicrobial substance after purified by Sephadex LH-20
2.7 抑制芽孢杆菌活性物质的反向高效液相色谱纯化
图5为经半制备型反向高效液相色谱纯化获得的抑菌活性组分,采用反向高效液相色谱进一步纯化的图谱,通过对各洗脱峰的抑菌活性检测发现,只有在出峰时间12.18 min的洗脱峰具有明显的抑菌活性,如图5所示,说明经过一系列的分离纯化步骤,本研究已经成功的获得纯度较高的抑菌活性物质,将该组分收集后用于下一步的分子量鉴定。

图5 抗菌物质纯化后的HPLC图Fig.5 HPLC assay of the purified antimicrobial substance
2.8 抑制芽孢杆菌活性物质的分子量测定
将反向高效液相色谱纯化获得抑菌活性组分收集后采用液质联用(LC-HR-ESI-MS)首先检测样品的纯度,由图6的结果可以看出,液相色谱分离得到的组分在2.32 min具有单一洗脱峰,周围无明显的的杂峰,且所对应的质谱响应结果也为单一的质谱峰,说明前期收集获得的抑菌活性组分纯度较高,几乎无其他杂质。进一步通过高分辨质谱(HR-ESI-MS)进行分析测定细菌素的分子量,结果见图7。由图7可知,出现了明显的单一质谱峰,分子量的计算方式为M+H=图中所得峰值,因此该抗菌物质的分子量应为694.129 Da。

图6 HPLC纯化后的抗菌物质的LC-MS图Fig.6 LC-MS spectrum of the antimicrobial substance after purified by HPLC注:a:质谱响应图;b:液相色谱分离图。

图7 HPLC纯化后抗菌物质的高分辨电喷雾质谱图Fig.7 HR-ESI-MS spectrum of the antimicrobial substance after purified by HPLC
2.9 抑制芽孢杆菌活性物质蛋白酶稳定性研究
将纯化得到的抑菌活性物质分别经胃蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰凝乳蛋白酶37 ℃度水浴处理3 h,抑菌结果见表4,从表4中可以看出,与对照组相比,经这几种蛋白酶处理后对蜡样芽孢杆菌的抑菌活性完全消失,表明该抗菌物质对常见的蛋白酶均非常敏感,因此可知植物乳杆菌JLY-7产的抗菌物质具有蛋白性质,参考以前的文献研究报道[33],可以初步判定植物乳杆菌JLY-7产的抑菌物质为细菌素类。

表4 植物乳杆菌JLY-7产抗菌物质的蛋白酶稳定性Table 4 The stability of antimicrobial substance from Lactobacillus plantarum JLY-7 for different enzymes treatments
2.10 抑制芽孢杆菌活性物质的抑菌活性
琼脂孔扩散实验结果如图8所示,结果表明经半制备型反向高效液相色谱分离纯化获得的抑菌活性组分对食品中常见的一些致病性和腐败性芽孢杆菌具有显著的抑制作用,包括蜡样芽孢杆菌、枯草芽孢杆菌、凝结芽孢杆菌、巨大芽孢杆菌、短小芽孢杆菌、嗜热脂肪地芽孢杆菌、多粘类芽孢杆菌、生孢梭菌、产气荚膜梭菌和艰难梭菌。
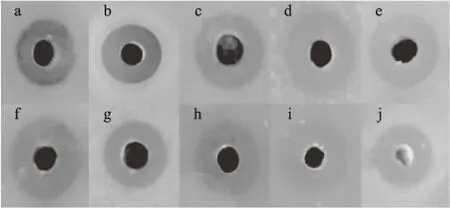
图8 植物乳杆菌JLY-7产抗菌物质的抑菌活性Fig.8 The inhibitory activity of antimicrobial substance from Lactobacillus plantarum JLY-7注:a:蜡样芽孢杆菌;b:枯草芽孢杆菌;c:凝结芽孢杆菌; d:巨大芽孢杆菌;e:短小芽孢杆菌;f:嗜热脂肪地芽孢杆菌; g:多粘类芽孢杆菌;h:生孢梭菌; i:产气荚膜梭菌;j:艰难梭菌。
3 结论
本研究从吉林省朝鲜族传统食品辣白菜中筛选鉴定得到1株LactobacillusplantarumJLY-7。对该菌株发酵液中抗菌物质采用正丁醇进行粗提取,选用Sephadex LH-20凝胶层析和反向高效液相色谱等手段进一步纯化最后得到1种分子量为694.129 Da的细菌素,该细菌素对食品中常见的腐败性及致病性芽孢杆菌具有较好的抑制作用。在以后的研究中可以对细菌素的分子结构、编码基因、表达调控等方面进一步深入分析,为开发新型的具有控制食品中芽孢杆菌污染的益生发酵菌株奠定理论基础。
[1]王伟军,何光华,王娇,等. 原料乳粉中常见芽孢菌的分离鉴定及控制[J]. 中国乳品工业,2016,44(1):15-18.
[2]章乐怡,张秀尧,李毅,等. 婴幼儿奶粉和米粉中蜡样芽胞杆菌及其毒素、毒力基因的调查研究[J]. 中国食品卫生杂志,2014,26(6):600-604.
[3]秦泓,符丽媛,陶平. 面粉及面制品中的芽孢杆菌[J]. 现代面粉工业,2006(1):38-39.
[4]杨晓韬,李春,周晓宏. 7种食品防腐剂对肉制品污染微生物的抑菌效果比较研究[J]. 食品科学,2012,33(11):12-16.
[5]史振霞,杜洪利,欧旭,等. 桃罐头中腐败微生物的分离纯化及鉴定研究[J]. 食品科学,2009,30(21):278-282.
[6]刘青梅,喻勇新,张玲,等. PCR扩增法鉴定年糕中腐败细菌的初步研究[J]. 中国食品学报,2011,11(5):158-161.
[7]蔡健,华景清,徐良. 午餐肉罐头酸败原因分析[J]. 食品与发酵工业,2005,31(6):62-63.
[8]童巧云. 蔬菜罐头平酸败坏问题浅析[J]. 食品科技,1995(1):15-15.
[9]杨红红,陈国刚,刘娅,等. 桶装胀罐番茄酱中腐败菌分离纯化及鉴定研究[J]. 食品工业科技,2014,35(1):164-167.
[10]Tewari A,Abdullah S.Bacilluscereusfood poisoning:international and Indian perspective[J]. Journal of Food Science and Technology,2015,52(5):1-12.
[11]Peck MW,Vliet A H V. Impact of Clostridium botulinumgenomic diversity on food safety[J]. Current Opinion in Food Science,2016,10:52-59.
[12]Gálvez A,Abriouel H,López RL,et al. Bacteriocin-based strategies for food biopreservation[J]. International Journal of Food Microbiology,2007,120(1-2):51-70.
[13]Axelsson L,Salminen S,Von Wright A,et al. Lactic acid bacteria:Classification and physiology[J]. Lactic Acid Bacteria Microbiology & Functional Aspects,2004:1-66.
[14]Saraniya A,Jeevaratnam K. Purification and mode of action of antilisterial bacteriocins produced byLactobacilluspentosusSJ65 isolated from uttapam batter[J]. Journal of Food Biochemistry,2015,38(6):612-619.
[15]H-Kittikun A,Biscola V,El-Ghaish S,et al. Bacteriocin-producingEnterococcusfaecalisKT2W2G isolated from mangrove forests in southern Thailand:Purification,characterization and safety evaluation[J]. Food Control,2015,54:126-134.
[16]Yong CC,Khoo BY,Sasidharan S,et al. Activity of crude and fractionated extracts by lactic acid bacteria(LAB)isolated from local dairy,meat,and fermented products againstStaphylococcusaureus[J]. Annals of Microbiology,2015,65(2):1037-1047.
[17]杜静芳,缪璐欢,马欢欢,等. 拮抗阪崎肠杆菌乳酸菌的筛选鉴定及抑菌特性[J]. 食品科学,2016,37(11):125-130.
[18]Martinez RC,Staliano CD,Vieira AD,et al. Bacteriocin production and inhibition ofListeriamonocytogenesbyLactobacillussakeisubsp. sakei 2a in a potentially synbiotic cheese spread[J]. Food Microbiology,2015,48:143-152.
[19]Zhu X,Zhao Y,Sun Y,et al. Purification and characterisation of plantaricin ZJ008,a novel bacteriocin againstStaphylococcusspp. fromLactobacillusplantarumZJ008[J]. Food Chemistry,2014,165(3):216-223.
[20]王刚,金星,印伯星,等. 1株具有拮抗空肠弯曲杆菌作用的唾液乳杆菌的研究[J]. 中国食品学报,2014,14(12):6-12.
[21]凌代文. 乳酸菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社,1998.
[22]Hu M,Zhao H,Zhang C,et al. Purification and characterization of plantaricin 163,a novel bacteriocin produced byLactobacillusplantarum163 isolated from traditional Chinese fermented vegetables[J]. Journal of Agricultural & Food Chemistry,2013,61(47):11676.
[23]贾锐,陆兆新. 原桃胶中1株芽孢杆菌的分离鉴定及其主要抗菌物质[J]. 食品科学,2016,37(21):136-143.
[24]Luo F,Feng S,Sun Q,et al. Screening for bacteriocin-producing lactic acid bacteria from kurut,a traditional naturally-fermented yak milk from Qinghai-Tibet plateau[J]. Food Control,2011,22(1):50-53.
[25]Buchanan R. 伯杰氏系统细菌学手册[M]. 北京:中国科学出版社,1984:
[26]Hu M,Zhao H,Zhang C,et al. Purification and characterization of plantaricin 163,a novel bacteriocin produced byLactobacillusplantarum163 isolated from traditional Chinese fermented vegetables[J]. J Agric Food Chem,2013,61(47):11676-11682.
[27]高鹏,韩金志,陆兆新,等. 广谱抗菌乳酸菌的分离鉴定及细菌素的提取和纯化[J]. 食品科学,2016,37(11):160-166.
[28]王英,周剑忠,李清,等. 植物乳杆菌SD-7的分离鉴定及其亚硝酸盐降解特性[J]. 中国食品学报,2016,16(7):97-104.
[29]O’Sullivan L,Ross RP,Hill C. Potential of bacteriocin-producing lactic acid bacteria for improvements in food safety and quality[J]. Biochimie,2002,84(6):593-604.
[30]Atrih A,Rekhif N,Moir AJ,et al. Mode of action,purification and amino acid sequence of plantaricin C19,an anti-Listeria bacteriocin produced byLactobacillusplantarumC19[J]. International Journal of Food Microbiology,2001,68(1-2):93.
[31]Zhu X,Zhao Y,Sun Y,et al. Purification and characterisation of plantaricin ZJ008,a novel bacteriocin againstStaphylococcusspp. fromLactobacillusplantarumZJ008[J]. Food Chemistry,2014,165(3):216.
[32]Song DF,Zhu MY,Gu Q. Purification and characterization of plantaricin ZJ5,a new bacteriocin produced byLactobacillusplantarumZJ5[J]. Plos One,2014,9(8):e105549.
