肺炎支原体感染的哮喘患儿发病中血清CD40L、VCAM-1水平的意义
2018-06-29卞相丽张金萍
卞相丽,国 志,张金萍
0 引言
哮喘是由多种细胞参与的常见慢性炎性[1-2]。肺炎支原体(Mycoplasma pneumoniae,MP)是引发儿童和青少年肺炎的常见病原体,以往研究表明,MP可能与新发哮喘、哮喘恶化和哮喘慢性恶化有关[3-4]。虽然目前关于MP在哮喘发作中的确切作用和发病机制尚不清楚,但各种细胞因子和趋化因子参与诱导是重要的组成部分[5]。哮喘儿童缺乏MP感染的细胞和体液免疫,MP可能感染上、下呼吸道,引起肺炎或支气管炎。
CD40L是一种在活化B细胞-T细胞上表达的33 kD的Ⅱ型跨膜糖蛋白,其最初被认为是介导B细胞-T细胞同源相互作用所必需的,能促进B细胞活化、分化和IgE生成[6-7]。最近的研究已经证明,CD40L在促进细胞产生抗原呈递能力和共刺激分子表达方面发挥重要作用,包括CD80和CD86[8-9]。在发生哮喘方面,CD40L是诱导IgE在气管-支气管的过敏炎症反应的必要条件,与过敏性气道炎症鼠模型的肺部炎症发生和嗜酸性粒细胞增多密切相关[10]。此外,内皮细胞表面CD40L与CD40结合后,能刺激多种内皮黏附分子如血管细胞黏附分子-1(VCAM-1)的表达增加,继而引起肥大细胞的白细胞与IgE附着在一起,随时可能引发变态反应[11-12]。因此,本研究观察了MP感染的哮喘患儿发病中血清CD40L和VCAM-1的水平变化,并探讨二者的作用机制。
1 资料与方法
1.1 研究对象 选择2013年1月至2014年12月在我院呼吸科接受治疗的59例哮喘儿童作为观察组,男37例,女22例,年龄0~15岁,平均年龄(6.65±2.28)岁。哮喘诊断参照2008年中国医学会儿科呼吸疾病学会儿科专科组制定的诊断标准[13]。另外,55例未发生呼吸道感染的健康儿童作为对照组,男36例,女19例,年龄1~12岁,平均年龄(6.39±2.34)岁。纳入标准:①伴有过敏性哮喘、短暂呼吸、咳嗽、胸闷的患者,接触过变应原,受到冷空气或物理、化学等外界因素刺激,运动引起的病毒性呼吸道感染;②患有喘息呼吸音和长时间或中断的呼气流量的患者;③对吸入支气管扩张剂具有显著疗效的患者。排除患有严重的心脏病,包括自身免疫疾病或免疫缺陷病史,具有严重肺部疾病、肾脏疾病或患有过敏性支气管哮喘病史的患者,以及在过去6个月接受过敏原免疫治疗者。MP感染的诊断标准包括:MP-IgM抗体阳性,MP免疫球蛋白G(MP-IgG)-阴性抗体变为阳性或IgG抗体滴度升高>4倍。本研究获得纳入儿童父母的知情同意,并经本院伦理委员会审核批准。
1.2 方法
1.2.1 治疗方案 MP-IgM抗体阴性的哮喘患儿接受β-内酰胺抗生素(青霉素或头孢菌素),急性哮喘患儿用支气管扩张剂或激素治疗。除常规疗法外,MP-IgM抗体阳性的哮喘患儿接受10 mg/(kg·d)阿奇霉素治疗,连续服用阿奇霉素3~5 d,待患儿体征恢复正常、临床症状基本消失后,每周口服10 mg/(kg·d)阿奇霉素3 d,持续3周。在给药期间进行血液和尿常规以及肝功能检查。出现异常症状时,停止服用相关药物。
1.2.2 标本采集和检测 入组第2天清晨抽取所有患儿空腹静脉血2 mL,对收集到的样本在1 500 r/min离心15 min分离血清。酶联免疫吸附法(ELISA)检测受试者血清MP-IgM阳性率,使用Serodia Myco Ⅱ试剂盒(Fujirebio公司,东京,日本)。血清IgM水平(>750 U/mL)被认为是一种抗体阳性水平,提示MP感染。同时,ELISA检测血清CD40L、VCAM-1水平,使用人可溶性CD40配体试剂盒和人血管细胞黏附分子-1试剂盒(Abcam公司,伦敦,英国)。

2 结果
2.1 两组一般资料比较 观察组和健康对照组儿童在性别、年龄、BMI、城市家庭儿童所占比例、暴露于粉尘、烟草烟雾环境所占比例方面差异无统计学意义(P>0.05)。观察组患儿家族哮喘史所占比例略高于健康对照组,但两组比较差异无统计学意义(18.6% vs. 7.2%,P=0.073)。见表1。
2.2 血清IgM抗体阳性率情况 观察组患儿的MP-IgM阳性率为54.2%(32/59),健康对照组的MP-IgM阳性率为16.4%(9/55),两组比较差异有统计学意义(χ2=41.115,P<0.01)。见图1。
2.3 外周血 CD40L、VCAM-1水平 对未合并MP哮喘患儿、合并MP哮喘患儿和健康对照儿童的外周血CD40L、VCAM-1水平进行比较,整体差异均有统计学意义(F=4.83、27.54,P均<0.01)。与对照组比较,未合并MP和合并MP哮喘患儿的CD40L、VCAM-1水平升高(P<0.05),并且合并MP哮喘患儿的CD40L、VCAM-1水平均高于未合并MP哮喘患儿(P<0.05)。见图2。
2.4 哮喘合并MP的危险因素分析 以CD40L、VCAM-1表达水平为自变量,以是否感染MP 为因变量(感染=1,未感染=0)进行Logistic回归分析,结果显示,外周血CD40L、VCAM-1为哮喘合并MP的独立危险因素(P<0.05)。见表2。

表1 两组一般资料比较(例,%)
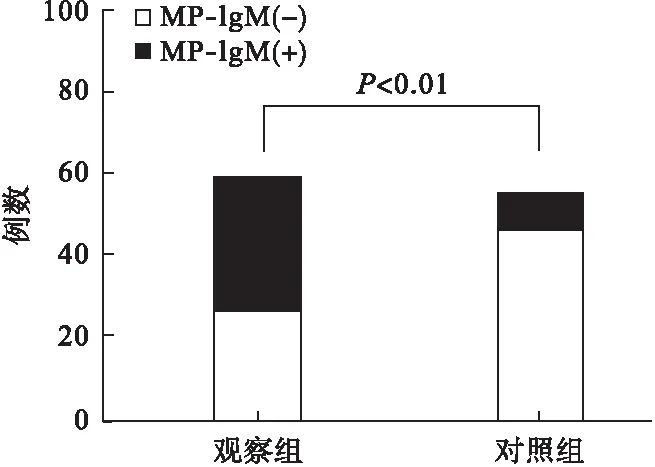
图1 两组受试儿童的MP-IgM阳性率比较

图2 三组受试儿童外周血CD40L、VCAM-1表达水平比较
3 讨论
有关研究表明,MP感染可能与支气管炎和哮喘发生相关[14-15],但关于其中潜在的作用机制尚未完全了解。本研究发现,与健康对照组相比,哮喘儿童MP-IgM阳性率较高,说明儿童哮喘发病可能与MP-IgM阳性率升高有关。通常,MP-IgM阳性可用作初始急性MP感染的早期诊断标准。MP作为一种特异性抗原,可引起即刻或迟发型超敏反应,并可能引起气道过敏性炎症反应和刺激IgE和IgM水平上调来介导1型变态反应[16]。此外,除了特异性IgG和IgE应答之外,MP感染与特异性IgM反应显著相关[17]。因此,特异性MP-IgM的产生可能在哮喘恶化中起重要作用。Varshney等[18]在哮喘恶化期间感染MP的患者的外周血中发现高水平的MP-IgM抗体。Smith-Norowitz等[19]发现,与健康对照相比,哮喘患者的IgM阳性率显著升高,并且表明增加的特异性MP-IgM反应在哮喘患者的MP感染中起重要作用。
本研究中的另一个重要发现:哮喘患儿的外周血 CD40L、VCAM-1水平显著高于非哮喘对照组,并且合并MP的哮喘患儿的CD40L、VCAM-1水平均显著高于未合并MP哮喘患儿。提示合并MP的哮喘患儿可能患有过敏性炎症,并且升高的CD40L、VCAM-1水平在哮喘的发病机制中可能是至关重要的。CD4+T细胞表面的CD40L表达在哮喘发病过程中发挥着重要的促炎作用,因为其介导物-嗜酸性粒细胞在哮喘中被识别,但在健康的肺中未被发现。研究发现,CD40L与血管内皮细胞、平滑肌细胞表面的CD40受体结合后,进而激活NF-κB及c-JunN-末端激酶的信号转导途径,激发多种炎性细胞因子表达增加,进而导致炎症反应进一步恶化[20]。通过糖皮质激素抑制哮喘疾病中的嗜酸性粒细胞增殖,可能与改善症状和气道功能紊乱相关[21]。因此,以气道嗜酸粒细胞浸润为特征的哮喘通常被认为与外周血CD40L水平升高相关,CD40L可能在支气管哮喘的发病机制中起重要作用[22]。VCAM-1是一种重要的细胞黏附分子,研究发现,在炎症阶段白细胞表面整合素的活化发生与内皮细胞上的VCAM-1表达有关,活化后的白细胞会迁移到内皮下组织与IgE附着在一起,随时可能引发变态反应[23]。还有学者认为,嗜酸性粒细胞的移行与内皮细胞上的VCAM-1表达有关,进而增加其与其他细胞间的相互作用,导致免疫应答放大,诱发哮喘[24]。因此,我们推测MP影响气道的可能解释除了包括产生特异性的IgM抗体,还与激活了哮喘患儿的信号分子CD40-CD40L和内皮细胞上的VCAM-1表达有关。进一步Logistic回归分析结果显示,外周血CD40L、VCAM-1水平升高为哮喘合并MP的独立危险因素,证实了我们的推测。

表2 哮喘合并MP的危险因素分析
号分子CD40-CD40L和内皮细胞上的VCAM-1表达有关。进一步Logistic回归分析结果显示,外周血CD40L、VCAM-1水平升高为哮喘合并MP的独立危险因素,证实了我们的推测。
总之,本研究结果显示,哮喘患儿较非哮喘儿童具有较高的MP-IgM阳性率,表明MP感染可促进哮喘患儿的IgM产生,外周血CD40L、VCAM-1水平升高可能导致MP-IgM阳性率升高,这可能反映哮喘易感性增加。但是,由于本研究的局限性,如样本量小、没有从分子生物学探究CD40L、VCAM-1在MP感染的哮喘患儿发病中的作用机制等,可能会影响本研究的结论。今后仍需通过开展大型前瞻性研究来确认二者在MP感染与哮喘风险中的预测价值。
参考文献:
[1] Wu W,Wang T,Dong JJ,et al.Silencing of c-kit with small interference RNA attenuates inflammation,in a murine model of allergic asthma[J].Int J Mol Med,2012,30(1):63-68.
[2] Earl CS,An SQ,Ryan RP.The changing face of asthma and its relation with microbes[J].Trends Microbiol,2015,23(7):408-418.
[3] Yeh JJ,Wang YC,Hsu WH,et al.Incident asthma and Mycoplasma pneumoniae:A nationwide cohort study[J].J Allergy Clin Immunol,2016,137(4):1017-1023.e6.
[4] Giavina-Bianchi P,Kalil J.Mycoplasma pneumoniae infection induces asthma onset[J].J Allergy Clin Immunol,2016,137(4):1024-1025.
[5] Zhang H,Lv G,Shang Y,et al.Changes of airway reactivity after mycoplasma pneumoniae infection in children:a study for early precautions against pediatric asthma[J].Iran J Allergy Asthma Immunol,2015,14(5):476-482.
[6] Noelle RJ,Roy M,Shepherd DM,et al.Pillars article:a 39-kDa protein on activated helper T cells binds CD40 and transduces the signal for cognate activation of B Cells.Proc.Natl.Acad.Sci.1992.89:6550-6554[J].J Immunol,2016,197(11):4195-4199.
[7] Gupta S,Termini JM,Rivas Y,et al.A multi-trimeric fusion of CD40L and gp100 tumor antigen activates dendritic cells and enhances survival in a B16-F10 melanoma DNA vaccine model [J].Vaccine,2015,33(38):4798-4806.
[8] Lagos LX,Iliev DB,Helland R,et al.CD40L--a costimulatory molecule involved in the maturation of antigen presenting cells in Atlantic salmon (Salmo salar)[J].Dev Comp Immunol,2012,38(3):416-430.
[9] Ruybal P,Gravisaco MJ,Barcala V,et al.Complete rejection of a T-cell lymphoma due to synergism of T-cell receptor costimulatory molecules,CD80,CD40L,and CD40[J].Vaccine,2008,26(5):697-705.
[10]Hong GU,Park BS,Park JW,et al.IgE production in CD40/CD40L cross-talk of B and mast cells and mediator release via TGase 2 in mouse allergic asthma[J].Cell Signal,2013,25(6):1514-1525.
[11]蔡玮婷,彭瑜,张钲.血小板及其趋化因子在动脉粥样硬化中作用的研究进展[J].中国循环杂志,2016,31(8):816-818.
[12]Stach K,Nguyen XD,Lang S,et al.Simvastatin and atorvastatin attenuate VCAM-1 and uPAR expression on human endothelial cells and platelet surface expression of CD40 ligand[J].Cardiol J,2012,19(1):20-28.
[13]中华医学会儿科学分会呼吸学组《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,46(10):745-753.
[14]Maffey AF,Barrero PR,Venialgo C,et al.Viruses and atypical bacteria associated with asthma exacerbations in hospitalized children[J].Pediatr Pulmonol,2010,45(6):619-625.
[15]栾海丽,张晗,尚云晓.儿童肺炎支原体肺炎肺泡灌洗液中T细胞亚群及细胞因子检测的意义[J].中国小儿急救医学,2017,24(11):850-854.
[16]柯莉芹,王凤美,李银洁,等.儿童肺炎支原体肺炎流行病学特征[J].中国当代儿科杂志,2013,15(1):33-36.
[17]Huang F,Lu L,Jiang W,et al.The epidemiology and clinical features of Mycoplasma pneumoniae infection in neonates[J].Braz J Infect Dis,2016,20(4):374-378.
[18]Varshney AK,Chaudhry R,Saharan S,et al.Association of Mycoplasma pneumoniae and asthma among Indian children[J].FEMS Immunol Med Microbiol,2009,56(1):25-31.
[19]Smith-Norowitz TA,Silverberg JI,Kusonruksa M,et al.Asthmatic children have increased specific anti-Mycoplasma pneumoniae IgM but not IgG or IgE-values independent of history of respiratory tract infection[J].Pediatr Infect Dis J,2013,32(6):599-603.
[20]王海萍,陈秀丽,周朱瑛,等.肠道病毒71型脑炎患儿血清和脑脊液CD40、CD40L和血管细胞黏附分子-1检测的价值[J].疾病监测,2015,30(7):534-538.
[21]Castro M,Mathur S,Hargreave F,et al.Reslizumab for poorly controlled,eosinophilic asthma:a randomized,placebo-controlled study[J].Am J Respir Crit Care Med,2011,184(10):1125-1132.
[22]Fleming L,Wilson N,Regamey N,et al.Use of sputum eosinophil counts to guide management in children with severe asthma[J].Thorax,2012,67(3):193-198.
[23]Wang L,Shirure VS,Burdick MM,et al.UVB-irradiation regulates VLA-4-mediated melanoma cell adhesion to endothelial VCAM-1 under flow conditions[J].Mol Carcinog,2011,50(1):58-65.
[24]王丽培,成志锋.血管细胞黏附分子1及其与痛风和其他代谢性疾病的相关性[J].医学综述,2017,23(11):2111-2115.
