水稻花药开裂前茉莉酸水平及信号途径相关基因表达的动态变化
2018-06-29何永明刘遂飞雷抒情
何永明,刘遂飞,雷抒情
(江西农业大学 作物生理生态与遗传育种教育部重点实验室/江西省作物生理生态与遗传育种重点实验室,江西 南昌 330045)
水稻颖花开放(或称开花)是其生殖生长的重要环节,直接影响授粉、受精和结实。成熟稻穗的颖花开放时间容易受到品种特性和环境条件的影响,通常发生在09:00—12:00[1]。水稻开花期遇35 ℃以上高温引起的颖花不育现象与开花后花药不开裂密切相关[2]。除常见的花粉败育外,花药开裂异常也是水稻雄性不育系的性状之一[3]。研究水稻花药开裂机制不仅有助于揭示水稻雄性生殖发育过程,同时对花期高温不育危害的解决及新型雄性不育系的创制也具有实践意义。
植物激素茉莉酸类(jasmonates,JAs)属于氧化的脂肪酸衍生物,是由脂类经十八烷酸途径产生的末端化合物。大量研究表明,JAs在植物根系生长、花器官发育、花青素合成、卷须环绕、块茎形成、叶片衰老以及抗病虫反应等方面发挥重要调控作用[4]。近年研究还发现,JA信号转导涉及SCFCOI1复合体依赖的JAZ抑制蛋白的降解[5]。许多研究发现,JA在水稻颖花开放中发挥了关键作用。颖花开放是由浆片膨大推开外稃所引起的,并同步发生花丝伸长和花药开裂的复杂事件。外源MeJA或JA对水稻、小麦、黑麦、高粱等禾本科植物颖花开放有强烈的诱导作用[6-7]。水稻颖花和浆片內源JA水平在颖花张开时会大幅上升,相应地JA途径相关基因表达的也会上调[8-9];并且浆片内源JA缺乏是导致雄性不育系珍汕97A花时零散的主要原因[10]。JA途径突变体dad1、aos、opr3和coi1花药均异常开裂[4]。近期发现水稻JA不敏感突变体osjar1[11]花药开裂异常并导致雄性不育,但是花药开裂前内源JA信号的动态变化和调控位点目前并不清楚。为此,本文以粳稻中花11为试验材料,测定和分析其花药开裂前内源JA水平以及JA合成和信号途径关键基因表达的变化,以期进一步阐明JA调控水稻花药开裂的分子机制。
1 材料与方法
1.1 试验材料
水稻品种为粳稻中花11,2015年4月10日播种,种植于江西农业大学科技园试验田,常规管理,抽穗期为7月上旬。
1.2 试验方法
1.2.1 颖花开放动态 调查08:00随机选取6株上部已少量开花的大分蘖穗,调查08:00—16:00的颖花开放数,每30 min调查1次。
1.2.2 花药样品的采集 根据调查,颖花开放的高峰时间为11:30,高峰期开花数占日总开花数的80%左右。挂牌标记前1~2 d已开过少量颖花的大分蘖,分别剥取颖花开放前24,4,2,0 h(刚开放)的花药,花药成熟度的判断依据颖花着生位置和花药长度。所剥取的花药立即用液氮速冻,保存于-80 ℃冰箱中备用。
1.2.3 JA和JA-Ile的提取和测定 激素提取方法参照黄俊宝等[9]。液氮研磨样品,准确称取约0.1 g粉末,装入1.5 mL离心管中,加500 μL预冷的提取液(甲醇/水/乙酸=90/9/1),置于平板摇床(200 r/min)上,4 ℃避光浸提24 h,4 ℃ 12 000 r/min离心15 min,吸取上清液;共提3次,合并3次提取液。提取液在室温下用N2吹干,加200 μL甲醇溶解过夜,甲醇容液经0.22 μm尼龙滤膜过滤后保存于-20 ℃冰箱中待测。采用UFLC-ESI-MS系统,按Liu等[12]的方法测定JA和JA-Ile含量。每份样品4次生物学重复。
1.2.4 Real-time PCR分析方法 参考何永明和曾晓春[13]。花药总RNA的提取采用Trizol试剂(北京全式金公司)。取1 μg RNA,先用DNaseⅠ(Invitrogen)去除少量的基因组DNA,再用M-MLV逆转录酶(Invitrogen)反转录合成cDNA。Real-time PCR采用SYBR Premix Ex TaqⅡ试剂盒(大连TaKaRa公司),样品cDNA(10 ng/μL)2 μL,F/R引物(10 μmol/L)各0.2 μL,反应体积10 μL。扩增反应在ABI PRISM 7500 real-time PCR系统上进行,反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 35 s,40个循环。以OsGAPDH作内参,目标基因和内参基因的信息和引物序列参见黄俊宝等[9],此外脂氧合酶OsLOX6的登录号是LOC_Os03g08220,检测引物F:5′-CTTCTTCCTGAACGCGATG-3′,R:5′-TCAGATGGAGATGCTGTTGG-3′。每份样品3次生物学重复。
1.3 数据处理
以Microsoft Excel 2010软件处理数据和作图,差异显著性分析采用LSD法。
2 结果与分析
2.1 试验条件下中花11的颖花开放动态和结实率

图1 试验条件下粳稻中花11的颖花开放动态Fig.1 The floret opening time of Japonica rice cultivar Zhonghua 11 in experiment condition
由于水稻颖花开放容易受到品种基因型和环境条件的影响,本研究取样前先考查了试验条件下中花11的颖花开放动态。由图1可知,试验材料的盛花时间为11:30,约占日开花总数的80%,因此以11:30作为颖花开放时间。正常情况下,水稻花药开裂与颖花开放是同步进行的,否则影响结实率。试验材料的结实率为(84.6±2.8)%,说明花粉活力和花药开裂正常。
2.2 花药开裂时JA和JA-Ile水平急剧增加
植物细胞新合成的JA不能直接激活下游信号转导途径,需进一步与异亮氨酸(isoleucine,Ile)结合形成茉莉脂异亮氨酸(JA-Ile)后,才能诱导下游响应基因的表达[5]。JA-Ile是细胞内JA众多代谢物之一。为此,本试验同时测定花药JA和JA-Ile的水平。从表1可知,花药JA水平从开裂前24 h至2 h增加4.1倍,开裂时花药JA水平较开裂前2 h增加8.3倍;从开裂前24 h至2 h,花药JA-Ile水平无显著变化,但开裂时花药JA-Ile水平急剧上升,较开裂前2 h增加55倍。这说明,花药JA和JA-Ile水平从花药开裂前2 h起会急剧上升。开裂时花药JA-Ile与JA含量的摩尔比为4.2,表明新形成的JA迅速与异亮氨酸结合,转变为JA-Ile。
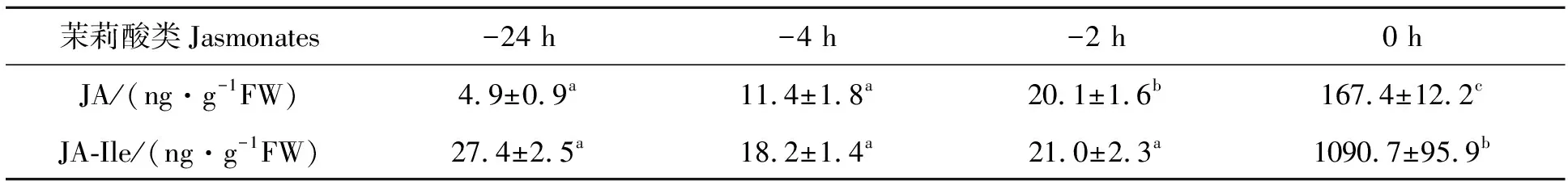
表1 水稻花药开裂前不同时间点JA和JA-Ile的水平Tab.1 The levels of JA and JA-Ile in rice anthers at different points before splitting
-24 h、-4 h、-2 h及0 h表示花药开裂24、4、2、0 h;不同小写字母表示在P<0.05水平上差异显著
-24 h,-4 h,-2 h and 0 h mean 24,4,2,0 h before anther dehiscence.Different small letters indicate significant difference at 0.05 level
2.3 花药开裂前JA代谢途径相关基因的表达变化
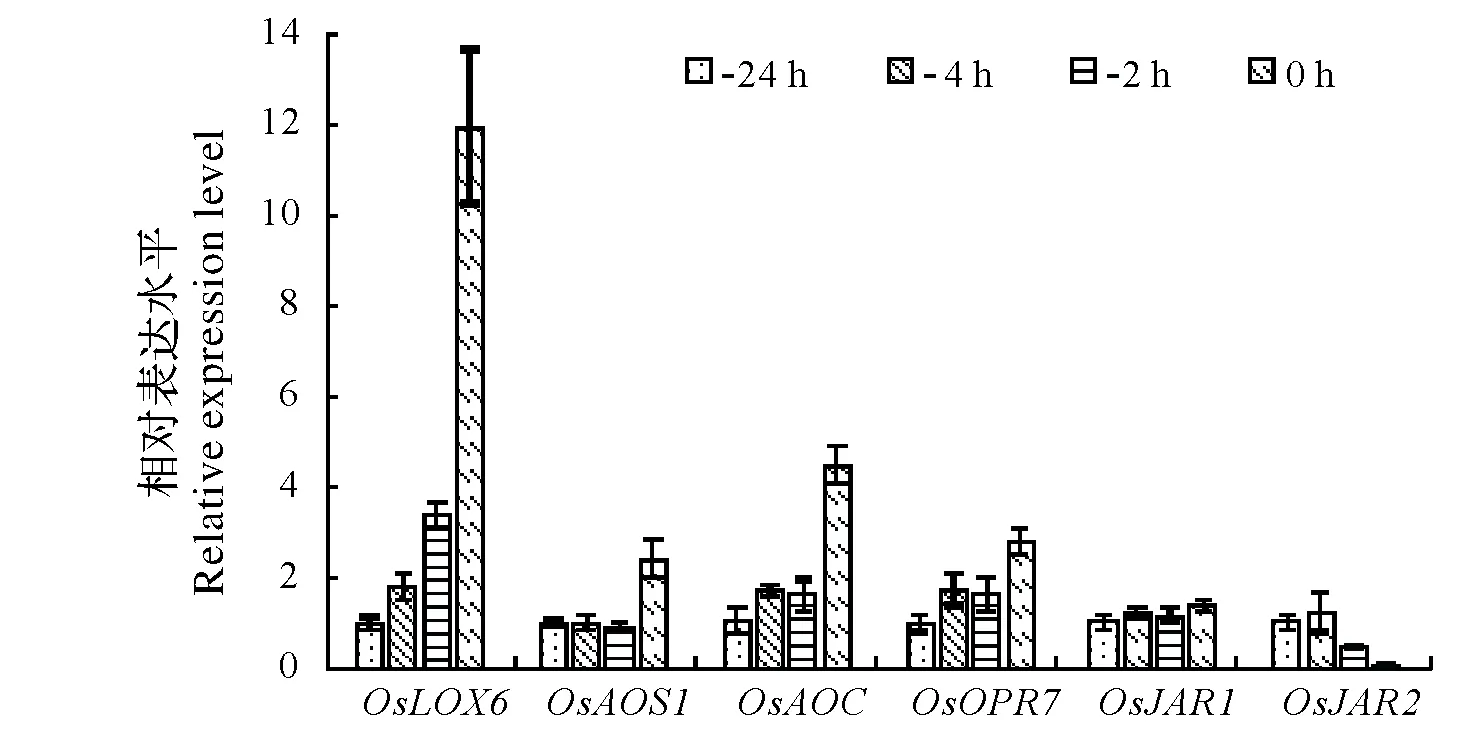
图2 水稻花药开裂前不同时间点JA代谢途径相关基因的表达水平 Fig.2 The expression levels of genes related to JA metabolism pathway in rice anthers at different points before splitting
细胞内JA生物合成起始于亚麻酸(a-linolenic acid),亚麻酸经13-LOX、AOS、AOC和OPR3的依次催化和3步β-氧化反应(β-oxidation)后,最终生成(3R,7S)-JA[4]。拟南芥lox3lox4双突变体出现开花时花药不开裂的表型[14],水稻基因组含有6个13-LOX家族基因,其中与AtLOX3和AtLOX4同源性最高的是OsLOX6,达到62.8%和64.4%[15]。水稻编码AOS同工酶的基因为OsAOS1和OsAOS2;OsAOS2在成熟花药中的表达量非常低[9],本文也得到相同的结果(数据未给出),OsAOS2在花药晚期发育中应该不起主要作用。催化水稻JA生物合成的AOC和OPR3分别由单个同源基因OsAOC和OsOPR7编码[8]。从图2可知,随着颖花开放的临近,花药JA生物合成关键基因OsLOX6、OsAOS1、OsAOC和OsOPR7的表达量均有一定程度的上升,分别较开裂前24 h增加12、2.4、4.5和2.8倍,其中OsLOX6表达上调幅度最大。
在茉莉酸-氨基酸合成酶(JAR1)的催化下,新合成JA与异亮氨酸(Ile)结合,转变为JA信号转导活性形式JA-Ile。拟南芥中该酶由单基因AtJAR1编码,水稻基因组中与AtJAR1同源的基因为OsJAR1和OsJAR2[16]。从开裂前24 h至0 h,花药OsJAR1的表达水平略有增加,而OsJAR2的表达水平急速下降(图2)。
2.4 花药开裂前JA信号转导途径相关基因的表达变化
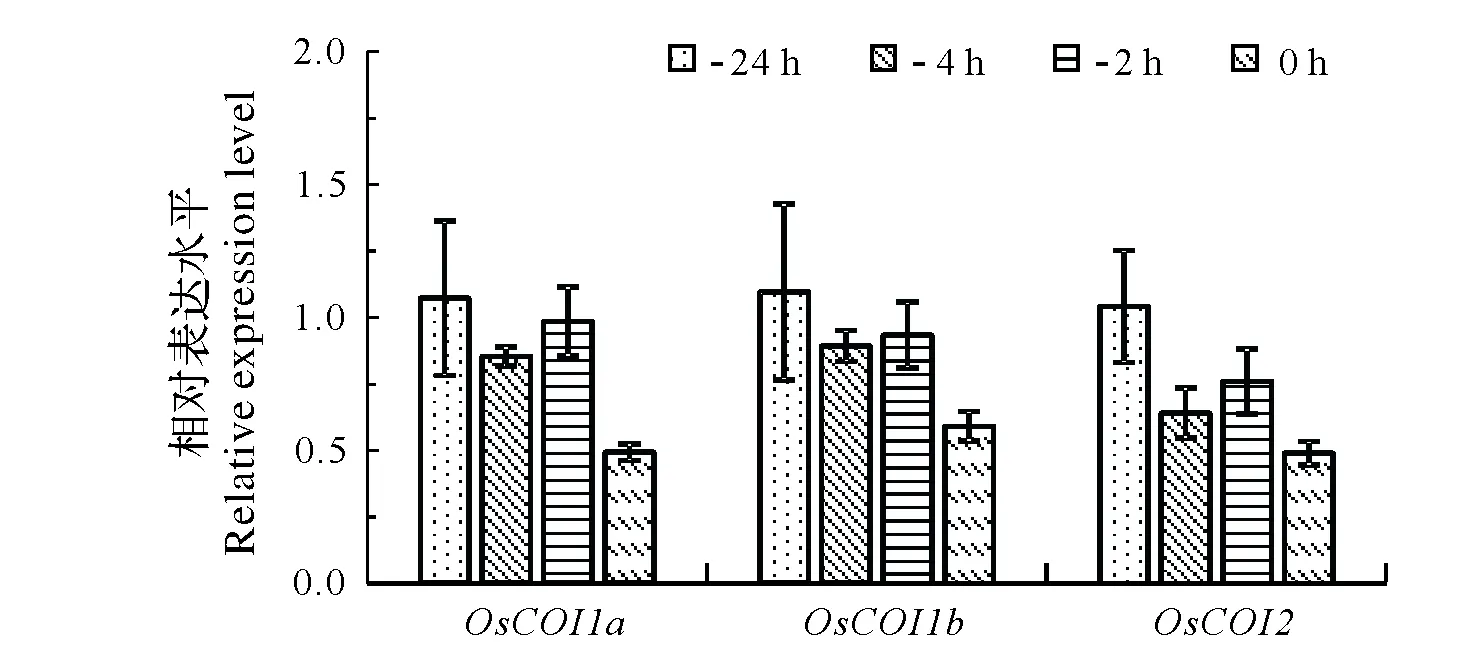
图3 水稻花药开裂前不同时间点COI1同源基因的表达水平Fig.3 The expression levels of COI1 homologous genes in rice anthers at different points before splitting
JA信号感知的受体蛋白是COI1,其属于SCF E3连接酶复合体的F-box蛋白组分,能特异识别活性分子JA-Ile,水稻基因组中存在3个编码COI1蛋白的家族基因OsCOI1b、OsCOI1a和OsCOI2[17],花药开裂时这3个基因的表达水平都略有下降,较开裂前24 h分别降低50%左右(图3)。
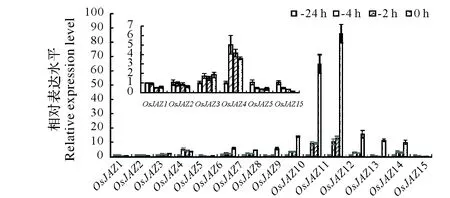
图4 水稻花药开裂前不同时间点OsJAZ家族基因的表达水平Fig.4 The expression levels of OsJAZs in rice anthers at different points before splitting
JAZ蛋白家族是JA信号转导的负向调控因子,在休止状态(JA-Ile低),JAZ蛋白与转录因子(MYC2)结合,阻碍JA响应基因的表达;在活化状态(JA-Ile高),SCFCOI1召唤JAZ蛋白并将其泛素化,导致JAZ蛋白被26S 蛋白酶体降解,从而启动JA 响应基因的转录[5]。水稻OsJAZ基因家族共有15个成员(OsJAZ1-15),发挥精细调控JA响应的作用[18]。从图4可知,花药开裂时OsJAZ1、OsJAZ2、OsJAZ5和OsJAZ15表达水平下降,其余11个OsJAZs的表达水平上升。其中,OsJAZ15下降幅度最大,较开裂前24 h降低7.3倍;OsJAZ10和OsJAZ11上升幅度最大,比开裂前24 h分别升高65和86倍。
3 讨 论
花药开裂为花药发育过程中需经历的最后一个阶段,花药能否适时开裂直接影响植物的传粉和受精。JA是调控双子叶拟南芥花药开裂的重要信号分子。例如,拟南芥JA缺失突变体lox3lox4、opr3、aos以及JA不敏感突变体coi1均表现出开花时花药不同步开裂的异常现象[4,15]。同时,拟南芥花苞JA水平在接近花药开裂时(11-12期)会显著上升,较发育早中期(1-10期)增加6.7倍[19]。早期鉴定的JA缺失突变体hebiba是雄性不育,但它是雄性器官早期发育缺陷所导致的[20]。近期研究[11]发现,水稻JA不敏感突变体osjar1也表现出开颖时花药不正常开裂的现象。osjar1的颖花JA水平比野生型高3.5倍,但JA-Ile水平比野生型低100倍,即JA-Ile是调控花药开裂的的JA信号分子。本研究表明,水稻花药开裂时JA和JA-Ile水平较开裂前2 h分别升高8.3和55倍,这表明花药临近开裂前会产生大量的JA,并迅速转变为JA-Ile,佐证了Xiao等[11]的结果。
雄性不育系珍汕97A花时零散的现象与浆片OsAOC表达水平较低引起的JA含量不足有关[10],同样花药开裂时OsAOC的表达水平较开裂前2 h升高2.8,以满足JA大量合成的需要。新合成的JA转变为JA-Ile需要JAR1的催化,OsJAR1和OsJAR2均有此功能,但OsAJAR1的表达与花器官发育更密切[11,17]。水稻浆片膨大时JA含量快速上升,OsJAR1的表达也相应显著上调[9]。本研究通过检测JA合成途径关键基因的表达,发现花药开裂前OsLOX6、OsAOS1、OsAOC和OsOPR7的表达量均上升,这与花药JA水平的上升相对应。OsLOX6表达水平的增加幅度较其他3个基因大的多,表明上游催化酶的表达对JA生物合成的影响更大,这与非诱导植株JA生物合成严格受到底物供给的限制相一致[21]。虽然花药开裂时JA-Ile的水平急速上升,但OsJAR1的表达水平不明显上调,OsJAR2表达水平显著下调。这可能与花药开裂早期OsJAR1的表达水平就已非常高,OsJAR1的酶活性不是限制JA-Ile形成的主要因素有关。相关研究[22]也指出,JAR1虽必需但不是主要调控位点,前体物JA或OPDA的供应对JA-Ile迸发有直接影响。
COI1是感知JA-Ile的受体蛋白,多数情况下JA水平的升高会促进COI1基因的表达,但在拟南芥花青素积累thf1突变体中JA含量的上升并不相应伴随COI1的上调表达[23]。水稻中3个COI1同源基因OsCOI1a、OsCOI1b和OsCOI2的表达水平在花药开裂时略有下降,并不随JA-Ile的迸发而上调。这表明,JA依赖的花药开裂主要归功于JA和JA-Ile水平的大幅上升。JA-Ile信号引起JAZ抑制蛋白的泛素化途径降解,从而诱导JA响应基因的表达。JAZ家族蛋白间存在同型或异型的相互作用,形成精细的JAZs调控网络,响应JA特异生理功能。目前发现OsJAZ1、OsJAZ8、OsJAZ9和OsJAZ10分别参与花器官发育、抗病性、抗盐性、茎秆发育[24]。水稻花药开裂时15个OsJAZs家族成员的表达差异很大,OsJAZ1、OsJAZ2、OsJAZ5和OsJAZ15表达水平下降,其余11个OsJAZs的表达水平均会上升。花药OsJAZ10和OsJAZ11的上升幅度最大,比开裂前24 h分别增加了65和86倍。许多研究[5,25]已证实,JA诱导的JAZ抑制蛋白降解能反馈促进JAZ基因的表达,以补充JAZ库。结果表明,JA信号诱导的OsJAZ10和OsJAZ11蛋白的快速降解在花药开裂中发挥重要调控作用,后续将利用分子生物学手段深入研究。
参考文献:
[1] 何永明,曾晓春,向妙莲,等.水稻花时调控研究进展[J].湖北农业科学,2014,53(7):1489-1492.
He Y M,Zeng X C,Xiang M L,et al.Advances on floret opening time of rice[J].Hubei Agricultural Sciences,2014,53(7):1489-1492.
[2] Ishimaru T,Hirabayashi H,Ida M,et al.A genetic resource for early-morning flowering trait of wild riceOryzaofficinalisto mitigate high temperature-induced spikelet sterility at anthesis[J].Annals of Botany,2010,106(3):515-520.
[3] 袁隆平.杂交水稻学[M].北京:中国农业出版社,2002:246-279.
Yuan L P.Hybrid Rice Sciences[M].Beijing:China Agricultural Press,2002:246-279.
[4] Wasternack C.Jasmonates:an update on biosynthesis,signal transduction and action in plant stress response,growth and development[J].Annals of Botany,2007,100(4):681-697.
[5] Pauwels L,Goossens A.The JAZ proteins:a crucial interface in the jasmonate signaling cascade[J].The Plant Cell,2011,23(9):3089-3100.
[6] Zeng X C,Zhou X,Zhang W,et al.Opening of rice floret in rapid response to methyl jasmonate[J].Journal of Plant Growth Regulation,1999,18(4):153-158.
[7] 闫芝芬,周燮,马春红,等.冠毒素和茉莉酸甲酯对诱导小麦、黑麦和高羊茅草颖花开放的效应[J].中国农业科学,2001,34(3):334-337.
Yan Z F,Zhou X,Ma C H,et al.Inducing effect of coronatine and methyl jasmonate on the opening of spikelets in wheat,rye and mildew[J].Scientia Agricultura Sinica,2001,34(3):334-337.
[8] 何永明,林拥军,曾晓春.水稻颖花自然开放过程中茉莉酸(JA)生物合成的变化[J].作物学报,2012,38(10):1891-1899.
He Y M,Lin Y J,Zeng X C.Dynamic changes of jasmonic acid biosynthesis in rice florets during natural anthesis[J].Acta Agronomica Sinica,2012,38(10):1891-1899.
[9] 黄俊宝,何永明,曾晓春,等.水稻颖花开放前花器官茉莉酸水平变化及浆片茉莉酸信号基因表达分析[J].中国农业科学,2015,48(6):1219-1227.
Huang J B,He Y M,Zeng X C,et al.Changes of JA levels in floral organs and expression analysis of JA signaling genes in lodicules before floret opening in rice[J].Scientia Agricultura Sinica,2015,48(6):1219-1227.
[10] Liu L,Zou Z,Qian K,et al.Jasmonic acid deficiency leads to scattered floret opening time in cytoplasmic male sterile rice Zhenshan 97A[J].Journal of Experimental Botany,2017,68(16):4613-4625.
[11] Xiao Y G,Chen Y,Charnikhova T,et al.OsJAR1 is required for JA-regulated floret opening and anther dehiscence in rice[J].Plant Molecular Biology,2014,86(1/2):19-33.
[12] Liu H,Li X,Xiao J,et al.A convenient method for simultaneous quantification of multiple phytohormones and metabolites:Application in study of rice-bacterium interaction[J].Plant Methods,2012,8(1):2.
[13] 何永明,曾晓春.开花期水稻颖花实时定量RT-PCR分析中内参基因的选择[J].江西农业大学学报,2012,34(6):1086-1092.
He Y M,Zeng X C.Reference gene selection for quantitative real-time RT-PCR normalization in rice florets during anthesis[J].Acta Agriculturae Universitatis Jiangxiensis,2012,34(6):1086-1092.
[14] Caldelari D,Wang G,Farmer E E,et al.Arabidopsislox3lox4 double mutants are male sterile and defective in global proliferative arrest[J].Plant Molecular Biology,2011,75(1/2):25-33.
[15] Borrego E,Kolomiets M V.Synthesis and functions of jasmonates in maize[J].Plants,2016,5(4):41.
[16] Wakuta S,Suzuki E,Saburi W,et al.OsJAR1 and OsJAR2 are jasmonyl-L-isoleucine synthases involved in wound-and pathogen- induced jasmonic acid signaling[J].Biochemical and Biophysical Research Communications,2011,409(4):634-639.
[17] Lee H Y,Seo J S,Cho J H,et al.OryzasativaCOI homologues restore jasmonate signal transduction inArabidopsiscoi1-1 mutants[J].PLoS ONE,2013,8(1):e52802.
[18] Ye H,Du H,Tang N,Li X,et al.Identification and expression profiling analysis of TIFY family genes involved in stress and phytohormone responses in rice[J].Plant Molecular Biology,2009,71(3):291-305.
[19] Nagpal P,Ellis C M,Weber H,et al.Auxin response factors ARF6 and ARF8 promote jasmonic acid production and flower maturation[J].Development,2005,132(18):4107-4118.
[20] Riemann M,Muller A,KorteA,et al.Impaired induction of the jasmonate pathway in the rice mutanthebiba[J].Plant Physiology,2003,133(4):1820-1830.
[21] Laudert D,Schaller F,Weiler E W.TransgenicNicotianatabacumandArabidopsisthalianaplants overexpressing alleneoxide synthase[J].Planta,2000,211(1):163-165.
[22] Browse J.Jasmonate passes muster:a receptor and targets for the defense hormone[J].Annual Review of Plant Biology,2009,60:183-205.
[23] Gan Y,Li H,Xie Y,et al.THF1 mutations lead to increased basal and wound-induced levels of oxylipins that stimulate anthocyanin biosynthesis via COI1 signaling inArabidopsis[J].Journal of Integrative Plant Biology,2014,56(9):916-927.
[24] Dhakarey R,Peethambaran P K,Riemann M.Functional analysis of jasmonates in rice through mutant approaches[J].Plants,2016,5(1):15.
[25] Chung H S,Koo A J,Gao X,et al.Regulation and function ofArabidopsisJASMONATE ZIM-domain genes in response to woundingand herbivory[J].Plant Physiology,2008,146(3):952-964.
