丁酸对瘤胃上皮细胞生长和凋亡的影响
2018-06-29彭志鹏熊小文温庆琪瞿明仁欧阳克蕙
彭志鹏,罗 丹,许 超,熊小文,温庆琪,瞿明仁,欧阳克蕙*
(1.江西农业大学 江西省动物营养重点实验室/营养饲料开发工程研究中心,江西 南昌 330045;2.上海美农生物科技股份有限公司,上海 201800)
丁酸是瘤胃微生物产生的一种短链脂肪酸,是反刍动物的重要能量来源[1]。但当反刍动物采食高精料日粮时,丁酸浓度可能会上升到正常情况下的2~3倍[2-3],诱导亚急性瘤胃酸中毒的发生[4],给现代反刍动物生产带来严重影响。许多研究显示,丁酸对维持和保护上皮屏障结构和功能有益,能促进上皮细胞的增殖[5-6]。也有研究显示,过高浓度的丁酸反而会促进细胞凋亡[7-8]。反刍动物发生瘤胃酸中毒情况下,往往造成瘤胃上皮屏障结构破损和功能丧失[9-10],这是否与瘤胃丁酸浓度过高引起的瘤胃上皮细胞凋亡有关尚不明确。本试验通过体外细胞培养技术,研究丁酸对瘤胃上皮细胞生长及凋亡的影响。
1 材料与方法
1.1 试验材料
DMEM培养基、胎牛血清、青链霉素、ITS、丁酸;DMSO、MTT、Tunel试剂盒、DNA ladder试剂盒、Annexin-V/PI试剂盒;全自动酶标仪、荧光显微镜、流式细胞仪。
1.2 试验方法
瘤胃上皮细胞原代培养:试验动物为15日龄湖羊,颈动脉放血处死,剪取瘤胃组织用PBS冲洗干净并用完全培养基带回实验室超净工作台中,钝性分离瘤胃上皮,剪碎后用胶原酶和胰蛋白酶进行消化处理,收集细胞悬液接种于含10%胎牛血清、100 EU/mL青链霉素、1×ITS的DMEM培养基中,于5% CO2、37 ℃的培养箱中培养,30 min后将悬液换瓶培养,重复1次。
待培养的瘤胃上皮原代细胞长满约80%~90%,用胰蛋白酶消化5 min,呈单细胞悬液,调整细胞密度为5×103接种于96孔板中培养。培养24 h贴壁后,每孔加培养液100 μL,设8个处理,每个处理6个重复,在培养液中分别添加0,20,40,60,80,100,120,140 mmol/L的丁酸,调节pH至7.4。于5% CO2,37 ℃培养箱中培养,分别于4,6,8,10 h后用于检测各组细胞活力。
根据相对细胞活力(细胞相对活力为70%左右)筛选最适宜的丁酸处理设为丁酸组(普通培养基+适宜浓度丁酸),与对照组(普通培养基),采用荧光标记法、电泳法、流式细胞术检测细胞凋亡情况。
1.3 测定项目和方法
1.3.1 瘤胃上皮细胞活力的检测 采用MTT法检测瘤胃上皮细胞的细胞活力。将培养物小心地吸去上清液弃去,用PBS冲洗2~3遍,加普通培养基120 μL(含20 μL 5 mg/mL MTT溶液),继续培养4 h,弃上清液,再每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪上分析,OD490nm处测量各孔的吸光值。将每个时间段对照组细胞活力定义为100%,试验组相对细胞活力根据下列公式计算:
相对细胞活力(%)=OD试验组/OD对照组×100%
(1)
1.3.2 细胞凋亡检测 (1)荧光标记法。原代细胞长满约80%~90%,消化离心去上清,接种于6孔板加玻璃盖片进行爬片培养,铺层至80%~90%时,添加丁酸培养至细胞活力为70%左右,培养好的细胞用4%多聚甲醛固定30 min,PBS洗2 min×3,3%双氧水室温处理10 min,PBS洗2 min×3,Proteinase K 37 ℃消化30 s,PBS洗2 min×3,加标记缓冲液于湿盒中37 ℃标记2 h,PBS洗2 min×3,加封闭液30 min,生物素化抗地高辛抗体于湿盒中37 ℃ 30 min,PBS洗2 min×3,SABC-FITC 37 ℃ 30 min,PBS洗5 min×4,DAPI轻度复染30 s,PBS洗5 min×3,抗荧光衰减封片剂封片,分别用490 nm和360 nm激发光照射并在荧光显微镜观察。阴性对照中用PBS替换DIG-dUTP。结果判定:细胞核中有黄绿色颗粒者为阳性细胞,即凋亡细胞。
(2)电泳法。取对数生长期的瘤胃上皮细胞接种于25 cm2培养瓶中,与丁酸共培养至细胞活力为70%左右。培养好的细胞,胰蛋白酶消化收集细胞,按DNA ladder试剂盒说明书进行操作。电泳后观察细胞核酸变化。
(3)流式细胞术。取对数生长期的瘤胃上皮细胞接种于6孔板中,与丁酸共培养至细胞活力为70%左右,将细胞上层培养液去除,PBS洗涤2次,用胰蛋白酶消化细胞并终止消化,1 000 g离心5 min,PBS清洗1次,用PBS重悬细胞。制成细胞悬液,取1×106重悬的细胞离心后,加入500 μL结合液轻轻重悬。再加入5 μL Annexin V-FITC,轻轻混匀,再加入5 μL碘化丙啶,轻轻混匀。 室温避光孵育10 min。随即进行流式细胞仪检测,激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。结果判定:Annexin和PI双染阴性为正常细胞;Annexin阳性,PI阴性为早期凋亡细胞;Annexin和PI双染阳性为晚期凋亡细胞;Annexin阴性,PI阳性为坏死细胞。早期凋亡和晚期凋亡的细胞统计为凋亡细胞。细胞凋亡指数根据下列公式计算:
细胞凋亡指数(PI)=凋亡细胞数/检测的细胞总数×100%
(2)
1.4 统计分析
采用SPSS 17.0方差分析程序对试验数据统计分析。数据分析采用独立样本单因素分析(One-way ANOVA)和多重比较(Duncan’s)。数据用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果分析
2.1 不同浓度丁酸对瘤胃上皮细胞活力的影响
MTT法检测各组和各时间点的相对细胞活力,结果见表1。结果显示:各时间点细胞活力随丁酸浓度的增加均呈现先上升后下降趋势。20,40 mmol/L丁酸处理组在各培养时间点与对照组差异均不显著,60~140 mmol/L丁酸处理组均显著低于对照组。
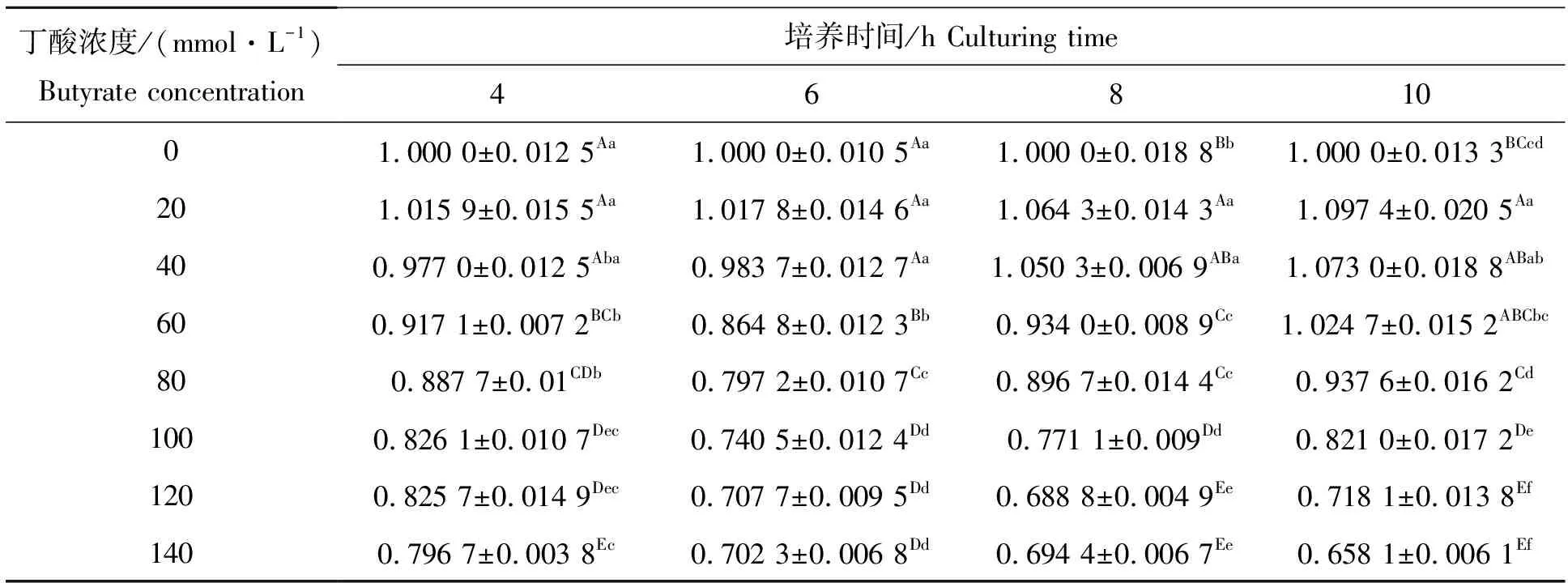
表1 丁酸对瘤胃上皮相对细胞活力的影响Tab.1 Effects of butyrate on the relative viability of ruminal epithelial cell %
同列之间比较,不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。下同
Different capital letters in same column mean significant difference at the 0.01 level,and different small letters indicate significant difference at the 0.05 level.The same as bellow
随着培养时间的延长,20~40 mmol/L丁酸处理组细胞活力呈现逐渐提高的趋势,其中20 mmol/L丁酸处理组在各时间点均高于对照组(P>0.05),40 mmol/L丁酸组在培养4~6 h时降低细胞活力(P>0.05),在培养8~10 h时提高细胞活力(P>0.05)。随着培养时间的延长,60~120 mmol/L丁酸处理组显示细胞活力随时间延长先下降后上升,其中60 mmol/L丁酸处理组在培养10 h处提高细胞活力(P>0.05),其他各处理组均降低细胞活力,除80 mmol/L丁酸组10 h处差异不显著(P>0.01)外,其他各组均达到了极显著的差异(P<0.01)。120 mmol/L、140 mmol/L丁酸处理组显示细胞活力最低,且两组间比较差异不显著(P>0.05)。
2.2 免疫荧光法检测结果
根据上一结果,选择较温和的条件(细胞相对活力70%左右[11])来观察细胞凋亡情况,具体条件为120 mmol/L丁酸,培养6 h。细胞TUNEL染色检测结果见图1。由图1可见,丁酸组的上皮细胞出现大面积脱落,且细胞“群落”边缘多为黄绿色标记的细胞;对照组中只有少部分细胞被标记为黄绿色,未有细胞脱落现象。

A:对照组;B:120 mmol/L丁酸组A:Control group;B:120 mmol/L Butyrate group图1 荧光标记凋亡细胞的观察Fig.1 Apoptotic cell marked by fluorescent

M:Marker;A:对照组;B:120 mmol/L丁酸组M:Marker;A:Control group;B:120 mmol/L Butyrate group图2 电泳法对瘤胃上皮细胞DNA Ladder的检测Fig.2 DNA ladder examination of ruminal epithelial cell by electrophoresis analysis
2.3 DNA ladder电泳检测结果
DNA ladder电泳检测结果见图2。由图2可见,120 mmol/L丁酸作用6 h,可见100~500 bp处呈现条带拖尾现象;对照组在100~500 bp处未见此现象。
2.4 流式细胞仪检测结果
流式细胞仪检测结果见图3和表2。结果显示:120 mmol/L丁酸处理6 h后,相比于对照组的74.2%正常细胞、9%早期凋亡细胞和15.1%晚期凋亡细胞,丁酸组变为69.5%正常细胞,7.8%早期凋亡细胞和20.6%晚期凋亡细胞。可见,丁酸组减少了早期凋亡的细胞数量,增加了晚期凋亡的细胞数量,其总凋亡指数(28.4%)与对照组(24.1%)比较有显著差异(P<0.05)。
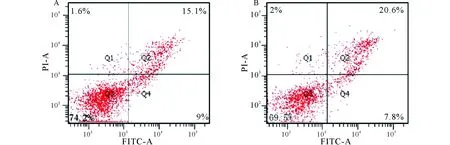
A:对照组;B:120 mmol/L丁酸组A:Control group;B:120 mmol/L Butyrate group图3 丁酸处理对瘤胃上皮细胞凋亡指数的影响Fig.3 Effects of butyrate on apoptotic index of ruminal epithelial cell
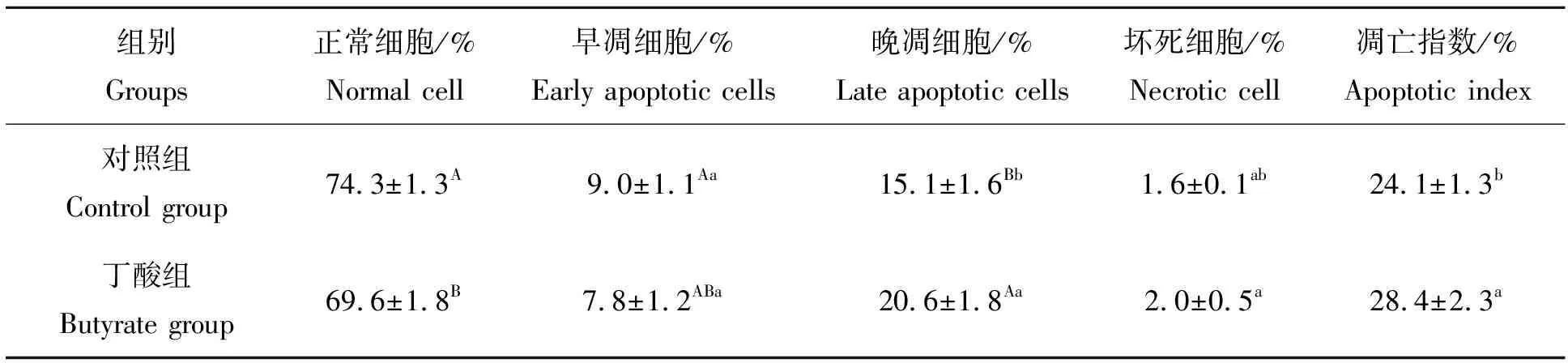
表2 丁酸处理对瘤胃上皮细胞凋亡的影响Tab.2 Effects of butyrate on apoptotic of ruminal epithelial cells
3 讨论结论
本研究发现,低浓度的丁酸能促进瘤胃上皮细胞生长,而浓度过高的丁酸会抑制细胞生长,这种抑制作用可能和高浓度丁酸促进了瘤胃上皮细胞凋亡有关。许多研究表明,短链脂肪酸丁酸可供给细胞能量,是一种有效的肠道保健剂,能促进胃肠道上皮细胞增殖[6-7]。Guilloteau等[12]用3 g/kg丁酸钠替代黄霉素,发现丁酸钠可以提高胃和结肠中热休克蛋白HSP27和HSP70浓度,保护胃肠上皮细胞,促进犊牛胃肠功能成熟。胡卫[13]研究发现,体内肠腔正常浓度(10 mmol/L)的丁酸钠,在体外亦有抑制大鼠结肠上皮细胞凋亡的作用,从而有助于治疗溃疡性结肠炎。但Siavoshian[14]研究表明,丁酸浓度大于8 mmol/L时完全抑制人肠道上皮细胞的生长。这可能是由于不同细胞对丁酸的耐受程度不同所致。丁酸是瘤胃微生物发酵的产物之一,是反刍动物生长的重要能源[1]。正常情况下,瘤胃内丁酸浓度并不高。但在发生瘤胃酸中毒情况下,丁酸在瘤胃内迅速累积,对瘤胃粘膜屏障的结构完整造成破坏[9]。在黄晓忠[15]的研究中,2 mmol/L丁酸钠能促进肠上皮屏障功能,而中、高浓度丁酸钠(5~8 mmol/L)则刺激p38MAPK的表达,诱导大量Caco-2细胞凋亡,破坏细胞肠屏障功能。Pant[8]也证实,5 mmol/L的丁酸可抑制组蛋白去乙酰化酶SIRT-1的表达,增强活性氧的产生,从而增加肝细胞凋亡,抑制肝细胞的生长和增殖。这与本研究结果相似。
丁酸对瘤胃上皮细胞生长有影响且存在剂量依赖性。低浓度丁酸(20 mmol/L)对细胞生长有益,高浓度丁酸(40~140 mmol/L)对细胞生长有抑制作用。120 mmol/L丁酸培养6 h后诱导了瘤胃上皮细胞发生凋亡。
参考文献:
[1] Bergman E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].Physiological Reviews,1990,70(2):567.
[2] 胡红莲,卢德勋,刘大程,等.日粮不同NFC/NDF比对奶山羊瘤胃pH、挥发性脂肪酸及乳酸含量的影响[J].动物营养学报,2010,22(3):595-601.
Hu H L,Lu D X,Liu D C,et al.Effects of different dietary NFC/ NDF ratios on ruminal pH,VFA and lactate content in dairy goats[J].Animal Nutrition,2010,22(3):595-601.
[3] Coe M L,Nagaraja T G,Sun Y D,et al.Effect of virginiamycin on ruminal fermentation in cattle during adaptation to a high concentrate diet and during an induced acidosis[J].Journal of Animal Science,1999,77(8):2259-2268.
[4] Brossard L,Martin C,Michalet Doreau B.Ruminal fermentative parameters and blood acido-basic balance changes during the onset and recovery of induced latent acidosis in sheep[J].Animal Research,2003,52(6):513-530.
[5] Kien C L,Blauwiekel R,Bunn J Y,et al.Cecal infusion of butyrate increases intestinal cell proliferation in piglets[J].Journal of Nutrition,2007,137(4):916-922.
[6] Mentschel J,Leiser R,Mülling C,et al.Butyric acid stimulates rumen mucosa development in the calf mainly by a reduction of apoptosis[J].Archives of Animal Nutrition,2001,55(2):85-102.
[7] Ruemmele F M,Schwartz S,Seidman E G,et al.Butyrate induced Caco-2 cell apoptosis is mediated via the mitochondrial pathway[J].Gut,2003,52(1):94-100.
[8] Pant K,Yadav A K,Gupta P,et al.Butyrate induces ROS-mediated apoptosis by modulating miR-22/SIRT-1 pathway in hepatic cancer cells[J].Redox Biology,2017,5(12):340-349.
[9] 杨淑青,高民,胡红莲.亚急性瘤胃酸中毒产生机制及对瘤胃上皮屏障功能的影响[J].黑龙江畜牧兽医,2013,44 (15):24-26.
Yang S Q,Gao M,Hu H L,et al.Pathogenesis of subacute rumen acidosis and the effect on ruminal epithelial barrier function[J].Heilongjiang Animal Science and Veterinary Medicine,2013,44 (15):24-26.
[10] Steele M A,Croom J,Kahler M,et al.Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J].American Journal of Physiology Regulatory Integrative & Comparative Physiology,2011,300(6):1515-1523.
[11] 孟云.黄芪多糖对LPS诱导奶牛乳腺上皮细胞凋亡的体外保护作用研究[D].合肥:安徽农业大学,2014.
Meng Y.The protective effects of astragalus polysaccharides on bovine mammary epithelial cells apoptosis induced by LPS in vitro[D].Hefei:Anhui Agricultural University,2014.
[12] Guilloteau P,Zabielski R,David J C,et al.Sodium-butyrate as a growth promoter in milk replacer formula for young calves[J].Journal of Dairy Science,2009,92(3):1038-1049
[13] 胡卫.丁酸钠对结肠上皮细胞凋亡的影响[J].武汉大学学报(医学版),2007,28(4):468-470.
Hu W.Effect of sodium butyrate on the apoptosis of colonic epithelial cells[J].Medical Journal of Wuhan University,2007,28(4):468-470.
[14] Siavoshian S,Segain J P,Kornprobst M,et al.Butyrate and trichostatin A effects on the proliferation/differentiation of human intestinal epithelial cells:induction of cyclin D3 and p21 expression[J].Gut,2000,46(4):507-514.
[15] 黄晓忠,林正秀,张田丰,等.丁酸钠在Caco-2细胞肠屏障中的作用及p38MAPK的影响[J].中华小儿外科杂志,2013,34(6):458-462.
Huang X Z,Lin Z X,Zhang T F,et al.Effects of sodium butyrate on the intestinal barrier function in a Caco-2 cell monolayer model of intestinal barrier[J].Chinese Journal of Pediatric Surgery,2013,34(6):458-462.
