小脑血管母细胞瘤术后血红蛋白值的变化及其分析
2018-06-29州医科大学临床学院江苏000州医科大学附属医院神经外科江苏000
, , , (.州医科大学临床学院, 江苏 州 000;.州医科大学附属医院神经外科, 江苏 州 000)
小脑血管母细胞瘤(hemangioblastoma,HBL)是起源于中枢神经系统中胚叶细胞的胚胎残余组织,是一种较为少见的富含毛细血管的良性肿瘤,占颅内肿瘤的1.5%~2%,占成人幕下肿瘤的7%~12%,以30~40岁的青壮年发病最多,男性稍多于女性[1-2]。小脑HBL既可以散发形式发病,也可以作为希佩尔-林道综合征(Von Hippel-Lindau disease,VHL)的一部分而存在[3-5]。文献报道10%~50%的中枢神经系统HBL患者血液中血红蛋白值升高超过正常值,呈现红系增多的表现[2,6]。但并没有相关文献探讨血红蛋白值与肿瘤大小之间的关系,对于患者的血红蛋白值接近正常值上限时是否可以提示肿瘤的发生也未有相关报道。基于此,本研究探讨术后血红蛋白检测值的变化及其与肿瘤大小的相关性,深化对小脑血管母细胞瘤的认识,提高对该病的诊疗水平,为术后随访寻找简便有效的新方法。
1 资料与方法
1.1 临床资料
选取我院自2015年01月至2016年12月收治我院的经手术切除并获得病理证实为血管母细胞瘤的病例24例。其中男13例,女11例;年龄21~74岁,平均36.5岁;病程2 d~10年,平均病程10.5个月。本组病例中出现头痛的患者24例,头晕17例,头痛14例,恶心呕吐7例,行走不稳7例,耳鸣1例,右手指麻木1例。病例纳入标准:①术后病理诊断为血管母细胞瘤的患者;②单发病灶;③随访资料完全的患者;④无希佩尔-林道综合征(VHL)。
1.2 方法
1.2.1 收集资料 记录每位患者的住院号、性别、年龄,部位,是否全切、是否复发,肿瘤的大小,术前、术后的血红蛋白值。
1.2.2 测量肿瘤大小 本组所有患者术前均行头颅MRI检查,囊实性占17例、实质性占7例。典型病例囊实性及实质性肿瘤的大小测量方法见图1~3。图1~3中D1、D2、D3分别为MRI图像三轴定位层上肿瘤的最大直径。D1=(A1+C1)/2,D2=(A2+B1)/2,D3=(B2+C2)/2。体积测量方法,球形近似法:V=4∏/3×r3=∏/6(D1× D2×D3) ≈1/2(D1×D2×D3)。
1.3 实验室血红蛋白检查方法
采集患者的外周静脉血,标本用EDTA-K2抗凝,采用流式细胞技术,通过双鞘流电阻原理进行红细胞测定,采用氰化高铁血红蛋白(HICV)法检测血红蛋白,采集的血样在4 h内完成检测。
1.4 随访
查阅我科长期随访建立的患者资料数据库并通过电话随访患者,随访时间6~36个月。
1.5 统计学方法

a:横轴位片,A1为横轴位片上的左右径最大值,A2为横轴位片上的前后径最大值;b:矢状位片,B1为矢状位片上的前后径最大值,B2为矢状位片上的上下径最大值;c:冠状位片,C1为冠状位片上的左右径最大值,C2为冠状位片上的上下径最大值
图1典型病例实质型肿瘤影像资料
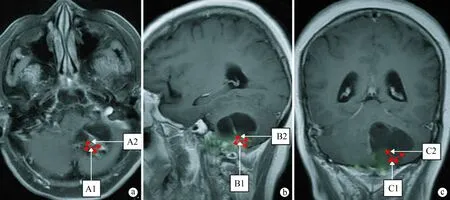
a:横轴位片,A1为横轴位片上的左右径最大值,A2为横轴位片上的前后径最大值;b:矢状位片,B1为矢状位片上的前后径最大值,B2为矢状位片上的上下径最大值;c:冠状位片,C1为冠状位片上的左右径最大值,C2为冠状位片上的上下径最大值
图2典型病例囊实性肿瘤结节影像资料

a:横轴位片,A1为横轴位片上的左右径最大值,A2为横轴位片上的前后径最大值;b:矢状位片,B1为矢状位片上的前后径最大值,B2为矢状位片上的上下径最大值;c:冠状位片,C1为冠状位片上的左右径最大值,C2为冠状位片上的上下径最大值
图3典型病例囊实性肿瘤影像资料
2 结果
2.1 血红蛋白值
本组24例患者,男13例,女11例。所有患者术前血红蛋白值为(144.83±18.43)g/L,术后第1天、第7天、第21天的血红蛋白值分别为(124.38±18.55)g/L、(121.33±14.29)g/L、(118.38±9.57)g/L。将患者按术前血红蛋值是否高于正常值分为高于正常值组(Hb2)和未高于正常值组(Hb3)。高于正常值组患者术前血红蛋白值为(168.83±12.172)g/L,术后第1天、第7天、第21天的血红蛋白值分别为(142.23±16.008)g/L、(132.50±12.988)g/L、(124.67±9.933)g/L。未高于正常值组患者术前血红蛋白值为(136.83±12.045)g/L,术后第1天、第7天、第21天的血红蛋白值分别为(118.39±15.435)g/L、(117.61±12.962)g/L、(116.28±8.737)g/L。将所有患者、高于正常值组患者及未高于正常值组患者的术前Hb值与术后第1天、第7天、第21天的Hb值采用单样本配对t检验比较,结果见表1。表1中Hb1为总体血红蛋白值组, Hb2为术前血红蛋白值高于正常值组,Hb3为术前血红蛋白值未高于正常值组。
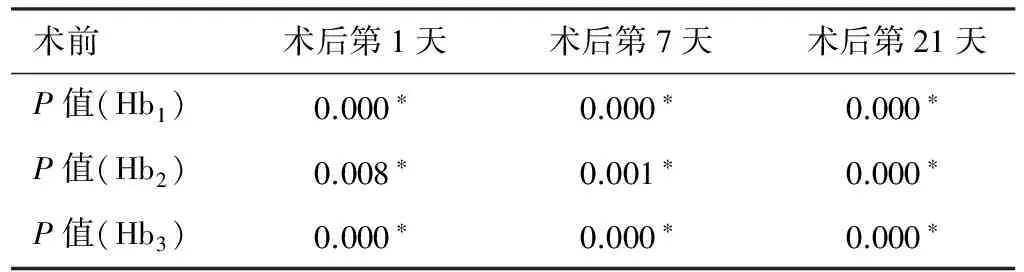
表1 24例患者术前与术后血红蛋白值比较(g/L,n=24)
*:与术前比较,P<0.05
手术前后Hb值比较单样本配对t检验,患者术前与术后Hb值比较差异具有统计学意义(P<0.05),患者术前血红蛋白值高于术后第1天、术后第7天、术后第21天(表1)。 对患者术后第1天、第7天、第21天的血红蛋白值进行两两配对t检验比较,患者术后第1天与术后第7天比较,P=0.178,术后第7天与术后第21天比较,P=0.121,术后第1天与术后第21天比较,P=0.049,患者术后第1天与第21天的血红蛋白值之间差异具有统计学意义(P<0.05),术后血红蛋白值在持续下降。
2.2 肿瘤大小
实质型肿瘤直径为10~38 mm,平均(27±3.7)mm,体积为(14 959.70±412.37)mm3;囊实性肿瘤直径30~54 mm,平均(40.4±7.4)mm,体积为(36 447.30±16 917.19)mm3;囊性肿瘤壁结节直径6~32 mm,平均(21.7±8.6)mm,体积为(5 212.10±5 577.28)mm3。
患者术前的血红蛋白值与肿瘤最大直径、肿瘤实性体积大小及囊腔大小之间无相关性;患者术后血红蛋白下降值(△Hb)的多少与肿瘤最大直径、肿瘤体积大小及囊腔大小之间也无相关性,见表2、3(△Hb1:术前与术后第1天的Hb差值;△Hb7:术前与术后第7天的Hb差值;△Hb21:术前与术后第21天的Hb差值)。
2.3 复发情况的描述
本组中有1例囊实性患者术后6个月复发,第1次术前血红蛋白为129 g/L,术后第1天、第7天、第21天的血红蛋白值分别为99 g/L、99 g/L、120 g/L。第2次术前血红蛋白为118 g/L,术后第1天、第7天、第21天的血红蛋白值分别为97 g/L、100 g/L、97 g/L。术后随访1年未见肿瘤复发,血红蛋白值未再升高。

表2 血红蛋白值与肿瘤大小的Spearman相关系数(r)值

表3 血红蛋白值与肿瘤大小的指数曲线相关系数(r)值
3 讨论
小脑血管母细胞瘤是起源于中枢神经系统中胚叶细胞的胚胎残余组织,是一种较为少见的富含毛细血管的良性肿瘤[1,7]。小脑HBL分为囊实性和实质性两种类型,前者约占70%左右,后者约占30%左右[2]。
3.1 术前与术后Hb比较结果分析
促红细胞生成素是促使患者血液中红细胞系增多和血红蛋白值升高的激素[8]。文献报道小脑HBL患者的肿瘤细胞可以合成和分泌促红细胞生成素[9-11]。丁兴华等[12]的研究发现小脑HBL中的间质细胞可以合成和分泌促红细胞生成素,但外周血的血清中促红细胞生成素的检测值多正常。本研究数据显示患者术前血红蛋白值高于正常值的比例为25%(6/24),术后21 d患者血红蛋白值下降至正常范围内,与文献报道结果相一致[2]。但是本研究另发现患者术前血红蛋白值未高于正常值组,在肿瘤切除后患者的血红蛋白值也下降,且下降值差异具有统计学意义,同时发现术后患者的血红蛋白值呈持续下降趋势,可以排除手术中出血及其他干扰因素的影响,提示肿瘤切除后患者的血红蛋白值下降。本研究发现患者术后血红蛋白值下降与术前血红蛋白值是否高于正常值无关,患者术后血红蛋白值的显著性下降提示肿瘤被完全切除,可能原因是手术切除肿瘤后,患者体内异常分泌促红细胞生成素的来源被切断了。这一发现提示肿瘤与血红蛋白值之间可能存在某种相关性。
3.2 血红蛋白值与肿瘤大小相关性分析
Trimble等[9]用分子生物学手段证实了血管母细胞瘤患者的肿瘤细胞合成和分泌促红细胞生成素。Delanghe等[13]研究发现小脑HBL中的间质细胞可以合成和分泌促红细胞生成素。由此猜想肿瘤越大,包含肿瘤细胞越多,分泌促红细胞生成素的量就越多,其促进红系增多及血红蛋白值升高的作用也就越明显。本研究分别运用线性Spearman相关以及指数曲线相关对患者的血红蛋白值与肿瘤大小之间的相关性进行分析,结果显示患者术前血红蛋白值及术后血红蛋白降低值(△Hb)与肿瘤最大直径、肿瘤实性体积、肿瘤囊腔体积之间无相关性。本研究未发现肿瘤大小与血红蛋白值之间存在相关性,可能系本研究样本量较少的缘故,进一步探索血红蛋白值与肿瘤大小之间的相关性还需要大样本的数据研究。
3.3 血红蛋白值评价手术效果及监测复发中的应用
显微神经外科手术是本病的首选治疗方法,全切可以达到根治[14-16]。但是由于小脑HBL邻近血管、神经、脑干等重要结构,因而手术难度相对较大[17]。对于嚢实性小脑血管母细胞瘤切除囊壁结节是手术目的,可以先穿刺囊腔留取囊液作脱落细胞学检查,然后切开囊壁吸除囊液,于囊壁内仔细寻找囊壁结节,进行完整切除结节,可避免损伤正常的脑组织,再沿肿瘤包膜与正常脑组织之间分离,最后做到完整切除肿瘤,切除瘤结节是手术成功的金标准[18]。而对于实质性小脑血管母细胞瘤术中应严格遵循处理颅脑动静脉畸形(AVM)的原则切除肿瘤组织,从距肿瘤边缘处分离,依据患者术前影像结合术者术中所见来综合判断供血动脉并阻断之(准确找到供血动脉并成功阻断是手术成功的关键),然后再阻断引流静脉,在主要供血动脉阻断前,不要阻断引流静脉,以免引起肿瘤组织肿胀及出血,导致继发性的脑肿胀,处理供血动脉切记要靠近肿瘤,跨越肿瘤表面的动脉要仔细辨认,分离并予以保护,最后完整切除肿瘤[19-20]。对于实质性小脑HBL切忌分块切除,否则极易引起难以控制的大出血。术前栓塞及术中吲哚菁绿荧光造影(ICG)的应用,对于切除巨大实质性肿瘤可以起到良好的辅助作用[21-22]。
患者术前血红蛋白值高于正常值的,肿瘤全切后血红蛋白值居高不降,或者下降后再次升高者提示肿瘤未全切或者复发的可能[2,23]。So等[24]认为肿瘤全切后促红细胞生成素的再次升高可以作为患者术后复发的一个早期监测指标,复发患者血液中血红蛋白值的升高早于影像学检查。本组中1例复发患者血红蛋白值的变化情况提示对患者术前血红蛋白值未高于正常值者,术后对患者定期随访,进行血液学检查监测血红蛋白变化情况及结合头颅MRI检查可以早期监测肿瘤有无复发。
本组24例患者中,17例嚢实性肿瘤完全切除,7例实质性肿瘤中有1例与脑干粘连较紧密予以次全切除,脑干面少量残留。对于不能耐受手术及不能手术切除的多发病变或合并VHL的患者可以考虑行放射治疗。Tago等[25]对13例血管母细胞瘤行γ刀治疗,随访7~147个月,97.4%的肿瘤得到了有效控制。本组7例实质性肿瘤中有1例次全切除术后辅助放疗,术后随访2年未见肿瘤体积增大,血红蛋白值在正常范围内。该现象提示患者血红蛋白值有可能作为放射辅助治疗效果的评价指标之一。
综上所述,小脑血管母细胞瘤全切除后预后良好,当肿瘤被全切后患者血液中的血红蛋白值显著性下降,其下降与血红蛋白是否高于正常值无相关性。囊壁结节未切除是术后复发的主要原因,对囊实性肿瘤的应仔细探查囊腔避免遗漏瘤结节全切除病灶。对于实质性肿瘤在争取最大安全前提下全切肿瘤病灶,对次全切除的病灶术后予以放疗辅助治疗,控制肿瘤的生长速度,延缓复发的时间,提高患者的生活质量。
[参考文献]
[1] Pandey S,Sharma V,Pandey D,et al.Supratentorial haemangioblastoma without von Hippel-Lindau syndrome in an adult:A rare tumor with review of literature[J].Asian J Neurosurg,2016,11(1):8.doi:10.4103/1793-5482.165782.
[2] 王忠诚.王忠诚神经外科学[M].武汉:湖北科技技术出版社,2015:611-614.
[3] Padhi S,Sarangi R,Challa S,et al.A 10-year retrospective study of hemangioblastomas of the central nervous system with reference to von Hippel-Lindau (VHL) disease[J].J Clin Neurosci,2011,18(7):939-944.doi:10.1016/j.jocn.2010.12.050.
[4] Huntoon K,Lonser RR.Findings from the natural history of central nervous system hemangioblastomas in von Hippel-Lindau disease[J].Neurosurgery,2014,61 (Suppl 1):159-162.doi:10.1227/NEU.0000000000000384.
[5] 毛渭东,黄 琦,陈仕明.von Hippel-Lindau 综合征中枢神经系统血管母细胞瘤临床病理特征[J].局解手术学杂志,2016,25(11):848-850.doi:10.11659/jjssx.03E016056.
[6] Law EKC,Lee RKL,Griffith JF,et al.Spinal nerve root haemangioblastoma associated with reactive polycythemia[J].Case Rep Radiol,2014,2014:798620.doi:10.1155/2014/798620.
[7] Le RP,Henaux PL,Morandi X,et al.Sporadic intracranial haemangioblastomas:surgical outcome in a single institution series[J].Acta Neurochirurgica,2013,155(6):1003-1009.doi:10.1007/s00701-013-1681-5.
[8] Ribatti D.Angiogenic effects of erythropoietin[J].Int Rev Cell Mol Biol,2012,299:199.doi:10.1016/B978-0-12-394310-1.00005-9.
[9] Trimble M,Caro J,Talalla A,et al.Secondary erythrocytosis due to a cerebellar hemangioblastoma:demonstration of erythropoietin mRNA in the tumor[J].Blood,1991,78(3):599-601.
[10] Ribatti D,Vacca A,Roccaro AM,et al.Erythropoietin as an angiogenic factor[J].Eur J Clin Invest,2003,33(10):891.
[11] Ribatti D.Erythropoietin and tumor angiogenesis[J].Stem Cells Dev,2010,19(1):1-4.doi:10.1089/scd.2009.0402.
[12] 丁兴华,谢 嵘,张 涛,等.促红细胞生成素在后颅窝血管母细胞瘤中的表达及意义探讨[J].中国临床神经科学,2008,16(1):54-56.doi:10.3969/j.issn.1008-0678.2008.01.009.
[13] Delanghe SE,Dierick J,Maenhout TM,et al.An abnormally glycosylated isoform of erythropoietin in hemangioblastoma is associated with polycythemia[J].Clinica Chimica Acta,2015,438:304-306.doi:10.1016/j.cca.2014.09.013.
[14] Gläsker S.Central nervous system manifestations in VHL:genetics,pathology and clinical phenotypic features[J].Familial Cancer,2010,4(1):37.doi:10.1007/s10689-004-5347-6.
[15] 马德选,周良辅.中枢神经系统血管母细胞瘤[J].中华神经外科杂志,2014,30(2):206-208.doi:10.3760/cma.j.issn.1001-2346.2014.02.031.
[16] Fukuda M,Takao T,Hiraishi T,et al.Clinical factors predicting outcomes after surgical resection for sporadic cerebellar hemangioblastomas[J].World Neurosurg,2014,82(5):815-821.doi:10.1016/j.wneu.2014.06.018.
[17] Cervio A,Villalonga JF,Mormandi R,et al.Surgical treatment of cerebellar hemangioblastomas[J].Surg Neurol Int,2017,8(1):163.doi:10.4103/sni.sni_490_16.
[18] 刘 佳,姜 勇,吴鹏飞,等.后颅窝血管母细胞瘤的影像学和治疗特点:59例临床分析[J].中国医科大学学报,2016,45(4):371-374.doi:10.12007/j.issn.0258-4646.2016.04.021.
[19] Wan JQ,Cui H,Wang Y.Surgical management of large solid hemangioblastomas of the posterior fossa[J].J Clin Neurosci,2011,18(1):39-42.doi:10.1016/j.jocn.2010.07.099.
[20] Jito J,Nozaki K.Treatment strategies for cerebellar hemangioblastomas:simple or further studies?[J].World Neurosurg,2014,82(5):619-620.doi:10.1016/j.wneu.2014.08.018.
[21] Hojo M,Arakawa Y,Funaki T,et al.Usefulness of tumor blood flow imaging by intraoperative indocyanine green videoangiography in hemangioblastoma surgery.[J].World Neurosurg,2013,82(3-4):e495-e501.doi:10.1016/j.wneu.2013.02.009.
[22] Xu QW,Xu R,Du ZY,et al.Surgical treatment for hemangioblastomas in the medulla oblongata[J].Acta Neurochirurgica,2010,152(8):1331.doi:10.1007/s00701-010-0668-8.
[23] 周良辅.现代神经外科学[M].第2版.复旦大学出版社,2015:694-699.
[24] So CC,Ho LC.Polycythemia secondary to cerebellar hemangioblastoma[J].Am J Hematol,2002,71(4):346-347.doi:10.1002/ajh.10196.
[25] Tago M,Terahara A,Shin M,et al.Gamma knife surgery for hemangioblastomas[J].J Neurosurg,2015,102(Suppl):171.doi:10.3171/jns.2015.102.s_supplement.0171.
