以尿崩症为首发表现的垂体转移性肿瘤临床特征分析
2018-06-29王诺金张楠邓大同唐松涛章秋
王诺金,张楠,邓大同,唐松涛,章秋
本文要点:
目前,以尿崩症为首发表现的垂体转移性肿瘤(PM)缺乏详尽的总结,本文对国内外的各类恶性肿瘤垂体转移引起尿崩症为首发表现的病例进行了详实、完整的回顾性分析,总结并探讨恶性肿瘤垂体转移的临床特征,旨在提高医生对PM与尿崩症关系的认识,避免误诊与漏诊。但本研究为病例分析研究,实际诊治患者例数过少,需要进一步积累临床经验进而研究总结。
垂体转移性肿瘤(PM)指恶性肿瘤转移至垂体区域,其发病率低。颅外肿瘤的垂体转移率为1.0%~1.5%[1],在颅内转移性肿瘤中PM占0.87%,且肿瘤患者尸检结果显示垂体转移率为1.9%[2]。仅7% PM患者有相应症状,其中尿崩症和/或动眼神经麻痹最为常见[3]。临床上以尿崩症为首发表现的PM患者时有报道,但多以个案报道或小样本研究为主。本研究回顾性分析以尿崩症为首发表现的42例PM患者的临床资料,以期提高临床医生对中枢性尿崩症(CDI)与PM关系的认识和诊治水平。
1 资料与方法
1.1 病例资料 选取2016年11月安徽医科大学第一附属医院内分泌科收治的1例PM患者为研究对象,该患者既往无肿瘤病史,以多尿、烦渴起病,发病过程中仅有尿崩症表现。经实验室检查及影像学诊断判定其尿崩症是由肺癌垂体转移所引起,详细临床资料如下。
患者,男,54岁,因“多尿、烦渴1个月”于2016-11-30入院,多喜饮凉水,每天尿量约10 L;查体:体温36.6 ℃,脉搏97次/min、呼吸20次/min、血压126/72 mm Hg(1 mm Hg=0.133 kPa );营养良好,意识清晰,全身浅表淋巴结无肿大,口唇无发绀,心肺腹查体未见异常,无杵状指,双下肢无水肿,视野正常。胸部正位X线检查示双肺内未见实质性病变,尿常规示尿比重1.005(参考范围1.015~1.025);血生化示血钠134.1 mmol/L(参考范围135.0~145.0 mmol/L),余项正常;肝肾功能正常;甲状腺功能正常;性激素六项示泌乳素37.71 ng/ml(参考范围2.10~17.70 ng/ml),余项正常。2016-12-01禁水-加压素试验结果为阳性,符合CDI诊断,随后予以口服去氨加压素片治疗,当日患者多尿、烦渴症状好转。2016-12-02肝胆胰脾泌尿系彩超示肝脏弥漫性病变,肝右叶稍高回声灶;腹部CT检查示肝脏多发占位、左肺下叶占位;颅脑、垂体MRI平扫+增强检查示垂体后部及垂体柄异常信号(见图1),考虑PM;予以完善生长激素(GH)及皮质醇、促肾上腺皮质激素(ACTH)昼夜节律检查,增加癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、非小细胞肺癌相关抗原(CYFRA21-1)检查。2016-12-04 GH及皮质醇、ACTH昼夜节律正常,CEA 4.28 ng/ml(参考范围<5.00 ng/ml),NSE 42.76 ng/ml(参考范围 <16.30 ng/ml),CYFRA21-1 4.54 ng/ml(参考范围<3.30 ng/ml),结合肺癌三项(CEA、NSE、CYFRA21-1)结果,考虑肺癌垂体转移肝多发转移可能性大,请肿瘤科会诊。2016-12-05 肿瘤科会诊建议完善胸、腹部CT+增强检查,并联系行肺、肝穿刺检查明确病理诊断,患者拒行穿刺活检;内分泌科治疗上仍继续予以去氨加压素口服,记录24 h尿量。2016-12-07前1日液体入量3 400 ml、尿量3 200 ml,患者尿量仍较多,但已无明显烦渴、多饮症状;当日胸、腹部CT检查示左肺下叶占位,双肺下叶少许纤维化灶,肝脏多发占位,考虑肺癌伴双肺内、肝脏多发转移;针对患者肺部原发病再次请肿瘤科会诊。2016-12-08 肿瘤科会诊意见为:结合病史,考虑诊断为小细胞肺癌伴垂体转移肝转移,建议转入肿瘤科进一步治疗;患者家属拒绝进一步治疗,鉴于患者排尿、饮水次数得以控制,本科治疗已完善,沟通病情后,予以带药出院。其后本科进行电话随访,患者病情恶化迅速,于发病3个月后死亡。

图1 PM典型病例垂体MRI改变Figure 1 Typical changes in pituitary gland of PM patients identified by sellar MRI
1.2 文献检索 利用PubMed、ISI Web of Knowledge、中国知网、万方数据知识服务平台,检索时间限定为1990年1月—2017年10月,以“pituitar*/hypophys*”“metasta*”“diabetes insipidus”“垂体”“转移”“尿崩症”为关键词,对国内外有关恶性肿瘤垂体转移引起尿崩症的文献进行检索,范围仅限于中英文。
1.3 文献纳入及排除标准 纳入标准:(1)患者既往无肿瘤病史,以尿崩症为首发表现或就诊原因。(2)病理学检查结果为恶性肿瘤;未行病理学检查,但临床表现和/或实验室、影像学检查提示为恶性肿瘤。(3)临床资料详尽:必须包含患者一般情况、鞍区磁共振成像检查和/或血生化、腺垂体激素、病理学检查、治疗措施及病情转归等。排除标准:重复病例。
1.4 统计学方法 应用SPSS 22.0软件进行统计学处理。计量资料以()或中位数表示;中位生存时间的计算采用Kaplan-Meier法,并绘制生存曲线,计算累积生存率。
2 结果
2.1 文献检索结果 报道以尿崩症为首发表现病例的文献有31篇[1,4-33],其中PM患者41例,结合本院收治的1例以尿崩症为首发表现的肺癌伴垂体转移病例,共42例患者。
2.2 一般资料 42例患者中男24例、女18例;年龄11~78岁,平均年龄(56.6±12.7)岁;原发病:肺癌31例、淋巴瘤3例、白血病1例、肾癌1例、肝癌1例、胰岛细胞瘤1例、神经母细胞瘤1例、甲状腺癌1例、乳腺癌1例、未分化腺癌1例。患者均以尿崩症为首发表现,就诊过程中证实或高度提示恶性肿瘤垂体转移。
2.3 临床表现 以P1~P42代表42例患者,11例仅表现为多尿、烦渴,其余患者临床表现见表1。肺癌患者中,3例(P2、P14、P24)出现呼吸道症状,1例(P16)伴随颅内压增高;胰岛细胞瘤患者(P38)原发部位异位分泌生长激素释放激素,表现为肢端肥大;9例患者体质量下降。42例患者发生尿崩症到确认原发病灶时间为2周~1年,中位时间为2.0个月。
2.4 辅助检查 病理学检查确诊41例患者的原发恶性肿瘤(见表1);P1拒行经皮穿刺肺活检,其胸部CT结合血清肿瘤标志物检查,考虑诊断为小细胞肺癌。肿瘤转移部位通过病理学检查、颅脑MRI及胸/腹部CT、骨扫描和其他影像学资料判定,29例患者存在2个以上部位肿瘤转移(见表1)。26例肺癌患者胸部CT检查结果显示仅1例(P15)未见异常,经开颅病理检查证实P15为小细胞肺癌垂体转移;21例肺癌患者胸部X线检查结果显示9例未见异常。41例患者有明确的鞍区占位,P19下丘脑-垂体区域MRI未见异常(见表1),12例患者复查鞍区肿物显示其在短期内出现进行性增大。结合多尿、烦渴症状与禁水-加压素试验结果,41例患者诊断为PM;P19禁水-加压素试验为阳性,后发现肺癌多处转移,予垂体放疗后多尿、烦渴症状好转,考虑其CDI是原发灶转移所致。
实验室检查结果显示26例患者存在腺垂体激素分泌不足,其中21例促甲状腺激素(TSH)降低,15例黄体生成素(LH)降低,15例泌乳素(PRL)增高,3例ACTH增高,1例GH增高(见表1)。42例患者中11例存在电解质紊乱,其中高钠血症4例、低钠血症4例、高钠合并低钾血症2例、低钾血症1例。
2.5 治疗及预后 42例患者中,38例接受不同的治疗方案,4例放弃治疗(见表1)。患者治疗期间,8例复查MRI显示垂体肿瘤增大,2例死亡。患者治疗后,18例尿量减少,11例头痛缓解,10例电解质紊乱得到纠正,6例视力改善,6例垂体占位缩小。
随访40例患者,随访时间为1~36个月,其中28例死亡、12例存活。42例患者中位生存时间为6.0个月,患者1年、3年累积生存率为22.1%、17.7%,患者生存曲线见图2。
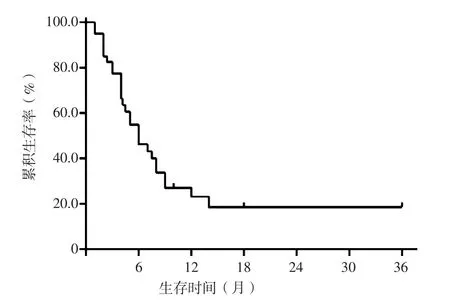
图2 42例PM患者生存曲线Figure 2 Survival curve of 42 PM patients
3 讨论
PM是中老年系统性恶性肿瘤少见的并发症,其临床表现多种多样,如激素分泌过多引起相应症候群;因肿瘤压迫正常垂体而使激素分泌减少;肿瘤直径>1 cm可侵犯鞍膈导致头痛;瘤体向前上方发展可推压视神经交叉出现视力减退、视野缺损;瘤体向上发展可影响下丘脑而导致尿崩症、睡眠异常、食欲亢进或减退、性腺功能减退;瘤体向侧方发展则可侵入海绵窦,压迫第3、4、6颅神经引起眼睑下垂、眼外肌麻痹和复视;瘤内出血(称为垂体卒中),引起昏睡、昏迷、颅内压增高[34]。
PM发病率低,仅1.0%~1.5%颅外肿瘤发生垂体转移[1]。近年来,随着MRI应用广泛和医生更加注重CDI病因诊断,临床报道PM病例逐年增加。PM患者中,女性以乳腺癌多见,男性以肺癌多见,儿童以生殖细胞肿瘤多见,其他原发病灶包括:消化道、甲状腺、肾脏及血液系统等,绝大多数恶性肿瘤均可累及垂体[35]。目前PM发生机制与转移途径尚未明确,但肿瘤转移至垂体至少存在4条路径:(1)通过血行转移至
鞍膈或垂体实质;(2)转移至下丘脑或垂体并随后种植于前后叶;(3)肿瘤首先转移至斜坡、蝶鞍、海绵窦然后播散到垂体;(4)经颅底直接侵袭转移[35]。国外一项201例PM患者的临床研究显示,50.7%神经垂体受累,15.4%腺垂体受累,33.8%全垂体受累[36]。究其原因,腺垂体由垂体门脉系统及起源于神经垂体的漏斗干下动脉供血,而垂体下动脉直接供血于神经垂体。因此肿瘤经血行转移易播散至神经垂体,后叶病变可直接浸润累及前叶。

表1 42例PM患者临床资料Table 1 Clinical data of 42 PM patients

(续表1)
上述垂体血供方式导致PM常侵犯神经垂体影响抗利尿激素释放,引起CDI且多以CDI为首发表现。CDI是一种少见的神经垂体疾病,严重影响机体水代谢,可造成脱水、电解质紊乱,甚至危及生命。约半数CDI为神经垂体及附近部位肿瘤引起[37]。非肿瘤病因的CDI经去氨加压素替代治疗可控制多尿、烦渴症状;但肿瘤或转移瘤继发的CDI,如不及早进行病因治疗,可危及生命[4]。研究显示垂体转移的CDI发生率为42.34%,是PM最常见症状[2]。国外研究指出乳腺癌是PM最常见的原发病[35],但乳腺癌垂体转移致CDI却鲜有报道,可能是以下原因造成的:(1)乳腺癌似乎对腺垂体有更高的亲和力,前叶高泌乳素环境有利于乳腺癌细胞增殖,且腺垂体激素缺乏症状不易被发现[36];(2)早期乳腺癌诊治技术相对成熟,尤其是芳香化酶抑制剂的临床应用,显著降低远端垂体转移可能;(3)人种差异可能会影响乳腺癌垂体转移的临床表现[38]。临床上也有PM患者表现出一过性CDI,其原因可能是:(1)神经垂体纤维组织再生;(2)肿瘤蔓延前叶而出现全垂体功能减退,而低皮质醇水平与ACTH缺乏可掩盖CDI症状[12]。
本研究结果显示,26例患者存在不同程度的腺垂体激素分泌不足,其中10例仅有激素水平下降,而无乏力、食欲不振、淡漠、怕冷等腺垂体功能低下的临床表现。另有15例PRL增高,3例ACTH增高,1例GH增高,原因如下:(1)瘤体压迫垂体柄和垂体门脉血供而使PRL增高;(2)胰岛细胞瘤、嗅神经母细胞瘤等原发肿瘤本身具有内分泌功能。对PM可疑患者,腺垂体激素试验应纳入常规检查,目的在于早期发现、预防垂体危象。另外,血电解质检查也不容忽视。尿崩症严重影响人体内水代谢,造成高渗性失水,引起高钠血症。而出现尿崩症的PM患者还可发生低钠血症,其原因可能是:(1)高渗失水后补充水分过多,引起稀释性低钠血症;(2)伴腺垂体功能减退,垂体-肾上腺轴功能失调,造成低渗性失水,引起缺钠性低钠血症。本研究结果显示,3例患者存在低钾血症,其病因可能为异源性ACTH综合征引起肾脏失钾。
确诊PM须行病理检查,目前垂体病理检查主要采用两种方法,即鼻内镜下经鼻蝶垂体活检与开颅病理检查,前者操作难度大,可由于取材部位不准确而致误诊。并且转移瘤血供丰富,鼻内镜下经鼻蝶垂体活检或致出血甚至垂体卒中[39],而只有达到手术指征时,才能对患者开颅进行病理检查。因此,临床医生多采用排除性诊断方法,而患者临床表现及鞍区影像学改变通常是诊断PM的重要依据。
PM影像学检查存在一些特殊表现,其主要特点有[40]:(1)多位于神经垂体和/或垂体柄,可单发或伴颅内多发转移;(2)CT检查常显示鞍区等密度或稍高密度占位影,增强扫描后呈均匀或不均匀强化;(3)MRI检查常显示肿物骑跨鞍膈,向鞍内和鞍上生长,形似哑铃(见图1A、C),垂体柄增粗,T1加权成像(T1WI)示神经垂体高信号减少或消失(见图1A);腺垂体受累时,可见残存组织,多不对称,累及周围结构(见图1B),常浸润漏斗隐窝,破坏不均,增强扫描静脉期强化程度下降。如条件允许,可考虑行核医学检查。对于各类恶性肿瘤垂体转移,正电子发射计算机断层显像(PET-CT)具有重要的诊断价值,可协助判断原发肿瘤的性质、部位、垂体占位与原发肿瘤的关系,即垂体占位与远处肿瘤无关或是由肿瘤转移导致垂体占位。对于影像学检查初诊阴性患者,亦要保持警觉,密切随访。
由于PM患者垂体柄与神经垂体经常受累,因此临床上需与以下疾病鉴别:(1)淋巴细胞性垂体炎:该病多发于妊娠后期或产后女性,常表现为头痛急性发作,MRI显示弥漫性、对称性垂体增大,向鞍上呈“舌状”延伸,平扫示等信号或低信号,增强呈均匀强化,有自发缓解倾向,免疫抑制或激素治疗有效[41];(2)垂体腺瘤:年轻女性多见,常无尿崩症,多出现泌乳素增高症状,MRI显示垂体上缘膨出,腺瘤多生长在垂体一侧,可伴垂体柄偏移,事实上仅1%足够大的垂体腺瘤累及垂体柄和/或引起CDI,最常见的垂体腺瘤是泌乳素瘤,多巴胺受体激动剂有显著疗效[42]。PM患者多>50岁,可查出原发病灶,但仍有13% PM来源不明[2],瘤体呈破坏性生长,相同大小转移瘤较垂体炎、腺瘤症状更严重,且病情进展迅猛,短期内可突破鞍膈。PM患者全身状况差,常伴乏力、食欲不振,早期出现CDI是鉴别PM与垂体腺瘤的最重要依据。且研究认为,颅神经损伤致眼球运动异常和/或CDI是PM的独立预测指标[43]。
一般而言,颅外肿瘤发生垂体转移时,已在体内广泛转移[44],本研究结果显示,29例PM患者已确认存在2个以上部位转移。由于患者就诊时绝大多数处于晚期,各种治疗措施的目的在于改善症状和提高生存质量,其包括肿瘤切除手术、全身化疗、垂体放射治疗、视交叉减压手术与鞘内注射[12]。此外,对有CDI表现的PM患者辅以激素替代治疗有助于减少尿量,提高生活质量。
对于PM患者是否应采取积极治疗仍存在争议,有研究表示PM生存期取决于原发癌灶情况,其中位生存时间为6~7个月,是否手术治疗对预后的影响无差异[36];也有研究认为尽管PM预后较差,但及早行放疗或垂体手术可改善症状、提高生活质量、延长生存时间[45]。本研究结果显示,42例PM患者中位生存时间为6.0个月,与相关研究较一致[36]。本研究31例患者接受过手术、放疗、化疗、γ刀等综合治疗,病情曾暂时缓解,垂体占位缩小、尿崩症减轻,但最终预后差,多数患者因肿瘤广泛转移而死于全身衰竭。由于本研究纳入例数有限,难以比较不同治疗方案对PM预后的影响,今后将进一步增加临床样本量及纳入后续发表的文献以完善该研究。
综上所述,PM是一种少见且预后较差的肿瘤相关并发症,尿崩症可作为PM患者的首发表现,甚至唯一症状。在诊治CDI或癌症时,医生除关注引起主要症状的局部病变外,还应考虑全身系统性疾病的影响,特别是以CDI为首发表现的中老年患者,查出垂体占位时,如伴有其他部位病灶,应考虑垂体病变是否与肿瘤转移相关。
作者贡献:王诺金负责收集病例资料、整理数据,撰写论文;张楠、唐松涛负责收治患者;邓大同负责分析影像资料;章秋负责选题和设计,文章审阅和修改。
本文无利益冲突。
[1]KOMNINOS J,VLASSOPOULOU V,PROTOPAPA D,et al.Tumors metastatic to the pituitary gland:case report and literature review[J].J Clin Endocrinol Metab,2004,89(2):574-580.DOI:10.1210/jc.2003-030395.
[2]HE W,CHEN F,DALM B,et al.Metastatic involvement of the pituitary gland:a systematic review with pooled individual patient data analysis[J].Pituitary,2015,18(1):159-168.DOI:10.1007/s11102-014-0552-2.
[3]TEEARS R J,SILVERMAN E M.Clinicopathologic review of 88 cases of carcinoma metastatic to the putuitary gland[J].Cancer,1975,36(1):216-220.
[4]茅江峰,李玉秀,顾锋,等.以尿崩症为首发表现的肺癌伴垂体转移六例临床分析[J].中华内科杂志,2005,44(8):606-608.DOI:10.3760/j.issn:0578-1426.2005.08.014.MAO J F,LI Y X,GU F,et al.Lung cancer with metastasis to pituitary gland[J].Chinese Journal of Internal Medicine,2005,44(8):606-608.DOI:10.3760/j.issn:0578-1426.2005.08.014.
[5]李俊岩,牛晓红,王俊丽,等.垂体转移癌1例报道及误诊原因分析[J].长治医学院学报,2013,27(4):302-303.DOI:10.3969/j.issn.1006-0588.2013.04.023.LI J Y,NIU X H,WANG J L,et al.Metastatic carcinoma to the pituitary gland:a case report and analysis of misdiagnosis[J].Journal of Changzhi Medical College,2013,27(4):302-303.DOI:10.3969/j.issn.1006-0588.2013.04.023.
[6]王颖倩,王先令,吕朝晖,等.以中枢性尿崩症为首发症状的肺癌垂体转移三例并文献复习[J].中华内分泌代谢 杂 志,2013,29(2):176-178.DOI:10.3760/cma.j.issn.1000-6699.2013.02.021.WANG Y Q,WANG X L,LYU Z H,et al.Pituitary metastatic tumor from primary lung cancers with the initial symptoms of central diabetes insipidus:a report of 3 cases and literature review[J].Chinese Journal of Endocrinology and Metabolism,2013,29(2):176-178.DOI:10.3760/cma.j.issn.1000-6699.2013.02.021.
[7]史双伟,郑丽丽,王志芳,等.以全垂体功能减退为首发表现的垂体转移癌1例[J].疑难病杂志,2014,13(4):427-428.DOI:10.3969/j.issn.1671-6450.2014.04.033.SHI S W,ZHENG L L,WANG Z F,et al.Metastatic carcinoma to the hypophysis with pituitary dysfunction as the first manifestation:a case report[J].Chinese Journal of Difficult and Complicated Cases,2014,13(4):427-428.DOI:10.3969/j.issn.1671-6450.2014.04.033.
[8]靳腾龙,孙红卫,田研.肺乳头状腺癌垂体转移一例报告并文献复习[J].中华肿瘤防治杂志,2015,22(23):1853-1855.DOI:10.16073/j.cnki.cjcpt.2015.23.015.JIN T L,SUN H W,TIAN Y.Pituitary metastasis of papillary adenocarcinoma of lung:a case report and literature review[J].Chinese Journal of Cancer Prevention and Treatment,2015,22(23):1853-1855.DOI:10.16073/j.cnki.cjcpt.2015.23.015.
[9]赵永才,王荣荣,丁文萃,等.以尿崩症为首发表现的垂体转移瘤一例报告[J].中华内分泌代谢杂志,2015,31(2):172-173.DOI:10.3760/cma.j.issn.1000-6699.2015.02.017.ZHAO Y C,WANG R R,DING W C,et al.Diabetes insipidus as the first symptom caused by cancer metastasis to the pituitary glands:a case report[J].Chinese Journal of Endocrinology and Metabolism,2015,31(2):172-173.DOI:10.3760/cma.j.issn.1000-6699.2015.02.017.
[10]乔华,张向宁,姜尧,等.少见部位转移为首发症状的肺癌3例临床分析[J].国际呼吸杂志,2016,36(15):1137-1141.DOI:10.3760/cma.j.issn.1673-436X.2016.15.004.QIAO H,ZHANG X N,JIANG Y,et al.Clinical analysis of lung cancer with metastasis of rare parts as the first symptom:a report of three cases[J].International Journal of Respiration,2016,36(15):1137-1141.DOI:10.3760/cma.j.issn.1673-436X.2016.15.004.
[11]LIAN W,REN Z,WU C.Diagnosis and treatment of the pituitary metastases[J].Chin Med Sci J,2004,19(1):68-71.
[12]MAO J F,ZHANG J L,NIE M,et al.Diabetes insipidus as the first symptom caused by lung cancer metastasis to the pituitary glands:clinical presentations,diagnosis,and management[J].J Postgrad Med,2011,57(4):302-306.DOI:10.4103/0022-3859.90080.
[13]CHON H,YOON K,KWON D H,et al.Hypofractionated stereotactic radiosurgery for pituitary metastases[J].J Neurooncol,2017,132(1):127-133.DOI:10.1007/s11060-016-2346-z.
[14]SIQUEIRA P F,MATHEZ A L,PEDRETTI D B,et al.Pituitary metastasis of lung neuroendocrine carcinoma:case report and literature review[J].Arch Endocrinol Metab,2015,59(6):548-553.DOI:10.1590/2359-3997000000139.
[15]JUNG J W,NOH G Y,LEE T H,et al.Polyuria and polydipsia in a patient with non-small-cell lung cancer[J].Clin Lung Cancer,2007,8(9):565-567.DOI:10.3816/CLC.2007.n.044.
[16]AGHA A,BRENNAN S,MOORE K B,et al.Small-cell lung cancer presenting as diabetes insipidus and Cushing's syndrome[J].Pituitary,2005,8(2):105-107.DOI:10.1007/s11102-005-3308-1.
[17]HARZALLAH L,MIGAW H,HARZALLAH F,et al Diabetes insipidus and panhypopituitarism revealing pituitary metastasis of small cell lung carcinoma:a case report[J].Ann Endocrinol(Paris),2005,66(2 Pt 1):117-120.
[18]REDDY P,KALEMKERIAN G P.Unusual presentations of lung cancer:case 1.Diabetes insipidus as the initial manifestation of non-small-cell lung cancer[J].J Clin Oncol,2002,20(23):4597-4598.DOI:10.1200/JCO.2002.20.23.4597.
[19]SAEKI N,MURAI H,KUBOTA M,et al.Oedema along the optic tracts due to pituitary metastasis[J].Br J Neurosurg,2001,15(6):523-526.
[20]CASTRO CABEZAS M,VRINTEN D H,BURGERS J A,et al.Central diabetes insipidus and Cushing's syndrome due to ectopic ACTH production by disseminated small cell lung cancer:a case report[J].Neth J Med,1998,53(1):32-36.
[21]TRINCADO P,PLAYÁN J,ACHA J,et al.Adrenal failure due to metastasis both to the hypothalamic-pituitary area and the adrenals[J].Tumori,1996,82(4):401-404.
[22]MATSUDA R,CHIBA E,KAWANA I,et al.Central diabetes insipidus caused by pituitary metastasis of lung cancer[J].Intern Med,1995,34(9):913-918.
[23]SANGUINETTI C M,MARCHESANI F,BICHI-SECCHI E,et al.Neurogenic diabetes insipidus:an unusual clinical presentation of small cell lung cancer[J].Monaldi Arch Chest Dis,1993,48(2):130-133.
[24]MEGAN OGILVIE C,PAYNE S,EVANSON J,et al.Lymphoma metastasizing to the pituitary:an unusual presentation of a treatable disease[J].Pituitary,2005,8(2):139-146.DOI:10.1007/s11102-005-4535-1.
[25]BASARIA S,KROP J S,BRAGA-BASARIA M.A rare cause of pituitary stalk enlargement and panhypopituitarism[J].Mt Sinai J Med,2003,70(4):265-267.
[26]RAMSAHOYE B H,GRIFFITHS D F,WHITTAKER J A.Angiocentric T-cell lymphoma associated with diabetes insipidus[J].Eur J Haematol,1996,56(1/2):100-103.
[27]以尿崩症为主要表现的急性髓性白血病[J].河南医学研究,2001(2):167.
[28]PAYANDEH M,SADEGHI M,SADEGHI E.The complete response to targeted drugs without surgery or radiotherapy:a case of pituitary metastasis from renal cell carcinoma[J].Acta Med Iran,2016,54(9):617-619.
[29]GENKA S,SOEDA H,TAKAHASHI M,et al.Acromegaly,diabetes insipidus,and visual loss caused by metastatic growth hormone-releasing hormone-producing malignant pancreatic endocrine tumor in the pituitary gland.Case report[J].J Neurosurg,1995,83(4):719-723.DOI:10.3171/jns.1995.83.4.0719.
[30]周水洪,阮凌翔,李红,等.嗅神经母细胞瘤引起尿崩症一例[J].中华耳鼻咽喉头颈外科杂志,2006,41(6):465-466.DOI:10.3760/j.issn:1673-0860.2006.06.019.ZHOU S H,RUAN L X,LI H,et al.Diabetes insipidus caused by olfactory neuroblastoma:a case report[J].Chinese Journal of Otorhinolaryngology Head and Neck Surgery,2006,41(6):465-466.DOI:10.3760/j.issn:1673-0860.2006.06.019.
[31]LIM W,LIM D S,CHNG C L,et al.Thyroid carcinoma with pituitary metastases:2 case reports and literature review[J].Case Rep Endocrinol,2015,2015:252157.DOI:10.1155/2015/252157.
[32]POURSADEGH FARD M,BORHANI HAGHIGHI A,BAGHERI M H.Breast cancer metastasis topituitary infandibulum[J].Iran J Med Sci,2011,36(2):141-144.
[33]CHIANG M F,BROCK M,PATT S.Pituitary metastases[J].Neurochirurgia(Stuttg),1990,33(4):127-131.DOI:10.1055/s-2008-1053571.
[34]葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:666.
[35]ARIEL D,SUNG H,COGHLAN N,et al.Clinical characteristics and pituitary dysfunction in patients with metastatic cancer to the sella[J].Endocr Pract,2013,19(6):914-919.DOI:10.4158/EP12407.OR.
[36]FASSETT D R,COULDWELL W T.Metastases to the pituitary gland[J].Neurosurg Focus,2004,16(4):E8.
[37]LEROY C,KARROUZ W,DOUILLARD C,et al.Diabetes insipidus[J].Ann Endocrinol(Paris),2013,74(5/6):496-507.DOI:10.1016/j.ando.2013.10.002.
[38]KRIEGER N,CHEN J T,WATERMAN P D,et al.Race/ethnicity and changing US socioeconomic gradients in breast cancer incidence:California and Massachusetts,1978-2002(United States)[J].Cancer Causes Control,2006,17(2):217-226.DOI:10.1007/s10552-005-0408-1.
[39]DUTTA P,BHANSALI A,SHAH V N,et al.Pituitary metastasis as a presenting manifestation of silent systemic malignancy:a retrospective analysis of four cases[J].Indian J Endocrinol Metab,2011,15(Suppl 3):S242-245.DOI:10.4103/2230-8210.84875.
[40]MORITA A,MEYER F B,LAWS E R Jr.Symptomatic pituitary metastases[J].J Neurosurg,1998,89(1):69-73.DOI:10.3171/jns.1998.89.1.0069.
[41]王志芳,崔西春,张丽侠,等.淋巴细胞性垂体炎五例临床诊疗分析[J].中国全科医学,2017,20(2):224-227.DOI:10.3969/j.issn.1007-9572.2017.02.021.WANG Z F,CUI X C,ZHANG L X,et al.Clinical diagnosis and treatment analysis of five cases with lymphocytic hypophysitis[J].Chinese General Practice,2017,20(2):224-227.DOI:10.3969/j.issn.1007-9572.2017.02.021.
[42]LAKE M G,KROOK L S,CRUZ S V.Pituitary adenomas:an overview[J].Am Fam Physician,2013,88(5):319-327.
[43]AL-ARIDI R,EL SIBAI K,FU P,et al.Clinical and biochemical characteristic features of metastatic cancer to the sella turcica:an analytical review[J].Pituitary,2014,17(6):575-587.DOI:10.1007/s11102-013-0542-9.
[44]MARSH J C,GARG S,WENDT J A,et al.Intracranial metastatic disease rarely involves the pituitary:retrospective analysis of 935 metastases in 155 patients and review of the literature[J].Pituitary,2010,13(3):260-265.DOI:10.1007/s11102-010-0229-4.
[45]HUININK D T,VELTMAN G A,HUIZINGA T W,et al.Diabetes insipidus in metastatic cancer:two case reports with review of the literature[J].Ann Oncol,2000,11(7):891-895.
