盐胁迫对红叶石楠花青素含量及抗氧化系统的影响
2018-06-28林义成傅庆林丁能飞
林义成,傅庆林,郭 彬,刘 琛,丁能飞
(浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021)
盐胁迫对红叶石楠花青素含量及抗氧化系统的影响
林义成,傅庆林,郭 彬*,刘 琛,丁能飞
(浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021)
摘 要:采用盆栽实验研究不同NaCl添加量(质量分数分别为0、0.1%、0.2%、0.3%和0.4%)对红叶石楠地上部鲜重、株高、叶片Na含量、K+/Na+、细胞膜透性、叶片含水量、脯氨酸含量、抗氧化酶活性,以及花青素含量的影响。结果表明,在0.2%及更高浓度的NaCl处理下,红叶石楠生长受到抑制,叶片Na含量、细胞膜透性、脯氨酸含量显著(P<0.05)增加,K+/Na+、叶片相对含水量显著(P<0.05)下降。盐胁迫造成红叶石楠叶片的H2O2及丙二醛(MDA)含量显著(P<0.05)增加,0.4%NaCl处理下,H2O2及MDA含量在新叶上的增幅分别为162%和128%,在老叶上的增幅分别为114%和33%。随着盐胁迫加剧,新叶氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性显著(P<0.05)升高,过氧化物酶(POD)活性和花青素含量显著(P<0.05)下降。与之相反,老叶的SOD和CAT酶活显著(P<0.05)下降,而POD活性和花青素含量显著(P<0.05)上升。由此可见,花青素在抵御盐胁迫诱导的氧化伤害中具有重要作用,其在叶片中的含量与CAT酶活性呈现此消彼长的关系。
关键词:花青素;抗氧化酶;红叶石楠;盐胁迫
土壤盐渍化及次生盐渍化是制约农业生产的主要障碍因子之一,也是影响生态环境的重要因素。目前,世界上大约1/3的耕地都不同程度地受到自然或次生盐渍化的影响[1]。盐胁迫打破植物对营养离子的吸收平衡,干扰植物的正常代谢过程,引发生理生化紊乱,致使植物光合能力下降,最终导致植株死亡[2]。不同植物对盐害的耐受性不同,大宗蔬菜,如番茄、萝卜等属盐分敏感植物,0.1%的土壤含盐量即可显著影响其对土壤养分和水分的吸收[3]。而耐盐植物,如盐地碱蓬,可在含盐量0.48%的土壤中存活,其耐盐性与盐分在液泡的区隔化过程有关[4]。此外,植物还可通过平衡K+/Na+、调控Ca2+吸收、加速脯氨酸等渗透调节物质合成、提高植物抗氧化系统活性等多种途径降低盐胁迫造成的伤害[5]。
浙江滨海盐土存在盐分高、肥力低、土壤结构不良等不利因素[6]。在浙江省滨海盐土上筛选种植具有一定经济价值的耐盐彩叶苗木品种,不仅可以快速降盐、肥沃土壤,而且对充分利用滨海盐渍土资源、改善生态环境等也具有十分积极的意义[7]。红叶石楠是我国东南沿海地区广泛种植的一种彩叶苗木,具有较强的抗旱和抗盐碱能力,其新梢和嫩叶含有大量花青素,呈火红色,色彩艳丽持久[8]。花青素是一类广泛存在于植物的花、根、叶、果实、种皮等部位的水溶性色素,属于类黄酮化合物,具有很强的抗氧化功能,能清除植物体内的自由基[9]。目前,关于盐胁迫对花青素合成的影响仍存在争论。研究显示,40mmol·L-1NaCl可促进草莓花青素的合成[10],海水叶面喷施可促进苹果表皮花青素的累积[11],但孙红等[12]研究表明,长期低盐处理抑制了葡萄果皮花青素的形成。在本研究检索范围内,关于盐胁迫下花青素合成与植物抗氧化能力间响应关系的报道并不多见。本研究通过盆栽实验,研究盐胁迫对红叶石楠生理生化,特别是对花青素在抗氧化方面作用的影响,以期为调控彩叶苗木花青素的形成提供科学依据。
1 材料与方法
1.1 实验材料及处理
实验用土系浙江省上虞涂区水稻土,土壤pH值6.7,有机质11.7g·kg-1,速效磷20.4mg·kg-1,速效钾118.3mg·kg-1,碱解氮96.5mg·kg-1,土壤样品风干后过2mm筛混匀。实验用扦插苗购自德清阳光园艺有限公司,规格统一为茎高30cm、胸径0.5cm,栽植于装有2 kg供试土壤的盆钵中(每盆1棵),置于浙江省农业科学院温室培养,光暗周期12h∶12h,昼夜温度25℃/20℃。每天适时浇水,以保持土壤湿度在80%土壤饱和含水量。扦插苗生长60d后,挑选一致的植株用于实验。实验共设5个处理:CK(对照),S1[0.1%(质量分数,下同)NaCl],S2(0.2% NaCl),S3(0.3% NaCl),S4(0.4% NaCl)。每个处理重复5次。根据土壤质量,按比例称取NaCl溶解于100mL水中,将盐水均匀地滴灌至盆钵土壤中。盐处理28d后,采集每个处理的新叶和老叶,其中新叶为新抽枝条顶端展开叶,老叶为植株中部枝干内侧叶片。叶片采集后,用自来水和蒸馏水反复冲洗干净后,置于-80℃冰箱保存。
1.2 测试项目与方法
1.2.1 土壤电导率(EC)
土水质量体积比1∶5浸提,采用DDS-11A型电导率仪测定。
1.2.2 叶片Na、K含量
将采集的叶片于70℃烘干72h,粉碎,过1mm筛,干灰化法制成待测液后,用原子光谱分析法测定Na、K含量。
1.2.3 叶片细胞膜透性
将5个新鲜叶圆片(每个0.78cm2)用蒸馏水冲洗3次,随后浮于10mL蒸馏水中。24h后于室温下用电导仪测定溶解电导率。将烧杯置于烘箱(95℃)2h后得到总电导率。结果用总电导率百分比表示[13]。
1.2.4 脯氨酸含量
称取植物叶片 0.5g,用5mL 3%的磺基水杨酸溶液研磨匀浆,沸水浴中提取10min,冷却后于3000r·min-1离心10min。吸取1mL上清液,加入2mL冰醋酸及2mL 2.5%酸性茚三酮试剂,在沸水浴中加热30min,冷却后加入4mL甲苯,振荡后,取上层脯氨酸红色甲苯溶液于比色杯中,以甲苯溶液为空白对照,在520mm波长处测定吸光度值,同时绘制标准曲线,计算脯氨酸浓度[14]。
1.2.5 抗氧化酶活性及H2O2、丙二醛(MDA)含量
称取新鲜植物样品0.5 g于研钵中,4℃下用10mL pH值7.8的磷酸缓冲液研磨至匀浆,8000r·min-1离心15min。取上清液分析测量超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性,以及可溶性蛋白含量。SOD活性采用四唑氮蓝光氧化还原法测定,以每分钟每克蛋白的反应体系对四唑氮蓝(NBT)光化还原抑制50%为1个活性单位(U)。CAT活性采用紫外吸收法测定,以1min内D240减少0.1的酶量为1个酶活单位。POD活性采用愈创木酚法测定,将每分钟1个单位的吸光度变化定义为1个POD活性单位。可溶性蛋白含量的测定参照考马斯亮蓝法[15]。
植物叶片H2O2采用丙酮提取—TiSO4比色法测定,MDA采用硫代巴比妥酸比色法测定[16]。
1.2.6 花青素含量
将待测叶片用液氮研磨成粉末,用1%盐酸-甲醇溶液萃取。3000r·min-1离心5min,取上清液分别在530 nm和657 nm处测定吸光值,以1%盐酸-甲醇溶液作为空白对照,同时绘制花青素标准曲线,计算花青素含量[17]。
1.3 数据处理
所有实验数据用Excel 2003计算均值和标准差。用统计分析软件SPSS 17.0对实验数据进行单因素方差分析,用Duncan多重比较检验各处理平均值之间的差异显著性,显著性水平为P<0.05。
2 结果与分析
2.1 对植物生长的影响
土壤溶液电导率是评价土壤溶液盐浓度的一个常用方法[18],也是判断土壤盐害的一个重要指标。随着NaCl加入量的增加,土壤电导率逐渐升高,平均增加幅度为0.45 mS·cm-1(图1)。S3和S4处理显著(P<0.05)提高了红叶石楠叶片的Na含量,分别是对照的4.7倍和11.1倍,株高增量显著(P<0.05)下降(分别为对照的48%和30%),地上部鲜重显著(P<0.05)降低(分别为对照的50%和48%)。S1和S2处理对红叶石楠叶片Na+含量和植株生长无明显影响。
2.2 对植物叶片盐害生理指标的影响
K+/Na+、细胞膜透性、叶片相对含水量及脯氨酸含量是反映盐胁迫对植物伤害的主要生理指标。对于红叶石楠新叶来讲,S1处理的K+/Na+与对照相比未发生显著变化,但随着NaCl添加量增加,K+/Na+迅速减小,S2、S3、S4处理分别减少至对照的60%、22%和6%(图2)。S1处理新叶的膜透性与对照相比无显著差异,但S2、S3、S4处理的膜透性显著(P<0.05)增加,约为对照的3倍。对照处理新叶相对含水量保持在91%,盐胁迫降低了叶片相对含水量,S2~S4处理与对照相比差异显著(P<0.05)。新叶S1处理的脯氨酸含量与对照相比无显著变化,然而S2~S4处理的脯氨酸含量增加到对照(36mg·kg-1)的2倍左右。
对于老叶来讲,对照处理的K+/Na+、叶片相对含水量、膜透性均略低于新叶,而脯氨酸含量却高于新叶。S1和S2处理下,上述4个指标与对照相比均未发生显著变化。随着NaCl浓度增加,K+/Na+、叶片相对含水量有所下降,但下降幅度均低于新叶。S4处理的细胞膜透性显著(P<0.05)增加,而S3处理下与对照却无显著差异。S3和S4处理的脯氨酸含量均较对照显著(P<0.05)增加。
2.3 对植物叶片花青素含量及抗氧化酶的影响
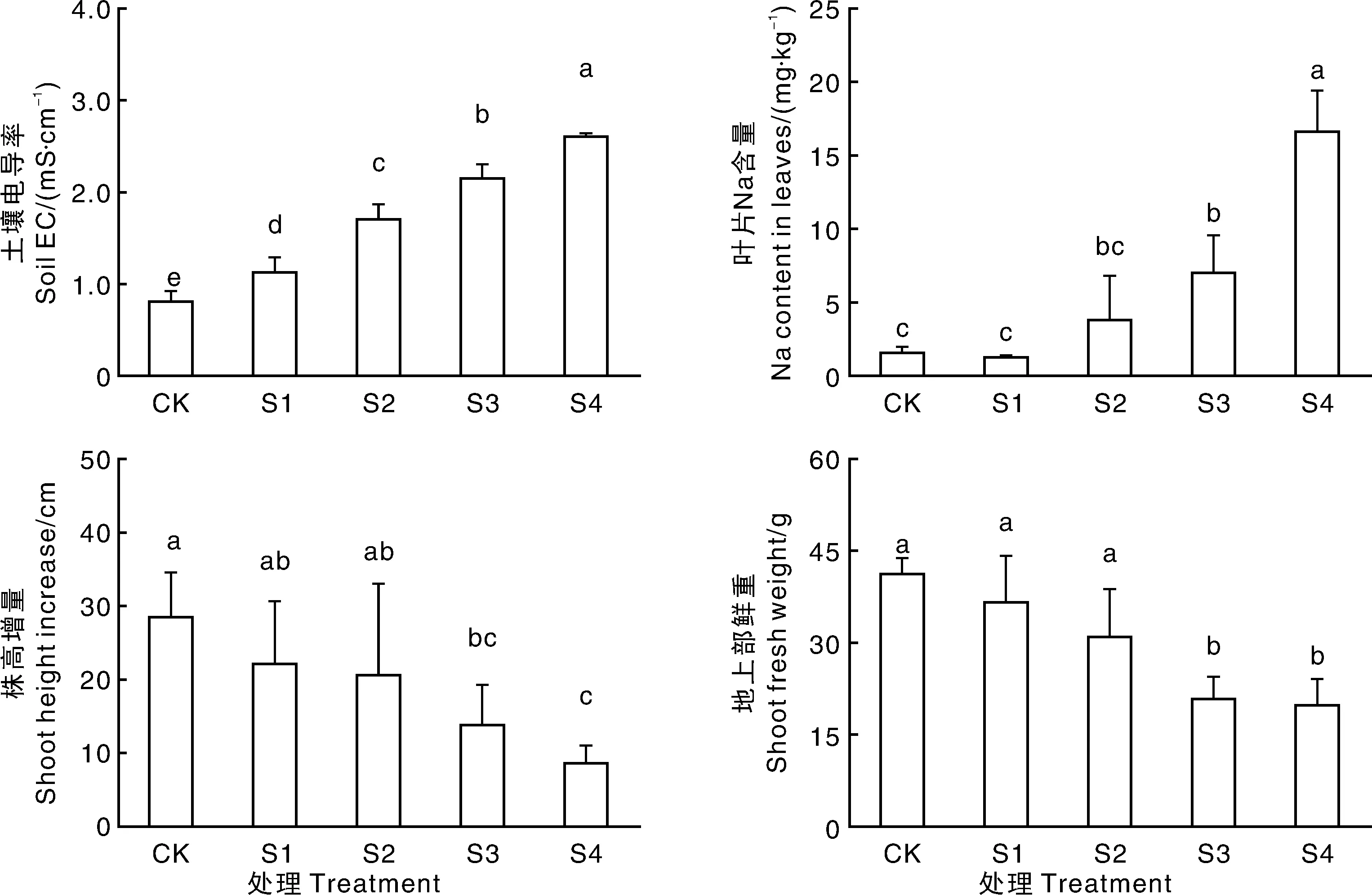
柱上无相同字母的表示差异显著(P<0.05)。Bars marked by no same letters indicated significant difference at P<0.05.图1 各处理对土壤电导率、叶片Na含量、株高增量和地上部鲜重的影响Fig.1 Effects of salt stress on electrical conductivity of the soil solution,Na concentration in leaves,plant height increase and shoot biomass

柱上无相同小、大写字母的分别表示新叶或老叶上处理间差异显著(P<0.05)。下同。Bars marked by no same lowercase or uppercase letters indicated significant difference at P<0.05 within treatments in new leaves or old leaves,respectively.The same as below.图2 各处理对叶片K+/Na+、膜透性、相对含水量和脯氨酸含量的影响Fig.2 Effects of salt stress on K+/Na+,cellular leakage,relative water content and proline content of leaves
在低浓度NaCl处理下(S1、S2处理),红叶石楠新老叶片H2O2和MDA含量与对照相比无显著差异(图3)。但随着NaCl浓度增加,红叶石楠新老叶片H2O2和MDA含量均显著(P<0.05)增加,且新叶的增幅远高于老叶。如在S4处理下,新叶H2O2和MDA含量与对照处理相比分别增加162%和128%,而老叶H2O2和MDA含量与对照处理相比分别增加114%和33%。
S1、S2处理对红叶石楠新叶SOD酶活未产生显著影响,而S3、S4处理则显著(P<0.05)提升了新叶SOD酶活,S4处理与对照相比增幅达111%。对于红叶石楠老叶来讲,对照处理的SOD酶活略高于新叶,随着NaCl浓度增加,SOD酶活略有下降,S4处理与对照相比显著(P<0.05)下降,降幅12.8%。
对于红叶石楠新叶来讲,S1和S2处理对CAT酶活无显著影响,而S3和S4处理下,CAT酶活显著(P<0.05)提高,S4处理与对照相比增幅达456%。对于老叶来讲,对照处理的CAT酶活略低于新叶,S2、S3处理下CAT酶活显著(P<0.05)下降,分别为对照的71%和44%,S4处理下CAT酶活又显著(P<0.05)上升,与对照相比增加37%。
红叶石楠新叶S1和S2处理下POD酶活与对照相比未产生显著变化,但随着NaCl浓度增加,POD活性显著(P<0.05)下降,S3和S4处理下分别为对照的35%和9%。各盐分处理下,老叶的POD酶活下降趋势与新叶相似,但是降幅远低于新叶,如老叶S3和S4处理的POD酶活分别为对照的81%和78%。
对照处理中,新叶花青素含量约是老叶的4倍。随着NaCl浓度的增加,S1~S4处理的新叶花青素水平分别下降至对照的95%、63%、50%、21%。对于老叶来讲,随着NaCl浓度增加,花青素含量有上升趋势,S1~S4处理分别比对照提高19%、18%、20%和58%。
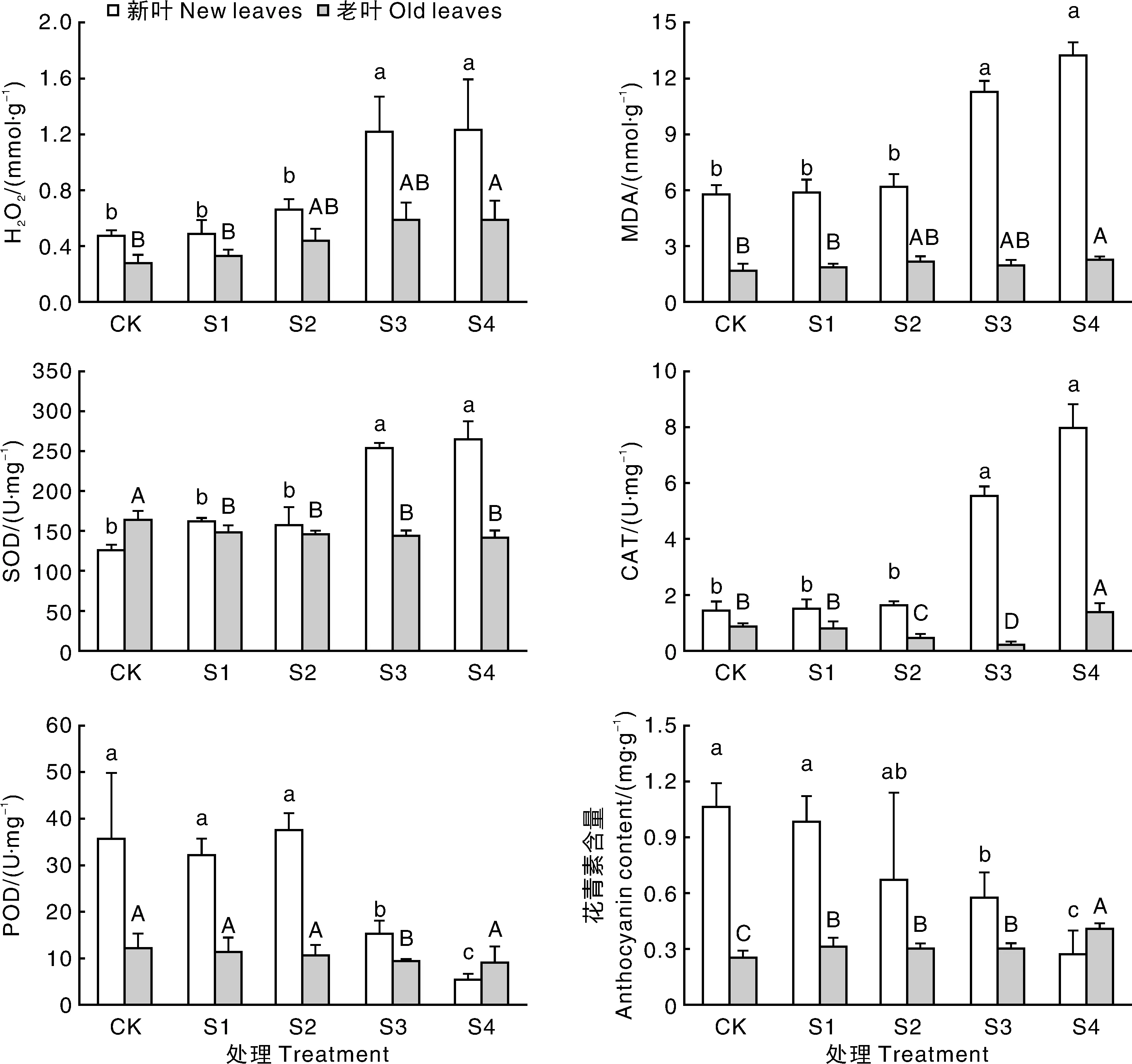
图3 盐胁迫对叶片H2O2和MDA含量,SOD、CAT、POD活性,以及花青素含量的影响Fig.3 Effects of salt stress on contents of H2O2 and MDA,activities of SOD,CAT,POD,and anthocyanin content of leaves
3 讨论
植物的耐盐性是一个由多基因控制的复合遗传性状,主要取决于根系对离子的选择性吸收和盐分在器官组织和细胞水平上的区域化分布,以及在满足细胞渗透调节对离子需求的前提下,保持地上部分相对较低的盐分浓度的能力[2,5]。在S1和S2处理(低盐胁迫)下,红叶石楠的株高增量与地上部鲜重并未受到显著影响,表明红叶石楠可耐受0.2%以下的盐胁迫,其耐盐主要机制与限制Na+向地上部转移、维持了K+的胞内平衡有关。这和Lacand等[19]的报道相一致。该研究认为,植物根对Na的截留是限制Na向地上部运输的主要原因,并指出这种截留作用是在质膜H+-ATPase驱动下通过木质部/共质体的K/Na交换完成的。K是植物三大营养元素之一,对气孔行为、渗透调节、酶活、细胞膨胀和质膜极化均有十分重要的作用[20]。在S1处理下,高K+/Na+维持了红叶石楠新老叶片细胞膜透性和叶片相对含水量,稳定了抗氧化系统的正常运转。盐胁迫下红叶石楠叶片脯氨酸含量显著增加。脯氨酸作为植物体内重要的渗透调节物质,能够增加胞质浓度,改善细胞膜和其他高分子物质的水环境,维持渗透压和质膜稳定性,在植物应对盐胁迫的适应中具有重要的作用[21]。
一旦土壤盐分超出了红叶石楠的耐受能力(S3和S4处理),植物盐害随即发生。红叶石楠叶片中Na+大量累积,造成地上部鲜重和株高增量显著下降。除了Na+的直接毒害外,盐胁迫还造成植物生理干旱与作物生长代谢所必需的矿质营养元素竞争性吸收,新老叶片细胞膜透性显著增加,新老叶片胞内K+和Na+的动态平衡被扰乱。受渗透胁迫的限制,叶片表面扩张减小[22],叶片相对含水量显著下降。此外,在高盐胁迫下,红叶石楠的新叶较老叶更为敏感,例如新叶的K+/Na+比例下降程度远高于老叶,细胞膜稳性更易被打破,叶片对水分的把持能力,以及合成脯氨酸的能力也均低于老叶,这可能是植物主动适应盐胁迫的结果。一方面,植物主动弱化新叶对盐分的应对能力,进而抑制新叶的生长来减少对水分的需求和丢失;另一方面,老叶的叶片功能较新叶更为完整,是光合作用的主要贡献者,植物加强对老叶的保护,以更好地维持生存所必需的物质和能量。
盐胁迫干扰了植物体内抗氧化系统的正常运行,引起氧自由基的累积,导致氧化伤害。H2O2是活性氧的重要组分之一,也是氧化胁迫的重要指标。MDA是膜脂过氧化作用的主要产物之一,其含量高低指征植物细胞受氧化伤害程度的大小[15]。随着盐分胁迫的加剧,植株叶片H2O2含量不断累积,与之对应的MDA含量也进一步积累。尽管叶片脯氨酸含量有所增加,但在K+缺乏和渗透压力不断加剧的情况下,质膜过氧化反应的发生不可避免。

花青素的合成受多个基因协同调控,其同化过程与叶绿体和整个叶片发育进程密切相关。在新叶发育初期,其抗氧化的调节能力较弱,需要合成大量的花青素辅助抗氧化酶系来清除光合过程电子传递形成的活性氧,以便在叶片发育的关键时期提供有效保护[24]。随着叶片组织中叶绿体的不断发育成熟,花青素含量逐渐下降,被叶绿素的绿色所掩盖,这正是红叶石楠新生幼叶呈现为红色,并随着叶片的发育成熟其叶色由红变绿的原因[25]。盐胁迫造成叶片抗氧化体系紊乱,新叶花青素的合成受阻,而老叶花青素含量有所上升。孙红等[12]的研究也表明,长期低盐处理下,葡萄果实中的24个花青素代谢相关结构基因中,有21个显著下调,造成花青素含量显著下降。但对于不同植物,盐胁迫对花青素的代谢影响并不相同。Galli等[10]的研究表明,长期的低盐胁迫(40mmol·L-1NaCl,85d)促进了草莓的生长,以及抗生素合成基因的表达,花青素含量与对照相比提高了60%。Yamada等[11]的研究也表明,50倍稀释海水喷施苹果显著提高了果皮中花青素的含量。这可能与植物应对环境胁迫的机制有关。适度的盐胁迫加强了植物的抗氧化能力,促进了花青素的合成,但长期或过量的盐胁迫则超出了植物耐受力,造成花青素合成代谢过程受阻。作为植物重要的抗氧化剂,花青素的合成与其他抗氧化酶系在抵御氧化伤害时各自所起的作用,以及它们之间这种此消彼长的关系仍有待于进一步研究。
:
[1] 李建国,濮励杰,朱明,等.土壤盐渍化研究现状及未来研究热点[J].地理学报,2012,67(9):1233-1245.
LI J G,PU L J,ZHU M,et al.The present situation and hot issues in the salt-affected soil research[J].ActaGeographicaSinica,2012,67(9):1233-1245.(in Chinese with English abstract)
[2] ZHU J K.Plant salt tolerance[J].TrendsinPlantScience,2001,6(2):66-71.
[3] 曹玲,王艳芳,陈宝悦,等.主要蔬菜作物耐盐性比较[J].华北农学报,2013,28(增刊):233-237.
CAO L,WANG Y F,CHEN B Y,et al.The comparison of salt tolerance in major vegetable crops[J].ActaAgriculturaeBoreali-Sinica,2013,28(Supp.):233-237.(in Chinese with English abstract)
[4] 张立宾,徐化凌,赵庚星.碱蓬的耐盐能力及其对滨海盐渍土的改良效果[J].土壤,2007,39(2):310-313.
ZHANG L B,XU H L,ZHAO G X.Salt tolerance ofSuaedasalsaand its soil ameliorating effect on coastal saline soil[J].Soils,2007,39(2):310-313.(in Chinese with English abstract)
[5] DEINLEIN U,STEPHAN A B,HORIE T,et al.Plant salt-tolerance mechanisms[J].TrendsinPlantScience,2014,19(6):371-379.
[6] 俞海平,郭彬,傅庆林,等.滨海盐土肥盐耦合对水稻产量及肥料利用率的影响[J].浙江农业学报,2016,28(7):1193-1199.
YU H P,GUO B,FU Q L,et al.Coupling effects of salt stress and fertilizer application on rice yield and fertilizer using efficiency in coastal saline soil[J].ActaAgricultruaeZhejiangensis,2016,28(7):1193-1199.(in Chinese with English abstract)
[7] 刘延吉,许建秋,王嵩,等.盐碱地综合改良技术对营口沿海产业基地土壤盐度及3种绿化苗木生理特性的影响[J].沈阳农业大学学报,2010,41(3):354-356.
LIU Y J,XU J Q,WANG S,et al.Influence on soil salinity and physiological characteristic of 3 plants with integrative technique of soline-alkali improvement in Yingkou coastal industrial base[J].JournalofShenyangAgriculturalUniversity,2010,41(3):354-356.(in Chinese with English abstract)
[8] 陈卫元,曹晶,姜卫兵.干旱胁迫对红叶石楠叶片光合生理特性的影响[J].中国农学通报,2007,23(8):217-220.
CHEN W Y,CAO J,JIANG W B.Effects of drought stress on photosynthetic characteristics ofPhotiniafraseryDress[J].ChineseAgriculturalScienceBulletin,2007,23(8):217-220.(in Chinese with English abstract)
[9] TANAKA Y,SASAKI N,OHMIYA A.Biosynthesis of plant pigments:anthocyanins,betalains and carotenoids[J].PlantJournal,2008,54(4):733-749.
[10] GALLI V,SILVA MESSIAS R,PERIN E C,et al.Mild salt stress improves strawberry fruit quality[J].LWT-FoodScienceandTechnology,2016,73:693-699.
[11] YAMADA H,TAKIMOTO S,TOSHINARI D.Effect of seawater irrigation on water relations and fruit quality in potted citrus trees[J].HorticultureJournal,2015,84(3):195-201.
[12] 孙红,孙田雨,许丽丽,等.长期低盐处理对葡萄果实品质及转录组的影响[J].植物生理学报,2017,53(12):2197-2205.
SUN H,SUN T Y,XU L L,et al.Effects of the long-term treatment of low-concentrated salt on grape berry quality and transcriptome[J].PlantPhysiologyJournal,2017,53(12):2197-2205.(in Chinese with English abstract)
[13] 夏阳,梁慧敏,束怀瑞,等.NaCl胁迫下苹果幼树叶片膜透性、脯氨酸及矿质营养水平的变化[J].果树学报,2005,22(1):1-5.
XIA Y,LIANG H M,SHU H R,et al.Changes of leaf membrane penetration,proline and mineral nutrient,contents of young apple tree under NaCl stress[J].JournalofFruitScience,2005,22(1):1-5.(in Chinese with English abstract)
[14] HARE P D,CRESS W A.Metabolic implications of stress-induced proline accumulation in plants[J].PlantGrowthRegulation,1997,21(2):79-102.
[15] GUO B,LIANG Y C,ZHU Y G,et al.Role of salicylic acid in alleviating oxidative damage in rice roots(Oryzasativa) subjected to cadmium stress[J].EnvironmentalPollution,2007,147(3):743-749.
[16] GUO B,LIANG Y,ZHU Y.Does salicylic acid regulate antioxidant defense system,cell death,cadmium uptake and partitioning to acquire cadmium tolerance in rice?[J].JournalofPlantPhysiology,2009,166(1):20-31.
[17] NAGPALA E G L,NOFERINI M,PICCININI L,et al.Exogenous application of plant growth regulators enhances color and anthocyanin content of cherry fruits[J].ActaHorticulturae,2017(1161):621-626.
[18] 林义成,丁能飞,傅庆林,等.土壤溶液电导率的测定及其相关因素的分析[J].浙江农业学报,2005,17(2):83-86.
LIN Y C,DING N F,FU Q L,et al.The measurement of electric conductivity in soil solution and analysis of its correlative factors[J].ActaAgricultruaeZhejiangenesis,2005,17(2):83-86.(in Chinese with English abstract)
[19] LACAND D,DURAND M.Na+and K+transport in excised soybean roots[J].PhysiologiaPlantarum,1995,93(1):132-138.
[20] SHABALA S,CUIN T A.Potassium transport and plant salt tolerance[J].PhysiologiaPlantarum,2008,133(4):651-669.
[21] DELAUNEY A J,VERMA D P S.Proline biosynthesis and osmoregulation in plants[J].PlantJournal,1993,4(2):215-223.
[22] KATERJI N,VAN HOORN J W,HAMDY A,et al.Osmotic adjustment of sugar beets in response to soil salinity and its influence on stomatal conductance,growth and yield[J].AgriculturalWaterManagement,1997,34(1):57-69.
[23] 唐忠厚,周丽.花青素对人类健康影响的研究进展及其前景[J].食品研究与开发,2009,30(7):159-162.
TANG Z H,ZHOU L.Study on anthocyanins influencing on human health and its prospect[J].FoodResearchandDevelopment,2009,30(7):159-162.(in Chinese)
[24] VERBRUGGEN N,HERMANS C.Proline accumulation in plants:a review[J].AminoAcids,2008,35(4):753-759.
[25] HUGHES N M,MORLEY C B,SMITH W K.Coordination of anthocyanin decline and photosynthetic maturation in juvenile leaves of three deciduous tree species[J].NewPhytologist,2007,175(4):675-685.
EffectsofsaltstressonanthocyanincontentandactivitiesofantioxidantenzymesinleavesofPhotiniafrasery
LIN Yicheng,FU Qinglin,GUO Bin*,LIU Chen,DING Nengfei
(InstituteofEnvironment,Resources,SoilandFertilizer,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China)
Abstract:In the present study,a pot experiment withPhotiniafraserywas conducted to examine NaCl addition(0,0.1%,0.2% 0.3%,0.4%) on fresh weight of aboveground parts,plant height increase,plant growth,Na and K concentration,electrolyte leakage,relative water content,contents of proline,H2O2,malondialdehyde(MDA),anthocyanin and activities of the enzymes related to antioxidant system of plant leaves.It was shown that the growth ofPhotiniafraserywas inhibited when NaCl addition amount was 0.2% or higher.Na and proline content,electrolyte leakage were significantly(P<0.05) increased,while K+/Na+and relative water content were significantly(P<0.05) decreased.Salt stress induced oxidative stress of leaves.The H2O2and MDA contents were significantly(P<0.05) increased by 162% and 128% in new leaves,and by 114% and 33% in old leaves,respectively.For new leaves,activities of SOD and CAT were significantly(P<0.05) enhanced,while POD activity and anthocyanin contents were significantly(P<0.05) decreased as the salt stress increased.However,activities of SOD and CAT were significantly(P<0.05) decreased,while POD activity and anthocyanin contents were significantly(P<0.05) increased as the salt stress increased in old leaves.Thus,it could be concluded that anthocyanin was an important antioxidant molecular ofPhotiniafrasery,which partially replaced the antioxidant roles of CAT under salt stress.
Key words:anthocyanin;antioxidant enzyme;Photiniafrasery;salt stress
中图分类号:Q945.78;S153
A
文章编号:1004-1524(2018)06-0970-08
收稿日期:2018-02-26
基金项目:国家自然科学基金(41001184);浙江省科技厅重大科技专项(2015C03020);宁波市科技计划(2014C10019)
作者简介:林义成(1962—),男,浙江建德人,副研究员,主要从事土壤改良研究。E-mail:lyc5918@sina.com.cn
,郭彬,E-mail:ndgb@163.com
10.3969/j.issn.1004-1524.2018.06.12
(责任编辑高 峻)
