猪乙型脑炎病毒SCYA201201株感染小鼠后突破血脑屏障能力研究
2018-06-28柴春霞赖雅兰徐伊璇文心田曹三杰黄小波文翼平
柴春霞,王 侨,赖雅兰,徐伊璇,文心田,曹三杰,黄小波,文翼平,赵 勤,伍 锐
(四川农业大学 动物医学院 猪病研究中心,四川 成都 611130)
猪乙型脑炎病毒SCYA201201株感染小鼠后突破血脑屏障能力研究
柴春霞,王 侨,赖雅兰,徐伊璇,文心田,曹三杰,黄小波,文翼平,赵 勤,伍 锐*
(四川农业大学 动物医学院 猪病研究中心,四川 成都 611130)
摘 要:将猪乙型脑炎病毒SCYA201201株(F122代次,弱毒株)脑内接种小鼠,评估该病毒株对小鼠的致病性。通过腹腔接种小鼠,分别在接种后6、12、18、24h观察小鼠脑部病理变化,同时利用荧光定量PCR方法检测其血液、脑组织E基因拷贝数,探究该毒株突破小鼠血脑屏障的能力,从而评估SCYA201201株(F122代次)作为弱毒活疫苗的潜力。结果显示,SCYA201201株(F122代次)高度弱化,对乳鼠的脑内半数致死量(LD50)仅为4×105PFU·40μL-1。该毒株腹腔接种24h内,小鼠脑部未出现病理变化,且荧光定量PCR检测为阴性,表明该毒株不能突破小鼠的血脑屏障,具有很高的安全性。
关键词:猪乙型脑炎病毒;半数致死量;荧光定量PCR;血脑屏障
日本乙型脑炎(Japanese encephalitis,JE)是一种经蚊虫传播的人畜共患传染病,病原体是日本乙型脑炎病毒(JEV)。JEV属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),包括衣壳蛋白C、膜蛋白M、囊膜蛋白E等3个结构蛋白和NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5等7个非结构蛋白[1]。猪是JEV主要传染源和最重要的自然增殖动物。猪感染JEV虽然不会引起较高的死亡率,但是会引起种猪的繁殖障碍,如母猪发生流产,产死胎、弱仔以及木乃伊胎,公猪发生急性睾丸炎或者不育[2],给养猪业带来严重损失。
JEV的E基因与病毒吸附穿入致病和机体宿主的免疫应答作用密切相关,能刺激机体产生中和抗体和血凝抑制抗体,为免疫原性蛋白,前膜蛋白prM和E蛋白具有免疫原性,E蛋白在决定病毒致病力上起着重要作用。根据E基因核苷酸序列的差异,可以将JEV分为5个基因型:即基因Ⅰ型、Ⅱ型、Ⅲ型、Ⅳ型、Ⅴ型[3]。基因Ⅰ型主要来源于泰国北部、柬埔寨、韩国;基因Ⅱ型来自泰国南部、印度尼西亚、马来西亚、澳大利亚;基因Ⅲ型主要分离于亚洲温带地区,如日本、中国、印度等地;基因Ⅳ型主要存在于印度尼西亚;基因Ⅴ型出现得少,在马来西亚、中国和韩国分离得到。在我国,JEV的基因型主要是Ⅰ型和Ⅲ型[4],1979年我国研究人员分离出Ⅰ型JEV毒株,在我国辽宁[5]等多地出现,数量逐渐增多,危害也越来越大。在我国应用广泛的是WH1株的鼠脑灭活苗和SA14-14-2株减毒活疫苗,这2个毒株均属于基因Ⅲ型。目前我国尚无商品化的基因Ⅰ型疫苗,对基因Ⅰ型疫苗的研究刻不容缓。
血脑屏障(blood-brain barrier,BBB)由脑微管内皮细胞及其细胞间的紧密连接、完整的肌膜、周细胞、小胶质细胞、星形胶质细胞脚围成的神经胶质膜构成[6]。乙脑病毒主要通过破坏内皮细胞间紧密连接[7]穿越血脑屏障入侵脑部,破坏神经细胞与脑内微环境,引起中枢神经系统感染,因此,检测乙型脑炎病毒早期突破血脑屏障的能力,可作为乙型脑炎减毒活疫苗安全性评估的有效手段。本实验选用BHK-21细胞上的连续传代培养、毒力致弱的F122代次乙脑病毒SCYA201201株接种小鼠,测定小鼠脑内半数致死量(LD50),荧光定量PCR检测腹腔接种24h内F122代病毒在血液、脑组织中的病毒含量与脑组织病理变化,对该毒株的安全性进行基础评估,为后续将SCYA201201株继续致弱制备弱毒疫苗提供研究基础。
1 材料与方法
1.1 毒株、细胞与实验动物
猪源乙型脑炎病毒(SCYA201201株),于2012年8月从四川雅安某猪场流产胎儿脑组织中分离鉴定,由四川农业大学动物医学院猪病研究中心保存。F122代次乙脑病毒,由SCYA201201株乙脑病毒在BHK-21细胞上连续传代致弱得到。BHK-21细胞由四川农业大学动物医学院猪病研究中心冻存。3周龄SPF昆明小鼠购自四川成都达硕有限公司。
1.2 主要试剂
RNAsimple Total RNA Kit、Real Master Mix(SYBR Green)FP202均购自天根生化科技(北京)有限公司,PrimeScriptTMRT reagent Kit购自宝生物工程(大连)有限公司。
1.3 乙脑病毒滴度的测定
将生长良好的BHK-21细胞按常规消化后接种于6孔板中,每孔2mL。在接种病毒液之前将病毒原液用DMEM营养液按照10倍梯度稀释至合适稀释倍数。将稀释好不同梯度的病毒液接种于6孔板中,每孔0.5mL,并设置1孔为对照组,37℃孵育,1.5h后吸取孵育液,每孔加入2mL的甲基纤维素维持液,37℃培养4~6d,待细胞出现病变后,吸取维持液,加入5%甲醛固定15min,再加入1%结晶紫染色15~20min,数出空斑数量,计算出病毒的滴度(PFU·mL-1)。
1.4 乳鼠LD50测定
将F122代病毒液10倍梯度稀释后,取10-1~10-5病毒稀释液接种小鼠(平均体质量7~8g),每个稀释度接种5只,每只脑内注射40μL,弃去2d内死亡的小鼠,连续观察14d,记录小鼠死亡情况并以Reed-Muench法计算LD50。
1.5 小鼠腹腔接种及样品采集
将3周龄SPF昆明雌鼠随机分成2组,每组12只,其中1组作为对照。SCYA201201株接种组按3.58 LD50腹腔接种,对照组接种PBS。接种后6、12、18、24h分别取小鼠血液及脑组织,观察脑部病理变化。
1.6 荧光定量PCR E基因拷贝数的测定
将取好的脑组织和血液按照天根生化科技(北京)有限公司生产的RNA simple Total RNA Kit说明书提取总RNA,反转录参照TaKaRa PrimeScriptTMRT Reagent Kit试剂盒的说明进行。标准曲线参照Yuan等[8]文章所示乙脑病毒检测方法:将实验室已制备好的E基因标准品阳性模板进行10倍梯度稀释,以浓度梯度起始模板数的对数值为X轴,相应的循环数(Ct)值为Y轴作回归曲线,由Mini opticon Real-Time PCR Detection System(Bio-Rad,USA)得出定量PCR的动力学曲线和标准曲线的表达式。荧光定量反应体系参照Real Master Mix(SYBR Green)FP202试剂盒说明。E基因引物序列:F,5′-CATTGGAGCCACTTGGGTG-3′;R,5′-TTGTGGGCTTCTCCTGTCG-3′。反应体系20μL:RealMasterMix/SYBR solution 9.0μL,上游引物0.8μL,下游引物0.8μL,cDNA 1.0μL,ddH2O 8.4μL。反应程序:95℃ 2min;95℃ 15s,57℃ 20s,68℃ 20s,79℃ 10s,39个循环;65~95℃溶解循环。
2 结果与分析
2.1 乙脑病毒滴度的测定
将F121代乙脑病毒[感染复数(MOI)0.01]接种于铺满单层的BHK-21细胞中,24h细胞没有明显变化,到48h细胞由梭形变圆缩,大面积脱落堆积(图1),并收毒。收取的F122代乙脑病毒液在BHK-21细胞上作空斑实验(图2),培养至3.5d,细胞出现变形裂解,结晶紫染色后,计数蚀斑数目,测定F122代病毒的滴度为4.2×107PFU·mL-1。
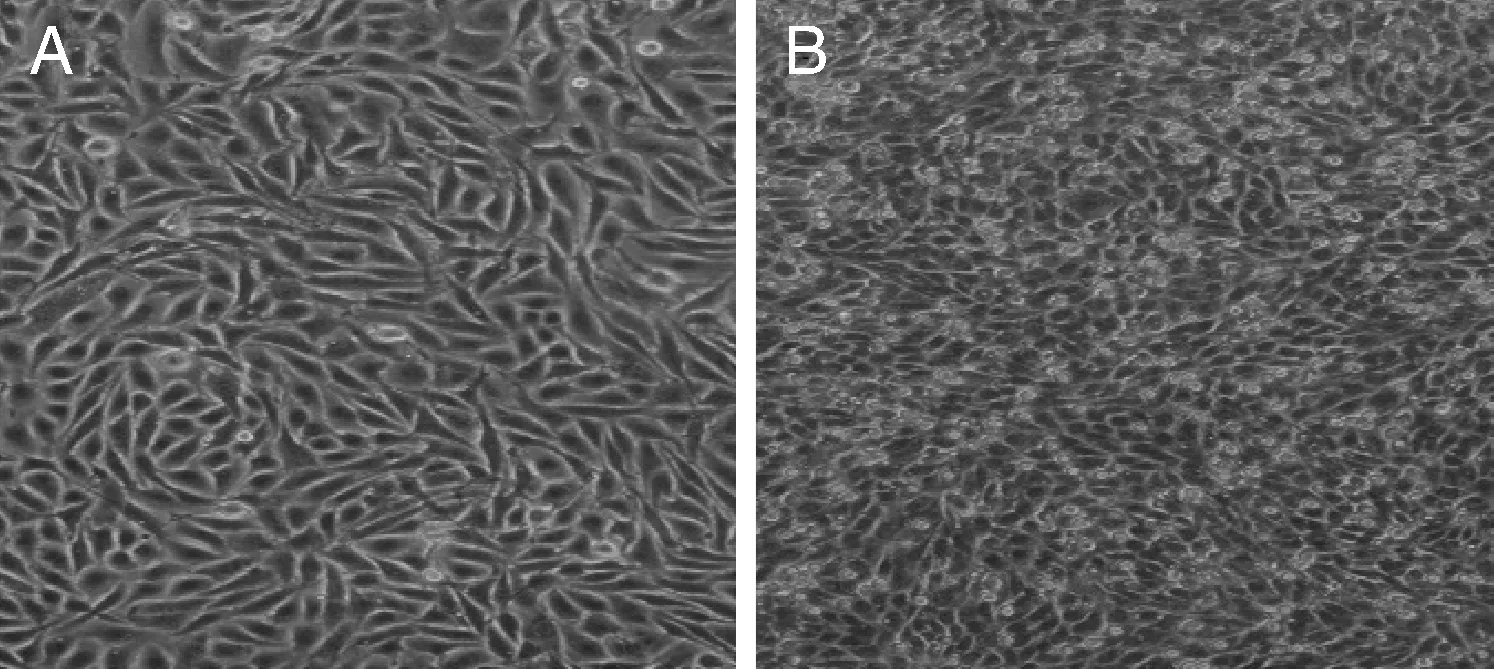
A,BHK-21阴性对照;B,接毒48h细胞病变。A,Control of BHK-21;B,Cytopathies of injection at 48h.图1 猪乙型脑炎F122代次毒株接种BHK-21的细胞病变Fig.1 Cytopathies of BHK-21 inoculated with F122 generation of porcine JEV

A,F122代次蚀班;B,空白对照。A,Plaque of F122 strain;B,Negative control.图2 猪乙型脑炎病毒F122代次毒株接种BHK-21细胞后的蚀斑观察Fig.2 Results of plaque after inoculation with F122 generation of porcine JEV in BHK-21
2.2 小鼠LD50的测定
将病毒10倍梯度稀释脑内接种后:在10-1稀释倍数下小鼠在第5天开始出现麻痹、四肢抽搐,并开始死亡,第6天5只全部死亡;在10-2稀释倍数下小鼠在第5天出现四肢间歇性抽搐症状,在第6天死亡4只,第7天死亡1只;在10-3稀释倍数下小鼠第6天开始出现麻痹等神经症状,第7天死亡4只;在10-4稀释倍数下小鼠也出现了抽搐等症状,在第7天、第8天各死亡1只;在10-5稀释倍数下小鼠没有出现死亡。通过统计死亡数据,按照Reed-Muench法计算出F122代乙脑病毒对乳鼠的半数致死量(LD50)为10-3.7·40μL-1(4×105PFU·40μL-1)。
2.3 脑部组织病变观察结果
将F122代乙脑病毒按3.58 LD50腹腔接种小鼠后,分别在6、12、18、24h获取小鼠脑部,并记录其颅骨外膜及脑组织的病理眼观变化。如图3所示,有颅骨外膜的小鼠从接种病毒后6~24h内与PBS对照组并无明显差异。
将脑部颅骨去掉、脑组织完全暴露后,观察发现,组织形态与PBS对照组基本一致(图4),并无感染乙脑病毒的非化脓性脑炎病理变化,如脑软膜模糊、脑实质充满斑点状出血点或脑灰质出血。

A,6h;B,12h;C,18h;D,24h.图3 颅骨外膜病理变化Fig.3 Histopathological changes of skull epicardium
2.4 标准曲线建立
以JEVE基因标准品阳性模板进行荧光定量RT-PCR反应,由Miniopticon Detection System得到标准曲线:Y=-3.292X+39.1,拷贝数为3.2×10xcopies·μL-1,拟合度r2为0.995。
2.5 荧光定量PCR检测乙脑病毒E基因拷贝数
根据读取到的不同时间点血液和脑组织病毒cDNA模板Ct值和标准曲线公式计算得到模板的初始拷贝数值,再转换为初始模板拷贝数的平均值对数值(lg copies),结果如图5所示。SCYA201201组在6h脑组织和血液中病毒含量均高于PBS组,12h脑组织病毒含量较6h显著(P<0.05)下降,并低于PBS组,血液中病毒含量在6~12h变化并不明显,18~24h脑组织病毒含量缓慢下降,且仍低于PBS组,血液中病毒含量在18h最低,低于PBS组,24h脑组织和血液中病毒含量基本与PBS组持平。总体来看,F122代乙脑病毒在感染小鼠早期没有突破血脑屏障。

图5 病毒感染小鼠后不同时间脑组织(A)和血液(B)中的病毒拷贝数Fig.5 Virus copies of E gene in brain(A) and blood(B) at different time
3 讨论
乙脑病毒会严重影响人畜中枢神经系统,并引起脑炎症状。人或动物被感染后,病毒侵入体内并迅速进入血流,在外周血管中增殖,随后进入到神经外组织,特别是其网状内皮细胞和血管内皮细胞中。病毒经脊液或内皮细胞、吞噬细胞、淋巴细胞感染或血源路线进入中枢系统(CNS)[9]。当病毒感染的剂量大或具有极高毒力时,病毒可能突破血脑屏障(BBB),侵入中枢神经系统,并在脑组织内大量增殖,产生病变,引起神经症状。因此,对乙脑病毒在早期突破血脑屏障作探究很有必要。通过分析荧光定量PCR结果,并结合脑组织和血液的共同分析可知,病毒首先进入血液后,在外周血管中迅速增殖,所以在6~12h血液中含量较高,而病毒也可能随着血流暂时性地进入大脑血管中,因此在6h测得脑组织中病毒含量亦较高,但随着时间推移,机体对此会做出免疫反应,而且F122代次的病毒是在BHK-21细胞传代毒力致弱的,病毒会被逐步消灭,所以最终无法在24h内透过内皮细胞间隙造成血脑屏障损伤。结合脑部解剖结果,也没有出现中枢神经系统中的典型病变:大脑皮质、中脑、脑桥和基底核的病变;神经细胞变性与坏死,形成软化灶;血管充血,形成血管套;脑实质斑点状的出血点等[10]。先前研究表明,乙脑病毒与西尼罗病毒、蜱传脑炎病毒一样,中枢系统的感染时间晚于血脑屏障发生功能障碍时间[11-13],本研究结果也间接验证了这一结论。
我国早期成功研制的日本乙型脑炎病毒的鼠脑和鸡胚疫苗,由于鼠脑疫苗中含有动物脑组织成分,不良反应较重,少数人群可引起过敏性休克、变态反应性脑脊髓炎等[14-15],后逐步被淘汰。20世纪80年代后期,我国成功研制的乙脑减毒活疫苗采用了具有良好免疫原性的减毒株SA14-14-2[15-16],通过原代地鼠肾细胞培养制备的活疫苗。有报道显示,当前用于人的唯一乙脑弱毒活疫苗JEV-L株,接种疫苗的40%会有过敏反应,2%出现神经反应,2.5%出现了严重的不良反应[17]。疫苗的安全性是能否广泛应用的关键,对于减毒活疫苗,毒株的毒力、安全性、免疫原性等都是研究的重点。针对目前我国乙脑病毒基因型流行情况,以及疫苗研发进展,以基因Ⅰ型的猪源SCYA201201株作为研究主体,将该毒株细胞传代致弱,目前已经传到F122代次,已获得其病毒细胞滴度,并使用昆明鼠测得乳鼠LD50的指标。据文献报道,昆明品系的小鼠是黄病毒科病毒研究的模型动物[18],可为新的减毒活疫苗做准备。JEV在BHK-21细胞的连续传代培养,使病毒在BHK-21细胞的适应性增强,病毒的细胞滴度明显提高,病毒细胞毒的滴度从F16代病毒的104.71PFU·mL-1提高到F122代病毒的107PFU·mL-1,乳鼠的半数致死量LD50也从F16代10-4.22·40μL-1增加到F122代10-3.7·40μL-1。病毒的滴度与半数致死量的大小成正相关,从上述数据可以发现,SCYA201201株毒力是逐渐减弱的,结合荧光定量PCR结果,F122代乙脑病毒无法在24h内突破血脑屏障,并且脑部没有眼观病理变化。因此,本研究可为SCYA201201株作为疫苗应用的安全性研究做一定铺垫,也为后续将其开发成弱毒活疫苗奠定了研究基础。
:
[1] SUMIYOSHI H,MORI C,FUKE I,et al.Complete nucleotide sequence of the Japanese encephalitis virus genome RNA[J].Virology,1987,161(2):497-510.
[2] 曾小凤.乙型脑炎疫苗的运用与研究进展[J].湖北畜牧兽医,2013,34(10):62-63.
ZENG X F.Application and research progress of Japanese encephalitis vaccine[J].HubeiJournalofAnimalandVeterinarySciences,2013,34(10):62-63.(in Chinese)
[3] SOLOMON T,NI H,BEASLEY D W,et al.Origin and evolution of Japanese encephalitis virus in southeast Asia[J].JournalofVirology,2003,77(5):3091-3098.
[4] WANG H Y,TAKASAKI T,FU S H,et al.Molecular epidemiological analysis of Japanese encephalitis virus in China[J].JournalofGeneralVirology,2007,88(Pt 3):885-894.
[5] ZHANG J S,ZHAO Q M,GUO X F,et al.Isolation and genetic characteristics of human genotype 1 Japanese encephalitis virus,China,2009[J].PLoSOne,2011,6(1):e16418.
[6] 朱耐伟,朱勇喆,戚中田.病毒穿越血脑屏障的两种方式与可能机制[J].微生物与感染,2016,11(6):366-373.
ZHU N W,ZHU Y Z,QI Z T.Two ways and possible mechanisms of virus crossing the blood-brain barrier[J].JournalofMicrobesandInfections,2016,11(6):366-373.(in Chinese with English abstract)
[7] CHANG C Y,LI J R,CHEN W Y,et al.Disruption of in vitro endothelial barrier integrity by Japanese encephalitis virus-infected astrocytes[J].Glia,2015,63(11):1915-1932.
[8] YUAN L,WU R,LIU H,et al.Tissue tropism and molecular characterization of a Japanese encephalitis virus strains isolated from pigs in southwest China[J].VirusResearch,2016,215:55-64.
[9] DIAGANA M,PREUX P M,DUMAS M.Japanese encephalitis revisited[J].JournaloftheNeurologicalSciences,2007,262(1/2):165-170.
[10] KING N J,GETTS D R,GETTS M T,et al.Immunopathology of flavivirus infections[J].ImmunologyandCellBiology,2006,85(1):33-42.

ŽEK D,SAL T J,SINGH S K,et al.Breakdown of the blood-brain barrier during tick-borne encephalitis in mice is not dependent on CD8+T-cells[J].PLoS One,2011,6(5):e20472.
[12] MORREY J D,OLEN A L,SIDDHARTHAN V,et al.Increased blood-brain barrier permeability is not a primary determinant for lethality of West Nile virus infection in rodents[J].JournalofGeneralVirology,2008,89(2):467-473.
[13] MORRY J D,SIDDHARTHAN V,OLEN A L,et al.Humanized monoclonal antibody against West Nile virus envelope protein administered after neuronal infection protects against lethal encephalitis in hamsters[J].TheJournalofInfectiousDiseases,2006,194(9):1300-1308.
[14] HALSTEAD S B,THOMAS S J.Japanese encephalitis:new options for active immunization[J].ClinicalInfectiousDiseases,2010,50(8):1155-1164.
[15] CHARLES H.HOKE M D A N.Protection against Japanese encephalitis by inactivated vaccines[J].TheNewEnglandJournalofMedicine,1988,319(10):608-614.
[16] MONATH T P.Japanese encephalitis vaccines:current vaccines and future prospects[J].CurrentTopicsinMicrobiologyandImmunology,2002,267(1):105-138.
[17] LIU Y,LIN H L,ZHU Q,et al.Safety of Japanese encephalitis live attenuated vaccination in post-marketing surveillance in Guangdong,China,2005-2012[J].Vaccine,2014,32(15):1768-1773.
[18] KIMURA T,SASAKI M,OKUMURA M,et al.Flavivirus encephalitis:pathological aspects of mouse and other animal models[J].VeterinaryPathology,2010,47(5):806-818.
Abilitytobreakthroughblood-brainbarrierofporcineJapaneseencephalitisvirusSCYA201021strainafterinfectioninmice
CHAI Chunxia,WANG Qiao,LAI Yalan,XU Yixuan,WEN Xintian,CAO Sanjie,HUANG Xiaobo,WEN Yiping,ZHAO Qin,WU Rui*
(ResearchCenterofSwineDisease,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China)
Abstract:In the present study,SPF Kuming mice were inoculated with SCYA201021 strain(F122 generation,attenuated strain of porcine Japanese encephalitis virus) by intracerebral injection in order to evaluate its potential value as the attenuated live vaccine,and its ability to break through the blood-brain barrier in mice.After infection in mice,pathological changes in mice brain were observed,and theEgene copes were measured by fluorescent quantitative PCR in the blood and brain at 6,12,18,24h after inoculation,respectively.The results indicated that the virulence of SCYA201021 strain(F122 generation) was significantly weakened as the half lethal does(LD50) in suckling mice brain was only 4×105PFU·40μL-1.Moreover,the mice did not show pathological changes in the brain during the 24h after intraperitoneal injection,and the quantitative PCR results were negative,indicating that the SCYA201021 strain could not break through the blood-brain barrier in mice and the SCYA201021 strain had high safety.
Key words:porcine Japanese encephalitis virus;half lethal does;fluorescent quantitative PCR;blood-brain barrier
中图分类号:S855.3
A
文章编号:1004-1524(2018)06-0926-06
收稿日期:2017-10-30
基金项目:国家重点研发计划(2016YFD0500403)
作者简介:柴春霞(1993—),女,内蒙古呼和浩特人,硕士,主要从事猪乙型脑炎病毒研究。E-mail:chaichunxia_ccx@126.com
,伍锐,E-mail:wurui1977@163.com
10.3969/j.issn.1004-1524.2018.06.06
(责任编辑卢福庄)
