急性肾损伤对远隔器官机体重要脏器功能的影响和治疗靶点
2018-06-27许书添综述李世军审校
许书添 综述 李世军 审校
急性肾损伤(AKI)是危重患者常见的并发症之一,也是预后不良的标志。脓毒症、心脏外科手术、对比剂、肝脏衰竭及心力衰竭等多种病因均可导致AKI。其中脓毒症是重症监护病房(ICU)中AKI的主要病因,据统计45%~70%的AKI与脓毒症有关[1-2]。AKI患者常常合并远隔器官的功能障碍,包括心脏、肺、脾、脑、肝以及胃肠道(图1)。需要肾脏替代的AKI患者病死率达40%~50%,一旦合并远隔器官功能障碍(如心力衰竭和呼吸衰竭),则病死率高达60%~80%[3]。此外AKI并发心力衰竭和呼吸衰竭时常常增加ICU患者死亡率,尤其是血流动力学不稳定的危重症患者,无论是连续性肾脏替代治疗(CRRT)还是连续缓慢低效透析(SLED),均不能降低病死率。本文主要探讨AKI患者肾脏与远隔器官的相互作用和影响,以期寻找潜在的治疗靶点。

图1 ICU中AKI患者肾脏与远隔器官间的相互作用RRT不能充分改善ICU中AKI患者的预后,预示着肾脏与远隔器官存在着未被认识的相互作用;AKI:急性肾损伤;RRT:肾脏替代治疗;MV:机械通气; VAD:心室辅助装置; VV/VA-ECMO:静脉-静脉/静脉-动脉体外膜肺氧合
肺肾相互作用
流行病学的数据表明危重患者存在肺肾对话,AKI患者极易合并急性肺损伤(ALI)或急性呼吸窘迫综合征(ARDS)。有研究表明:约24%的ARDS患者合并AKI[4],与无ARDS患者相比,ARDS患者极易合并AKI(44%vs27%)[5]。同时,AKI也是ARDS患者机械通气时间延长和撤机延迟的独立危险因素。近年来,已认识到AKI时肺损伤已不单纯是容量负荷所致,特别是在血液净化治疗后,容量高负荷在AKI患者已得到有效控制。然而,Liu等[4]研究表明ALI与AKI时炎症反应和细胞因子瀑布级联反应有关,比如白细胞介素6(IL-6)、纤溶酶原激活物抑制剂1、可溶性肿瘤坏死因子(sTNF)受体。双侧肾缺血性损伤或双侧肾切除造成AKI引起肺损伤动物模型发现,肺组织内中性粒细胞浸润、血管通透性增加及水盐通道蛋白失调,同时炎症因子和趋化因子表达明显升高,比如IL-1β、IL-6。这些结果预示着拮抗炎症因子可减轻AKI导致的ALI。此外,作为病原体识别和激活固有免疫的Toll样受体4(TLR4)可识别脂多糖、硫酸肝素、热休克蛋白及高机动组蛋白B1(HMGB1)。其中HMGB1作为凋亡细胞释放的晚期促炎细胞因子,已被证实在靶细胞上与TLR4相互作用,从而激活NF-κB和诱导免疫调理反应。动物研究已经表明TLR4-HMGB1通路是AKI诱导肺损伤的重要机制[6]。总之,AKI与ALI之间有密切联系,这两个器官相互对话,被形象喻为空气与水由管道相连接的关系:一个器官损伤加重另一个器官损伤;一方面,肾脏在生成和清除炎症介质及ALI的发生发展中有着重要作用,另一方面,ALI的炎症环境和机械通气引起的肺损伤促进AKI的发生。
心肾相互作用
心肾综合征(CRS)通常指的是病理状态下泵(心脏)与滤过(肾脏)相互作用,心脏或肾脏中任一器官发生急性或慢性功能损害,继而导致另一器官急性或慢性功能损害,两者存在动态的相互关系。急性失代偿性心力衰竭(ADHF)常伴中重度肾功能损伤。通常将CRS分成5型(Ⅰ~Ⅴ型)。Ⅰ型(急性心肾综合征):急性心功能迅速恶化(心源性休克或ADHF)导致AKI。例如心排血量减少致肾静脉压增高、肾脏充血和(或)肾素血管紧张素醛固酮系统(RAAS)激活,导致肾小球滤过率(GFR)迅速降低和AKI。Ⅱ型(慢性心肾综合征):慢性心功能异常(慢性充血性心力衰竭)导致进行性或永久性肾脏病变。慢性心力衰竭时RAAS过度活化及致命的细胞因子瀑布级联反应呈现的炎症状态导致肾脏持续性损伤。Ⅲ型(急性肾心综合征):肾功能迅速恶化(急性肾脏缺血或肾小球肾炎)引起的心脏疾病(心力衰竭、心律失常或缺血),此型中AKI是原发的,心力衰竭是继发的,有关其发病机制尚不明确,但病因可能与血压失控、容量失衡、电解质异常相关。Ⅳ型(慢性肾心综合征):慢性肾脏病(CKD),如糖尿病肾病,导致心功能减退,包括心肌肥厚、心脏扩大及心脏纤维化等心血管事件。CKD是心血管疾病的独立危险因素,并随肾功能恶化而加重。此型发病与贫血、钙磷代谢异常、慢性容量负荷、慢性炎症、高同型半胱氨酸血症、氧化应激、尿毒症毒素和促炎症细胞因子等有关。Ⅴ型(继发性心肾综合征):全身性疾病导致心肾功能障碍。如糖尿病、淀粉样变性、系统性红斑狼疮和脓毒症。此型一般认为与体液循环介质有关。脓毒症介导Ⅴ型CRS除了血流动力学和液体管理策略之外,自主神经功能障碍、缺血再灌注损伤(IRI)、细胞因子介导损伤、内分泌调节紊乱和炎症通路均参与其发病机制[7-8],且目前研究认为脓毒症患者并发Ⅴ型CRS是其预后不良的标志之一[9]。
脾肾相互作用
感染是AKI常见的严重并发症,也是AKI的主要死亡原因之一,AKI合并感染患者病死率可高达70%。AKI患者细胞免疫功能低下、白细胞趋化功能不足、淋巴细胞相对较少都是患者感染的主要原因。脾脏是身体最大的网状内皮系统的免疫器官。脾切除术后,无脾患者爆发菌血症病死率可达50%~70%[10]。脓毒症动物模型体内存在脾细胞凋亡[11],脾切除术后TLR9抑制剂(氯喹)可减轻脓毒症AKI[12]。另外脾切除术后同样可减弱超声波对肾脏的保护作用[13],脾切除术后立即出现IRI对AKI无明显影响,但是随后会加重肺损伤,与之相反,脾脏的IL-10会减轻肺损伤[14]。目前所有研究表明脾脏是脓毒症AKI和缺血性AKI的修饰者,并非无辜旁观者。脾脏功能改变在AKI中的作用,尚需进一步研究证实。
肾脑相互作用
危重症AKI患者一旦出现中枢神经系统并发症,可增加病死率和延长住院时间。AKI可表现躁动、谵妄、抽搐、意识障碍等尿毒症脑病症状。一般认为其发病机制与毒素潴留(不仅是尿素氮)、水电解质紊乱和酸碱失衡有关,但确切的发病机制仍不太清楚。动物实验发现肾脏IRI时,下丘脑小胶质细胞和致癌的神经细胞数量的增加,大脑皮层和下丘脑可见促炎细胞因子表达增加,其中包括粒细胞集落刺激因子。另外AKI小鼠运动功能减弱且与AKI严重程度相关[15]。大鼠IRI模型发现,下丘脑和纹状体的TLR4表达增加,提示TLR4的作用可能与AKI时其在肺肾相互作用类似[6]。AKI患者脑卒中发病率高于非AKI患者,且几乎与糖尿病相当。甚至在校正进展至CKD或终末期肾病的影响因素之后,AKI同样是导致脑卒中的独立危险因素。脑肾之间相互作用可能是通过改变血脑屏障或影响血管内皮前体细胞而实现的,但确切机制尚有待深入研究。
此外,危重症患者常常需要使用镇痛和镇静药物(包括苯二氮卓类、丙泊酚和右美托咪定)。丙泊酚具有抗炎和免疫调节特性,右美托咪定具有调节肾血流和减轻肾皮质集合小管水钠转运功能。有动物研究表明右美托咪定可通过抑制骨形态生成蛋白7和脱乙酰化酶2、脱乙酰化酶5来减轻肾损伤[16]。临床研究观察到右美托咪定可降低病死率和术后出现AKI的概率[17-18]。因此,可考虑通过研究镇静药物的机制,作用于脑肾之间的共同调节通路来保护肾脏。
肝肾相互作用
肝肾综合征(HRS)是肝硬化最严重并发症之一,其肾损伤是功能性的,常继发于晚期肝硬化伴重度门脉高压或爆发性肝衰竭。其特点是GFR与肾血流量明显降低且除外其他引起肾衰竭的原因。发病机制包括:(1)肾血管极度收缩,周围动脉扩张;(2)刺激肾植物神经系统;(3)心脏功能障碍参与循环紊乱和肾脏低灌注;(4)各种细胞因子和血管活性介质作用于肾脏循环和其他血管床。肾小管功能完好,无蛋白尿,肾组织学正常。HRS分为两种类型。HRS 1型:肾功能进行性减退,2周内血清肌酐倍增且>2.5 mg/dl;HRS 2型:肾功能损害无急进性过程,血清肌酐缓慢升至>1.5 mg/dl,但<2.5 mg/dl。HRS 1型常有明显的诱因,如急性食管静脉曲张出血、大量利尿或引流腹水,此型预后差,生存时间的中位数不足2周;而HRS 2型中位生存时间为4~6个月[19-20]。临床研究表明肝硬化导致AKI肾前性因素占60%,肾性因素(如急性肾小管坏死和肾小球病变)占30%,而梗阻性因素仅占1%[21]。肝硬化导致AKI的发病机制可能与颗粒胆汁或亚铁血红素管型及炎症反应有关。
AKI是否可导致肝功能障碍?动物研究发现AKI可通过白细胞浸润、炎症因子、氧化应激和凋亡来诱导肝损伤[22-23]。临床上认为肝肾功能在药物代谢中扮演重要角色。AKI时药物在肾脏和非肾脏清除率均发生改变。如万古霉素在AKI和肾功能正常时非肾脏清除率分别为15 ml/min和40 ml/min[24]。临床研究报道在静脉注射1 mg咪达唑仑4 h后,发现血药浓度随着AKI严重程度逐渐增加。证明AKI会影响肝脏对咪达唑仑的清除,而进一步的研究发现AKI可能会影响肝药酶CYP450 3A的代谢活性[25]。总之,肝肾之间的相互作用体现在一起清除有害物质。
肠肾相互作用
胃肠道反应常为AKI的首发症状,主要表现食欲减退、厌食、恶心、呕吐、腹胀、腹泻、呃逆、肠梗阻及原因不明的腹痛等。最近越来越多的研究开始关注CKD和尿毒症患者相关炎症反应和免疫功能异常与胃肠道的关系。因为肠道不仅发挥着正常的微生态生理功能,还介导着微生态失调的病理功能。研究发现,AKI时肠道微生态发挥着重要作用,肠道无菌小鼠比有菌小鼠肾小管损伤水平更重,且肾脏CD8+T细胞浸润更多,预示着将来调节肠道菌群可能是AKI治疗的靶目标[26]。短链脂肪酸细菌(short-chain fatty acid-producing bacteria,SCFAs)可通过减少局部和全身的炎症因子和细胞因子的表达,减轻肾功能损害。由于肾脏本身不产生SCFAs,但是通过调整肠道的SCFAs可能是未来针对AKI的新的治疗策略。此外,小肠的潘氏细胞是机体抵御微生物的重要武器,研究发现潘氏细胞通过分泌IL-17A作为肾脏、肝脏及肠道器官之间相互作用的纽带。去除潘氏细胞和IL-17A可减轻AKI带来的肝肠损伤[27-28]。目前认为潘氏细胞产生的IL-17A在多器官功能障碍中起着重要作用。总之,肠肾组成膈肌下器官联盟,两者之间的作用密不可分(表1)。
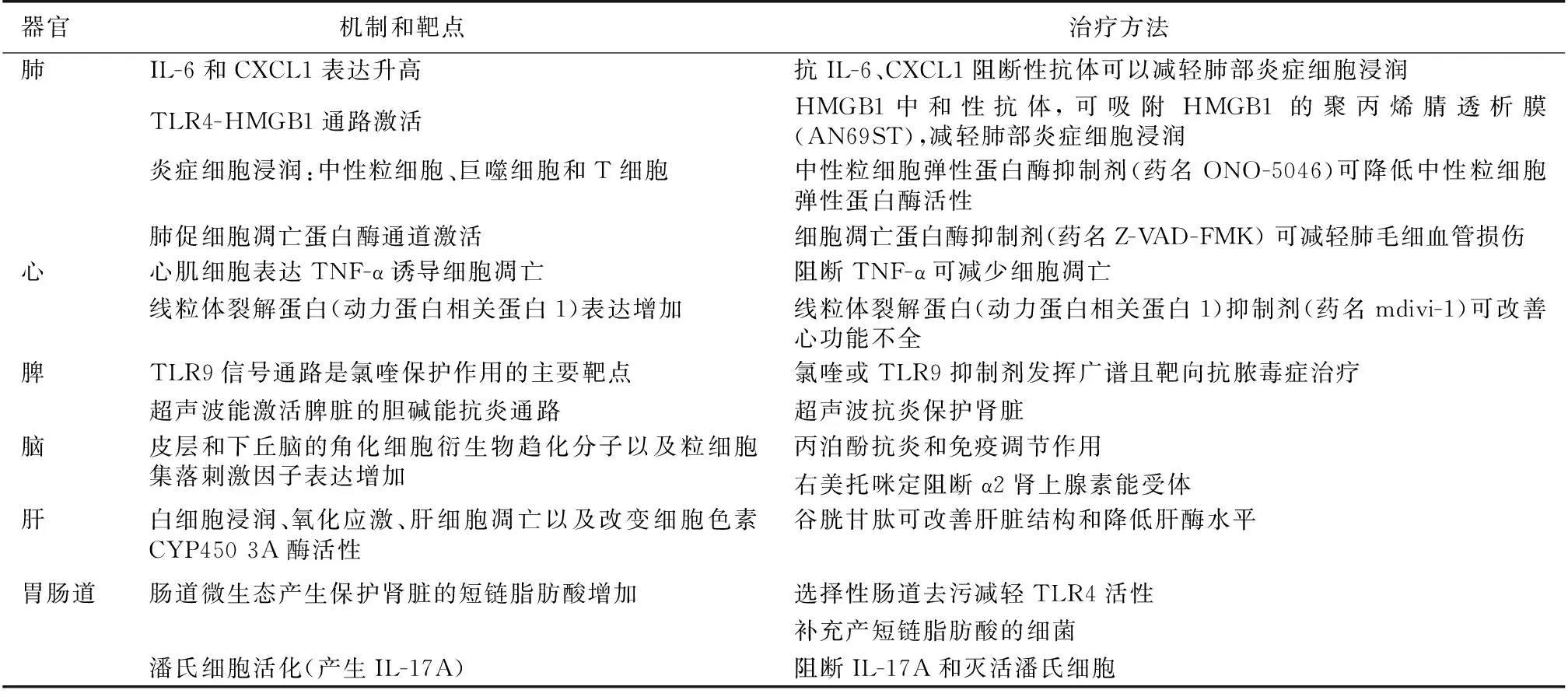
表1 AKI对远隔器官的影响、潜在治疗靶点和方法[29]
AKI:急性肾损伤; CXCL1:趋化因子配体1 ; HMGB1:高机动组蛋白B1; IL:白细胞介素; TLR:Toll样受体; TNF-α:肿瘤坏死因子α
小结:当机体受到严重感染、创伤、烧伤等打击后,两个或两个以上器官发生序贯性功能障碍或衰竭,这一过程就称之为多器官功能障碍综合征(MODS)。肾脏与MODS关系密切,MODS累及肾脏的发生率仅次于肺和肝。MODS累及的器官数目越多,病死率越高。尽管肾脏替代治疗可解决大部分AKI并发症问题,但是仍不能改善危重AKI患者的预后。过去10年,有许多研究不断关注肾与肺、心、脾及胃肠道之间的联系。关注肾脏与其他远隔器官相互作用通路,有望靶向切断器官之间的联系通路,降低AKI诱发MODS的病死率。
1 Silvester W,Bellomo R,Cole L.Epidemiology,management,and outcome of severe acute renal failure of critical illness in Australia.Crit Care Med,2001,29(10):1910-1915.
2 Bagshaw SM,Laupland KB,Doig CJ,et al.Prognosis for long-term survival and renal recovery in critically ill patients with severe acute renal failure: a population-based study.Crit Care,2005,9(6):R700-709.
3 Chao CT,Hou CC,Wu VC,et al.The impact of dialysis-requiring acute kidney injury on long-term prognosis of patients requiring prolonged mechanical ventilation: nationwide population-based study.PLoS One,2012,7(12):e50675.
4 Liu KD,Glidden DV,Eisner MD,et al.Predictive and pathogenetic value of plasma biomarkers for acute kidney injury in patients with acute lung injury.Crit Care Med,2007,35(12):2755-2761.
5 Ranieri VM,Rubenfeld GD,Thompson BT,et al.Acute respiratory distress syndrome: the Berlin Definition.JAMA,2012,307(23):2526-2533.
6 Doi K,Ishizu T,Tsukamoto-Sumida M,et al.The high-mobility group protein B1-Toll-like receptor 4 pathway contributes to the acute lung injury induced by bilateral nephrectomy.Kidney Int,2014,86(2):316-326.
7 Doi K,Rabb H.Impact of acute kidney injury on distant organ function: recent findings and potential therapeutic targets.Kidney Int,2016,89(3):555-564.
8 McCullough PA,Kellum JA,Haase M,et al.Pathophysiology of the cardiorenal syndromes: executive summary from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI).Contrib Nephrol,2013,182:82-98.
9 Virzì GM,Clementi A,Brocca A,et al.Cardiorenal Syndrome Type 5 in Sepsis: Role of Endotoxin in Cell Death Pathways and Inflammation.Kidney Blood Press Res,2016,41(6):1008-1015.
10 Styrt B.Infection associated with asplenia: risks,mechanisms,and prevention.Am J Med,1990,88(5N):33N-42N.
11 Doi K,Hu X,Yuen PS,et al.AP214,an analogue of alpha-melanocyte-stimulating hormone,ameliorates sepsis-induced acute kidney injury and mortality.Kidney Int,2008,73(11):1266-1274.
12 Yasuda H,Leelahavanichkul A,Tsunoda S,et al.Chloroquine and inhibition of Toll-like receptor 9 protect from sepsis-induced acute kidney injury.Am J Physiol Renal Physiol,2008,294(5):F1050-1058.
13 Gigliotti JC,Huang L,Ye H,et al.Ultrasound prevents renal ischemia-reperfusion injury by stimulating the splenic cholinergic anti-inflammatory pathway.J Am Soc Nephrol,2013,24(9):1451-1460.
14 Andrés-Hernando A,Altmann C,Ahuja N,et al.Splenectomy exacerbates lung injury after ischemic acute kidney injury in mice.Am J Physiol Renal Physiol,2011,301(4):F907-916.
15 Liu M,Liang Y,Chigurupati S,et al.Acute kidney injury leads to inflammation and functional changes in the brain.J Am Soc Nephrol,2008,19(7):1360-1370.
16 Hsing CH,Lin CF,So E,et al.α2-Adrenoceptor agonist dexmedetomidine protects septic acute kidney injury through increasing BMP-7 and inhibiting HDAC2 and HDAC5.Am J Physiol Renal Physiol,2012,303(10):F1443-1453.
17 Ji F,Li Z,Nguyen H,et al.Perioperative dexmedetomidine improves outcomes of cardiac surgery.Circulation,2013,127(15):1576-1584.
18 Ji F,Li Z,Young JN,et al.Post-bypass dexmedetomidine use and postoperative acute kidney injury in patients undergoing cardiac surgery with cardiopulmonary bypass.PLoS One,2013,8(10):e77446.
19 Angeli P,Ginès P,Wong F,et al.Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites.J Hepatol,2015,62(4):968-974.
20 Salerno F,Gerbes A,Ginès P,et al.Diagnosis,prevention and treatment of hepatorenal syndrome in cirrhosis.Postgrad Med J,2008,84(998):662-670.
21 Regner KR,Singbartl K.Kidney Injury in Liver Disease.Crit Care Clin,2016,32(3):343-355.
22 Golab F,Kadkhodaee M,Zahmatkesh M,et al.Ischemic and non-ischemic acute kidney injury cause hepatic damage.Kidney Int,2009,75(8):783-792.
23 Park SW,Chen SW,Kim M,et al.Cytokines induce small intestine and liver injury after renal ischemia or nephrectomy.Lab Invest,2011,91(1):63-84.
24 Vilay AM,Churchwell MD,Mueller BA.Clinical review: Drug metabolism and nonrenal clearance in acute kidney injury.Crit Care,2008,12(6):235.
25 Kirwan CJ,MacPhee IA,Lee T,et al.Acute kidney injury reduces the hepatic metabolism of midazolam in critically ill patients.Intensive Care Med,2012,38(1):76-84.
26 Jang HR,Gandolfo MT,Ko GJ,et al.Early exposure to germs modifies kidney damage and inflammation after experimental ischemia-reperfusion injury.Am J Physiol Renal Physiol,2009,297(5):F1457-1465.
27 Lee HT,Kim M,Kim JY,et al.Critical role of interleukin-17A in murine intestinal ischemia-reperfusion injury.Am J Physiol Gastrointest Liver Physiol,2013,304(1):G12-25.
28 Park SW,Kim M,Brown KM,et al.Paneth cell-derived interleukin-17A causes multiorgan dysfunction after hepatic ischemia and reperfusion injury.Hepatology,2011,53(5):1662-1675.
29 Doi K,Rabb H.Impact of acute kidney injury on distant organ function: recent findings and potential therapeutic targets.Kidney Int,2016,89(3):555-564.
