开口箭皂苷对人甲状腺髓样癌TT细胞的抑制作用及对Notch1的影响*
2018-06-27夏玉坤张莹雯
沈 鑫,夏玉坤,张莹雯,周 珍,艾 望,张 朋
甲状腺髓样癌(MTC)是一种神经内分泌肿瘤,来源于甲状腺滤泡C细胞,侵袭性强,早期易发生淋巴转移和血行转移[1]。近二十年来,MTC的发病率急剧升高[2-3],其发病率约占全部甲状腺恶性肿瘤的3%~5%,病死率高达13.4%[4]。手术切除是治愈MTC的唯一手段,但对于手术无法完全切除或术后复发及有远处转移的患者,由于MTC对放射性I131,促甲状腺激素及化疗不敏感,目前尚无令人满意的治疗方法[5]。因此,寻找治疗MTC更有效的药物是临床治疗迫切需要解决的问题。
开口箭是一种中草药,为百合科铃兰族开口箭属植物,味苦辛、性寒,具有清热解毒、散瘀止痛的功效[6],可治疗咽喉肿痛、风湿痹痛、毒蛇咬伤。开口箭提取物的主要活性成分为皂苷,开口箭总皂苷(TST)对人结肠癌LoVo细胞、人胃癌BGC-823细胞、人肺腺癌H1299细胞、人肝癌SMMC-7721、HepG2细胞、人乳腺癌MCF-7细胞和直肠癌SW480细胞等多种肿瘤细胞具有明显的抑制作用[7-10]。实验将通过观察TST对MTC-TT细胞增殖的抑制作用及Notch 1信号的影响,进一步探讨TST抗MTC机制,为临床治疗提供新思路。
1 材料
1.1 主要试剂与药物 MTC-TT细胞株购自中科院上海细胞库,开口箭购于武汉大学中南医院中药房,胎牛血清(杭州四季青公司,批号141215),F12k培养基(HyClone公司,批号 SH30023),胰酶溶液(吉诺生物医药技术有限公司,批号GNM25200),细胞周期检测试剂盒(天津三箭生物技术有限公司,批号CY2001-O),CCK8检测试剂盒(碧云天生物技术有限公司,型号C0038),三氯甲烷(国药集团化学试剂,批号 10006818),PrimeScript®RTreagent Kit with gDNA Eraser试剂盒(TaKaRa公司,批号RR047A)、SYBR®Premix Ex Taq®试剂盒(TaKaRa公司,批号RR420A),SDS-PAGE凝胶制备试剂盒(ASPEN公司,批号AS1012)、RIPA总蛋白裂解液(ASPEN公司,批号AS1004)、BCA蛋白质浓度测定试剂盒(ASPEN公司,批号AS1086)。
1.2 主要仪器 倒置相差显微镜(Olympus公司,型号IX51),紫外分光光度计(PerkinElmer公司,型号Lambda 45),酶标仪(Diatek公司,型号DR-200Bs),PCR 仪(杭州博日科技,型号 TC-XP),制冰机(常熟市雪科电器有限公司,型号IMS-20),电泳仪(北京市六一仪器厂,型号DYY-6C),流式细胞仪(BD公司,型号FACSCalibur),旋转蒸发仪(BUCHI公司,型号 R-210)。
2 方法
2.1 TST的制备
2.1.1 TST提取 取开口箭干燥根茎1 kg,3L 75%乙醇加热回流提取2 h,反复提取3次。合并提取液,减压蒸馏,得到浸膏加1 L水溶解,置于分液漏斗,500 mL石油醚萃取3次。水溶液用500 mL水饱和正丁醇萃取3次,合并正丁醇溶液减压蒸馏,得总皂苷粗品A,水相减压蒸馏得总皂苷粗品B。HPD-100大孔树脂柱层析,总皂苷粗品A依次用3 L 20%乙醇洗脱,10 L 40%乙醇洗脱,最后以10 L 70%乙醇洗脱,收集70%部位。减压浓缩,干燥后呈粉末状,即为开口箭总皂苷,称质量6.16 g。
2.1.2 TST成分及性质检测 泡沫实验及三氯醋酸反应实验均为阳性,确认为甾体皂苷。将适量样品溶解于甲醇中,定容至1 mg/mL浓度。取200μL溶液,60℃挥干溶剂,加入200μL 5%香草醛-冰乙酸溶液和800μL高氯酸,摇匀,60℃恒温水浴加热20 min,冰浴冷却15 min,加入5 mL冰醋酸,摇匀,测定458nm波长处吸光值。TST含量(%)=(W/0.2)×100%={[0.0631+0.2835(Ai-Ac)]/0.2}×100%。W:皂苷含量(mg);Ai:样品平均吸光度,Ac:空白对照平均吸光度。空白对照样品平均吸光度为0.066 6,70%部位样品平均吸光度为0.610 8。70%部位总皂苷含量为77.13%。
2.1.3 开口箭溶液的配制 用含20%灭活新生小牛血清(FBS)的F12K培养液配制成2 000μg/mL的溶液,其余浓度按需稀释配制,0.22μm的微孔滤过膜过滤除菌备用。
2.2 细胞培养 MTC-TT细胞复苏后用培养基(F12k培养基+20%胎牛血清+1%双抗)培养细胞,于5%CO2、37℃培养箱中常规培养,每3天换液1次,取对数生长期的细胞以0.25%胰蛋白酶及0.02%乙二胺四乙酸二钠(EDTA)消化传代。
2.3 TST对MTC-TT细胞的抑制作用及对Notch1的影响
2.3.1 CCK8法检测TST对MTC-TT细胞增殖抑制率影响 取对数生长期的MTC-TT细胞,调整细胞密度为1×106个/mL,接种至96孔细胞培养板,每孔100μL,过夜培养使细胞贴壁。24 h后实验组分别加入含 2、4、8、16、32 μg/mL 的 TST,对照组只加细胞不给药,每个浓度设4个复孔。分别于培养24、48、72 h后,取出培养板于倒置相差显微镜下观察细胞形态,吸弃培养基,并按照试剂盒说明书向每孔加入10μL CCK8溶液,37℃孵育4 h,酶标仪450 nm处测定每孔吸光度(OD值)。细胞增殖抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%,每次实验重复3次,以时间为横轴、抑制率为纵轴,绘制各组细胞的生长曲线,并计算IC50值。
2.3.2 实验分组 根据CCK8结果,选取最小IC50值,实验分为4组,对照组(对照组,培养基中无药物),TST低浓度组(TL,0.5倍 IC50),TST中浓度组(TM,IC50)和 TST 高浓度组(TH,2倍 IC50)。
2.3.3 流式细胞仪检测MTC-TT细胞周期 取对数生长期的MTC-TT细胞,按实验分组设计,实验组给予不同浓度TST,对照组加入等体积培养基,处理48h,胰酶消化后以1000r/min离心5min收集细胞,弃上清,收集细胞,沉淀中缓慢加入预冷的90%乙醇,重悬细胞,4℃孵育20min,1000r/min离心5min收集细胞,用3 mLPBS重悬细胞,300 g离心5 min。加入500μL碘化丙啶PI染液重悬细胞,避光染色20 min,上机检测。
2.3.4 RT-PCR检测Notch1mRNA的表达水平 按实验分组设计,实验组给予不同浓度TST,对照组加入等体积培养基,处理48 h。采用Trizol一步法提取总RNA,第一链cDNA的合成采用PrimeScriptTMRT reagent Kitwith gDNAEraser进行,扩增条件为:95℃预变性 1 min,循环 40次(95℃,15 s→58℃,20 s→72℃,45 s),熔解曲线(60℃→95℃,每 20 s升温1℃)。目的基因扩增用ΔΔCT法计算,A=CT(目的基因,实验样本)-CT(内标基因,实验样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),K=A-B,表达倍数=2-K。引物序列由武汉金开瑞生物工程有限公司合成,见表1。
2.3.5 Western blot检测Notch 1蛋白的表达 收集不同浓度TST处理48 h的实验组处理细胞和培养基处理48 h的对照组细胞裂解提取蛋白,使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度,以SDS-PAGE分离胶分离蛋白,转膜,将转好的膜加入封闭液室温封闭1 h,加入已稀释好的一抗4℃过夜,回收已稀释的一抗,用TBST洗3次,每次5 min,加入稀释好的二抗,室温孵育30 min,用TBST在室温下摇床上洗4次,每次5 min,化学发光检测,AlphaEaseFC4.0软件处理目标带的光密度值。

表1 引物序列
2.4 DAPT(Notch1抑制剂)对MTC-TT细胞的抑制作用及对Notch 1蛋白表达的影响
2.4.1 实验分组 将实验分为对照组(培养基中无药物)、TST 组(IC50)、TST(IC50)+DAPT(4.32 μg/mL)组和DAPT组(4.32μg/mL)。
2.4.2 CCK8检测DAPT(Notch1抑制剂)对MTCTT细胞增殖抑制率影响 采用CCK8法观察阴性对照组、TST组、TST+DAPT组和DAPT组作用于MTC-TT细胞48 h时细胞增殖抑制率。
2.4.3 Western blot检测DAPT对Notch 1蛋白表达的影响 采用Western bolt法检测阴性对照组、TST组、TST+DAPT组和DAPT组作用于MTC-TT细胞48 h时细胞Notch1蛋白的表达。
2.5 统计学方法 采用SPSS20.0统计分析,计量资料以均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
3 结果
3.1 TST对MTC-TT细胞增殖的影响 TST对MTC-TT细胞增殖具有抑制作用,具有时间—浓度依赖性,见图1。TST作用于MTC-TT细胞24、48和72 h的IC50值分别为59.01、31.54和31.63μg/mL。
3.2 TST对MTC-TT细胞周期的作用 对照组细胞大多处于G0/G1期,经不同浓度TST作用48 h后,MTC-TT细胞周期发生明显改变。相比于对照组,TST中浓度组和TST高浓度组G0/G1期细胞相对减少(P<0.05或 P<0.01),TL、TM、TH 浓度组 G2/M 期细胞增加(P<0.05或P<0.01),细胞阻滞在G2/M期。见表 2、图 2。
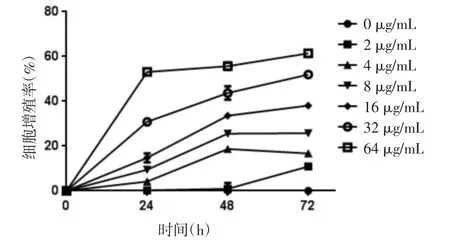
图1 TST对MTC-TT细胞增殖的影响

表2 TST对MTC-TT细胞周期的作用(x±s)%
3.3 TST对MTC-TT细胞Notch1的mRNA表达影响 TST低浓度、中浓度、高浓度组Notch1表达水平均高于对照组(P<0.01),TST高浓度组Notch1表达水平最高,Notch1表达呈浓度依赖性,组间比较具有统计学意义(P<0.01),见表3。
3.4 TST对MTC-TT细胞 Notch1的蛋白表达影响 TST低浓度、中浓度、高浓度组Notch1蛋白的表达水平均高于对照组(P<0.05或P<0.01),TST高浓度组Notch1表达水平最高,Notch1表达呈剂量依赖性,组间比较具有统计学意义(P<0.01),见表 4、图 3。

图2 TST对MTC-TT细胞周期的影响

表3 TST对MTC-TT细胞Notch1 mRNA表达影响(x±s)

表4 TST对MTC-TT细胞Notch1蛋白表达影响(x±s)

图3 TST作用于MTC-TT细胞的Western blot电泳图
3.5 DAPT对MTC-TT细胞增殖的影响 相比于阴性对照组,TST组和TST+DAPT组抑制率显著升高(P<0.01),DAPT组抑制率与之相比无统计学意义(P>0.05);TST组抑制率高于TST+DAPT组和DAPT组,组间比较具有统计学意义(P<0.01);DAPT组抑制率低于 TST 与TST+DAPT 组(P<0.01),见表 5。

表5 DAPT对MTC-TT细胞增殖的影响(x±s)
3.6 DAPT对MTC-TT细胞Notch1表达的影响 阴性对照组中有少量Notch1蛋白表达,与阴性对照组相比,TST组Notch1表达显著升高(P<0.01),TST+DAPT组Notch1表达无明显变化(P>0.05),DAPT 组 Notch1表达下降(P<0.01);与TST组相比,TST+DAPT组Notch1表达显著下降(P<0.01);DAPT组的Notch1表达均低于其余 3组(P<0.01),见表 6、图 4。
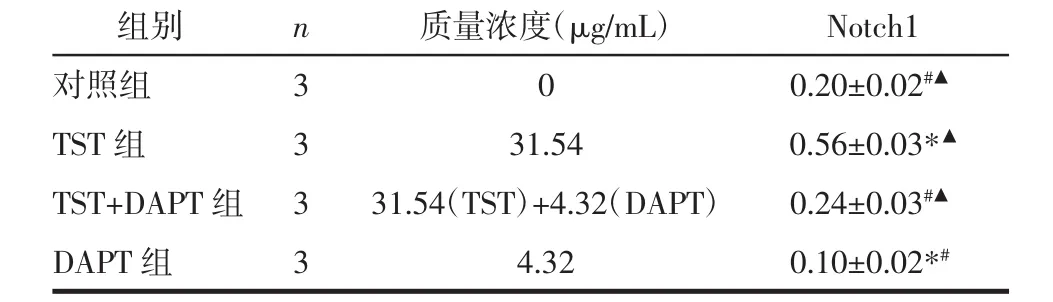
表6 DAPT对MTC-TT细胞Notch1蛋白表达影响(x±s)

图4 DAPT作用于MTC-TT细胞的Western blot电泳图
4 讨论
目前研究发现,Notch1既是致癌基因,也是抑癌基因,在多种肿瘤细胞中表达上调,包括结肠癌、卵巢癌、胰腺癌、非小细胞肺癌等,在神经内分泌肿瘤(NETs)中表达很低或者缺失[11-12]。由于甲状腺C细胞在胚胎学上系自神经嵴组织演化发育而来,属于神经内分泌细胞,所以MTC是一种神经内分泌肿瘤,Notch1在MTC中表现为抑癌基因作用。Kunnimalaiyaan等[13]发现人甲状腺髓样癌组织和MTC-TT细胞中,Notch1处于失活状态时,NE肿瘤标志物ASCL1、CgA、降钙素均表达较高;强力霉素激活Notch1后,ASCL1表达水平明显下降,进而CgA、降钙素表达水平均下降;Notch1还可通过上调细胞周期调节蛋白P21将细胞抑制在G1/S期,抑制细胞增殖。因此,激活Notch 1信号蛋白,可能是临床治疗MTC的新方法。
实验中,TST可呈剂量依赖性抑制MTC-TT细胞生长,并可使G0/G1期细胞相对减少,G2/M期细胞相对增多,实验表明TST可使细胞阻滞于G2/M期,通过有丝分裂干扰细胞进程,抑制细胞生长。MTC-TT细胞中有少量Notch 1表达,经不同浓度TST处理后,Notch 1的蛋白和基因表达均明显升高,且呈剂量依赖性,表明TST可上调Notch 1表达;为进一步验证TST通过调控Notch 1分子发挥抑制MTC-TT细胞的作用,将TST与Notch1抑制剂DAPT共同作用于MTC-TT细胞,CCK8结果示TST+DAPT组抑制率明显低于DAPT组,验证了TST通过Notch1发挥抑制细胞增殖作用。TST+DAPT组相比于对照组,仍具有一定的抑制作用,提示TST可能还通过其他通路发挥抑制MTC-TT细胞作用,还需进一步研究。结果表明开口箭可抑制MTC-TT细胞增殖,干扰细胞周期,其抑制作用与上调Notch1表达有关。
[1] 徐德全,代文杰.甲状腺髓样癌的靶向治疗[J].中国普外基础与临床杂志,2014(12):1579-1582.
[2]Aschebrook-Kilfoy B,Schechter RB,Shih YC,et al.The clinical and economic burden of a sustained increase in thyroid cancer incidence[J].Cancer Epidemiol Biomarkers Prev,2013,22(7):1252-1259.
[3]Kim TY,Kim WG,Kim WB,et al.Current status and future perspectives in differentiated thyroid cancer[J].Endocrinol Metab(Seoul),2014,29(3):217-225.
[4]Kazaure HS,Roman SA,Sosa JA.Medullary thyroid microcarcinoma:a population-level analysis of 310 patients[J].Cancer,2012,118(3):620-627.
[5]Kim BH,Kim IJ.Recent updates on the management of medullary thyroid carcinoma[J].Endocrinol Metab(Seoul),2016,31(3):392-399.
[6] 申玲玲,杜 光.开口箭属植物化学成分与药理作用研究进展[J].医药导报,2010,29(7):869-871.
[7] Li Y,Wang X,He H,et al.Steroidal saponins from the roots and rhizomes of tupistra chinensis[J].Molecules,2015,20(8):13659-13669.
[8] Pan ZH,Li Y,Liu JL,et al.A cytotoxic cardenolide and a saponin from the rhizomes of Tupistra chinensis[J].Fitoterapia,2012,83(8):1489-1493.
[9] Xiao YH,Yin HL,Chen L,et al.Three spirostanol saponins and a flavane-O-glucoside from the fresh rhizomes of Tupistra chinensis[J].Fitoterapia,2015(102):102-108.
[10]Xiang L,Yi X,Wang Y,et al.Antiproliferative and antiinflammatory polyhydroxylated spirostanol saponins from Tupistra chinensis[J].Sci Rep,2016,6:31633.
[11]Yu XM,Jaskula-Sztul R,Georgen MR,et al.Notch1 signaling regulates the aggressiveness of differentiated thyroid cancer and inhibits SERPINE1 expression[J].Clin Cancer Res,2016,22(14):3582-3592.
[12]Cook M,Yu XM,Chen H.Notch in the development of thyroid C-cells and the treatment of medullary thyroid cancer[J].Am JTransl Res,2010,2(1):119-125.
[13]Kunnimalaiyaan M,Vaccaro AM,Ndiaye MA,et al.Overexpression of the NOTCH1 intracellular domain inhibits cell proliferation and alters the neuroendocrine phenotype of medullary thyroid cancer cells[J].JBiol Chem,2006,281(52):39819-39830.
