B型流感病毒研究进展
2018-06-26焦鹏涛范文辉孙业平刘文军李晶
焦鹏涛,范文辉,孙业平,刘文军,3,李晶,3
1 中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101
2 广西大学 动物科学技术学院,广西 南宁 530004
3 中国科学院大学,北京 100049
流感病毒 (Influenza virus) 可引起人和其他动物季节性或大流行性流感的发生,根据其核蛋白 (NP) 和基质蛋白 (M1) 抗原性不同,可以分为A、B、C、D四个型[1-2]。其中,A型流感病毒(IAV) 流行广泛,可感染人和多种动物[3],是引发人类及畜禽流感的主要类型。B型流感病毒(IBV) 宿主特异性较强,目前报道主要感染人和海豹[4-5]。C型流感病毒主要感染人和猪,D型流感病毒主要感染猪和牛[6]。其中,IBV是Francis等在1940年首次从患病儿童体内分离获得,随后在 1971年,Chang等报道从犬中也分离得到了IBV,2000年荷兰科学家Osterhaus等又从海豹中成功分离[4]。在长期的进化中,根据病毒HA片段核苷酸序列差异,IBV主要分为两大谱系,即以B/Victoria/2/87毒株为代表的 B-Victoria分支和B/Yamagata/16/88毒株为代表的B-Yamagata分支。
流感几乎每年都会暴发,给人群造成了不同程度的呼吸系统疾病,对全球公共卫生造成了严重的威胁。大流行性流感主要由IAV引发,但IBV引发的季节性流感同样不容忽视。70多年来,IBV曾引起16次流感局部暴发和流行,感染后发病率和死亡率较高,多发于儿童及青少年[7-8],研究人员对美国1976–1999年流感相关死亡的调查分析发现,IBV引起的死亡率仅低于IAV的H3N2亚型,高于 IAV的 H1N1亚型[9],另外对美国1997–2009年间流感相关死亡的流行病学分析表明,由 IBV引发的死亡率约为 29%[10]。2017年入冬以来,以Yamagata谱系为主IBV与IAV中的H1N1、H3N2亚型在我国区域流行,且IBV在我国很多地区成为了引起流感发生的优势流行毒株,严重影响人们的健康[11]。本文综述了IBV最新的研究进展,旨在为疫苗的选择使用及新型抗病毒药物的研发提供科学依据及思路。
1 IBV的结构特性
IBV为单股负链分节段RNA病毒,其基因组分为8个节段,编码11个蛋白,分别为3种聚合酶蛋白PA、PB1、PB2,核蛋白NP,非结构蛋白NS1,核输出蛋白NS2,基质蛋白M1,离子通道蛋白BM2和3种表面糖蛋白HA、NA、NB。其中,PB1由节段1编码,PB1是一个转录酶,参与RNA转录延伸的过程中催化核苷酸的加入[9]。PB2由节段2编码,该蛋白是CAP依赖的核酸内切酶,参与病毒mRNA合成起始时引物的生成,即将宿主的帽子 RNA切下后转移到自身 mRNA的5′端以起始病毒mRNA的转录[12]。PA由节段3编码,主要参与病毒蛋白的磷酸化[13]。PA、PB1和 PB2一起组成流感病毒转录和复制所必需的RNA依赖的RNA聚合酶复合物[14]。血凝素蛋白HA由节段4编码,HA的主要功能为识别宿主细胞膜上的唾液酸受体,促使病毒囊膜和细胞膜进行融合,为病毒入侵宿主细胞提供便利[15]。NP由节段5编码,NP是流感病毒的核蛋白,对病毒的转录和复制起着关键的作用,是形成vRNP的主要骨架,也是区别不同类型流感病毒的主要依据之一[16]。NA和NB均由节段6编码,NA是一种水解酶,具有水解唾液酸的活性,可将子代病毒从感染的细胞表面水解,促进子代病毒的释放。NB包括18个氨基酸残基组成的胞外区、22个氨基酸残基组成的跨膜区以及 60个氨基酸残基组成的胞内区,NB对病毒在体内的复制及传播不是必需的[14,16]。节段7编码M1和BM2蛋白,M1为病毒的基质蛋白,除了参与维持病毒的形状外,还与病毒的复制效率有关,BM2则主要参与调控病毒粒子的脱壳,促进病毒RNA的释放等[17]。NS1和NS2均由节段8编码,NS1是一个多功能蛋白,不但对病毒的复制至关重要,还参与抑制宿主细胞中干扰素介导的天然免疫抗病毒反应[18-19];NS2则主要参与病毒vRNP的出核[20]。另外,IBV与其他类型流感病毒的区别见表1。
2 IBV的流行病学
IBV具有季节性流行的特点,且对特殊人群易感。近年来,关于 IBV引起季节性流感的报道越来越多,IBV存在与H1N1及H3N2共同流行的趋势,每隔2–4年会成为流行的优势毒株,且两个谱系交替流行[9]。在我国历史上IBV的感染高峰主要有3次,分别为1994年、1997年和2000年[21]。IBV不像IAV在自然界中存在中间宿主,因此不会引起流感大流行[22]。IBV除具有季节性局部流行的特点外,尤其对儿童、青少年及老人等特殊群体易感,Koutsakos等[23]对英国 2012–2013年间IBV感染人群年龄统计发现,主要集中在5–14岁;研究人员对 2008年澳大利亚季节性流感的调查中发现,54%的发病人群是由IBV引起的,且IBV感染者多数为儿童[24],泰国[25]、苏格兰[26]、吉隆坡等[27]地也存在类似的情况,我国也不例外[28]。儿童自身抵抗力差,感染流感病毒后若得不到及时救治还会引发细菌的继发性感染[29],诱发心脏疾病,造成死亡。据美国流感研究与监测中心报道,2010–2011年间因流感病毒感染死亡的儿童病例中被确诊为IBV感染的比例高达38%[30],中国疾病预防控制中心对我国2003–2008年流感病毒引起的死亡病例进行统计发现,超过一半以上的病例与IBV感染有关[31]。还有报道称,IBV在儿童感染中引起的死亡率甚至高于 IAV[32]。Walther等[33]对IBV临床感染病例研究发现,在B型流感两个谱系中相对于 Yamagata系,Victoria系对儿童更易感,分析其原因发现与受体结合的偏好性有关,即Yamagata系主要结合α-2,6唾液酸,Victoria系既能结合α-2,6唾液酸,还可以结合α-2,3唾液酸;呼吸道中的唾液酸会随着年龄的变化而发生改变,儿童呼吸道中主要含与Victoria系偏好结合的α-2,3唾液酸受体,而成年人呼吸道中主要含有与Yamagata系偏好结合的α-2,6唾液酸受体,这样就造成了 Victoria系对儿童更易感的现象存在。
2017年入冬以来,我国大范围暴发流感疫情,根据国家流感中心流感周报 (http://ivdc.chinacdc.cn/cnic/zyzx/lgzb/) 发布的数据,对2017年第1周至2018年第12周次 (共64周) 数据进行统计分析发现,2017年第 1–46周,我国的南北地区流感的发生情况存在一定的差异。南部地区主要有3个高峰期,即第9–22周,主要以IBV的Victoria谱系与 H1N1共同流行为特征;25–40周为第2个高峰期,则出现了主要以 H3N2为优势毒株的特征;第41周至次年第12周为第3个高峰期,主要以IBV的Yamagata谱系与H1N1共同流行为特征 (图 1A)。北部地区的第 1–15周,呈现出H3N2与 H1N1共同流行的特点,且具有 H1N1逐渐取代H3N2的趋势。第16–46周间,北部地区流感病毒的检出率一直处于较低水平 (图1B)。2017年的第47周至2018年的第8周,无论是南部还是北部地区,流感均进入高发期,尤其在 52周前后达到了发病高峰,主要流行的是 IBV的Yamagata谱系与H1N1为共同流行优势毒株;另外,我国南部地区还分离出了Victoria谱系毒株,所占比例较少。
3 IBV的免疫学
3.1 IBV诱发的天然免疫应答
流感病毒感染宿主后,首先通过HA与细胞表面的唾液酸受体结合,介导了病毒的吸附与进入,但与IAV不同,IBV的HA与唾液酸受体的结合力较弱[23-34]。IBV病毒进入宿主后,首先触发的是机体的天然免疫应答,且诱发的天然免疫应答比IAV更早更快[35],Trevor等[36]认为这与入核时间有关,IBV的vRNP是通过细胞内吞作用的前段即初级内体 (Early endosome) 入核,而IAV的vRNP则是通过细胞内吞作用的中段即次级内体 (Late endosome) 入核,因此IBV诱发了更早更快的宿主天然免疫应答。有报道称,IBV在 DC细胞中诱发的干扰素不但比 IAV早 (IBV感染后2–4 h干扰素-λ的mRNA即可达到峰值,而IAV感染后诱发的干扰素-λ的mRNA却在8–16 h达到峰值),而且干扰素的产生与病毒的复制及转录无关[4]。IBV引起的宿主天然免疫应答主要是通过RIG-I介导的信号通路完成的,其机制为NS1蛋白的 N端与 TRIM25发生结合,进一步形成RIG-I/TRIM25/NS1三元复合物,阻止了NS1的C端对RIG-I泛素化的抑制,从而保证了RIG-I迅速发生泛素化并定位于线粒体,将信号向下游传导,引起下游转录因子的活化,引发了宿主中大量炎症因子、干扰素及干扰素诱导基因等免疫因子的表达[37]。另有报道指出,MDA-5介导的信号通路在IBV引起的天然免疫应答中也起到了一定的辅助作用[38]。干扰素诱导基因PKR在细胞及动物水平上均能抑制IBV的复制,而PKR的产生则依赖于vRNP在细胞质内的出现,且vRNP在体外也可以激活PKR的生物活性[21]。
3.2 IBV诱发的体液免疫应答
与IAV相同,IBV诱发的抗体主要是针对HA蛋白产生的,HA中存在 4个主要抗原表位,主要位于其头部的球状区,分别为第 116–137位、141–150 位、162–167 位和 194–202 位氨基酸[39]。尽管IBV的不同分支的HA抗原性不同,但是针对HA的抗体仍具有一定的交叉保护作用,这可能是因为原始抗原痕迹相近引起的[40-41],除了HA外,NA也能诱发产生中和抗体并保护小鼠抵抗亚致死量IBV的攻击,且IBV Yamagata分支NA诱发的中和抗体还可以抵抗Victoria分支的感染,具有交叉免疫保护的功能[41]。
针对IBV的广泛中和抗体是近年来研究的热点。首次报道的 IBV广泛中和单克隆抗体是CR8033、CR8071和CR9114,这3种单抗均可以保护小鼠免受两个不同分支 IBV的致死剂量攻击,其中CR8033和CR8071分别识别HA头部的两个不同保守抗原表位,而 CR9114则识别 HA茎部的保守性抗原表位,并且对IAV (包括H1、H3、H5、H7和H9亚型) 也具有交叉保护。另外,单抗CR8033和单抗CR8071是通过抑制子代IBV的释放而不是抑制IBV的进入实现其抗病毒功能的[42],还有研究人员筛选到了针对 IBV的单抗46B8,该单抗也具有广泛的中和IBV的作用,其结合位点为HA的保守性抗原表位,通过阻断HA与唾液酸受体的结合发挥中和作用。通过进一步研究发现,46B8还可以保护小鼠抵抗HA结合位点 (301位丝氨酸突变为苯丙氨酸) 突变的致死剂量的IBV的攻击,随后研究人员开发了一种更广泛的IBV单抗C12G6,该单抗具有比先前文献报道的广泛单抗和抗病毒药奥司他韦更广泛有效的特点,可以保护小鼠及雪貂免受两种分支的IBV致死剂量的攻击,且该单抗与奥司他韦联用时,还可以提高奥司他韦的疗效,具有辅助治疗IBV感染的效果[43]。除了HA外,还有研究人员筛选到了针对 NA的单抗 1F2,该单抗不但具有广泛的抗两个分支IBV的特点,而且其保护及治疗效果比目前的标准治疗方案更好[44]。
3.3 IBV诱发的细胞免疫应答
关于CD8+T细胞在IAV感染后的免疫应答中的作用目前已广泛研究,但CD8+T细胞在IBV感染过程中的作用却鲜有报道。研究人员将小鼠的抗体应答相关基因敲除后进行IBV感染发现,该小鼠仍然能通过 CD8+T细胞依赖的途径抵抗IBV的攻击,且初次感染后还可以通过CD8+T细胞和 CD4+T细胞依赖的途径保护小鼠免受 IBV的二次感染[45],该结果说明同IAV类似,IBV感染后可以引起机体的 T细胞免疫应答,并在抗IBV感染的过程中发挥着重要的作用。通过与IAV的同功序列进行比较发现,IBV的核蛋白 NP上也具有保守的T细胞抗原表位,包括第30–38位、56–68位、82–94位及 263–271位等[46-47],随后又有研究人员证明仅第30–38位可以诱导IBV多克隆细胞毒性T淋巴细胞 (CTLs) 中干扰素γ的产生[48]。另外,部分IAV的PB1的保守性T细胞表位在IBV的PB1中也存在,说明该表位是保守的,但针对该表位的T细胞反应是否具有交叉反应及交叉保护活性,还需要进一步验证[49]。除了NP、PB1外,HA上也存在CD4+T细胞表位,而且该表位在IAV的16个亚型及IBV中较保守且针对该表位的CD4+T细胞反应具有交叉保护活性[50]。
4 IBV的防治
目前已注册的流感病毒治疗的药物分为两类,分别为金刚烷胺类及神经氨酸酶抑制剂类(NAIs)。其中金刚烷胺类主要通过抑制IAV的M2的离子通道功能实现其抗病毒作用,但不能抑制IBV的BM2的功能,主要因为IBV的BM2上的极性氨基酸残基阻断了该药物与离子通道孔的接触,因此,金刚烷胺类药物不能用于B型流感的治疗[51]。抑制剂类药物,如奥司他韦和扎那米韦,可通过抑制神经氨酸酶NA的水解活性来阻断子代病毒的释放,对IAV和IBV都有抑制作用,但随着耐药毒株的出现,其抗病毒效果也呈现出一定的差异。通过对临床治疗数据进行分析发现,扎那米韦抗IBV的效果要优于奥司他韦[10]。
虽然抑制剂类药物对流感病毒有良好的治疗效果,但长期使用会导致耐药毒株的产生,且目前已出现多株耐药毒株 (如 NA蛋白中 E119A、R152K、D198N、I222T、H274Y和 R371K等突变) 的报道[10,52-53],这些耐药毒株将来是否会在人群中造成感染并流行,现在还不可预知,因此近年来已有研究人员进行了针对IBV的广泛中和抗体的研发,该抗体的使用可以显著提高人们对IBV的预防及治疗效果。
首例报道的广泛中和单克隆抗体 CR8033、CR8071和CR9114可以完全保护小鼠抵御两个不同分支 IBV致死剂量的攻击,且 CR8033和CR8071可以中和全部 IBV的测试株。由于CR8033、CR8071和 CR9114分别识别头部受体结合域、头部底部的残留酯酶域和茎部高度保守的抗原表位,不存在抗原表位的竞争结合,且这3株抗体都具有显著的保护性,提示 3株抗体可联合使用,以增强效果[42]。5A7是针对IBV HA茎部保守型抗原表位的另一株单克隆抗体,其识别位点与CR9114不同,较CR9114的识别位点更保守,可以中和覆盖1980年至近年的IBV毒株,保护小鼠免受致死剂量的 B/Victoria/2/87类似株的攻击[54]。C12G6为人源化的鼠单克隆抗体,为人IgG1的Fc区与鼠IgG的V区嵌合体,减少了异源性抗体的免疫原性,同时保留了亲本抗体特异性结合抗原的能力,可以广泛中和1940年后的祖先谱系至近年的两个分支的 IBV,可以保护小鼠和雪貂抵御致死剂量两个分支的IBV的攻击。与之前报道的广泛单克隆相比,C12G6具有更好的治疗效果,包括致死剂量攻击后的完全保护、体重无显著差异及显著降低的病毒滴度。C12G6具有很高的血凝抑制效价,说明其结合的抗原表位位于HA的头部区域,与CR8033相似,C12G6识别的抗原表位与受体结合域较接近,在IBV中高度保守。C12G6与CR8033存在竞争结合,显示二者识别的抗原表位存在一定的重叠区域。C12G6可通过阻止病毒进入、膜融合及病毒释放等多方式抑制病毒,同时还表现出分支特异性的抗体依赖的细胞介导的细胞毒作用 (ADCC),在体外具有强大的补体依赖的细胞毒作用,为抗 IBV中和抗体在临床中的应用奠定了理论基础[55-56]。与 C12G6、CR8033与 CR8071抗体相似,46B8也通过与HA头部区域的抗体表位结合,阻止病毒与受体的结合、膜融合及病毒释放等,可体外诱导ADCC,完全保护小鼠抵御感染后72 h的致死剂量IBV的攻击[57]。除了HA外,NA也具有保守的抗原表位,并可诱导具有中和活性的单克隆抗体1F2,降低两个分支的IBV攻击后小鼠的发病率及死亡率[44]。与奥司他韦相比,抗 NA的单克隆抗体HCA2在治疗致死剂量IBV攻击72 h后表现出更好的效果,对两株药物耐受突变株IBV (E117D 和D197E) 也有治疗效果[58-59]。上述广泛中和抗体证明了IBV的HA及NA蛋白中存在保守性中和抗体表位,这些抗体有望研发为有价值的临床治疗及预防产品,为B型流感病毒的防控提供理论基础。
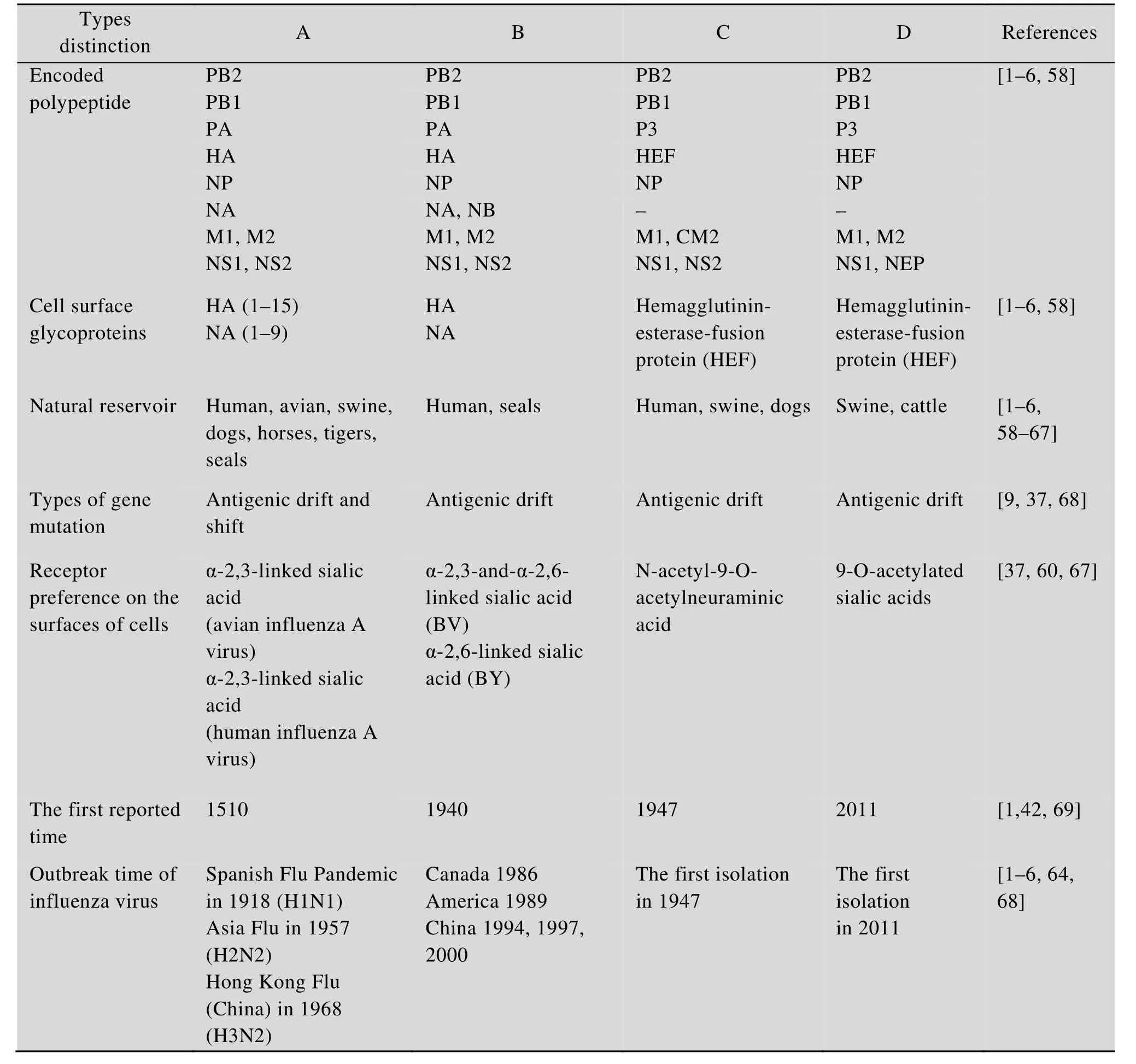
表1 不同类型流感病毒的比较Table 1 Comparison of different types of influenza viruses
除了研发新型抗流感病毒的化学药物及中和抗体外,对易感人群在流感高发季节进行疫苗免疫是预防流感发生的最有效措施。免疫疫苗可促进机体产生针对流感病毒HA蛋白头部区域的主要中和抗体,保护机体免受流感病毒的攻击,同时机体也会产生针对NA的抗体,所占比例较少。目前使用流感疫苗主要是三价疫苗,包括针对IAV中的H1N1、H3N2和IBV中的Yamagata谱系或 Victoria谱系中的一种[37]。商品化疫苗的大量生产一般需要耗时数月,需要在流感高发季到来之前进行储备,所以 WHO会对未来的流行毒株进行预测并把预测结果推荐给疫苗生产企业,因此难免会出现预测结果与实际流行毒株不符的现象。根据科罗拉多大学医学院 Ambrose等[66]对 2001–2011年世界卫生组织对流感流行季的疫苗预测结果调查发现,10年间仅约50%预测结果是准确的。本季 WHO推荐北半球使用的三价疫苗包含IAV中的H1N1、H3N2和IBV中的Victoria谱系 (表2),没有Yamagata谱系成分,且Victoria谱系与 Yamagata谱系之间几乎不存在免疫交叉保护[67],因此不能对 2017年入冬以来我国发生的 Yamagata谱系引起的 B型流感起到有效的预防。除此之外,我国较低的流感病毒疫苗接种率(仅为 1.9%[68]) 也是流感病毒大面积流行的另一个原因。2018年2月WHO推荐了2018–2019年北半球季节性流感疫苗的组分,与往年不同的是此次优先推荐四价疫苗成分 (包含B-Yamagata谱系和B-Victoria谱系),再推荐三价疫苗成分。与2017–2018年相比,IAV 中的 H3N2组分由 A/Singapore/INFIMH-16-0019/2016 (H3N2) 病毒株替换了A/Hong Kong/4801/2014病毒株,IBV中的Victoria谱系组分也由B/Colorado/06/2017病毒株替换了 B/Brisbane/60/2008病毒株[63]。四价疫苗更有利于季节性流感的防控,目前已在国外推广使用,但在我国大陆还未经批准上市。据中国国家卫生健康委员会网站公布显示,我国也在加快四价疫苗的研发进度,且中国食品药品监督局也把流感四价疫苗的评审纳入优先评审行列,有望于2018年秋冬流感流行季节推广使用。
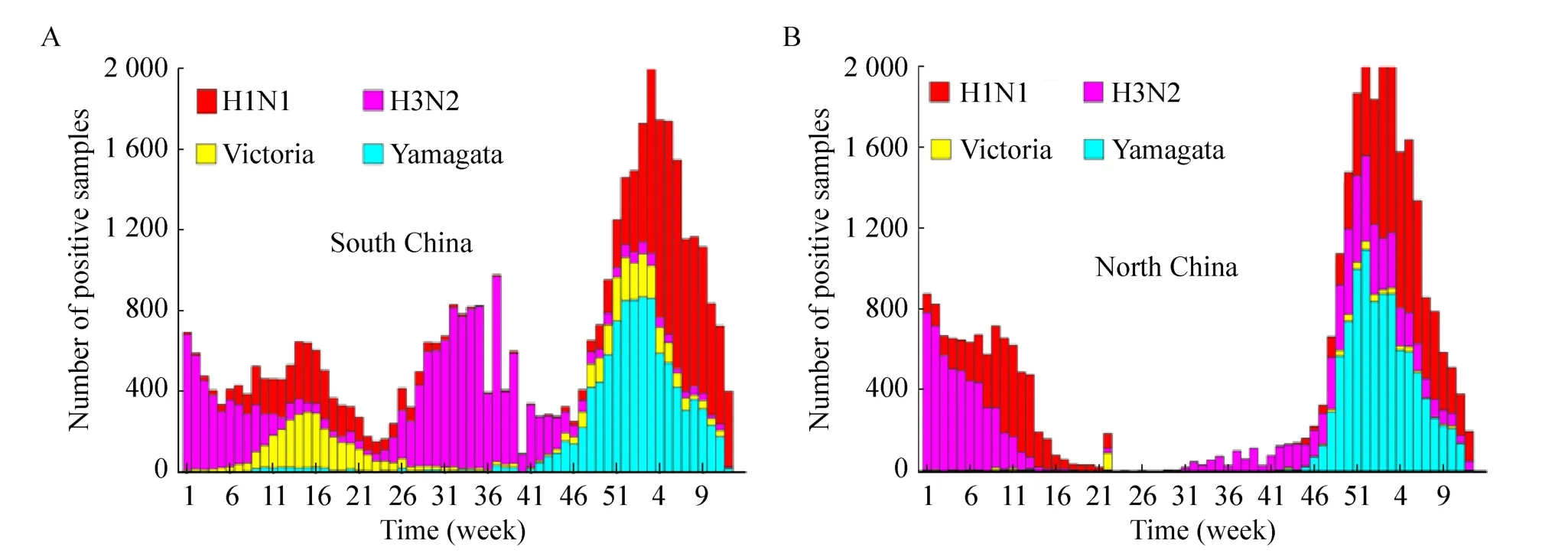
图1 2017–2018年我国流感病毒流行情况Fig. 1 The distribution of influenza virus strains in China (2017–2018). (A) The Southern provinces. (B) The Northern provinces.

表2 世界卫生组织优先推荐季节性流感病毒疫苗组分Table 2 The WHO recommended composition of influenza virus vaccines in influenza season
另外,研究人员还根据NS1截短的IAV弱毒疫苗的研发经验,开发了IBV的NS1截短的弱毒疫苗,可在小鼠体内产生针对IBV的免疫保护[19],但该疫苗目前尚处于研究阶段。
5 小结与展望
与IAV相比,人们对IBV的认知和关注较少。虽然IBV不会引起大流行性的流感暴发,但其引发的季节性流感同样不可小觑。不但给儿童、青少年等易感人群的健康带来了严重的威胁,而且该病毒会引发较严重的并发症,因此研究人员应更加关注IBV的监测与研究。
目前关于IBV的机理及应用研究相对滞后,存在较多问题亟待解决。未来我们需要加强对IBV的基础理论研究,包括IBV的进化特征、致病机理及免疫、病毒与宿主相互作用机制等,为疫苗研发及抗病毒药物的筛选提供理论基础及研发思路。我们可通过对IBV流行病学的监测来预测优势疫苗毒株;对IBV的致病机理及与宿主的相互作用的深入研究来解析病毒的致病性;对IBV免疫学的探究将便于我们筛选广泛的中和抗体及研发有效的通用疫苗等。在前期研究的基础上,继续开展B型流感病毒与宿主相互作用机制研究是我们下一步的工作重点。
综上,随着全球流感监测网络更加系统健全,B型流感病毒感染相关研究及监测会不断地补充完善。加强对B型流感病毒的关注,开展更多的相关研究,为B型流感抗病毒药物的推荐和新型疫苗的研发提供更多的科学依据。
REFERENCES
[1]Hause BM, Collin EA, Liu R, et al. Characterization of a novel influenza virus in cattle and swine: proposal for a new genus in the orthomyxoviridae family. mBio, 2014,5(2): e00031–14.
[2]Smith DB, Gaunt ER, Digard P, et al. Detection of influenza C virus but not influenza D virus in Scottish respiratory samples. J Clin Virol, 2016, 74: 50–53.
[3]El Moussi A, Pozo F, Kacem MABH, et al. Virological surveillance of influenza viruses during the 2008–2009,2009–2010 and 2010–2011 seasons in Tunisia. PLoS ONE, 2013, 8(9): e74064.
[4]Osterhaus ADME, Rimmelzwaan GF, Martina BEE, et al. Influenza B virus in seals. Science, 2000, 288(5468):1051–1053.
[5]Ramis AJ, Van Riel D, van de Bildt MWG, et al.Influenza A and B virus attachment to respiratory tract in marine mammals. Emerg Infect Dis, 2012, 18(5):817–820.
[6]McCullers JA, Hayden FG. Fatal influenza B infections:time to reexamine influenza research priorities. J Infect Dis, 2012, 205(6): 870–872.
[7]Glezen WP, Schmier JK, Kuehn CM, et al. The burden of influenza B: a structured literature review. Am Public Health, 2013, 103(3): e43–e51.
[8]Zhao B, Qin S, Teng Z, et al. Epidemiological study of influenza B in Shanghai during the 2009–2014 seasons:implications for influenza vaccination strategy. Clin Microbiol Infec, 2015, 21(7): 694–700.
[9]Thompson WW, Shay DK, Weintraub E, et al.Influenza-associated hospitalizations in the United States. JAMA, 2004, 292(11): 1333–1340.
[10]Koutsakos M, Nguyen TH, Barclay WS, et al. Knowns and unknowns of influenza B viruses. Future Microbiol,2016, 11(1): 119–135.
[11]Zhou M, Li LL, Mao CM, et al. Deep analysis of influenza epidemic in China in this year. Chin J Nosocomiol, 2018, 28(4): 631–635 (in Chinese).周密, 李雷雷, 毛晨梅, 等. 今年我国流感流行的深度解析. 中华医院感染学杂志, 2018, 28(4): 631–635.
[12]Reich S, Guilligay D, Pflug A, et al. Structural insight into cap-snatching and RNA synthesis by influenza polymerase. Nature, 2014, 516(7531): 361–366.
[13]Sanz-Ezquerro JJ, de la Luna S, Ortín J, et al. Individual expression of influenza virus PA protein induces degradation of coexpressed proteins. J Virol, 1995,69(4): 2420–2426.
[14]Deng QJ, Wang D, Xiang XX, et al. Nuclear localization of influenza B polymerase proteins and their binary complexes. Virus Res, 2011, 156(1/2): 49–53.
[15]Sherry L, Punovuori K, Wallace LE, et al. Identification of cis-acting packaging signals in the coding regions of the influenza B virus HA gene segment. J Gen Virol,2015, 97(2): 306–315.
[16]Sherry L, Smith M, Davidson S, et al. The N terminus of the influenza B virus nucleoprotein is essential for virus viability, nuclear localization, and optimal transcription and replication of the viral genome. J Virol, 2014,88(21): 12326–12338.
[17]Mould JA, Paterson RG, Takeda M, et al. Influenza B Virus BM2 protein has ion channel activity that conducts protons across membranes. Dev Cell, 2003,5(1): 175–184.
[18]Dauber B, Heins G, Wolff T. The influenza B virus nonstructural NS1 protein is essential for efficient viral growth and antagonizes beta interferon induction. J Virol, 2004, 78(4): 1865–1872.
[19]Hai R, Martínez-Sobrido L, Fraser KA, et al. Influenza B virus NS1-truncated mutants: live-attenuated vaccine approach. J Virol, 2008, 82(21): 10580–10590.
[20]Paragas J, Talon J, O’Neill RE, et al. Influenza B and C Virus NEP (NS2) proteins possess nuclear export activities. J Virol, 2001, 75(16): 7375–7383.
[21]Dauber B, Martínez-Sobrido L, Schneider J, et al.Influenza B virus ribonucleoprotein is a potent activator of the antiviral kinase PKR. PLoS Pathog, 2009, 5(6):e1000473.
[22]Jackson D, Elderfield RA, Barclay WS. Molecular studies of influenza B virus in the reverse genetics era. J Gen Virol, 2011, 92(1): 1–17.
[23]Wang MY, Veit M. Hemagglutinin-esterase-fusion(HEF) protein of influenza C virus. Prot Cell, 2016, 7(1):28–45.
[24]Nulens EF, Bourgeois MJ, Reynders MB. Post-influenza aspergillosis, do not underestimate influenza B. Infect Drug Resist, 2017, 21(10): 61–67.
[25]Tewawong N, Suwannakarn K, Prachayangprecha S, et al. Molecular epidemiology and phylogenetic analyses of influenza B virus in Thailand during 2010 to 2014.PLoS ONE, 2015, 1(10): e116302.
[26]Harvala H, Smith D, Salvatierra K, et al. Burden of influenza B virus infections in Scotland in 2012/13 and epidemiological investigations between 2000 and 2012.Euro Surveill, 2014, 19(37): 20903.
[27]Sam IC, Su YCF, Chan YF, et al. Evolution of influenza B Virus in Kuala Lumpur, Malaysia, between 1995 and 2008. J Virol, 2015, 89(18): 9689–9692.
[28]Ju JB, Chen AP, Chu XD, et al. Clinical epidemiological study on 178 patients with influenza virus type B. Mod Prevent Med, 2008, 35(2): 228–237 (in Chinese).鞠锦斌, 陈爱萍, 储旭东, 等. 178例乙型流行性感冒临床流行病学研究. 现代预防医学, 2008, 35(2):228–237.
[29]Baik JS, Kim JY, Heo JH, et al. Neurological manifestations associated with epstein-barr viral infection. J Korean Neurol Assoc, 1996, 14(1): 262–269.
[30]Pica N, Chou YY, Bouvier NM, et al. Transmission of influenza B viruses in the guinea pig. J Virol, 2012,86(8): 4279–4287.
[31]Feng L, Shay DK, Jiang Y, et al. Influenza-associated mortality in temperate and subtropical Chinese cities,2003–2008. Bull World Health Organ, 2012, 90(4):279–288B.
[32]Mccullers JA, Wang GC, He SQ, et al. Reassortment and insertion-deletion are strategies for the evolution of influenza B viruses in nature. J Virol, 1999, 73(9):7343–7348.
[33]Walther T, Karamanska R, Chan RWY, et al. Glycomic analysis of human respiratory tract tissues and correlation with influenza virus infection. PLoS Pathog,2013, 9(3): e1003223.
[34]Matrosovich MN, Gambaryan AS, Tuzikov AB, et al.Probing of the receptor-binding sites of the H1 and H3 influenza A and influenza B Virus hemagglutinins by synthetic and natural sialosides. Virology, 1993, 196(1):111–121.
[35]Jiang JW, Li J, Fan WH, et al. Robust Lys63-linked ubiquitination of RIG-I promotes cytokine eruption in early influenza B virus infection. J Virol, 2016, 90(14):6263–6275.
[36]Bedford T, Suchard MA, Lemey P, et al. Integrating influenza antigenic dynamics with molecular evolution.eLife, 2014, 3: e1914.
[37]van de Sandt CE, Bodewes R, Rimmelzwaan GF, et al.Influenza B viruses: not to be discounted. Fut Microbiol,2015, 10(9): 1447–1465.
[38]Loo YM, Fornek J, Crochet N, et al. Distinct RIG-I and MDA5 signaling by RNA Viruses in innate immunity. J Virol, 2008, 82(1): 335–345.
[39]Huang YW, Gao LD, Li FC, et al. Characterization of influenza B viruses isolated in Hunan Province after pandemic influenza A (H1N1). Chin J Infect Dis, 2012,30(6): 334–338 (in Chinese).黄一伟, 高立冬, 李芳彩, 等. 湖南省甲型H1N1流行性感冒大流行后乙型流行性感冒病毒的特征. 中华传染病杂志, 2012, 30(6): 334–338.
[40]Skowronski DM, Hottes TS, de Serres G, et al. Influenza Β/Victoria antigen induces strong recall of Β/Yamagata but lower Β/Victoria response in children primed with two doses of Β/Yamagata. Pediatr Infect Dis J, 2011,30(10): 833–839.
[41]Wohlbold TJ, Nachbagauer R, Xu H, et al. Vaccination with adjuvanted recombinant neuraminidase induces broad heterologous, but not heterosubtypic,cross-protection against influenza virus infection in mice.mBio, 2015, 6(2): e2556.
[42]Dreyfus C, Laursen NS, Kwaks T, et al. Highly conserved protective epitopes on influenza B viruses.Science, 2012, 337(6100): 1343–1348.
[43]Shen CG, Chen JY, Li R, et al. A multimechanistic antibody targeting the receptor binding site potently cross-protects against influenza B viruses. Sci Transl Med, 2017, 9(412): eaam5752.
[44]Wohlbold TJ, Podolsky KA, Chromikova V, et al.Broadly protective murine monoclonal antibodies against influenza B virus target highly conserved neuraminidase epitopes. Nat Microbiol, 2017, 2(10): 1415–1424.
[45]Epstein SL, Lo CY, Misplon JA, et al. Mechanism of protective immunity against influenza virus infection in mice without antibodies. J Immunol, 1998, 160(1):322–327.
[46]Robbins PA, Lettice LA, Rota P, et al. Comparison between two peptide epitopes presented to cytotoxic T lymphocytes by HLA-A2. Evidence for discrete locations within HLA-A2. J Immunol, 1989, 143(12):4098–4103.
[47]Robbins PA, Rota PA, Shapiro SZ. A broad cytotoxic T lymphocyte response to influenza type B virus presented by multiple HLA molecules. Int Immunol, 1997, 9(6):815–823.
[48]van de Sandt CE, Dou YY, Trierum SEVV, et al.Influenza B virus-specific CD8+T-lymphocytes strongly cross-react with viruses of the opposing influenza B lineage. J Gen Virol, 2015, 96(8): 2061–2073.
[49]Terajima M, Babon JAB, Co MDT, et al. Cross-reactive human B cell and T cell epitopes between influenza A and B viruses. Virol J, 2013, 10: 244.
[50]Babon JAB, Cruz J, Ennis FA, et al. A human CD4+T cell epitope in the influenza hemagglutinin is cross-reactive to influenza A virus subtypes and to influenza B virus. J Virol, 2012, 86(17): 9233–9243.
[51]Ma CL, Soto CS, Ohigashi Y, et al. Identification of the pore-lining residues of the BM2 ion channel protein of influenza B Virus. J Biol Chem, 2008, 283(23):15921–15931.
[52]Burnham AJ, Armstrong J, Lowen AC, et al.Competitive fitness of influenza B viruses with neuraminidase inhibitor-resistant substitutions in a coinfection model of the human airway epithelium. J Virol, 2015, 89(8): 4575–4587.
[53]Orozovic G, Orozovic K, Lennerstrand J, et al. Detection of resistance mutations to antivirals oseltamivir and zanamivir in avian influenza a viruses isolated from wild birds. PLoS ONE, 2011, 6(1): e16028.
[54]Yasugi M, Kubota KR, Yamashita A, et al. Human monoclonal antibodies broadly neutralizing against influenza B virus. PLoS Pathog, 2013, 9(2): e1003150.
[55]Cox F, Kwaks T, Brandenburg B, et al. HA antibody-mediated fcγRIIIa activity is both dependent on FcR engagement and interactions between HA and sialic acids. Front Immunol, 2016, 29(7):399.
[56]Leon PE, He W, Mullarkey CE, et al. Optimal activation of Fc-mediated effector functions by influenza virus hemagglutinin antibodies requires two points of contact.Proc Natl Acad Sci USA, 2016, 113(40): E5944–E5951.
[57]Chai N, Swem LR, Park S, et al. A broadly protective therapeutic antibody against influenza B virus with two mechanisms of action. Nat Commun, 2017, 8:14234.
[58]Doyle TM, Li C, Bucher DJ, et al. A monoclonal antibody targeting a highly conserved epitope in influenza B neuraminidase provides protection against drug resistant strains. Biochem Biophys Res Commun,2013, 441:226–229.
[59]Elderfield RA, Koutsakos M, Frise R, et al. NB protein does not affect influenza B virus replication in vitro and is not required for replication in or transmission between ferrets. J Gen Virol, 2016, 97(3):593–601.
[60]Ambrose CS, Levin MJ. The rationale for quadrivalent influenza vaccines. Hum Vaccin Immunother, 2012,8(1): 81–88.
[61]Belshe RB, Coelingh K, Ambrose CS, et al. Efficacy of live attenuated influenza vaccine in children against influenza B viruses by lineage and antigenic similarity.Vaccine, 2010, 28(9): 2149–2156.
[62]Yang J, Jit M, Leung KS, et al. The economic burden of influenza-associated outpatient visits and hospitalizations in China: a retrospective survey. Infect Dis Poverty,2015, 4: 44.
[63]Recommended composition of influenza virus vaccines for use in the 2018–2019 northern hemisphere influenza season. Wkly Epidemiol Rec, 2018, 93(12): 133-41.
[64]Chiapponi C, Faccini S, de Mattia A, et al. Detection of influenza D Virus among swine and cattle, Italy. Emerg Infect Dis, 2016, 22(2): 352–354.
[65]Muraki Y, Hongo S. The molecular virology and reverse genetics of influenza C virus. Jpn J Infect Dis, 2010,63(3): 157–165.
[66]Song H, Qi JX, Khedri Z, et al. An open receptor-binding cavity of hemagglutinin-esterasefusion glycoprotein from newly-identified influenza D virus: basis for its broad cell tropism. PLoS Pathog,2016, 12(1): e1005411.
[67]Morens DM, Taubenberger JK, Folkers GK, et al.Pandemic influenza’s 500th anniversary. Clin Infec Dis,2010, 51(12): 1442–1444.
[68]Francis TJ. A new type of virus from epidemic influenza.Science, 1940, 92(2392): 405–408.
[69]Chen JM, Guo YJ, Wu KY, et al. The origin and evolution of two genetic lineages of influenza B virus.Chin J Virol, 2001, 17(4): 322–327 (in Chinese).陈继明, 郭元吉, 吴昆昱, 等. 乙型流行性感冒病毒两大谱系的起源及其演变特征. 病毒学报, 2001,17(4): 322–327.
