灰分对挺水植物生物炭吸附硫丹的影响
2018-06-25卢少勇陈方鑫曹凤梅中国环境科学研究院国家环境保护洞庭湖科学观测研究站湖泊水污染治理与生态修复技术国家工程实验室北京100012
何 琦,卢少勇,陈方鑫,曹凤梅 (中国环境科学研究院,国家环境保护洞庭湖科学观测研究站,湖泊水污染治理与生态修复技术国家工程实验室,北京 100012)
硫丹属于有机氯农药(OCPs),为极性非离子型持久性有机污染物,可分为α-硫丹和β-硫丹 ,二者在环境中的持续停留时间分别为 800d和60d[1],其被微生物代谢降解的产物为硫丹硫酸盐[2],其毒性及环境中持久性远高于硫丹.硫丹及硫丹硫酸盐于 2011年被列入《斯德哥尔摩公约》控制指标[3].2016年12月,我国也公布“十三五”生态环境保护规划,要求截至2020年,基本淘汰硫丹.
硫丹污染在世界范围内广泛存在,即使在北极的空气、雨、雪、冰及细颗粒物[4],青藏高原的土壤[5]中都有检出.硫丹对鸟类[6]和哺乳类动物[7]属于高毒物质,抑制神经元和生殖系统发育和正常活动.一直以来,吸附技术对土壤、水体中硫丹污染控制及修复发挥重要作用.常见的吸附剂为活性炭、炭纳米管、零价Zn等,但因其性价较低而应用推广受限.而生物炭来源广、价格低,可通过生态固化和稳定化过程来降低环境中的有机污染,是控制硫丹的理想吸附剂.目前生物炭已运用在去除甲萘威和莠去津[8]、五氯酚[9]、双酚A[10]、磺胺甲恶锉[11]、诺氟沙星[12]等方面.在生物炭表面特性、多孔结构与吸附参数间建成联系进而探究吸附机理[10-13].为达到一定的吸附能力,通常要采用较高的热解温度(>500°C),但随温度的增高,其灰分可高达 80%[14].而目前对灰分的研究多集中对其影响生物炭去除重金属[15]、离子型有机污染物[16]的影响,而对去除非离子型的有机污染涉及有限.此外,挺水植物比其他陆生生物质材料所含无机盐成分高[17],其生物炭所含灰分也可能与其他生物炭存在较大差异.本文选取芦苇、菖蒲、美人蕉等挺水植物制备生物炭,研究去灰前后生物炭孔径分布、比表面积、表层元素及主体元素、官能团分布与吸附参数的关系初步探究灰分对吸附存在的影响,并通过添加上清液的吸附实验及去灰前后吸附参数与比表面积的归一化处理,进一步明确灰分的作用机理及相关组分,为资源化利用挺水植物控制硫丹污染提供参考.
1 材料及方法
1.1 生物炭制备
美人蕉、菖蒲、芦苇干燥粉碎后,置于刚玉舟内热解.升温程序:2h升至400℃,再用40min升至550℃,保持2.5h.氮气速率:300mL/min.室温下冷却得到CAIB(美人蕉生物炭),ACCB(菖蒲生物炭)以及 PHAB(芦苇生物炭).参考文献[15],利用盐酸和氢氟酸对生物炭进行去灰,标记为DCAI、DACC 和DPHA.
1.2 硫丹测定
α-硫丹和 β-硫丹购自美国 Accustand公司.色谱柱为 Hp-5ms毛细管柱(35m X 0.32mm X 0.25µm, Agilent Inc., USA),升温程序:80℃保持1min,以 30℃/min升至180℃,再以 3℃/min升至205℃,保持 4min,以 20℃/min 升至 290℃,保持2min.检测器温度 320℃,氮气尾吹扫 60mL/min,进样不分流,进样量 1µL.α-硫丹的保留时间为14.378min;β-硫丹的保留时间为17.710min.
1.3 基本特性测定
利用元素分析仪(ElementarVario EL, 德国)测定C、N、O、H等;并用X射线光电子能谱分析(XPS)分析生物炭表面元素,扫描深度 3~5nm.利用扫描电镜(SEM) (KYKY-2800B,中国)和 X射线能谱(EDS)(AXIS Supra,岛津,英国)分析表面结构和表层元素,傅里叶红外光谱(FTIR)仪(Perkin Elmer 1725X,美国)测定表面官能团,波束区间为 400-4000cm-1;采用 BET-N2的方法利用比表面积仪(Micromeritics, Norcross, GA,USA)测定比表面积和孔径.
1.4 吸附实验
分别配置初始浓度为0.50, 1.00, 2.00, 5.00,8.00,10.00mg/L 的硫丹溶液(α:β=1:1)对生物炭(CAIB、ACCB、PHAB、DCAI、DACC 和 DPHA)进行吸附实验.背景溶液 pH值用磷酸盐缓冲液作适当调整维持pH 5.60左右,以减弱硫丹水解,并加入 0.01mol/L氯化钙维持离子强度.具体操作如下:取生物炭15.00mg放入40mLEPA小瓶,瓶盖由聚四氟乙烯制成,以炭水比为 1:2加入硫丹混合溶液,避光,室温下置于摇床内,转速220r/min,震荡时间为7h,取上清液3mL,加等量正己烷,离心静置萃取分离干燥,重复2次,并取上清液进行测定,硫丹萃取率达到90%以上.
取15.00mg生物炭加入30mL去离子水,置于摇床内,摇晃 24h,取上清液配置浓度梯度为0.50, 1.00, 2.00, 5.00, 8.00, 10.00mg/L的系列硫丹溶液,控制 pH5.60左右.并将该一系列上清液添加至对应的去灰生物炭中,探究去灰过程中溶解性物质的潜在影响.
1.5 数据分析
采用 Frundlich模型对数据进行拟合[8.10],其线性拟合公式是:
式中:Qe为平衡时吸附量,mg/kg; Ce为平衡时溶液的浓度,mg/L;KF和n表示Frundlich吸附系数,L/kg与吸附常数.并参照文献[18]计算有机碳标准化系数Koc.
采用 Dual-model (DM)模型来区别吸附和分配作用[19-20].Qad表示吸附部分(mg/kg);QP表示分配部分(mg/kg);Q0为吸附能力(mg/kg),KP为分配系数(L/kg);m为数据拟合的点数;b为拟合方程中的系数个数为可调相关性系数.
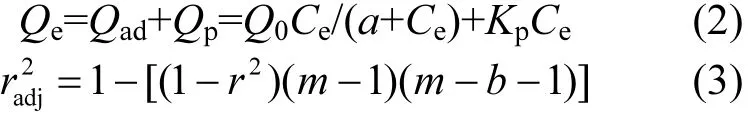
2 结果与讨论
2.1 生物炭的基本特性
由表 1可得:生物炭呈碱性,灰分占比约15.86~27.29%,孔径介于 6.30~19.20nm 之间,为介孔.由图1可看出,炭表面虽可见管状或孔状结构,但表面仍存在大量凸起或附着物.并通过EDS对炭表面所含金属元素进行半定量测定,发现炭表面含有钙、镁、铁、钾、铝等金属元素,其中CAIB所含铁、镁、钙含量较高且种类较全.
由表2可见,生物炭的H/C小于0.30[21],说明生物炭已形成紧实的芳香化结构.去灰后,炭表面未检出钙、铁等元素,说明去灰较为充分.且(O+N)/C值变小,说明极性官能团组分降低[22];但表层碳元素(surface-C)占比增加,对应的主体碳(bulk-C)占比也增加,说明去灰过程暴露出较多的有机质(OM).且surface-C比对应的bulk-C含量高,说明OM主要集中在炭表面,而灰分对OM的分配影响不大[23];另外,bulk-O和surface-O及bulk-(O+N)/C和surface-(O+N)/C都降低,说明去灰使生物炭主体和表层官能团极性都降低.此外,去灰后氧元素占比减少,说明生物炭表面氧元素与灰分的联系较多.
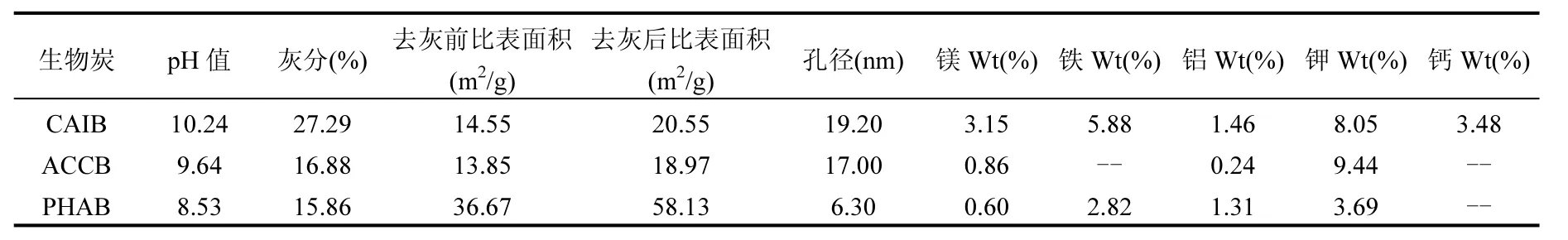
表1 生物炭基本特性表Table 1 Basic characteristics of biochars

图1 生物炭的SEM扫描图像Fig.1 SEM scanning images of biochars
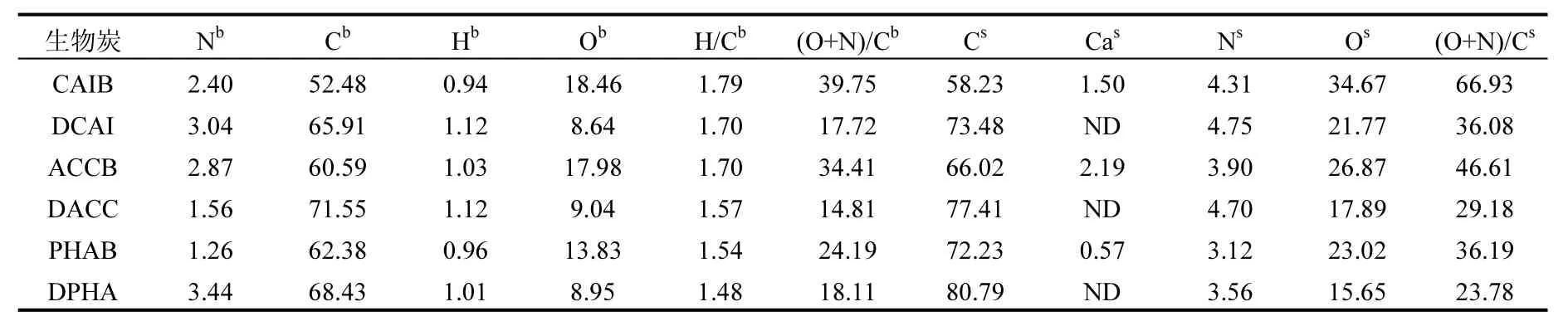
表2 生物炭元素占比 (%)Table 2 Elements proportion of biochars (%)
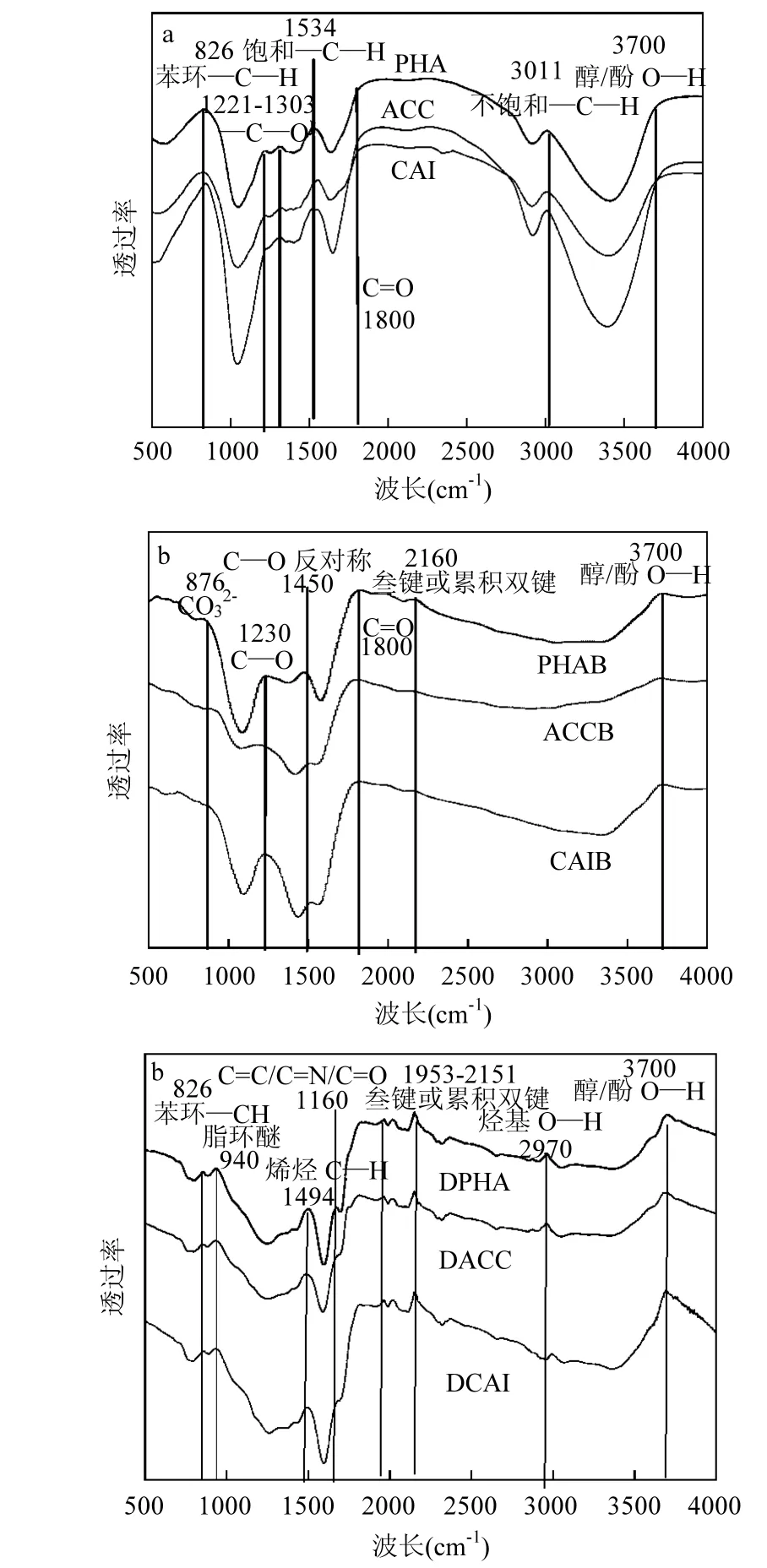
图2 生物炭(质)的FTIR谱Fig.2 FTIR of biochars orbiomass
如图 2显示,生物质经过热解后生成的生物炭,位于 3011cm-1处的不饱和 C—H 键消失,1800~3000cm-1间的含氢基团消失,而碳氧双键和叁键或累积双键产生,说明热解后饱和脂肪烃可变为芳香烃和不饱和脂肪烃[19].另外 870cm-1和1230cm-1处为碳酸盐的特征峰[10],说明表面无机盐成分可能为碳酸盐晶体[20].去灰后,生物炭生成940、1494、1660及2970cm-1处谱带,分别为脂环醚、烯烃碳氢、碳碳双键/碳氮双键/碳氧双键及羧基氢氧键,且叁键或累积双键谱带明显增加,说明去灰后炭表面的不饱和度增加.
2.2 吸附等温实验
从表3可知, DM模型表现出较好的拟合优度.说明在高浓度下生物炭对α-硫丹和β-硫丹的线性分配作用下较为明显.但DM模型对α-硫丹和 β-硫丹的拟合数据波动明显.例如:在拟合生物炭吸附α-硫丹时,DACC, PHAB, DPHA的拟Q0和Kp值.故本研究选用Freundlich模型讨论对生物炭对α-硫丹和β-硫丹的吸附特性.
生物炭对硫丹的吸附等温线用 Freundlich模型拟合的非线性系数 n在 0.63~0.80之间,且对 β-硫丹的非线性系数略小,说明 β-硫丹更易与生物炭发生吸附,其非均质性吸附作用较 α-硫丹明显[23-24],可能是因为 α-硫丹为非对称性空间椅状结构,其电子存在偏移,部分基团呈显负电,炭表面也为负电,可能会因静电排斥而导致 α-硫丹在生物炭表面的非均质吸附受限,故分配作用贡献率相对增大,因此线性吸附增强,n值变大.且生物炭对 β-硫丹的吸附系数(logKF)略大于α-硫丹 ,说明生物炭对β-硫丹的亲和力较高,与沉积物或土壤中硫丹的赋存形态相似[25].非线性系数n且与H/C原子比指数呈明显的正相关(P<0.05,r= 0.8720),与 Han[26]等认为 n与H/C指数正相关,可预测植物源生物炭对极性有机污染物的非线性吸附作用一致.此外,随着硫丹的平衡浓度(Ce=0.001Sw/0.01Sw)增加,其分配系数 logKoc减小,说明吸附过程以有机质的表面吸附为主[27].
2.3 灰分对硫丹的吸附的影响
如表3所示,去灰后,生物炭对硫丹的吸附常数(logKF)降低,说明生物炭去灰后对硫丹的吸附性能总体下降.随着平衡浓度 Ce的增加,logKoc也随之减少,说明去灰后生物炭对硫丹的非线性吸附增强[25,28].由表2得知: OM主要集中在表面,且去灰暴露出较多的 OM,从而增强有机质对硫丹的吸附作用[28].另外,去灰后生物炭对硫丹的 n值变小,表明生物炭的疏水性增加,其与硫丹的疏水作用也随之增强.与去灰后的生物炭 bulk(O+N/C)和surface(O+N/C)参数降低一致.

表3 生物炭等温模型参数表Table 3 Isotherm modes and parameters for biochars
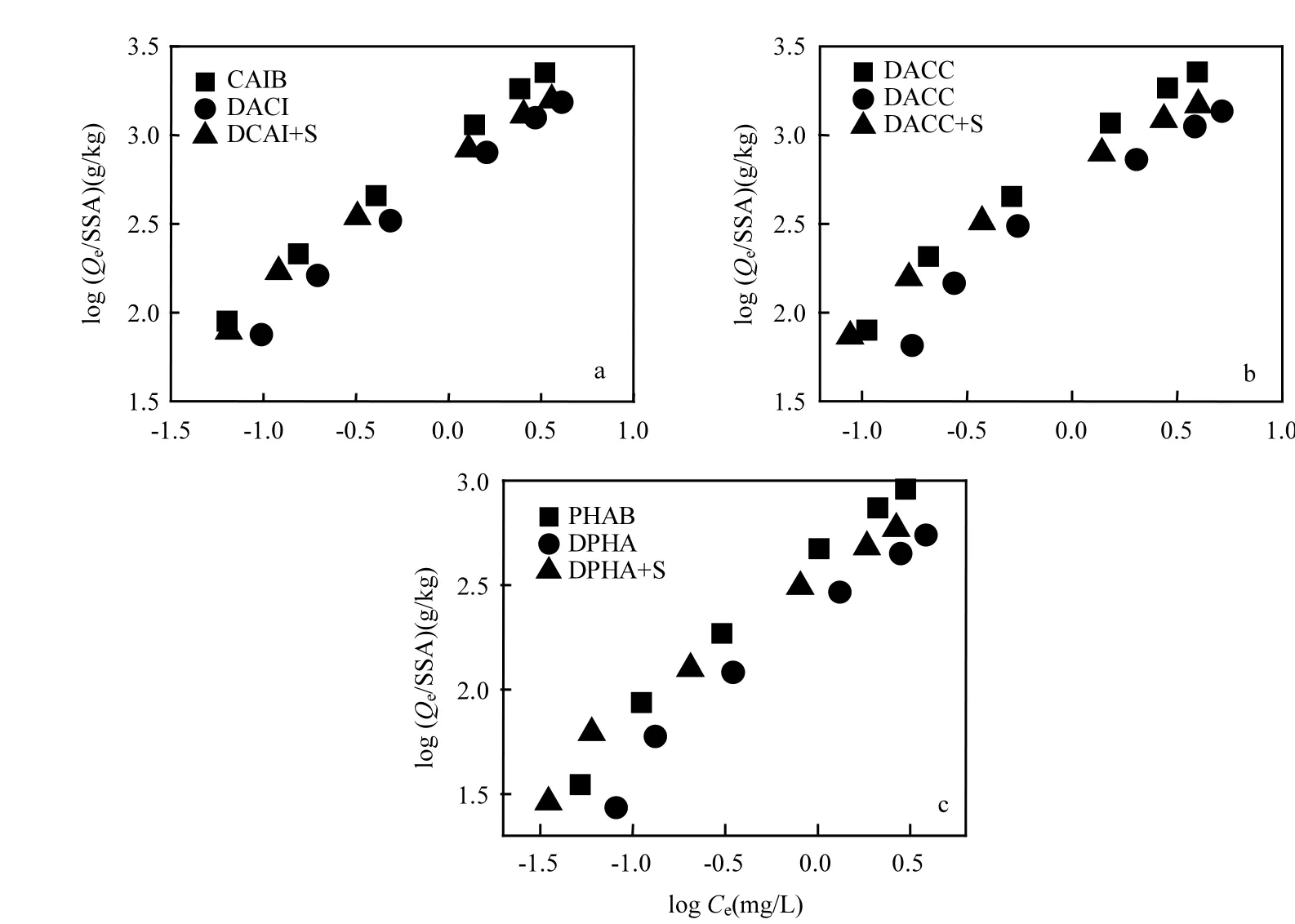
图3 生物炭吸附硫丹的比表面积归一化Fig.3 Specific surface area normalization diagram for adsorption of endosulfan on biochars
由元素分析及红外谱图可知去灰对吸附具有促进作用,但去灰后生物炭对硫丹的吸附能力却减少.为进一步明确去灰后吸附能力减弱的原因,探究是否去灰后生物炭表面特性(孔径、比表面积)发生变化而对吸附产生影响,故将等温吸附参数与比表面积作归一化处理.ACCB和PHAB在去灰前后,变化较CAIB明显,说明CAIB对硫丹的吸附受比表面积的影响较大.CAIB在去灰后,会暴露出原先被灰分覆盖的孔,从而使比表面积增加,增大对硫丹的吸附作用[30].一般来讲,吸附过程主要取决于溶质在生物炭颗粒内缓慢传递[31],虽去灰释放出原被灰分覆盖的孔径,但ACCB和PHAB的孔径较CAIB小,而吸附过程可能发生在亚颗粒规模[32],故受孔径利用率制约,因此 ACCB和 PHAB对硫丹的扩散作用较CAIB弱.所以ACCB和PHAB在去灰后,在较低溶质浓度(0.5~2mg/L)下,变化不明显,但在较高溶质浓度(5~10mg/L)下,变化明显,说明低浓度下对硫丹的吸附受比表面积影响大,在较高硫丹浓度下,反之.
加入上清液后,DACC、DPHA及DCAI变化较为明显,说明上清液对硫丹的吸附起促进作用.上清液中,含有溶解有机质与无机质,而溶解性有机质中含有类腐殖质或类富里酸物质,可增强对硫丹的疏水作用[33--35].事实上,生物炭去灰的同时也去除表面的溶解性物质,一方面可增加炭表面有机质占比,增大其比表面积,但也大大减少对吸附硫丹起积极作用的溶解性物质,从而直接影响去灰后生物炭对硫丹的总体作用效果.
3 结论
3.1 挺水植物 (芦苇、菖蒲、美人蕉)经高温限氧(550℃)后,炭表面孔隙发育成熟,部分呈碎片化,灰分含量在15.86~27.29之间,炭表面含有钙、镁、铁、钾、铝等金属元素,主要成分可能为碳酸钙等.
3.2 去灰后生物炭比表面积增大(20.55~58.13m2/g),(O+N)/C值变小,表层碳元素与对应主体碳占比增加,炭表面极性降低且暴露出更多的OM. 去灰后生物炭对硫丹的非线性吸附常数介于 0.61~0.72,较未去灰生物炭(0.63~0.80)低,且对β-硫丹的非线性系数略小(0.61~0.75),说明β-硫丹更易与生物炭表面发生吸附.但去灰后生物炭的吸附系数 logKF(6744~11111mg/kg)降低,说明生物炭去灰后对硫丹的吸附性能总体下降.3.3 加入上清液后,DACC、DPHA及DCAI对硫丹的吸附变化显著,表明上清液中的溶解性物质中可增强去灰后生物炭对硫丹的疏水作用.
[1]Hussen A, Westbom R, Megersa N, et al. Development of a pressurized liquid extraction and clean-up procedure for the determination of α-endosulfan, β-endosulfan and endosulfan sulfate in aged contaminated Ethiopian soils [J]. Journal of Chromatography A, 2006,1103(2):202-210.
[2]Ishag A E S A, Abdelbagi A O, Hammad A M A, et al.Biodegradation of endosulfan and pendimethalin by three strains of bacteria isolated from pesticides-polluted soils in the Sudan [J].Applied Biological Chemistry, 2017,60(3):287-297.
[3]Kim E J, Park Y M, Park J E, et al. Distributions of new Stockholm convention POPs in soils across So uth Korea [J].Science of the Total Environment, 2014,476:327-335.
[4]Carrera G, Fernández P, Grimalt J O, et al. Atmospheric deposition of organochlorine compounds to remote high mountain lakes of Europe [J]. Environmental Science & Technology,2002,36(12):2581-2588.
[5]Gai N, Pan J, Tang H, et al. Organochlorine pesticides and polychlorinated biphenyls in surface soils from Ruoergai high altitude prairie, east edge of Qinghai-Tibet Plateau [J]. Science of the Total Environment, 2014,478:90-97.
[6]Singh D K, Singh N S. Endosulfan a cyclodiene organochlorine pesticide: Possible pathways of its biodegradation [M]//Microbe-Induced Degradation of Pesticides. Springer International Publishing, 2017:105-130.
[7]Sebastian R, Raghavan S C. Molecular mechanism of endosulfan action in mammals [J]. Journal of biosciences, 2017,42(1):149-153.
[8]Zhang P, Sun H, Yu L, et al. Adsorption and catalytic hydrolysis of carbaryl and atrazine on pig manure-derived biochars: impact of structural properties of biochars [J]. Journal of Hazardous Materials, 2013,244:217-224.
[9]郎印海,刘 伟,王 慧.生物炭对水中五氯酚的吸附性能研究[J]. 中国环境科学, 2014,34(8):2017-2023.
[10]Li J, Liang N, Jin X, et al. The role of ash content on bisphenol A sorption to biochars derived from different agricultural wastes [J].Chemosphere, 2017,171:66-73.
[11]Shimabuku K K, Kearns J P, Martinez J E, et al. Biochar sorbents phenanthrene sorption by natural and engineered organic matter[J]. Environmental Science & Technology, 2014,48(19):11227-11234.
[12]张涵瑜,王兆炜,高俊红,等.芦苇基和污泥基生物炭对水体中诺氟沙星的吸附性能 [J]. 环境科学, 2016,(2):689-696.
[13]Fei Y, Leung K M Y, Li X. Adsorption of 17 α-ethyl estradiol with the competition of bisphenol A on the marine sediment of Hong Kong [J]. Marine pollution bulletin, 2017,124(2):753-759.
[14]Sun K, Kang M, Zhang Z, et al. Impact of deashing treatment on biochar structural properties and potential sorption mechanisms of phenanthrene [J]. Environmental Science & Technology, 2013,47(20):11473-11481.
[15]Kołodyńska D, Krukowska J, Thomas P. Comparison of sorption and desorption studies of heavy metal ions from biochar and commercial active carbon [J]. Chemical Engineering Journal,2017,307:353-363.
[16]Peiris C, Gunatilake S R, Mlsna T E, et al. Biochar based removal of antibiotic sulfonamides and tetracyclines in aquatic environments: A critical review. [J]. Bioresource Technology,2017,246:150-159.
[17]徐德福,李映雪,李久海,等.几种挺水植物对重金属锌的抗性能力及其影响因素 [J]. 生态环境学报, 2009,18(2):476-479.
[18]Sun K, Kang M, Zhang Z, et al. Impact of deashing treatment on biochar structural properties and potential sorption mechanisms of phenanthrene. [J]. Environmental Science & Technology,2013,47(20):11473-11481.
[19]马锋锋,赵保卫,刁静茹,等.牛粪生物炭对水中氨氮的吸附特性[J]. 环境科学, 2015,(5):1678-1685.
[20]李 靖.不同源生物炭的理化性质及其对双酚A和磺胺甲噁唑的吸附 [D]. 昆明:昆明理工大学, 2013.
[21]Zwieten L V, Kimber S, Morris S, et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility [J]. Plant and Soil, 2010,327(1):235-246.
[22]何 琦,曹凤梅,卢少勇,等.挺水植物生物炭对硫丹的吸附及催化水解作用 [J]. 中国环境科学, 2018,38(3):1126-1132.
[23]Sun K, Kang M, Ro K S, et al. Variation in sorption of propiconazole with biochars: The effect of temperature, mineral,molecular structure, and nano-porosity [J]. Chemosphere, 2016,142:56-63.
[24]武丽君,王朝旭,张 峰,等.玉米秸秆和玉米芯生物炭对水溶液中无机氮的吸附性能 [J]. 中国环境科学, 2016,36(1):74-81.
[25]Weber J, Halsall C J, Muir D, et al. Endosulfan, a global pesticide:a review of its fate in the environment and occurrence in the Arctic [J]. Science of the Total Environment, 2010,408(15):2966-2984.
[26]Han L, Sun K, Jin J, et al. Role of structure and microporosity in phenanthrene sorption by natural and engineered organic matter[J]. Environmental Science & Technology, 2014,48(19):11227-11234.
[27]Chen B, Chen Z. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures [J].Chemosphere, 2009,76(1):127-133.
[28]Im J K, Boateng L K, Flora J R V, et al. Enhanced ultrasonic degradation of acetaminophen and naproxen in the presence of powdered activated carbon and biochar adsorbents [J]. Separation and Purification Technology, 2014,123(3):96-105.
[29]Yavari S, Malakahmad A, Sapari N B. Biochar efficiency in pesticides sorption as a function of production variables-a review.[J]. Environmental Science & Pollution Research, 2015,22(18):13824-13841.
[30]轩盼盼,唐翔宇,鲜青松,等.生物炭对紫色土中氟喹诺酮吸附-解吸的影响 [J]. 中国环境科学, 2017,37(6):2222-2231.
[31]陈友媛,惠红霞,卢 爽,等.浒苔生物炭的特征及其对 Cr(Ⅵ)的吸附特点和吸附机制 [J]. 环境科学, 2017,38(9):3953-3961.
[32]Li J, Liang N, Jin X, et al. The role of ash content on bisphenol A sorption to biochars derived from different agricultural wastes [J].Chemosphere, 2017,171:66-73.
[33]Tang J F, Li X H, Luo Y, et al. Spectroscopic characterization of dissolved organic matter derived from different biochars and their polycylic aromatic hydrocarbons (PAHs) binding affinity. [J].Chemosphere, 2016,152:399-406.
[34]吴济舟.溶解性有机质分组及各组分对芘的生物有效性及其吸附解吸的影响研究 [D]. 天津:南开大学, 2012.
[35]龚香宜,徐 威,何炎志.溶解性有机质的光谱特征及其对土壤吸附β-HCH的影响 [J]. 环境科学学报, 2017,37(1):318-325.
