普伐他汀的光催化降解性能及机理研究
2018-06-25樊佳敏刘婷婷孙辰旭西安建筑科技大学环境与市政工程学院西安陕西710055陕西省膜分离重点实验室西安陕西710055
樊佳敏 ,王 磊 *,刘婷婷 ,陆 雪 ,孙辰旭 (1.西安建筑科技大学环境与市政工程学院,西安 陕西710055;2.陕西省膜分离重点实验室,西安 陕西 710055)
他汀类药物是高血脂患者广泛使用的一种处方类药物.目前市场上主要有两大类他汀:亲水性(普伐他汀,匹伐他汀,瑞舒伐他汀和氟伐他汀)和亲脂性(洛伐他汀,辛伐他汀和阿托伐他汀)[1].作为亲水性他汀类的代表,半合成化合物普伐他汀(PR)因具有不易进入肝脏外的其他组织、肌毒性小等特点而受到原发性高胆固醇血症患者的青睐.然而,他汀类药物在人和动物体内不能被完全吸收,多以原形和活性代谢产物的形式通过新陈代谢排入环境,导致其在环境水体中大量存在[2-3].随着痕量检测技术的不断发展与完善,研究人员已经在自然水体以及城市污水处理系统中频繁检测到他汀类药物,浓度范围为101.3~2652.1ng/L[4-7].虽然各类水体中的他汀类药物以痕量形式存在,但是由于其具有较强的持久性和难降解的特点,进入环境后可以通过食物链富集,会对人类健康和生态环境造成不可忽视的威胁[8].
Bi2WO6光催化技术是一种环境友好型处理难降解污染物的技术,近年来,由于其能一定程度提高太阳光的利用率而备受关注.张豪等[9]发现在pH值为5.18的条件下,采用2g/L Bi2WO6光催化降解20mg/L X-3B染料60min后,污染物的降解率可达 86%;Kaur等[10]合成纳米立方体Bi2WO6并用来降解水中的左氧氟沙星,发现在中性条件下光催化150min降解效果最好,高达约80%.此外,Behnaz等[2]采用高级氧化技术处理四种他汀物质并分析讨论了处理过程中的部分中间产物,然而,尚未有关于 Bi2WO6光催化降解他汀类药物的报道.
本文以典型的他汀类药物——普伐他汀(PR)为目标污染物.采用 Bi2WO6光催化技术对其降解性能进行了详细的探讨,并首次探明了Bi2WO6光催化降解 PR的机理以及降解前后产物毒性的变化,从而明确了该处理方法的可行性,并为后续光催化技术处理他汀类药物的研究及实际应用提供了理论依据.本文将从以下几方面展开:首先,通过水热法合成 Bi2WO6并对其性能进行表征;其次,通过光催化性能实验考察Bi2WO6投加量,溶液初始pH值对PR降解效果的影响;再者,通过自由基捕获实验确定反应过程中的主要活性自由基,最后,通过高效液相色谱-飞行时间质谱仪(LCMS-IT-TOF)检测分析光催化降解过程的中间产物及降解路径,并进一步探究 PR的光催化降解机理.此外,利用发光细菌急性毒性试验对PR降解前后的毒性进行评估.
1 材料与方法
1.1 材料与仪器
试剂为五水合硝酸铋(Bi(NO3)3·5H2O),二水合钨酸钠(Na2WO6·2H2O),溴酸钾(KBrO3),天津市科密欧化学试剂有限公司;普伐他汀(PR,C23H35O7Na),上海阿拉丁生化科技股份有限公司;草酸铵((NH4)2C2O4·H2O),异丙醇((CH3)2CHOH),天津市天力化学试剂有限公司;以上试剂皆为分析纯.仪器有 SH23-2恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;不锈钢反应釜,西安莫吉娜仪器制造有限公司;鼓风干燥箱,天津市泰斯特仪器有限公司; CEL-WLAX500长弧氙灯光源系统,北京中教金源科技有限公司;UV-2600紫外-可见光分光光度计,尤尼柯上海仪器有限公司;高效液相色谱-飞行时间质谱仪(LCMSIT-TOF),日本岛津; CenreoLIA-LB962微孔板生物发光检测仪,德国 Berthold Technologies公司;Modulus TM 单管型多功能检测仪,美国 Turner Biosystems公司.
1.2 催化剂的制备
采用水热法制备 Bi2WO6,其详细过程如下:将 0.02mol Bi(NO3)3·5H2O 和 0.01mol Na2WO6·2H2O 依次溶解于 150mL去离子水中,在恒温磁力搅拌器上持续搅拌1h使之混合均匀,过程中伴随大量白色沉淀产生.随后将此混合物移入200mL聚四氟乙烯内衬并置于不锈钢反应釜中,密封后放入鼓风干燥箱中于160℃反应12h,然后自然冷却至室温,得到淡黄色沉淀.用去离子水洗涤数次,于60℃恒温干燥得到样品.
1.3 催化剂的表征
采用 K-Alpha型 X-射线光电子能谱(XPS,美国热电公司)对样品的表面元素的组成及价态进行分析;利用UltimanIV X射线衍射(XRD,日本株式会社理学)鉴定样品的晶型;采用 JSM-6510LV型扫描电子显微镜(SEM,日本电子公司)观察样品的微观形貌;利用V-sorb 2800P比表面积及孔径分布仪(BET,北京金埃谱科技有限公司)获取样品的比表面积及孔径分布等信息;通过U-3900紫外-可见漫反射光谱(UV-Vis,日本日立公司)获得样品在紫外-近红外区对光的吸收范围.
1.4 光催化性能实验
反应装置为 CEL-WLAX500(λ>350nm)长弧氙灯光源系统,光强 154.5W/m2.配制一定量10mg/L的PR模拟污染液搅拌至溶解.称取一定量的 Bi2WO6投加到上述溶液中,首先在黑暗条件下搅拌 30min使反应达到吸附平衡,然后打开光源进行光催化反应,每隔一段时间取溶液过0.22µm滤膜后采用 UV-2600紫外-可见光分光光度计于238nm处测定溶液的吸光度.绘制不同浓度PR的标准曲线并计算不同时刻污染物的去除率 η=1-Ct/C0,式中 Ct,C0分别为反应时间为 t时及初始PR溶液浓度.
1.5 自由基捕获实验
自由基捕获实验是将不同活性自由基的捕获剂分别投加到光催化反应体系中,通过考察投加不同捕获剂后对光催化实验产生的影响来确定光催化反应过程中的主要活性自由基.异丙醇,草酸铵和溴酸钾分别作为羟基(·OH),空穴(h+)和电子(e-)捕获剂投加到该反应体系中.异丙醇投加量为 0.5mL/L,草酸铵和溴酸钾浓度为0.5mmol/L.
1.6 中间产物的鉴定
本实验采用 LCMS-IT-TOF对光催化降解PR的中间产物进行测定.采用Betasil C18色谱柱(热电,2.1mmid×150mm,3.5µm),柱温 40℃;流动相为乙腈:0.1%甲酸=35:65(V/V),流速0.2mL/min,进样体积和检测波长分别为10µL和238nm,在负离子模式下对样品进行检测,质荷比扫描范围为50~500.
1.7 毒性测试
本实验利用发光菌急性毒性试验(ISO 11348)检测PR原液及其光催化降解产物的生物毒性.实验过程如下:菌液经活化后,在 20℃,180r/min条件下进行培养,当其处于对数生长后期时,用2%NaCl稀释菌液;将100µL不同实验样品以及100µL菌液加入96孔板,在检测仪上高速震荡30s,在15℃环境温度下静置暴露15min后测定发光值.每个样品设置3个平行,样品的平均发光值记为 I,空白对照的平均发光值记为 I0,根据公式计算不同实验样品的发光抑制率 E,E=(I0-I)/I0×100%.
2 结果与讨论
2.1 Bi2WO6表征结果分析
图1a是Bi2WO6的XPS图谱.根据NIST XPS Database查出图中各峰位置电子结合能对应的元素分别为Bi4p, O1s, Bi4d, C1s, W4d, Bi4f和W4f,且由峰强度可以看出其主要元素为 O1s,Bi4f和 W4f[11].Bi2WO6的电子结合能 159.32eV,35.52eV分别对应其结构中的Bi4f7/2和W4f5/2[12],说明Bi元素是以+3价态存在而W元素以+6价态存在.
图1b为Bi2WO6的XRD图谱.由图中可知样品在 2θ=28.3°, 32.9°, 35.9°, 47.1°, 56.0°, 58.5°,68.8°, 76.1°和 78.5°处有明显衍射峰.与标准卡片(JCPDS No.39-0256)衍射数据对比发现,各衍射峰分别对应正交晶系 Bi2WO6的(131)晶面,(002)晶面,(115)晶面,(202)晶面,(133)晶面,(262)晶面,(400)晶面,(333)晶面和(420)晶面,说明样品为正交晶系Bi2WO6.
图1c是Bi2WO6的N2吸附-脱附等温曲线以及孔径分布曲线(插入图).由图可知,Bi2WO6的吸附-脱附曲线是 IV型等温曲线(IUPAC分类),同时具有 H3型滞后回环[13-14],表明该样品具有介孔结构(2~50nm).回滞环存在于 0.8~1.0的相对压力范围内,说明其具有大孔结构特征,即Bi2WO6有从介孔到大孔较宽的孔径分布[12].同时经测定得到 Bi2WO6的比表面积为26.67m2/g.
图1d为Bi2WO6的紫外-可见吸收光谱.从图中可知,Bi2WO6在紫外-可见光范围内有一个很强的吸收边,经切线拟合得到其吸收极限为452.1nm,说明该催化剂在可见光范围有响应.根据公式Eg=1240/λ0计算得出Bi2WO6的带隙能为2.74eV[12,15].
图 1e和 1f分别是 Bi2WO6样品放大 3000倍和6000倍的SEM照片.由图可知,样品是由大量纳米片组成的花瓣状微球[16-17],这些纳米片互相交织形成的多孔结构可以作为反应物通过的途径,从而增加催化剂的比表面积以提高其催化性能[18].同时由 Bi2WO6微观形状单一可以说明其纯度较高.
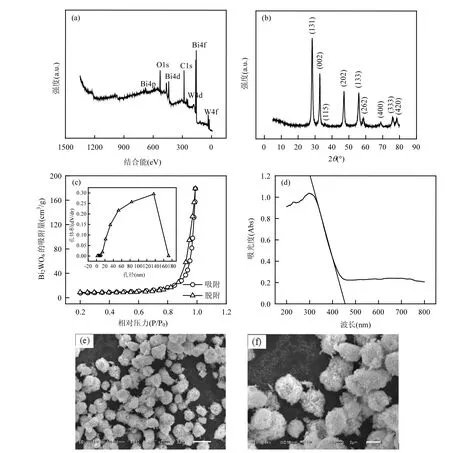
图1 Bi2WO6表征图谱Fig.1 The spectra of Bi2WO6
根据以上表征结果可知通过水热法合成的Bi2WO6是由大量纳米片组成的纯度较高的正交晶系花瓣状微球,各元素物质的量比为 Bi:W:O=2.5:1:6.7,同时经测定可知其比表面积和带隙能分别为26.67m2/g和2.74eV.
2.2 PR的光催化降解实验结果分析
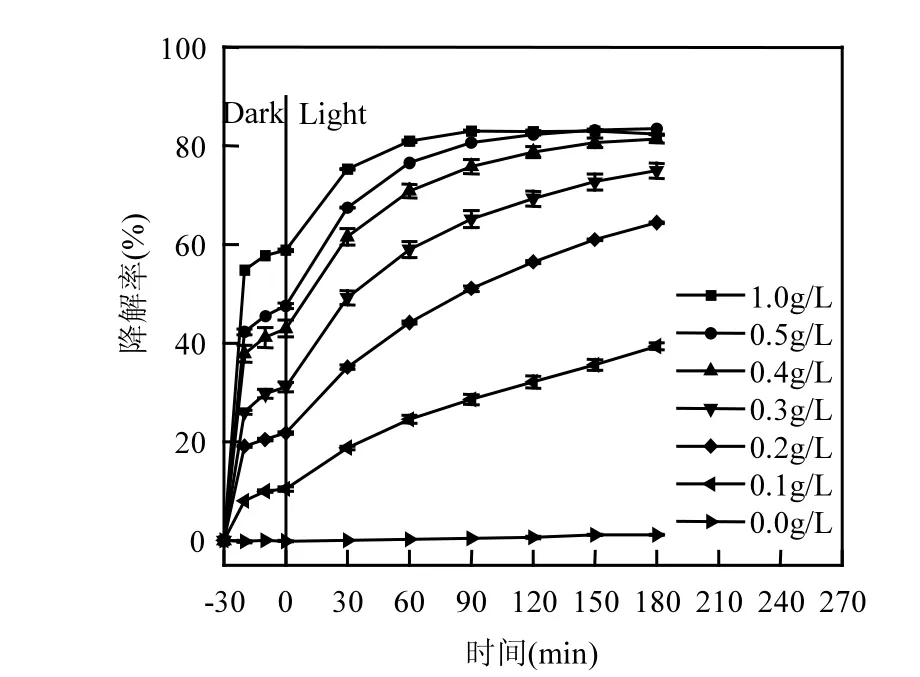
图2 Bi2WO6投加量对PR降解率的影响Fig.2 Effect of Bi2WO6 dosage on the degradation of PR
2.2.1 Bi2WO6投加量的影响 为了考察催化剂投加量对PR降解的影响,分别进行了Bi2WO6投加量为0.1g/L, 0.2g/L, 0.3g/L, 0.4g/L, 0.5g/L,1.0g/L的光催化实验,同时以未添加催化剂作为空白对照组.图2所示为Bi2WO6投加量对PR降解率的影响.

图3 pH值对PR降解率的影响Fig.3 Effect of pH on the degradation of PR
首先,由图可知未投加催化剂时,PR在光照条件下几乎不被降解.其次,当 Bi2WO6投加量从0.1g/L增加到1.0g/L,黑暗条件下Bi2WO6对PR的去除率从 10.5%增加到 58.8%.这是因为:(1)Bi2WO6是由大量纳米片组成的花瓣状微球,球型具有相对较大的比表面积,同时纳米片构成的花瓣状具有较多空隙,这样的结构有利于Bi2WO6将PR快速吸附;(2)随 Bi2WO6投加量的增加,其比表面积增加,有利于PR的大量吸附.再者,当Bi2WO6投加量从0.1g/L增加到0.5g/L时,光催化反应180min后PR的降解率从39.4%提高到 83.5%,但是当投加量继续增加到 1.0g/L时,Bi2WO6对PR的降解效果却略有下降,降解率为82.4%.上述结果是因为当体系中的Bi2WO6增加,相应的活性中心增加,光催化能力也随之增强.但是 Bi2WO6是细小的纳米粒子,当投加量增加到一定程度时,催化剂之间容易发生团聚导致活性中心减少同时粉末颗粒分散在体系中会对入射光产生散射作用,影响催化剂表面光子的吸收,从而影响 Bi2WO6对光能的利用率[19-20],因此当Bi2WO6投加量从0.5g/L增加到1.0g/L时,PR降解率反而有所下降.
由实验结果可知当投加量从 0.4g/L增加到0.5g/L时,光催化反应180min后,PR的降解率分别为 81.4%和 83.5%,降解率没有明显提高.所以综合考虑经济性与降解效果等因素,本实验Bi2WO6的最佳投加量为 0.4g/L.同时由图可知,Bi2WO6的投加量为 0.4g/L时,光催化反应150min和 180min的降解率分别为 80.6%和81.4%,说明150min时光催化降解过程基本稳定,所以选取150min为光反应时间.
2.2.2 溶液pH值的影响 为了研究溶液pH值对光催化降解过程的影响,进行了溶液初始 pH值为2.5, 4.5, 6.0, 6.5, 7.0, 9.5, 11.5的光催化实验.pH值对PR降解率的影响如图3所示.
结果表明,溶液初始pH值从2.5上升至6.5时,PR的降解率随着 pH值的增大而增大,当pH=6.5时降解效果最佳,降解率达 80.6%.当 pH值上升至9.5时,降解率有所下降,但当pH值继续增大至11.5时PR降解效果明显下降,PR几乎不被降解.上述结果是因为:首先,当 pH<6.5时,Bi2WO6在酸性条件下结构不稳定,可以完全地转化为H2WO4和Bi2O3,对可见光的利用率降低,Bi2WO6的催化活性变差[21].其次,不同pH值条件下,Bi2WO6和PR分子表面所带电荷的差异导致催化剂对 PR分子的吸附量不同,从而一定程度上影响整个光催化过程[22-23].当pH≥6.5时,PR分子中的羧基解离成 COO-和 H+,PR带负电.通过测定Bi2WO6的Zeta电位可知Bi2WO6的等电点为 6.29,即此时 Bi2WO6表面也带负电.随着溶液pH值从6.5增加到11.5,PR和Bi2WO6表面的负电荷增加,两者之间的相互排斥力增大,Bi2WO6对 PR的吸附量减小,导致光催化效率降低.另外,Lee等[24]的研究表明,不同 pH值条件下光催化过程中产生的主要活性自由基也会发生改变,从而影响光催化效率.
综上所述,采用 Bi2WO6光催化去除难降解有机物PR时,在溶液初始pH=6.5, Bi2WO6投加量为0.4g/L的条件下10mg/L PR的降解效果最佳,降解率可达80.6%.
2.3 PR的光催化降解机理分析
2.3.1 活性自由基鉴别结果分析 为确定Bi2WO6光催化降解 PR过程中的主要活性自由基,本研究在光催化实验前向溶液中分别添加0.5mmol/L草酸铵,溴酸钾以及 0.5mL/L异丙醇,同时以未添加捕获剂作为空白对照组.图 4所示是不同捕获剂对 PR降解率的影响.由图可知未添加任何捕获剂时 PR的去除效果最好,降解率为 80.6%,当添加草酸铵,溴酸钾和异丙醇后 PR降解受到了不同程度的抑制,降解率分别为10.41%,63.22%以及64.02%.

图4 不同捕获剂对PR降解率的影响Fig.4 Effect of different scavengers on the degradation of PR
结果表明,Bi2WO6降解PR的过程中空穴(h+)是起主要作用的活性自由基.一方面 h+自身具有氧化性,可以将PR氧化,所以当体系中h+被捕获后,PR的降解受到了明显的抑制,降解率仅10.41%,这也说明 h+的自身氧化是降解 PR的关键过程;另一方面,h+能够将催化剂表面的氢氧根(OH-)和水分子(H2O)氧化为·OH,同时电子(e-)能够还原氧气(O2)生成少量,根据捕获实验结果可知当体系中加入异丙醇和溴酸钾分别捕获·OH和e-后,PR降解率仅由80.6%分别下降至64.02%和 63.22%,因此在 Bi2WO6降解 PR的过程中,·OH 和只起到辅助作用.
一般来说,半导体的导带能(ECB)和价带能(EVB)可以通过下式进行估算[10,25]:

式中:Ee为4.5eV;Eg为半导体的带隙能; X是半导体的电负性.由XPS测定分析得出该法制备的Bi2WO6是由Bi, W, O三种元素组成,具体参数见表1.

表1 估算ECB、EVB的具体参数Table 1 Estimates of specific parameters for ECB and EVB
则
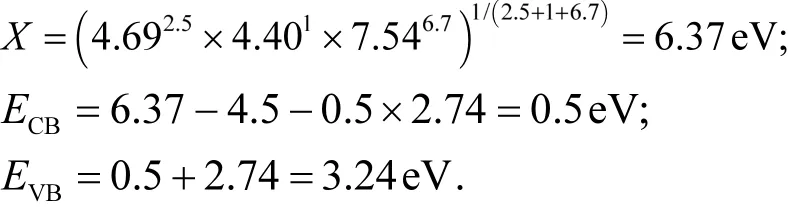
由于 EVB(3.24eV)与·OH/OH-势能(1.99eV)及·OH/H2O 势能(2.27eV)相比更正,因此 h+能够将OH-和H2O氧化为具有强氧化性的·OH,并将PR 降解[26];而 ECB(0.5eV)亦正于 O2/O2-势能(-0.28eV),所以 O2的单电子还原过程难以发生,但多电子转移仍有可能发生[27].所以 Bi2WO6光催化降解过程可能如下:
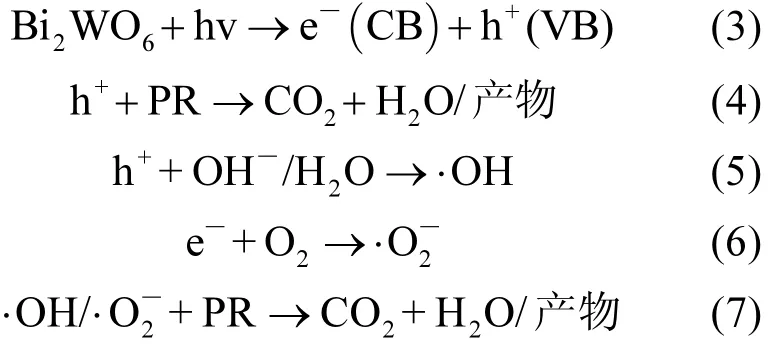
综上,Bi2WO6在光的激发下产生电子-空穴对.h+具有强氧化性,自身对污染物有强降解作用,同时也可捕获吸附于催化剂表面的H2O和OH-形成强氧化剂·OH,此外,多个具有强还原性的 e-可联合捕获吸附在催化剂表面的 O2分子生成,从而辅助降解小部分污染物[28-29].
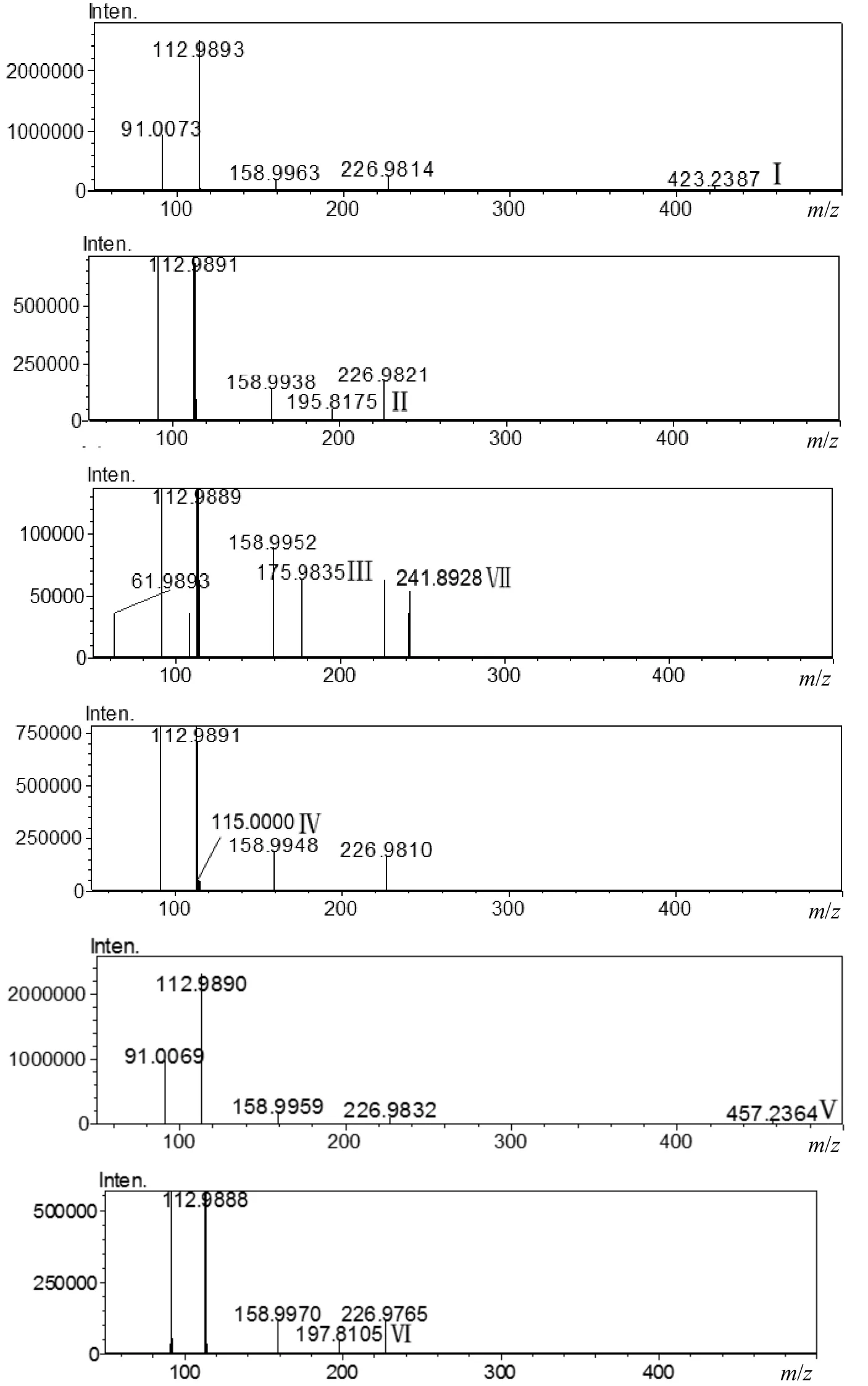
图5 Bi2WO6光催化降解PR过程中间产物的质谱Fig.5 Mass spectrograms of proposed intermediates generated during photocatalytic degradation of PR by Bi2WO6
2.3.2 中间产物及降解路径分析 通过高效液相色谱-飞行时间质谱仪(LCMS-IT-TOF)检测分析了 PR的光催化降解中间产物,部分降解产物的质谱如图 5所示.在负离子模式下检测到 6种中间产物,其m/z分别为195, 175, 115, 457, 197和 241,其分子结构式与产物Ⅱ-Ⅶ一一对应(同一分子量可能存在的多种异构形式).
根据检测到的分子结构提出了Bi2WO6光催化降解PR的路径,如图6所示.首先,PR的降解主要是通过h+氧化实现的.PR分子中链状C-C键和酯键被h+氧化断裂,生成相对分子量为162和102的有机物.同时,在·OH 攻击下生成相对分子量为178和196(对应m/z195的产物Ⅱ)的加羟基产物.相对分子量为178和162的有机物在h+的氧化作用下,继续发生酯化反应和环化反应生成相对分子量为 176(对应 m/z175的产物Ⅲ)和116(对应m/z115的产物Ⅳ)的易降解小分子产物.其次,·OH 和的氧化在PR降解过程中起到了辅助作用.一方面,羟基自由基攻击 PR分子中的C=C双键生成相对分子量为 458(对应 m/z457的产物Ⅴ)的加羟基产物,进而被 h+氧化断键生成相对分子量为198(m/z197的产物Ⅵ)的小分子产物;另一方面根据 Malgorzata等[30]关于改性TiO2降解PR机理的研究推测出PR分子在·OH和的联合作用下被氧化成相对分子量为242(对应m/z241的产物Ⅶ)的产物.

图6 PR的光催化降解路径Fig.6 Proposed photocatalytic degradation pathways of PR by Bi2WO6
通过PR降解前后溶液COD的变化表征降解过程的矿化度,结果表明反应体系矿化度为40.2%,由此看出,在氙灯照射下部分PR分子及中间产物被矿化.
综上所述,活性自由基捕获实验结果表明在Bi2WO6光催化降解PR过程中h+起主要的氧化作用,·OH 和的氧化起辅助作用.同时结合中间产物的鉴别结果进一步提出Bi2WO6光催化降解PR的机理是以空穴(h+)为主,羟基自由基(·OH)和超氧自由基为辅联合攻击PR分子中CC键,C=C双键,酯键等化学键,从而将其分解为易降解小分子有机物,进而部分小分子产物被矿化成CO2和H2O.
2.4 毒性评估
本实验通过测定费氏弧菌的发光抑制率(E)来评估PR原液及其光催化降解产物的毒性.结果表明,PR降解前后细菌的发光抑制率分别为12.91%和12.20%,即PR降解前后对费氏弧菌的发光抑制效果相近,这与 Małgorzata等[30]通过改性TiO2光催化降解PR,并采用该毒性测试法所测的毒性结果相似.结合PR降解路径及初步毒性测试结果可知,在光催化过程中,虽然PR分子经历了分解产生小分子有机物或小分子产物聚合成新的物质等一系列复杂的反应,但总体而言光催化降解后的产物与 PR原液相比毒性并没有增强.综上所述,在光催化反应中,难降解大分子有机物PR转化为易降解的小分子产物,与此同时产物毒性并没有明显增强.从环境保护的角度来说这一结论是非常重要的,这也充分说明了采用光催化技术去除水体中难降解有机物 PR是行之有效的.另外,后续关于水体中PR及其降解产物毒理学的研究将通过更广泛的生物体进行考察.
3 结论
3.1 采用水热法合成的 Bi2WO6是由大量纳米片组成的正交晶系花瓣状微球,各元素物质的量比为 Bi:W:O=2.5:1:6.7,比表面积和带隙能分别为26.67m2/g和2.74eV.
3.2 当溶液pH=6.5, Bi2WO6的投加量为0.4g/L时,10mg/L PR的降解效果最佳,降解率可达80.6%,矿化度为40.2%.
3.3 Bi2WO6光催化降解PR过程中起主要氧化作用的活性自由基是h+,同时·OH和起辅助氧化作用,且该过程产生了多种易降解小分子中间产物.
3.4 Bi2WO6光催化降解PR的机理可能是以空穴(h+)为主,羟基自由基(·OH)和超氧自由基为辅联合攻击 PR分子中 C—C键,C=C双键,酯键等化学键,从而将其分解为易降解小分子有机物,进而部分小分子产物被矿化成CO2和H2O
3.5 Bi2WO6光催化降解PR过程中产生的小分子产物与PR原液相比毒性并没有增强.
[1]Srinivasa R P, Nageswara R P, Ganduet V. High performance liquid chromatography mass spectrometric method for the simultaneous quantification of pravastatin and aspirin in human plasma: Pharmacokinetic application [J]. Pharmaceutical Analysis,2012,2(3):206–213.
[2]Behnaz R, Weihua S, Hanoz S, et al. Treatment of statin compounds by advanced oxidation processes: Kinetic considerations and destruction mechanisms [J]. Radiation Physics and Chemistry, 2011,80:453–461.
[3]杨 程.城市水系統中 PPCPs分布及污水处理优化研究 [D].重庆:重庆大学, 2014.
[4]Conley J M, Symes S J, Kindelberger S A, et al. Rapid liquid chromatography-tandem mass spectrometry method for the determination of abroad mixture of pharmaceuticals in surface water [J]. Chromatogr. A., 2008,1185:206–215.
[5]Grung M, Heimstad M S, Moe M, et al. Human and veterinary pharmaceuticals, narcotics, and personal care products in the environment [J]. Chemosphere, 2015,115:95–99.
[6]Lee H B, Peart T E, Svoboda M L, et al. Occurrence and fate of rosuvastatin, rosuvastatin lactone, and atorvastatin in Canadian sewage and surface water samples [J]. Chemosphere, 2009,77:1285–1291.
[7]Pereira A M, Silva L J, Meisel L M, et al. Environmental impact of pharmaceuticals from Portuguese wastewaters: geographical and seasonal occurrence, removal and risk assessment [J].Environmental Research Letters, 2015,136:108–119.
[8]Miguel M. Santos, Raquel Ruivo, Mónica Lopes-Marques.Statins: An undesirable class of aquatic contaminants? [J].Aquatic Toxicology, 2016,174:1–9.
[9]张 豪,王春英,李 方,等. Bi2WO6可见光催化降解活性艳红X-3B的研究 [J]. 中国环境科学, 2010,30(12):1608–1613.
[10]Kaur A, Kansal S K.Bi2WO6nanocuboids: An efficient visible light active photocatalyst for the degradation of levofloxacin drug in aqueous phase [J]. Chemical Engineering Journal,2016,302:194–203.
[11]Yang Z Y, Huang L, Xie Y Y, et al. Controllable synthesis of Bi2WO6nanoplate self-assembled hierarchical erythrocyte microspheres via a one-pot hydrothermal reaction with enhanced visible light photocatalytic activity [J]. Applied Surface Science, 2017,403:326–334.
[12]李小芳.新型钨酸铋可见光催化剂的制备改性及降解低浓度甲苯性能研究 [D]. 杭州:浙江大学, 2012.
[13]Zhu S W, Yang C Y, Li F, et al. Improved photocatalytic Bi2WO6/BiOCl heterojunctions: One-step synthesis via an ionic-liquid assisted ultrasonic method and first-principles calculations [J]. Molecular Catalysis, 2017,435:33–48.
[14]Huang H, Chen H F, Xia Y, et al. Controllable synthesis and visible-light-responsive photocatalytic activity of Bi2WO6fluffy microsphere with hierarchical architecture [J]. Journal of Colloid and Interface Science, 2012,370:132–138.
[15]Zhang L S, Wang W Z, Chen Z G, et al. Fabrication of flower-like Bi2WO6superstructures as high performance visible-light driven photocatalysts [J]. J. Mater. Chem., 2007,17:2526–2532.
[16]He J Y, Wang W M, Long F, et al. Hydrothermal synthesis of hierarchical rose-like Bi2WO6microspheres with high photocatalytic activities under visible-light irradiation [J].Materials Science and Engineering B, 2012,177:967–974.
[17]卓艺乔.钨酸铋(Bi2WO6)微晶的制备及太阳光催化性能研究[D]. 咸阳:陕西科技大学, 2013.
[18]Liu Y M, Ding Z W, Lv H, et al. Hydrothermal synthesis of hierarchical flower-like Bi2WO6microspheres with enhanced visible-light photoactivity [J]. Materials Letters, 2015,157:158–162.
[19]陈清华.改性Ti2O纳米带制备及光催化降解水中左氧氟沙星研究 [D]. 哈尔滨:哈尔滨工业大学, 2014.
[20]Curco D, Gimenez J, Addardak A, et al. Effects of radiation absorption and catalyst concentration on the photocatalytic degradation ofpollutants [J]. Catal Today, 2002,76(2/4):177–188.
[21]Fu H B, Pan C S, Yao W Q, et a1.Visible-Light-Induced Degradation of Rhodamine B by Nanosized Bi2WO6[J].Journal of Physical Chemistry (B), 2005,109:22432–22439.
[22]徐秀泉,于小凤,唐 燕,等. Ag/Ag3PO4光催化降解乳酸左氧氟沙星 [J]. 硅酸盐学报, 2012,40(12):1796–1801.
[23]吕 洋. pH值对光催化降解水中苯酚和氯酚的影响 [D].深圳:哈尔滨工业大学, 2008.
[24]Lee W L, Huang S T, Chang J L, et al. Photodegradation of CV over nanocrystalline bismuth tungstate prepared by hydrothermal synthesis [J]. Journal of Molecular Catalysis A:Chemical, 2012,361–362:80–90.
[25]Liu T T, Wang L, Lu X, et al. Comparative study of the photocatalytic performance for the degradation of different dyes by ZnIn2S4: adsorption, active species, and pathways [J].RSC Adv., 2017,7:12292–12300.
[26]Nakamura K J, Ide Y, Ogawa M. Molecular Recognitive Photocatalytic Decomposition on Mesoporous Silica Coated TiO2particle [J]. Materials Letters, 2011,65(1):24–26.
[27]李晓金.氧化钛和钨酸铋光催化有机物降解活性的改进及机理研究 [D]. 杭州:浙江大学, 2015.
[28]Chaudhari P, Chaudhari V, Mishra S. Low temperature synthesis of mixed phase titania nanoparticles with high yield,its mechanism and enhanced photoactivity [J]. Materials Research, 2016,19(2):446–450.
[29]Sheng J Y, Li X J, Xu Y M. Generation of H2O2and OH radicals onBi2WO6for phenol degradation under visible light[J]. ACS Catal, 2014,4:732–737.
[30]Małgorzata P, Mohamed S, Polonca T. Photocatalytic degradation of cholesterol-lowering statin drugs by TiO2-basedcatalyst.Kinetics, analytical studies and toxicity evaluation [J]. J.Photochem. Photobiol. A: Chemistry, 2010,213:61–69.
