禽腺病毒4型实时荧光PCR检测方法的建立与应用
2018-06-25杨金兴张玉霞袁小远山东省农业科学院家禽研究所山东济南250023
杨金兴,张玉霞,李 莉,袁小远(山东省农业科学院 家禽研究所,山东 济南 250023)
禽腺病毒(fowl adenovirus,FAV)根据抗原性差异可以分为3个群,其中Ⅰ群是传统的禽腺病毒,包括从鸡分离到的12个血清型、火鸡2个血清型、鹅3个血清型和鸭2个血清型[1-2]。禽腺病毒可以引起禽包涵体肝炎、心包积液、肌胃糜烂等病变。自2015年6月起,山东省部分地区的肉鸡中爆发了一种以传染速度很快、死亡速度快、死亡率高的传染病,临床以心包积液为主要病变特征[3]。经鉴定,最终确定病原为Ⅰ群禽腺病毒。目前,血清分型表明山东地区流行的禽腺病毒主要是血清4型和8 a/b型,该病毒造成鸡群的死亡率较高,经济损失较大[4-5]。
本研究根据GenBank中的FAV血清4型的基因组序列,在保守区域设计了特异性扩增引物和探针,建立了FAV的实时荧光PCR检测方法,可用于4型FAV样品的实验室检测。
1 材料与方法
1.1 材料
4型FAV分离毒株GF16和WF816由山东省农业科学院家禽研究所分离鉴定。
1.2 方法
1.2.1 引物设计
参照GenBank中FAV的基因组序列,设计引物FAV-FQ-F、FAV-FQ-R、探针P的5’-3序列分别为CTAGGGTTCTGAACTTTG、CGGTAAACATTTCA AGGA和TGACGCCAGTTTCGCTTTCG,探针用FAM和Eclipse荧光染料标记物进行标记。引物及探针均由TaKaRa(大连)公司合成,级别均为HPLC级。
1.2.2 实时荧光PCR
选取鸡FAV分离毒株GF16和WF816进行检测,设血清8型和水作为对照。病毒DNA的提取按照TaKaRa DNAiso试剂操作进行,最后用30 μL超纯水来溶解DNA。
Real-time PCR实时荧光PCR采用Probe qPCR进行,反应体系如下:Probe qPCR 缓冲液12.5 μL,上、下游引物各0.5 μL,探针1 μL,DNA模板2 μL,ddH2O 8.5 μL,共25 μL。反应体系为:95 ℃ 30 s,随后95 ℃ 5 s、55 ℃ 10 s、72 ℃ 20 s进行40个循环,反应结束后观察荧光曲线。同时取5 μL反应产物进行琼脂糖凝胶电泳检验。以100 bp DNA Ladder的标记物作为参考,TAE缓冲液为电泳缓冲液,电泳30 min,凝胶成像系统观察结果。
1.2.3 临床应用
对42份疑似禽腺病毒感染样品进行上述方法检测,后续进行病毒分离、序列测定等来验证建立的实时荧光PCR的准确性。
2 结果与分析
2.1 实时荧光PCR扩增
禽腺病毒4型的GF16分离毒株和WF816分离毒株实时荧光PCR扩增曲线良好(图1),2份样品的2个平行样品的Ct值基本一致,为19.3和19.8;阴性对照组未出现扩增曲线。琼脂糖凝胶电泳显示扩增得到预期大小的扩增片段,约150 bp,阴性对照组在此处未出现扩增条带(图2)。
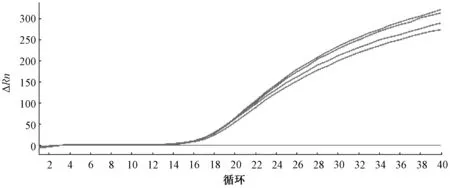
图1 禽腺病毒4型样品的扩增曲线
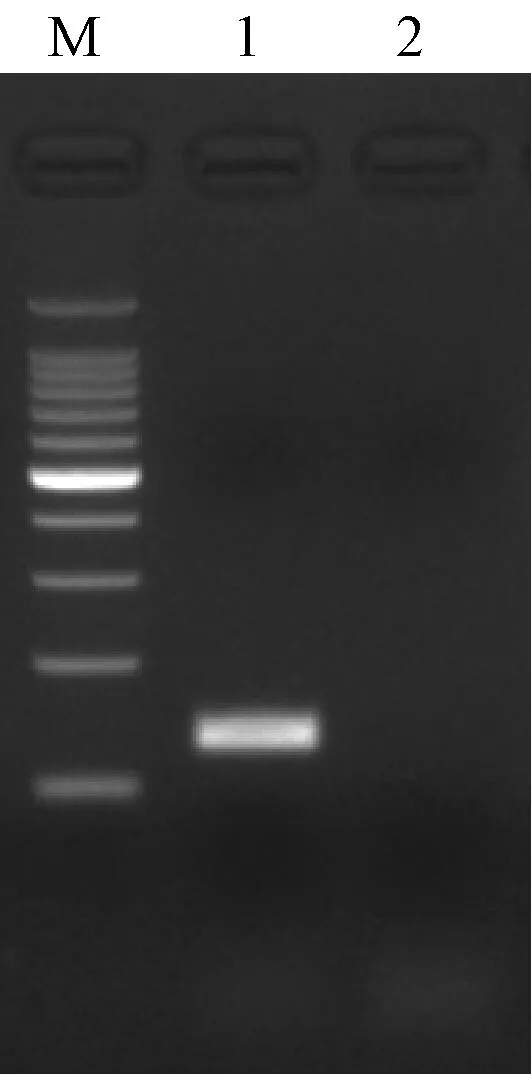
M为100 bp DNA Laddar Marker;1为样品的PCR扩增条带;2为阴性对照图2 部分样品的电泳结果
2.2 敏感性
将模板DNA进行10倍的倍比稀释,随后同样进行实时荧光PCR进行敏感度的检测。结果表明,本技术的检测最小量可为100拷贝·μL-1。本方法设计合成的双标记荧光探针和引物,扩增曲线良好;电泳结果显示目的条带清晰,说明探针引物性能良好。
2.3 临床应用
对42份疑似禽腺病毒感染样品进行检测后证实,检测到14份阳性样品。经后续的病毒分离、序列测定等证实建立的实时荧光PCR检测法特异性高,该方法可快速灵敏准确地检测禽腺病毒4型,极大地缩短检测时间,同时避免了普通PCR检测出现的的假阴/阳性情况。因此,本研究所建立的探针实时荧光PCR检测技术具有快速、准确、灵敏、重复性好等优点,可用于FAV样品的实验室检测。
3 讨论
本研究建立了可用于检测禽腺病毒4型的特异性方法。本方法特异性强,与其他几种家禽主要疫病病毒(8 a/b型FAV、NDV、H9亚型AIV、IBDV)均无交叉反应,所以建立的实时荧光PCR技术可用于临床检测。
我国主要流行6个血清型的禽腺病毒(火鸡1型、禽1型、4型、5型、8 a/b型),感染鸡群的发病快、死亡率较高[6-7]。禽腺病毒多存在于禽类的呼吸道和消化道,多数呈隐性带毒,但是一旦机体抵抗力下降就会引起发病,而且往往与其他病毒混合感染,导致死亡率提高[8]。鉴于禽腺病毒的发病特征和近几年来我国的高传播性分布特征,加强本病的快速诊断尤为重要。
参考文献:
[1] PARK H S, LIM I S, KIM S K, et al. Molecular analysis of the hexon, penton base, and fiber-2 genes of Korean fowl adenovirus serotype 4 isolates from hydropericardium syndrome-affected chickens[J]. Virus Genes, 2016:1-6.
[2] KAN F, FUJIMOTO Y, UJINO A, et al.Gallusgalluscoxsackievirus and adenovirus receptor facilitates the binding of fowl adenovirus serotype 1 in chickens[J]. Japanese Journal of Veterinary Research, 2016, 64(3):183-190.
[3] 王娟, 刘亮亮, 李慧昕,等. 禽腺病毒血清4型的分离鉴定及遗传演化分析[J]. 中国兽医科学, 2017(6):755-761.
[4] LI H, WANG J, QIU L, et al. Fowl adenovirus species C serotype 4 is attributed to the emergence of hepatitis-hydropericardium syndrome in chickens in China[J]. Infection Genetics & Evolution, 2016, 45:230-241.
[5] 李晓林, 王相芹, 罗济冠,等. Ⅰ群禽腺病毒的分离鉴定及其致病性研究[J]. 中国动物检疫, 2016, 33(8):86-89.
[6] YE J, LIANG G, ZHANG J, et al. Outbreaks of serotype 4 fowl adenovirus with novel genotype, China[J]. Emerging Microbes & Infections, 2016, 5(5):e50.
[7] 牛登云, 沈元, 王蕊,等. 2015年我国Ⅰ群禽腺病毒分子流行病学调查[J]. 中国家禽, 2016, 38(9):65-68.
[8] 姚克昌, 刘月月, 游国进,等. 西南部分地区Ⅰ群禽腺病毒的分子流行病学调查及致病性研究[J]. 浙江农业学报, 2017, 29(11):1809-1818.
