Methylocorus sp. MP 688菌株glyA基因体外表达及功能研究
2018-06-25孙宇桐邹琪琪孙菊鲜孙晓宇齐姗姗河北大学生命科学学院河北保定071002
孙宇桐,邹琪琪,孙菊鲜,孙晓宇,齐姗姗,辛 琪,葛 欣(河北大学 生命科学学院,河北 保定 071002)
甲基营养菌是一种广泛存在的微生物,它能够将一碳化合物作为唯一的碳源和能源。Methylocorussp. MP 688是从土壤中筛选到的一株高产吡咯喹啉醌细菌,能够以甲醇为唯一碳源生长。吡咯喹啉醌是在细菌中继烟酰胺和黄酮之后的第3个氧化还原因子,菌株MP 688作为重要的吡咯喹啉醌生产菌在工业上有着重要的经济价值[1-4]。因此,本文通过分析菌株MP688的基因组信息及代谢途径,来探究菌体代谢活动中丝氨酸循环对于细胞生命活动所起的作用,无疑会对今后进一步改造菌体代谢通路起到重要的指导作用。
1 材料与方法
1.1 材料
MP688野生型菌种、质粒pGX为本实验室保存;大肠埃希菌DH 5α及BL 21感受态、质粒pET-15b、琼脂糖凝胶DNA回收纯化试剂盒、普通质粒提取试剂盒购自北京天根生物公司;限制性内切酶、T4DNA连接酶等购自博迈德生物公司;考马斯亮蓝试剂、牛血清白蛋白溶液购自上海阿拉丁生化科技股份有限公司;无缝克隆试剂盒(ClonExpress®MultiS One Step Cloning Kit)购自Vazyme公司;测序及PCR引物合成由奥科鼎盛公司完成。
MP培养基。硫酸镁0.2 g·L-1,硫酸铵3 g·L-1,磷酸二氢钾1.4 g·L-1,磷酸氢二钠3 g·L-1,柠檬酸铁0.03 g·L-1,氯化钙0.03 g·L-1,氯化锰0.005 g·L-1,硫酸锌0.005 g·L-1,硫酸铜0.005 g·L-1,甲醇10 mL,pH值6.8。
逆向酶活底物反应液配置。DL-苯基丝氨酸(100 mmol·L-1) 25 mL,磷酸吡哆醛 100 μL(25 mmol·L-1),Na2EDTA(100 mmol·L-1) 500 μL,Na2SO4(250 mmol·L-1) 5 mL,K2HPO4-KH2PO4(pH 7.6) 5 mL,调节pH值至7.6,ddH2O定溶至50 mL。
1.2 SHMT蛋白体外表达及纯化方法
1.2.1glyA基因的克隆及pET15b-glyA质粒构建
登录GenBank查找菌株MP 688的glyA基因序列(NC014733),该开放阅读框编码一条由415个氨基酸组成的肽链,预测分子量为44.4 ku。通过Primer 5设计了一对寡聚核苷酸引物,序列见表1。基因组提取、PCR、酶切、连接、质粒转化等常规分子生物学操作按照文献[5]方法进行。使用质粒pET-15b作为glyA基因表达载体,转化大肠埃希菌BL 21感受态细胞。
1.2.2glyA基因诱导表达
SHMT酶的表达、纯化。按照1%接种量将转化入pET15b-glyA质粒的BL 21感受态接入100 mL含有氨苄青霉素100 μg·mL-1的液体LB培养基中,在37 ℃,200 r·min-1摇床培养至菌浓度为D=0.6时,加入IPTG终浓度1 mmol·L-1,16 ℃,100 r·min-1诱导表达12~16 h。随后,将全部培养物经10 000 r·min-1离心10 min。使用裂解缓冲液重悬菌体,超声破碎菌体,5 min,将破碎后菌体4 ℃,12 000 r·min-1离心30 min。将上清与处理好的Ni螯合Chelating-Sepharose树脂混匀,4 ℃旋转摇床缓摇1 h;4 ℃,500g离心3 min,轻去上清,收集树脂珠粒;加入5 mL含低浓度咪唑洗脱液,4 ℃旋转摇床缓摇10 min,洗脱杂质;4 ℃,500g离心3 min, 轻去上清,收集树脂珠粒,重复洗涤3次;再将1 mL洗脱液加入树脂中,充分混合后离心,上清液中应含有高浓度目的蛋白;电泳检测各组分,考察纯化效果。
SHMT酶保存条件:4 ℃透析除盐,每隔8 h更换一次透析液,逐渐降低透析液中的盐离子浓度,透析后的蛋白溶液加入终浓度为5%甘油,-20 ℃保存。
1.2.3 SHMT酶活测定
BSA标准曲线绘制。将BSA标准溶液10 mg·mL-1依次进行梯度稀释,取同样体积稀释液加入等体积的考马斯亮蓝溶液,每个梯度做3个平行并与96孔板中进行波长为595 nm吸光值检测,记录数值,并绘制BSA标准曲线。
苯甲醛标准曲线绘制。取苯甲醛母液(10 mmol·L-1)10 μL溶于10 mL ddH2O中,避光保存。将其依次进行梯度稀释,取同样的稀释液加入等体积的考马斯亮蓝溶液,每个梯度做3个平行并与96孔板中进行波长为275 nm吸光值检测,记录数值,并绘制标准曲线。
最适酶促反应条件实验及逆向酶活测定。在35 ℃条件下测定最佳酶促反应pH,分别使用磷酸缓冲液(pH值5.0~7.0)、Tris-HCl缓冲液(pH值7.5~8.5)作为缓冲体系。在pH 7.0条件下检测最适反应温度,范围为25~60 ℃。将最高酶活定义为100%,然后分别计算其他条件下的相对酶活,绘制pH/温度-相对酶活性曲线,以确定酶的最适pH值或温度。
逆向酶活测定。测定纯化后的酶蛋白浓度,再将1 μg酶蛋白加入1 mL底物溶液[6-10],最适温度及pH值条件下避光反应1 h,测定D275数值并记录。将SHMT酶活力单位定义为:1 μg SHMT酶35 ℃避光反应1 h条件下,转化生成1 μmol·L-1的苯甲醛所具有的酶活力,称为一个酶活力单位(IU,又称U)。
1.3 双交换系统glyA的敲除
1.3.1 敲除载体pGX-up-Gm-down构建
引物up-F、up-R用于扩增基因glyA的上游同源臂,引物down-F、down-R用于扩增基因glyA的下游同源臂;使用双交换敲除法进行敲除实验,以庆大霉素(Gm)为敲除标记。Gm-F,Gm-R引物用来扩增庆大霉素抗性基因。使用Vazyme公司无缝克隆试剂盒将片段和敲除载体pGX线性化质粒相连。引物序列及酶切位点见表1。

表1 引物序列的基本情况
1.3.2 双交换glyA基因敲除
将pGX-up-Gm-down质粒通过电击转化的方法导入MP688菌株中, 将其均匀涂布于以添加果糖(20 mmol·L-1)及庆大霉素(50 μg·mL-1)的MP固体培养基(FGMP)上,28 ℃培养3 d。挑取单菌落,转接FGMP液体试管2~3 mL,30 ℃摇床培养2 d。生长的培养液,转接添加果糖(20 mmol·L-1)及卡那霉素(50 μg·mL-1)的MP液体培养基(FKMP)中,若在FGMP中生长且在FKMP中不长,则为通过双交换法成功构建的glyA基因缺失菌。此外,还通过更换不同的碳源如甲醇来筛选敲除子。
2 结果与分析
2.1 glyA基因体外表达
2.1.1 pET15b-glyA质粒构建及表达
我们使用primer premier 5.0软件设计glyA基因引物,扩增得到完整的glyA基因,将其成功连接到表达质粒上,PCR验证结果及双酶切结果见图1。通过化学转化法成功构建大肠埃希菌BL 21转化子,诱导表达后进行SDS-聚丙烯酰胺凝胶电泳,发现加入诱导物的培养物在42.5 ku大小处条带明显加粗,蛋白电泳图片见图2。
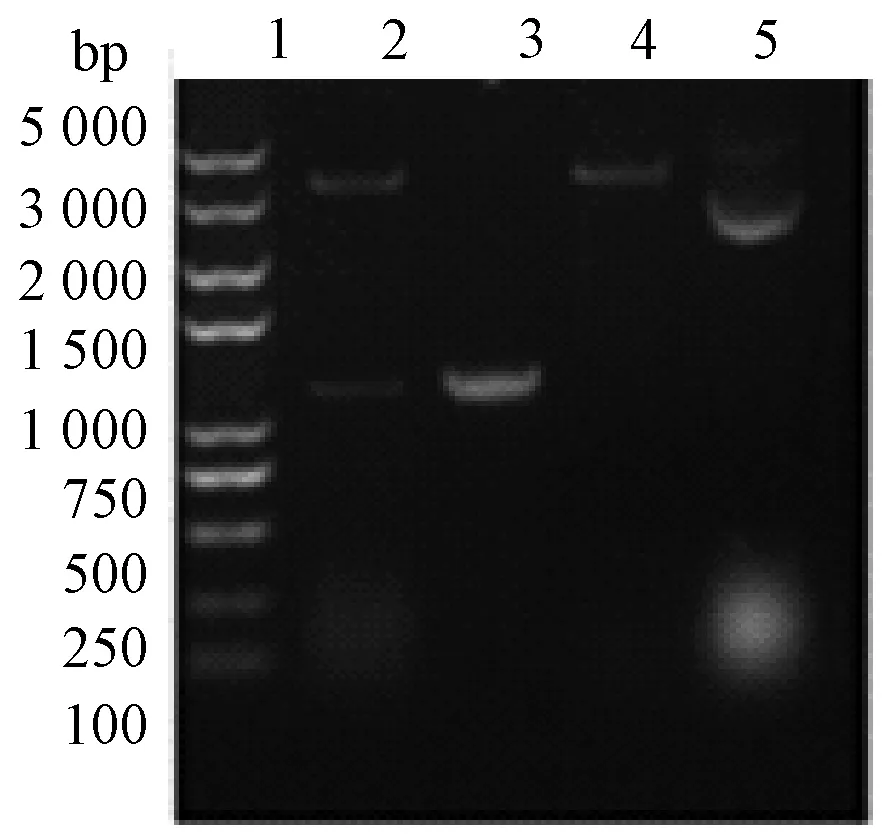
1为Marker;2为双酶切验证;3为glyA 基因;4为空载酶切;5为环状质粒图1 pET-15b-glyA质粒构建验证

1为Marker; 2为未诱导; 3~4为诱导图2 IPTG诱导转化子表达SHMT蛋白电泳结果
2.1.2 SHMT蛋白表达及纯化
根据胶图发现42.5 ku蛋白为双带。由此得出两个猜想:SHMT蛋白被水解破坏;SHMT蛋白上样缓冲液处理在变性过程中未能完全将其还原,其中含有两个或多个半胱氨酸,因此出现两种结构。为验证猜想的正确性,我们登录NCBI查找MP 688表达的SHMT氨基酸序列,分析其氨基酸序列及组成。由于SHMT序列在68及165位置处为半胱氨酸,可能导致分子内或分子间形成二硫键,序列如图3。进一步导致纯化的蛋白出现如图4中条带3~5的双带。因此,再次进行SDS-聚丙烯酰胺凝胶电泳,并在上样前补加β-ME,电泳结果见图5,从而解决了非均一条带的问题。

图3 SHMT氨基酸序列

1为Marker; 2为破碎菌体; 3~5为纯化蛋白图4 SHMT蛋白纯化电泳结果

1为Marker; 2为破碎菌体; 3~5为纯化蛋白图5 还原SHMT蛋白电泳结果
2.2 SHMT蛋白的酶活力
2.2.1 蛋白含量测定标准曲线
记录梯度稀释BSA蛋白D595吸光值并使用Excel绘制标准曲线如图6。

图6 蛋白浓度标准曲线
2.2.2 纯化后蛋白浓度
使用合适稀释梯度的纯化蛋白溶液加入考马斯亮蓝溶液,做3个平行并于96孔板中进行波长为595 nm吸光值检测,平均吸光值为0.018 4。代入BSA标准曲线所得方程式中计算,得出蛋白浓度为0.1 g·L-1。
2.2.3 苯甲醛标准曲线
苯甲醛母液(10 mmol·L-1):10 μL溶于10 mL ddH2O中,避光保存。记录苯甲醛标准曲线测定数据,使用Excel绘制苯甲醛标准曲线,见图7。

图7 苯甲醛标准曲线
2.2.4 逆向酶活力
测定不同温度或不同pH条件下的酶促反应速率,记录数值并计算在不同条件下的相对酶活力,绘制柱状图,如图8及图9。得出SHMT酶最适反应pH值为7.5,最适催化温度35~40 ℃。因此,后续实验选择在pH 值7.5的条件下,35 ℃反应1 h测定D275处的吸光值,并计算酶活。

图8 pH值对SHMT酶活力影响
结合SHMT酶一级结构序列,引发我们探究还原及非还原状态对酶活性的影响。我们在测定逆向酶活的同时,梯度添加β-巯基乙醇(β-ME)为实验组,正常不添加还原剂的反应组为对照组,分别做3组平行测定SHMT逆向酶活力,将1 μg酶蛋白加入1 mL底物溶液(pH值7.5)中,35 ℃ 避光反应1 h,测定D275。测定结果见表2。

图9 温度对SHMT酶活力影响
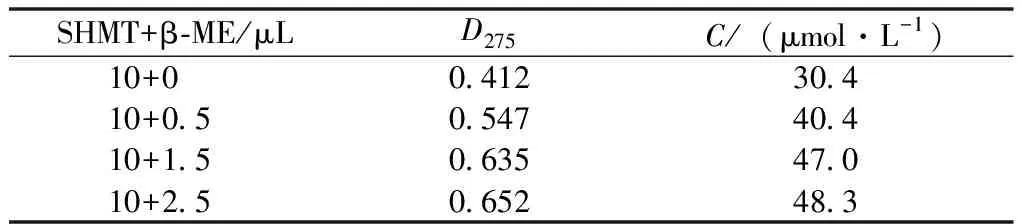
表2 苯甲醛的吸光值
注:β-ME影响吸光值,所以梯度添加β-ME时,应该以加β-ME的底物反应液为空白对照调0。
根据酶活定义可以得出1 μg SHMT酶在正常催化条件下的酶活力为30.4 IU,在添加β-ME的纯化条件下酶活力为48.3 IU。
2.3 glyA敲除质粒构建
2.3.1glyA敲除
通过GenBank中查找到glyA基因上下游各1 500 bp左右的片段及庆大抗性基因通过无缝克隆设计相关引物并成功扩增出3个条带,使用pGX质粒作为载体,成功构建出glyA敲除质粒。敲除质粒构建及双酶切验证见图10。

a为扩增片段(1表示DNA marker,2表示Up片段,3表示Gm片段,4表示down片段; 5表示glyA片段);b为pGX-glyA重组敲除质粒;c为敲除质粒双酶切验证图图10 pGX-glyA敲除质粒构建及双酶切验证
2.3.2 敲除结果
电转野生型MP 688感受态细胞,将其均匀涂布于FGMP固体平板上,28 ℃培养3 d。反复挑取单菌落,接FGMP液体试管2~3 mL,30 ℃摇床培养。2 d后,生长的培养液,转接FKMP液体培养基。通过更换不同的碳源如甲醇,代替果糖进行敲除子筛选实验。由于反复筛选敲除子,我们得到多株可在添加庆大霉素的MP培养基中生长的菌株,始终未得到缺失型菌株。
3 讨论
我们成功将MP688菌株glyA基因在体外表达、纯化并测定SHMT酶活性。在纯化蛋白的过程中发现,合理地添加β-ME可以使酶处于还原状态并维持均一的空间结构。发现相同的实验条件下,在酶促反应体系中添加β-ME,可大幅增加苯甲醛产量。依据本文酶活力单位的定义,我们可以得出,在相同的实验条件下,添加β-ME的酶促反应体系可显著增强SHMT酶催化效率。
由于反复筛选敲除子,并没有得到缺失型菌株。分析MP 688菌株代谢途径,参考报道的MethylobacteriumextorquensAM 1菌株代谢模块见图11[6]。细菌菌体代谢有机碳源为菌体生长代谢提供必需的能量,同化C1单位促进菌体生长繁殖。通常菌株经糖酵解途径后到达丝氨酸循环及柠檬酸循环实现C1单位利用。菌株MP 688与AM 1代谢途径存在巨大差异,可发现菌株MP 688基因组较AM 1所含信息量少。

图11 菌株Methylobacterium extorquens AM1的C1同化通路
菌株MP 688柠檬酸循环通路不完整,缺少草酰琥珀酸向琥珀酸-CoA转化的酶及琥珀酸向延胡索酸转化的酶基因。菌株MP 688没有完整的柠檬酸途径及丝氨酸循环途径,C1同化由SHMT酶催化完成,必将通过其他代谢通路来形成环形通路。
在MP688菌株基因组中发现能够催化丝氨酸-甘氨酸之间相互转化的基因只有glyA基因一种。因此,我们推测glyA基因在菌体固定C 1单位中作为关键基因存在,起到不可替代的作用。一旦缺失,菌株将会致死。这为后一步改造该菌种,构建吡咯喹啉醌高产菌株具有十分重要的意义。
参考文献:
[1] XIONG X H, ZHI J J, YANG L, et al. Complete genome sequence of the bacteriumMethylovorussp. strain MP688, a high-level producer of pyrroloquinolone quinone[J]. Journal of Bacteriology, 2011, 193(4):1012-1013.
[2] CHISTOSERDOVA L, CHEN S W, LAPIDUS A, et al. Methylotrophy inMethylobacteriumextorquensAM1 from a genomic point of view[J]. Bacteriology, 2003, 185(10): 2980-2987.
[3] 李大攀,葛欣,魏静远,等. 甲基营养菌 MP688甲醇脱氢酶基因mpq1818的敲除及功能研究[J]. 生物技术通讯, 2015, 25(5):632-635.
[4] NAYAK D D, MARX C J. Genetic and phenotypic comparison of facultative methylotrophy betweenMethylobacteriumextorquensstrains PA1 and AM1[J]. PLoS ONE, 2014, 9(9):e107887.
[5] 奥斯伯, 布伦特, 金斯顿, 等. 精编分子生物学实验指南[M]. 北京: 科学出版社, 1998.
[6] CHISTOSERDOVA L V, LIDSTROM M E. Genetics of the serine cycle inMethylobacteriumextorquensAM1: Cloning, sequence, mutation, and physiological effect ofglyA, the gene for serine hydroxymethyltransferase[J]. American Society for Microbiology, 1994, 176(21):6759-6763.
[7] 沈天翔,那淑敏,喻国策,等. 大肠杆菌丝氨酸羟甲基转移酶基因(glyA)的克隆和表达[J]. 微生物学报, 1997, 37(6): 423-428.
[8] FLORIO R, DI SALVO M L, VIVOLI M, et al. Serine hydroxymethyl-transferase: A model enzyme for mechanistic, structural, and evolutionary studies[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2010, 1814(11): 1489-1496.
[9] DIJKMAN W P, FRAAIJE M W. Discovery and characterization of a 5-hydroxymethylfurfural oxidase fromMethylovorussp. strain MP688[J]. Applied Environmental Microbiology, 2014, 80(3):1082-1090.
[10] GE X, WANG W, HAN Y, et al.Methylovorussp. MP688 exopolysaccharides contribute to oxidative defense and bacterial survival under adverse condition[J]. World Journal of Microbiology & Biotechnology, 2013, 29(12):2249-2258.
