四逆酸枣仁汤合方对失眠大鼠海马GABAARα1、γ2及NKCC1的影响
2018-06-25林炳岐马捷刘燕于雪范盎然张炜悦戴宁张蔚刘梦温佳雨李峰北京中医药大学中医学院中医诊断系北京100029
林炳岐,马捷,刘燕,于雪,范盎然,张炜悦,戴宁,张蔚,刘梦,温佳雨,李峰(北京中医药大学 中医学院-中医诊断系,北京 100029)
失眠症是临床常见疾病,失眠症是以频繁且持续的入睡困难或睡眠维持困难,并导致睡眠满意度不足为特征的睡眠障碍[1]。由于现代社会的特点,人们的工作压力增大,生活节奏加快,导致睡眠不规律,失眠的人数呈不断的上升趋势,尤其脑力劳动者最为严重。有学者研究发现,导致失眠的病因很多,但是由于现代社会人们心理负担的加重,情志因素已经成为失眠的主要原因[2]。同时,在临床的实践和文献分析中,很多学者发现失眠的病位在心,但是和肝脏的影响密切相关[3]。人的正常睡眠和海马中的γ-氨基丁酸(gamma-aminobutyric acid,GABA)能神经系统密切相关,它是存在于中枢神经系统中的抑制性神经递质,能够抑制神经系统,具有保护神经的作用,能够起到催眠、镇静和抗焦虑等功能[4]。GABA所起到的神经保护作用是通过结合其A受体来完成的,A受体中以GABAARα1和GABAARγ2型受体最多,也是GABAA受体重要的功能基团。这些受体都含有配体门控氯离子通道蛋白,在Na+-K+-Cl-协同转运蛋白1(NKCC1)的作用下,使Cl-快速内流,聚集于神经元内,当GABAA受体被激活时产生神经元的抑制保护作用。四逆散和酸枣仁汤是从肝论治失眠的经典方剂,具有疏肝解郁、养血安神的作用。本实验观察四逆酸枣仁汤合方对失眠大鼠GABA能传导系统中GABAARα1、GABAARγ2和NKCC1的影响,探讨四逆酸枣仁汤合方在GABA能传导系统中的作用。
1 实验材料
1.1 实验动物
本研究选用清洁级SD健康雄性大鼠90只,体质量180~200 g。动物购自北京斯贝福生物技术有限公司,许可证编号为SCXX(京)2016-0002。大鼠饲养于清洁级动物房,40 W日光灯照射,光照节律为12 h(06:00—18:00);室内温度为(23±1)℃,相对湿度为30%~40%;正常大鼠饲料喂养,自由饮水。
1.2 药物
四逆散:柴胡6 g,白芍6 g,枳实6 g,炙甘草6 g;酸枣仁汤:酸枣仁15 g,川芎9 g,知母9 g,茯苓9 g,炙甘草3 g;四逆酸枣仁汤合方:酸枣仁15 g,川芎9 g,知母9 g,茯苓9 g,炙甘草9 g,柴胡6 g,白芍6 g,枳实6 g。以上生药均由北京同仁堂医药有限责任公司提供,并由北京创立有限责任公司加工成浸膏备用,出膏率分别为:18.3%、17.6%、18.1%,4℃保存。艾司唑仑:1盒,常温保存,备用,购自中日友好医院。
1.3 主要试剂和仪器
对氯苯丙氨酸(PCPA)(Sigma,美国);戊巴比妥钠(Sigma,美国);BCA蛋白浓度测定试剂盒(索莱宝生物科技有限公司);兔抗GAPDH(Protein tech,美国),兔抗GABAARα1(Protein tech,美国),兔抗GABAARγ2(Protein tech,美国),NKCC1(Protein tech,美国),兔二抗(中山金桥);Reveraid First Strand cDNA Synthesis Kit(Thermo,美国),PCR Master Mix(Thermo,美国),PCR引物合成(上海生工公司);酶标仪Multiskan GO(Thermo,美国);电泳槽(Bio-RAD,美国),电转槽(Bio-RAD,美国);Alpha Innotech凝胶成像仪(FLUORCHEM,美国);CFX96 PCR检测仪(Bio-RAD,美国),PCR扩增仪(Bio-RAD,美国),Gene Amp PCR System 9700(Applied Biosystems,美国)。
2 实验方法
2.1 失眠模型复制
大鼠适应性喂养7天,自由进食、进水,保持垫料干燥,7 d后称体质量编号,随机分为正常组(15只)和造模组(75只),造模组腹腔注射PCPA混悬液[5-6]。PCPA用量按400 mg/10 mL/kg,用弱碱性生理盐水配置成混悬液备用,正常组腹腔注射等体积的弱碱性生理盐水,于每日8:00—8:30进行,两组连续注射2 d。第1次腹腔注射36 h后,造模组大鼠出现昼夜节律缺失,白天与夜晚活动不断,易激惹,整体观察和正常组不同,提示造模成功。将复制成功的模型大鼠随机分为模型组、西药组、四逆散组、酸枣仁汤组、合方组,并设置空白对照正常组。
2.2 实验动物分组和给药
正常组:连续7 d生理盐水灌胃;失眠模型复制成功的大鼠75只,按随机数字表法分成以下5组,每组15只。模型组:连续7 d生理盐水灌胃;西药组:连续7 d艾司唑仑灌胃;四逆散组:连续7 d四逆散浸膏灌胃;酸枣仁汤组:连续7 d酸枣仁汤浸膏灌胃;四逆酸枣仁汤合方组(以下简称:合方组):连续7 d四逆酸枣仁汤合方浸膏灌胃。各用药组根据中药浸膏的出膏率和大鼠给药体表面积公式计算出各组大鼠给药量。
2.3 观察指标
2.3.1 一般状态
观察大鼠的活动状态、精神状态、皮毛颜色、进食量、饮水量和对外界刺激的反应等。
2.3.2 体质量变化
记录各组大鼠的每天体质量,观察各组大鼠每天体质量的变化。
2.4 检测指标
2.4.1 取材
给药结束后第2天,大鼠戊巴比妥钠腹腔注射麻醉,腹主动脉取血、断头,冰上快速剥离大鼠海马,置于液氮中快速冷冻,再转移到-80℃冰箱冷冻保存待测,每组随机选取5只海马进行RCR检测,随机选取6只海马进行Western Blot检测。
2.4.2 实时荧光定量PCR
用Trizol破碎各组大鼠海马脑组织,离心取上清,依次加入氯仿、异丙醇等提取总RNA;根据总RNA浓度和反转录试剂盒逆转录成cDNA,反应条件为:退火25 ℃,5 min,延伸42 ℃,60 min,失活79 ℃,5 min;GABAARα1mRNA上游引物:5′-AGCTATACCCCTAACTTAGCCAGG-3′,下游引物:5′-AGAAAGCGATTCTCAGTGCAGAGG-3′;GABAARγ2mRNA上游引物:5′-CTTCTTCGGATGTTTTCCTTCAGG-3′,下游引物:5′-CATAGGGTATTAGATCGTTGGACT-3′;NKCC1mRNA:上游引物:5′-TTACTACCTGCGCACCTTCG-3′,下游引物:5′-TCCAGCTCATCGTGGAACTC-3′;β-actin上游引物:5′-CCCATCTATGAGGGTTACGC-3′,下游引物:5′-TTTAATGTCACGCACGATTTC-3′。PCR扩增反应条件:95 ℃ 30 s;95 ℃ 10 s~60 ℃ 30 s扩增40个循环。反应结束后,读取PCR软件内循环阈值(CT值),采用ΔΔCT法处理结果,以β-actin 为内参,计算GABAARα1、GABAARγ2和NKCC1的相对表达量,以2-ΔΔCT表示。
2.4.3 Western Blot
用ripa裂解液提取大鼠海马脑组织蛋白,采用BCA试剂盒测定总蛋白浓度,根据总蛋白浓度配平,使各样本蛋白等量,取40 μg蛋白样品,电泳分离,再电转到PVDF膜上,0.5%的脱脂奶粉封闭1h后,分别加入一抗GABAARα(1∶2 000)、GABAARγ2(1∶2 000)、NKCC1(1∶2 000),GAPDH(1∶50 000),4 ℃孵育过夜,经TBST洗膜后加入二抗,室温孵育1 h,经TBST洗膜后加入ECL试剂盒A、B混合液(1∶1),然后曝光、显影、定影,扫描胶片,用软件处理系统分析目标条带的光密度值。
2.5 统计学处理

3 实验结果
3.1 一般状态观察
正常组的大鼠精神状态良好,活动灵敏,毛发有光泽,体质量明显增加。模型组的大鼠精神亢奋,易激惹,毛发干枯、无光泽,饮水量明显增加,消瘦。西药组和各中药组的大鼠精神状态、活动情况与模型组相比有所改观。
3.2 体质量变化
实验结束后,各组大鼠体质量增量有非常显著性差异(P<0.01),和正常组相比,模型组体质量增量非常显著性降低(P<0.01);和模型组相比,西药组、酸枣仁汤组、合方组非常显著性升高(P<0.01);和西药组相比,酸枣仁汤组、合方组无统计学差异(P>0.05)。结果表明酸枣仁汤组、合方组均可增加大鼠的体质量,见表1。
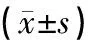
表1 大鼠体质量增量变化
注:与正常组相比,##P<0.01;与模型组相比,**P<0.01
3.3 失眠大鼠海马脑组织中GABAARα1mRNA、GABAARγ2 mRNA和NKCC1 mRNA的表达
实时荧光定量PCR结果显示:各组大鼠GABAARα1mRNA的表达有显著性差异(P<0.05),和正常组相比,模型组表达显著性下降(P<0.05);和模型组相比,西药组、酸枣仁汤组表达显著性上升(P<0.05),合方组GABAARα1mRNA表达非常显著性上升(P<0.01);和西药组相比,酸枣仁汤组、合方组无显著性差异(P>0.05)。各组大鼠GABAARγ2mRNA的表达没有显著性差异(P>0.05),但模型组表达显示出明显降低趋势,且各用药组都有提高其表达的趋势。各组大鼠NKCC1mRNA的表达没有显著性差异(P>0.05),但模型组表达显示出明显升高趋势,且各用药组都有降低其表达的趋势,见表2。

表2 大鼠海马GABAARα1mRNA、GABAARγ2mRNA、NKCC1mRNA表达变化
注:与正常组相比,#P<0.05;与模型组相比,*P<0.05,**P<0.01
3.4 失眠大鼠海马脑组织中GABAARα1、GABAARγ2和NKCC1蛋白的表达
Western Blot结果显示:各组大鼠GABAARα1有非常显著性差异(P<0.01),和正常组相比,模型组表达非常显著性下降(P<0.01);和模型组相比,西药组显著性升高(P<0.05),酸枣仁汤组、合方组非常显著性升高(P<0.01);和西药组相比,四逆散组、酸枣仁汤组、合方组无显著性差异(P>0.05)。各组大鼠GABAARγ2有非常显著性差异(P<0.01),和正常组相比,模型组表达非常显著性下降(P<0.01);和模型组相比,西药组、四逆散组显著性升高(P<0.05),合方组非常显著性升高(P<0.01);和西药组相比,四逆散组、酸枣仁汤组、合方组无显著性差异(P>0.05)。各组大鼠NKCC1有非常显著性差异(P<0.01),和正常组相比,模型组表达非常显著性上升(P<0.01);和模型组相比,西药组、四逆散组、酸枣仁汤组、合方组非常显著性下降(P<0.01);和西药组相比,四逆散组、合方组无显著性差异(P>0.05),见表3,电泳图见图1。

表3 大鼠海马GABAARα1、GABAARγ2、NKCC1蛋白的表达变化
注:与正常组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01
4 讨论
失眠是临床上一种常见的疾病,由于现在的时代特点和人们不规律的生活方式,失眠的人数也越来越多。有关失眠的发生机制,有两种比较公认的假说,一种是神经生物学层面的“过度觉醒假说”[7],另一种是认知行为学方面的“3P假说”[8-9]。而这两种机制的发生和海马脑组织中的GABA能神经系统有一定的关系,GABA是脑中重要的抑制性神经递质,一直被认为和睡眠密切相关,它通过和GABAA受体结合而发挥抑制性神经保护作用。GABAA受体是由2个α、2个β和1个γ组成的五聚体大分子[10],在这些受体中, GABAARα1和GABAARγ2是数量最多的受体,也是反应睡眠的最重要的功能基团,这些受体上的门控氯离子通道蛋白开放导致Cl-内流或者外流,从而发生抑制或者兴奋作用。在成熟的神经细胞中,胞膜内Cl-的浓度受到NKCC1的影响,若NKCC1表达量升高时,胞内出现高Cl-状态,当GABAA受体被激活,Cl-通道开放,Cl-外流,胞膜去极化,产生神经兴奋性作用;若NKCC1表达量下降时,胞内出现低Cl-状态,当GABAA受体被激活,Cl-通道开放,Cl-以内流,胞膜超极化,产生神经抑制性作用[11]。有研究发现[12],失眠通过不同强度的电针刺激能够上调GABAARα1的表达而起到治疗作用。也有研究发现酸枣仁-五味子药对醇水双提物能够提高GABAARα1和GABAARγ2的表达而达到失眠的治疗效果[13]。因此,本实验选取GABAARα1、GABAARγ2和NKCC1作为反应失眠机制的观察指标。

图1 各组大鼠海马GABAARα1、GABAARγ2、NKCC1蛋白的表达注:A.正常组;B.模型组;C.西药组;D.四逆散组;E.酸枣仁汤组;F.合方组
失眠中医又称为“不寐”“不得眠”“卧不安”等,中医认为失眠的病位在心,但是睡眠的发生也依赖于肝的正常生理功能,肝主疏泄和藏血功能正常,则人卧魂归于肝,神志安静,睡眠安稳;若由于各种情志因素导致肝的疏泄和藏血功能异常,就会出现失眠,正如《普济本事方·独活汤》云:“平人肝不受邪,故卧则魂归于肝,神静而得寐。今肝有邪,魂不得归,是以卧则魂扬若离体也。”治疗上我们选用四逆散和酸枣仁汤合方,二方出自《金匮要略》,是疏肝气、养肝血的经典方剂,二方合用可以恢复肝的正常生理功能,使睡眠正常。
本次实验中通过观察各组大鼠的一般状态,发现正常组的大鼠精神状态良好,活动灵敏,毛发有光泽,体质量明显增加。模型组的大鼠精神亢奋,易激惹,毛发干枯、无光泽,饮水量明显增加,消瘦。西药组和各中药组的大鼠精神状态和活动情况和模型组相比有所改善,体质量增量也有所增加。
Western Blot的实验结果显示:失眠大鼠和正常大鼠相比,海马中GABAARα1和GABAARγ2的表达明显降低,经过西药和各中药治疗,西药、合方能够有效升高失眠大鼠海马中GABAARα1和GABAARγ2的表达量,而四逆散能有效升高大鼠海马中GABAARγ2表达量,酸枣仁汤能够有效升高大鼠海马中GABAARα1的表达量。NKCC1的结果显示:失眠大鼠和正常大鼠相比,海马中NKCC1的表达明显升高,经过西药和各中药治疗,都能够有效降低大鼠海马中NKCC1的表达量,并且四逆散、合方和西药治疗效果无差异。实时荧光定量PCR的实验结果中显示:失眠大鼠和正常大鼠相比,GABAARα1mRNA表达明显下降,西药、酸枣仁汤、合方能够有效提高GABAARα1mRNA的表达,酸枣仁汤、合方和西药效果无差异;各组大鼠海马中的GABAARγ2mRNA和NKCC1mRNA表达虽然没有统计学差异,但是模型组GABAARγ2mRNA的表达有明显下降趋势,NKCC1mRNA表达有明显上升趋势,且各用药组都有升高GABAARγ2mRNA、降低NKCC1mRNA表达的趋势。两种实验说明,失眠大鼠海马中GABAARα1和GABAARγ2的蛋白和mRNA表达都降低,而NKCC1的蛋白和mRNA升高,经过药物治疗,西药和各组中药能够有效地升高GABAARα1和GABAARγ2蛋白和mRNA的表达,同时降低NKCC1蛋白和mRNA的表达,从而起到治疗作用,并且合方组治疗效果更全面。
综上所述,本实验观察到,四逆酸枣仁汤合方能够有效地改善失眠大鼠的睡眠节律,并且可能是通过上调大鼠海马中GABAARα1和GABAARγ2,降低NKCC1而发挥治疗作用。
[1] 中华医学会神经病学分会睡眠障碍学组.中国成人失眠诊断与治疗指南[J].中华神经科杂志,2012,45(7):534-540.
[2] 贾玉,贾跃进,郑晓琳.中医对失眠认识的探讨及展望[J].中华中医药杂志,2015,30(1):163-166.
[3] 马捷,李峰,宋月晗,等. 从肝论治失眠的文献研究[J]. 中华中医药杂志,2012,27(4):1076-1080.
[4] 蒋洁,赵百孝,哈略,等.不同波形电针对 PCPA 致失眠大鼠下丘脑5-HT和Glu、GABA含量的影响[J].上海针灸杂志,2015,34(7):678-681.
[5] Adrien J, Laguzzi R, Bourgoin S, et al, Sleep in the rate raphe lesion: pharmacologic of the systeme serotoninergique [J] . Waking and Sleeping,1980(4):80-85.
[6] 肖成荣,马增春,李海静,等. PCPA失眠大鼠模型的制作及其机制[J].毒理学杂志,2007,21(4):326.
[7] Riemann D, Spiegelhalder K, Feige B, et al. The hyperarousal model of insomnia: a review of the concept and its evidence[J]. Sleep Med Rev, 2010,14:19-31.
[8] Levenson JC, Kay DB, Buysse DJ. The pathophysiology of insomnia[J].Chest,2015(147):1179-1792.
[9] Laura Palagini, Knut Biber, Dieter Riemann.The genetics of insomniae Evidence for epigenetic mechanisms?[J]. Sleep Medicine Reviews,2014,18:225-235.
[10] 刘祖丽,唐成林,余敏,等.不同强度电针对PCPA失眠大鼠下丘脑γ-氨基丁酸及受体的影响[J].生命科学研究,2011,15(3):236-240.
[11] Kristopher T. The role and the mechanism of γ-aminobutyric acid during central nervous system development[J]. Neurosci Bull, 2008,24(3):195-200.
[12] 赵小明,张健.不同强度电针治疗对氯苯丙氨酸失眠大鼠模型的相关机制[J].医疗卫生装备,2016,37(5):13-16.
[13] 高家荣,季文博,姜辉,等.酸枣仁-五味子药对醇水双提物对PCPA致失眠大鼠氨基酸类神经递质的影响[J].中药材,2013,36(10):1635-1639.
