氮添加对贝加尔针茅草原土壤线虫群落特征的影响
2018-06-23张爱林赵建宁刘红梅张乃芹杨殿林
张爱林,赵建宁,刘红梅,洪 杰,张乃芹,杨殿林,*
1 沈阳农业大学园艺学院,沈阳 110866 2 农业部环境保护科研监测所,天津 300191 3 内蒙古鄂温克旗草原工作站,巴彦托海 021100 4 德州学院生态与园林建筑学院,德州 253023
大气氮沉降增加作为全球环境变化的重要现象之一,其所带来的一系列生态问题日趋严重,影响陆地生态系统结构和功能[1- 3]。氮素是草原生态系统的主要限制性养分之一,氮素添加会提高草原生态系统地上植物的初级生产力。生活在地下土壤生态系统中的土壤动物,对氮添加如何响应常常被忽略。近年来,越来越多的研究关注氮沉降增加在不同的生态系统中对地下土壤动物群落结构和组成的直接影响[4- 5]。
土壤线虫作为土壤动物中十分重要的类群之一,是土壤中最丰富的后生动物,由于土壤线虫是普遍存在的并在土壤腐屑食物网中占有重要位置,对外界环境变化反应迅速,因此土壤线虫被看作是生态系统变化的敏感性指示生物[6- 7]。以往有关线虫的研究主要集中于植物病原线虫的防控方面,当今生态学关注的重点则倾向于土壤线虫在生态环境中的作用。例如,土壤线虫与其他营养级生物的关系研究——土壤线虫与植物、大型草食动物、昆虫、土壤动物、微生物的相互作用关系;一些环境气候因子作用下土壤线虫的响应特点,例如,盐离子浓度的升高、梯度降水、增温、施肥等这些非生物因素与土壤线虫关系的研究也一直是近些年研究的热点[8]。在不同的草地类型和管理方式下,土壤线虫的丰度、营养类型和生态指标等也存在较大差异[9- 10]。有研究表明,由全球气候变化引起的温度、CO2浓度、降水、土壤氮含量等环境条件的改变都会对土壤线虫产生不同程度的影响[11- 13]。
贝加尔针茅(Stipabaicalensis)是中国温性草甸草原的代表类型之一,是开展草原生态系统对全球变化响应研究的理想试验平台。研究氮沉降对内蒙古贝加尔针茅草原土壤线虫群落变化,对于制定科学的草地生态系统管理对策,实现天然草地的可持续发展具有重要的理论和实践意义。
1 材料与方法
1.1 试验样地概况
研究区域位于内蒙古大兴安岭西麓鄂温克旗境内。在地带性植被贝加尔针茅草原典型地带(119°42′E, 48°30′N),半干旱大陆性季风气候,海拔高度760 m,年均气温-1.6 ℃,年降水量328.7 mm,土壤类型为暗栗钙土。植被类型为贝加尔针茅草甸草原,建群种贝加尔针茅在群落中占绝对优势,羊草(Leymuschinensis)为优势种,变蒿(Artemisiacommutata)、寸草苔(Carexduriuscula)、日荫菅(Carexpediformis)、扁蓿豆(Pocockiaruthenica)、祁洲漏芦(Rhaponticuuniflorum)、草地麻花头(Serratulayamatsutanna)、肾叶唐松草(Thaictrumpetaloideum)、多茎野豌豆(Viciamulticaulis)等为常见伴生种,共有植物66种,分属21科49属。
选择地势平坦、植被典型的地段设置试验样地,试验地用围栏保护。试验样地自2010年6月开展长期氮素添加试验。试验施氮素处理强度和频度参考国际上同类研究的处理方法,设置氮素添加水平为 0、15、30、50、100、150、200、300 kg N hm-2a-1,4次重复,小区面积8 m×8 m=64 m2,氮肥为NH4NO3。小区之间间隔2 m,重复间距设5 m隔离带。于每年6月中旬和7月中旬分两次施肥,每次施肥将每个小区内所需要的氮素(NH4NO3)溶于8 L水中,水溶后均匀喷洒到小区内,CK小区同时喷洒相当量的水。
1.2 样品采集与处理
于8月中旬,在不同处理小区内用直径为5 cm的土钻,根据“随机”、“等量”和“多点混合”的原则按照S型取样法各选取10个点,取样深度为0—10 cm和10—20 cm两层。将采集的土壤样品装入自封袋后放置于4 ℃冰箱保存。
1.3 分析方法
将 4 ℃保存的新鲜样品48 h内进行线虫分离并计数鉴定。从采取的新鲜土样中取50 g利用改良的浅盘法[14]对土壤线虫进行分离试验。分离后加入固定液(8%福尔马林、2%甘油和2—3滴冰醋酸)保存,并进行计数和到属水平的鉴定,计算每100 g干土中含有线虫的条数。鉴定采用形态学鉴定[15],鉴定参照Bongers的分类图和尹文英《中国土壤动物检索图鉴》。
根据线虫头部形态学特征和取食生境将土壤线虫分为不同功能营养类群,食细菌类群(Bacterivores)、食真菌类群(Fungivores)、植物寄生类群(Plantparasites)、捕食类群/杂食类群(Predators/Omnivores)[16],根据生态演替中属于k-选择和r-选择科属划分线虫的c-p类群[17]。
土壤理化性质的测定主要根据鲁如坤的《土壤农业化学分析方法》(1999)测定。
1.4 数据处理与分析
根据不同类群的多度,划分不同类群的优势度,个体数占总捕获量10%以上者为极优势类群(+++++),5%—10%为优势类群(++++),2%—5%为次优势类群(+++),1%—2%为常见类群(++),1%以下为稀有类群(+)。并通过自由生活线虫的成熟度指数(MI)、通路指数(NCR)、瓦斯乐思卡指数(WI)等指数,来指示土壤线虫群落功能结构特征[16]。公式如下:
MI指数:
MI= ∑v(i)·f(i)
式中v(i)是在生态演替中属于k-选择和r-选择科属分别赋予c-p值,f(i)是自由生活线虫科/属在线虫种群中所占的比重。是被用来描述土壤稳定程度的衡量指标,即土壤受外界活动扰动程度的大小。其值越小,其表示土壤受到外界活动的干扰越大,相反,其值越大,则其表示土壤相对比较稳定。
NCR指数:
NCR=B(B+F)
式中B和F分别为食细菌线虫和食真菌线虫所占线虫总数的相对多度。是间接评价土壤有机物分解主导途径的指标,临界值为0.75,若该值大于0.75,其表明土壤有机质的分解途径主要以细菌通道为主,若通道指数小于0.75,则表明土壤有机质的分解途径主要以真菌通道为主。
WI指数:
WI= (BF+FF)/PP
PP是植食性线虫数量,FF是食真菌线虫数量,BF是食细菌线虫数量。WI是间接描述土壤矿化途径的主要承担者是植食性线虫还是自由生活的食微线虫(食细菌食、真菌线虫),若该值大于 1,值越大表示其土壤健康状况越好,植物受线虫感染的几率越小,土壤矿化途径的承担着是食微线虫;当该值小于 1,值越小表示土壤健康状况越差,也间接表明该区域植物受线虫感染几率较大。
根据丰富度指数(SR)、Shannon-Wiener多样性指数(H′)、均匀度指数(J′)等研究土壤线虫的多样性和稳定性[16]。公式如下:
SR指数:
SR=(S-1)/lnN
S:鉴定分类单元的数目,N:鉴定的线虫个体数目。H′指数:
H′ = -∑pi(lnpi)
pi:某一给定的分类单元可以看作是第i个分类单元,pi为第i个分类单元中个体所占的比例。
J′指数:
J′=H′/ln(S)
S:鉴定分类单元的数。
利用SPSS 17.0和Origin 9.1对数据进行分析。
2 结果与分析
2.1 氮添加对水平草原土壤线虫相对密度和优势度的影响
研究期间在所有处理中共鉴定出土壤线虫52个属,22579条,其中食细菌类群线虫16属,食真菌类群线虫8属,植物寄生类群线虫16属,捕食类群/杂食类群线虫12属。在0—10 cm土壤中,土壤线虫平均密度为1016条/100 g干土,线虫分布33属,优势类群为螺旋属(Helicotylenchus)和丽突属(Acrobeles);在10—20 cm土壤中,土壤线虫平均密度480条/100 g干土,线虫种类26属,优势类群为螺旋属(Helicotylenchus)和真滑刃属(Aphelenchus),表明土壤线虫具有明显的表聚现象。
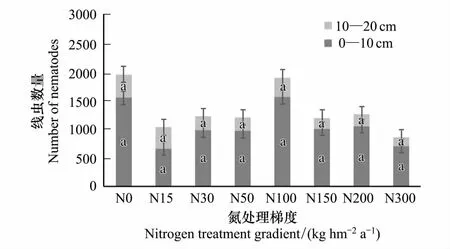
图1 不同施氮梯度下土壤线虫多度的变化 Fig.1 Change of soil nematode abundance in different nitrogen gradient
在施氮条件下,土壤线虫的相对密度均有降低趋势,但变化不显著(图1),在N100时相对密度最高,表明施氮对土壤线虫密度的影响不显著。随施氮浓度的增加,土壤线虫优势物种的数量显著增加。由于土壤线虫总密度变化并不显著,随着优势物种个体数量的增加,样地中伴生物种逐渐减少(表1)。
2.2氮素添加水平草原土壤线虫群落营养类群构成及空间分布的影响
在表层0—10 cm土壤中,食细菌类群线虫数量最多,占总数的41.2%—54.5%,捕食类群/杂食类群线虫数量最少,占总数的10%以下,食真菌类群线虫和植物寄生类群线虫数量相似,占总数的17.6%—27%;在10—20 cm土壤中,食细菌类群线虫占总数的25.5%—45.9%,食真菌类群线虫和植物寄生类群线虫占总数的24.6%—36.4%,捕食类群/杂食类群线虫的数量变化不大,和上层土壤所占百分比相近。随着施氮浓度的升高,在表层0—10 cm土壤中,食细菌类群线虫和捕食类群/杂食类群线虫的数量随施氮水平的升高显著下降(P<0.05),施氮和线虫数量之间有显著的线性关系;杂食性线虫的下降趋势更剧烈,食真菌类线虫随施氮浓度的变化波动变化,并在N50时出现峰值;植物寄生类群线虫随施氮浓度的增加无显著变化(表2,图2)。在10—20 cm土壤中,食细菌类群线虫在低氮区随施氮浓度的升高显著增加(P<0.05),在N50时达到峰值;捕食类群/杂食类群线虫的变化趋势与食细菌类群线虫相反,在低氮区随施氮浓度的增加线虫数量显著下降(P<0.05),在N50后随施氮浓度增加而降低;食真菌类群线虫和植物寄生类群线虫随施氮浓度的增加变化无显著变化(表2,图2)。施氮对食细菌类群线虫和捕食类群/杂食类群线虫的影响较为显著,而食真菌类群线虫和植物寄生类群线虫的变化较为稳定。
2.3 氮素添加水平草原土壤线虫生态指数及c-p类群分布的影响
土壤线虫的丰富度指数、多样性指数和均匀度指数在
在样地土壤中,线虫c-p2类群占优势约占总数的40%—70.1%,c-p4类群和c-p5类群共占总数的6.2%—24.4%即土壤中线虫以生活史更倾向于r对策者的占主体地位,而生活史更倾向于k对策者的数量较少。随着施氮浓度的增加,样地土壤中c-p2类群都显著增加,和氮梯度间成线性增长趋势,而c-p4类群和c-p5类群显著减少,和氮梯度间有线性下降的趋势,表层土壤中c-p4类群和c-p5类群比下层土壤下降趋势更显著,说明施氮增加了土壤环境的改变,使土壤中短世代型线虫增加而长世代型线虫减少,且在相同施氮条件下,上层土壤比下层土壤的环境改变更大,随着土壤环境的变化线虫的生长周期在缩短,世代交替在加快(图4)。
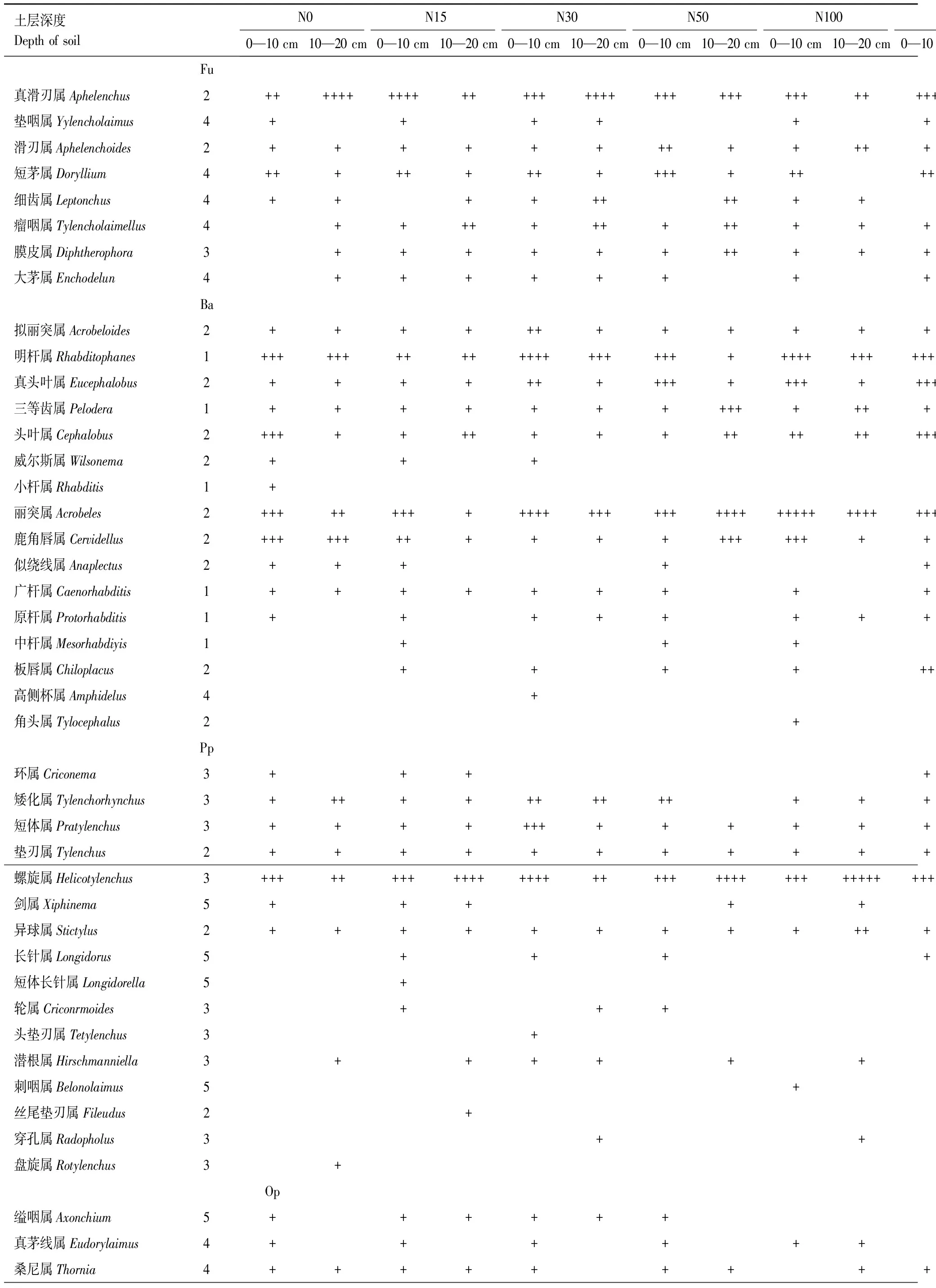
表1 在不同氮处理梯度下土壤线虫的优势度
N0表示空白,N 15表示 15 kg N hm-2a-1,N 30表示 30 kg N hm-2a-1,N 50表示50 kg N hm-2a-1,N 100表示100 kg N hm-2a-1,N 150表示150 kg N hm-2a-1,N 200表示200 kg N hm-2a-1,N 300表示300 kg N hm-2a-1;Fu:食真菌类群Fungivores,Ba:食细菌类群Bacterivores,Pp:植物寄生类群Plantparasites,Op:捕食类群/杂食类群Predators/Omnivores;10%以上者为极优势类群 (+++++),5%—10%为优势类群(++++),2%—5%为次优势类群(+++),1%—2%为常见类群(++),1%以下为稀有类群(+)
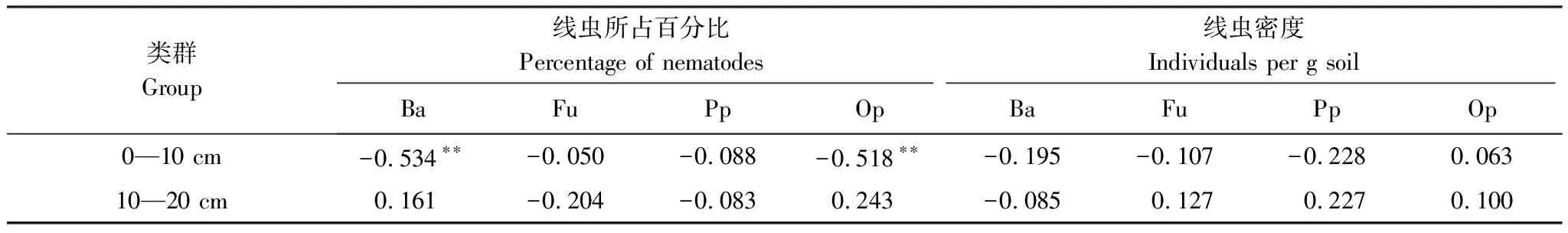
表2 线虫营养类群与施氮水平的相关关系
**,*分别代表P< 0.001和P< 0.05
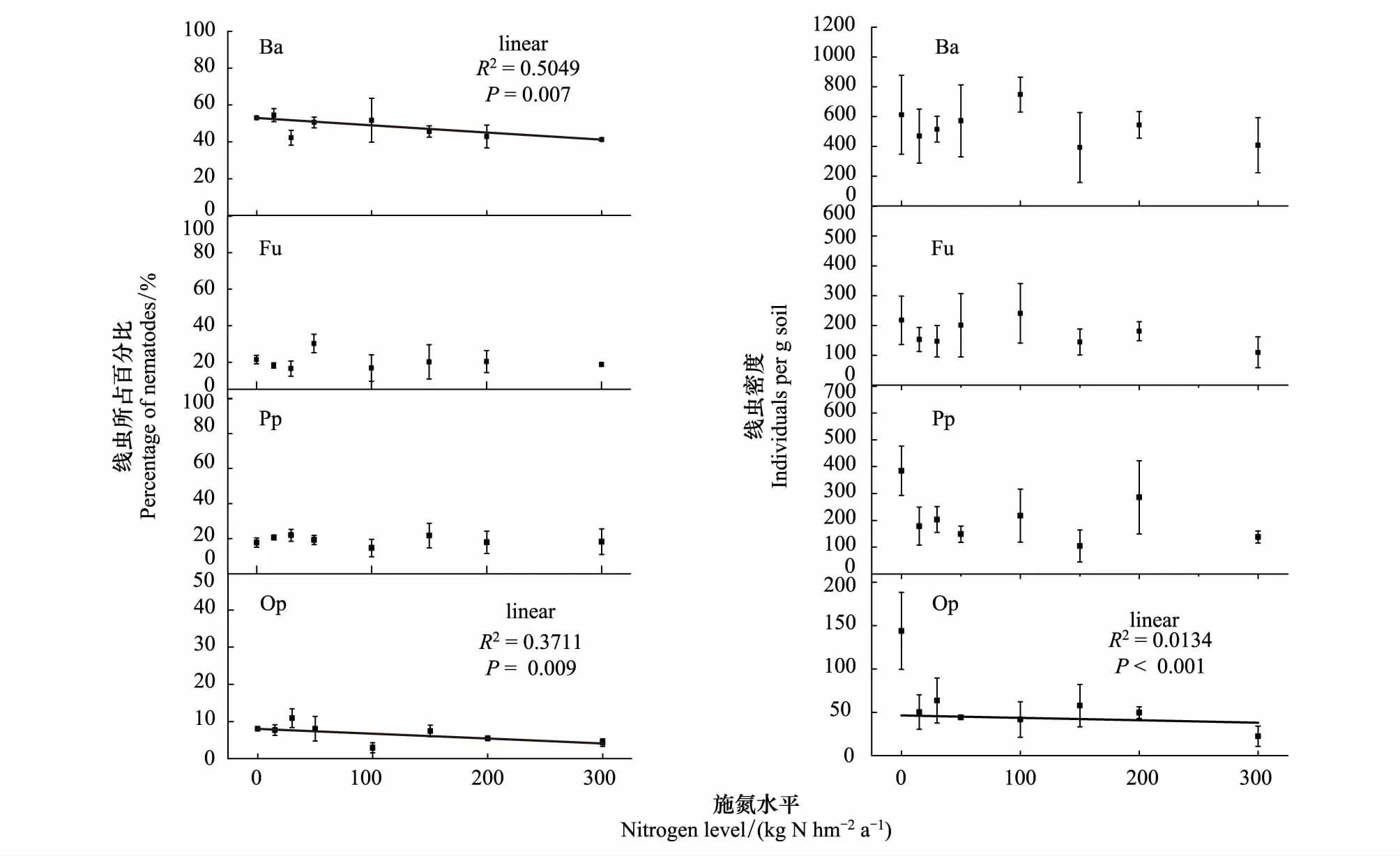
图2 不同施氮水平下0—10 cm土壤线虫营养类群的变化 Fig.2 Changes of nematode nutritional groups at 0—10 cm different nitrogen levels
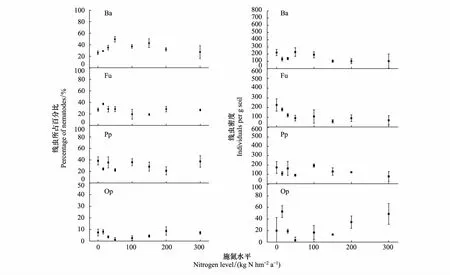
图3 不同施氮水平下10—20 cm线虫营养类群的变化 Fig.3 Changes of nematode utritional groups at 10—20 cm different nitrogen levels
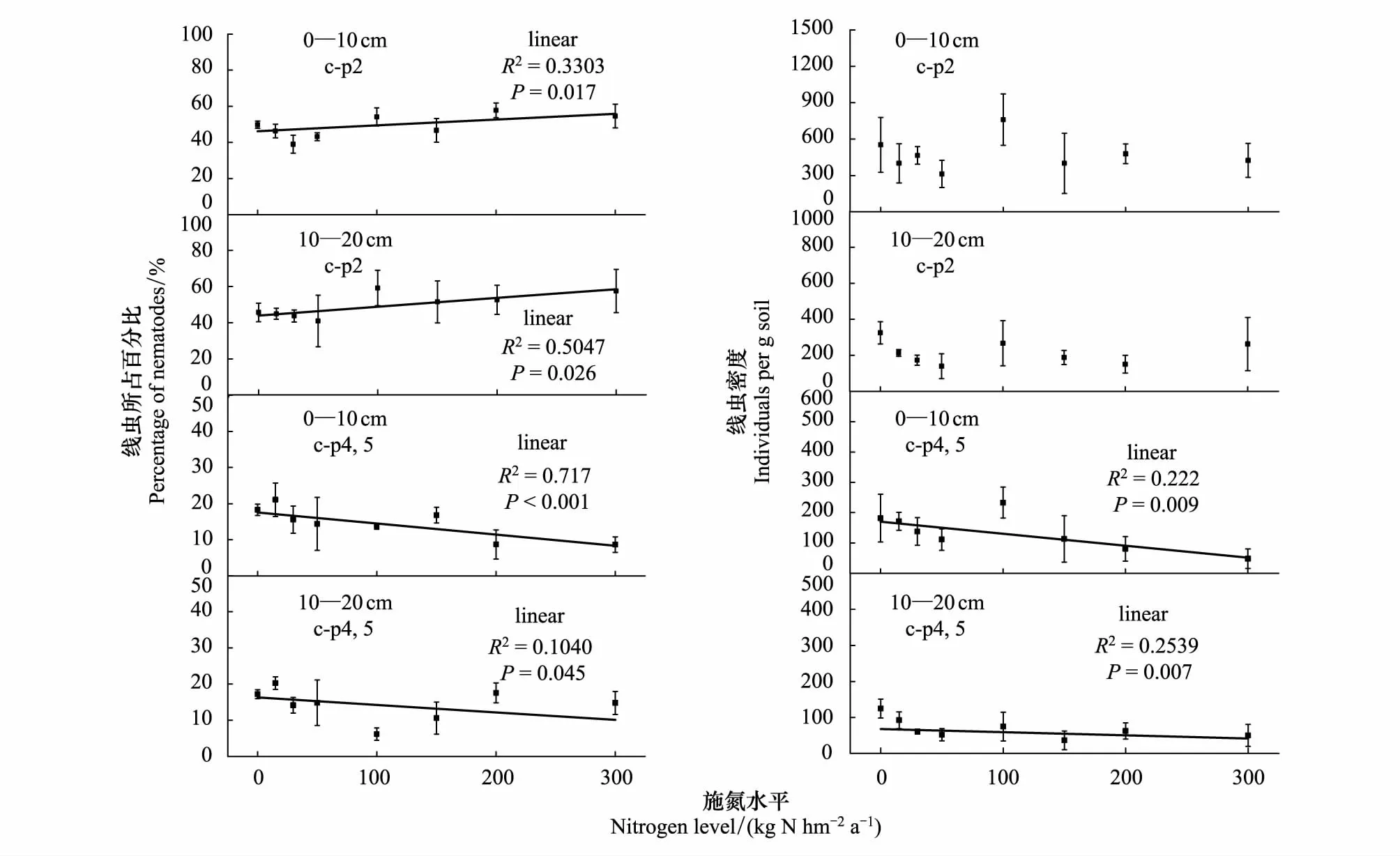
图4 不同施氮水平下土壤线虫c-p值的变化Fig.4 Changes of c-p values of soil nematodes under different nitrogen application levels
2.4 草原土壤线虫群落与土壤理化因子的关系
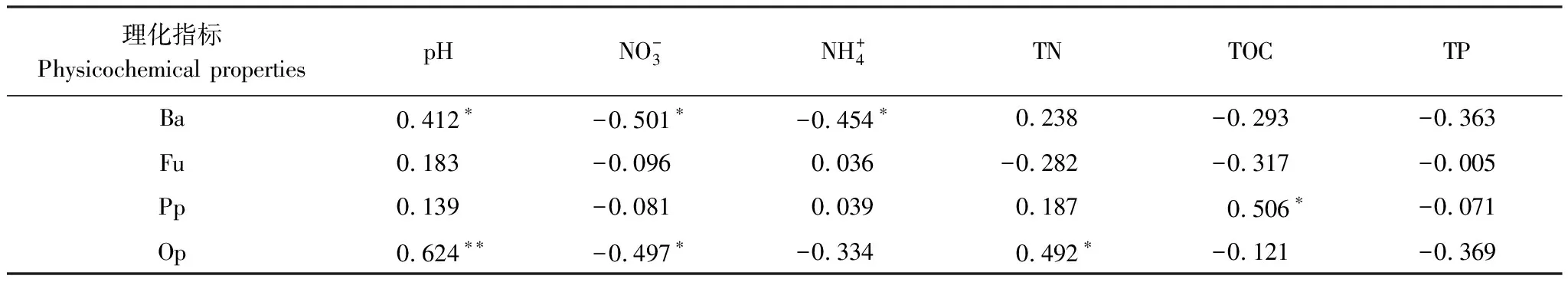
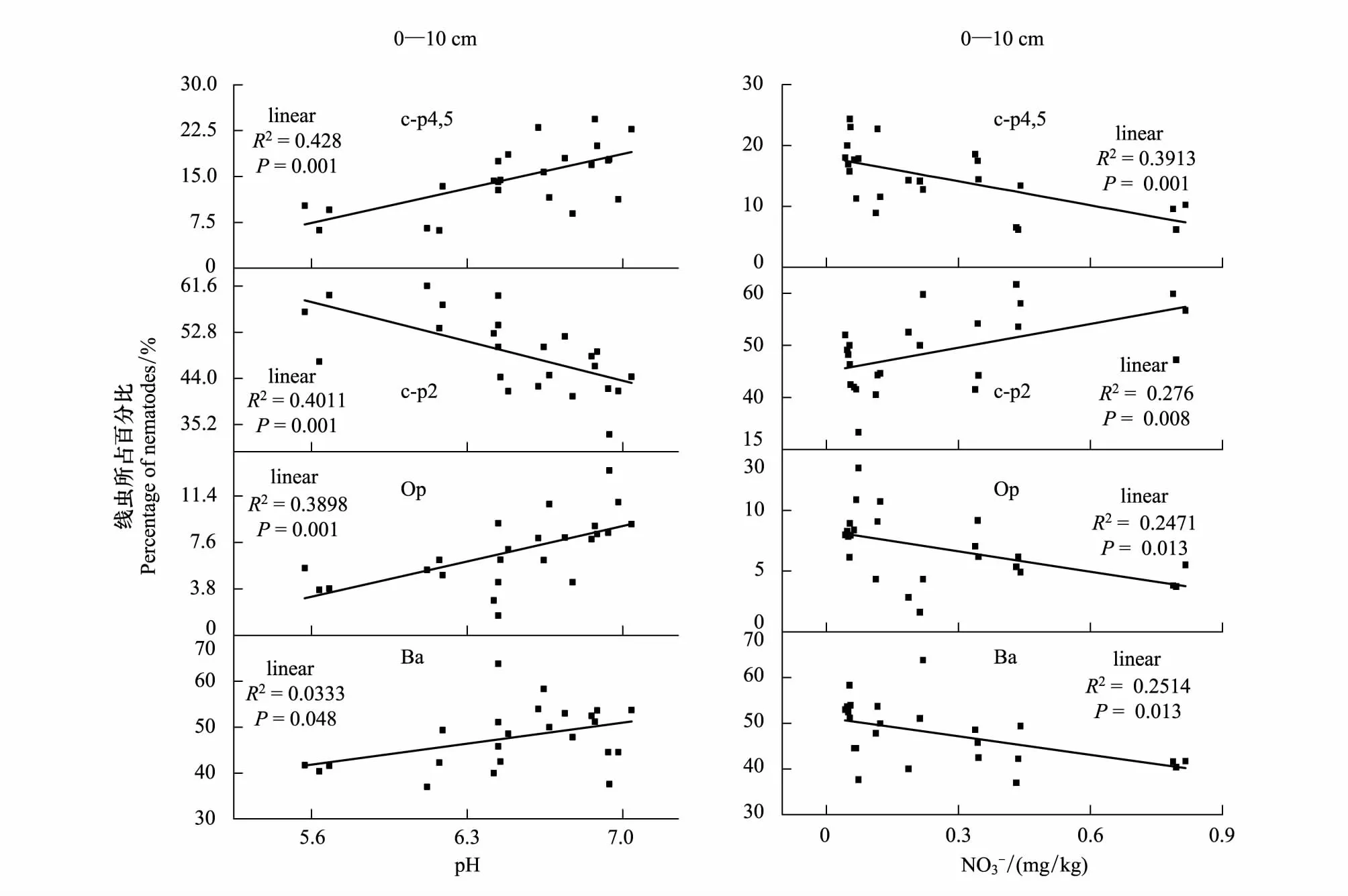
随着施氮水平的增加,土壤pH值显著降低,土壤逐渐酸化。在样地土壤中,土壤线虫的营养类群和c-p类群与pH值都存在显著的线性关系;食细菌线虫类群线虫、食真菌线虫类群线虫和捕食类群/杂食类群线虫都随pH值的减小而线性降低;土壤线虫中的优势类群c-p2类群,随pH值的降低线性增加,但c-p4类群和c-p5类群随pH值的降低有明显的下降趋势。施氮通过对土壤环境中pH值的改变,显著改变了线虫的群落结构,对土壤线虫的生长产生了抑制,但环境的剧烈变化也促进了偏r对策者(c-p2)的增长。
在表层0—10 cm土壤中,随施氮水平的增加土壤中硝态氮和铵态氮的含量显著增加,但在10—20 cm的土壤中, 表3 土壤线虫的生态学指标 a,b,c表示多重比较间的差异显著性,不同字母间差异显著,P<0.05 表4 线虫营养类群与环境因子的相关关系 图5 不同施氮水平下土壤线虫与pH值与硝态氮的关系Fig.5 Relationship between soil nematode and pH value and nitrate nitrogen under different nitrogen application levels 大气氮沉降对生态系统的功能和生物多样性的影响日益严重[18],大气氮沉降通过影响植物生长[18- 19],改变种间竞争关系,影响土壤理化性质,减少根系分泌及抑制微生物胞外酶活性等[20]来改变土壤线虫的群落组成和营养类群。在本实验中,土壤线虫具有明显的表聚现象,且不同施氮水平下不同线虫类群在表层0—10 cm土壤和10—20 cm土壤中的变化趋势不同。在表层0—10 cm土壤中食细菌类群和捕食类群/杂食类群线虫和施氮水平直接存在相关性,但在10—20 cm中线虫类群和施氮水平不存在相关性。在土壤中施氮对食真菌类群和植物寄生类群的影响不显著。草原长期施氮会降低土壤中微生物量碳、氮和土壤微生物的活性和多样性[21],所以食细菌类群线虫作为食物链的上一级,随食物来源的减少而降低;捕食类群/杂食类群线虫一般以食微线虫或者植食类线虫为食物来源[16],而实验样地中25.5%—54.5%为食细菌类群线虫,所以当食细菌类群线虫受氮梯度影响显著减少时,捕食类群/杂食类群线虫同样作为食物链的上一级随食物来源的减少而降低。土壤线虫会影响地上植物的生长及群落结构组成[22],而施氮显著增加了草原植物的地上生物量[23],说明地上生物量的变化对线虫的影响较小。在北方草甸草原,水分是植物和微生物生长的主要显著因素[24],在缺水环境下植物生物量下降使食真菌类群和植物寄生类群线虫整体生物量下降,降低了施氮的影响。即施氮可以通过影响土壤环境和食物链中下级生物的生物量,借助能量流通影响土壤中线虫的群落结构。 土壤线虫具有数量庞大、种类丰富的明显特点,因此为了便于观测研究,通常会运用生物统计学的方法计算土壤线虫的相关生态指数。采用土壤线虫研究中常用的群落多样性指数(H′)及均匀度指数(J′)反映线虫群落多样性及均匀度.采用富集指数(EI)、瓦斯乐思卡指数(SI)、通路指数(CI)[8]反映土壤食物网结构、养分富集状况及分解途径信息.采用成熟度指数(MI)[17]反映研究样地受干扰程度[25]。在本实验中,在小于N 30的施氮水平随着氮梯度的增加,在土壤中土壤线虫的丰富度指数、多样性指数和均匀度指数都有所升高但整体变化并不显著,但表层土壤中线虫的丰富度指数和多样性指数明显高于下层,而均匀度指数相反,且土壤中线虫多分布在上层土壤中[26],但少量施氮对线虫群落的稳定性和物种的多样性都有促进作用。土壤中食细菌类群(Bacterivores)线虫的数量最多,但土壤的有机质分解途径以真菌通道为主(通路指数<0.75),且在表层土壤中通路指数更大即细菌分解所占比重更大,同样在表层0—10 cm土壤中优势物种为丽突属(Ba2)和螺旋属(Pp3)在10—20 cm中为真滑刃属(Fu2)和螺旋属(Pp3)(表1)。有研究表明,食真菌线虫会在不同程度上促进真菌对土壤氮矿化的作用[27],本实验施氮处理中土壤线虫的瓦斯乐思卡指数都大于1但差异不显著,说明食真菌线虫对土壤的氮矿化作用受施氮影响较少。 c-p值作为描述线虫群落特征和生活史策略的指数,根据不同的繁殖能力以及对外界干扰的敏感程度划分的,其中 c-p1 类群对于外界的抗压能力最强,繁殖周期最短,c-p5 类群的线虫对于外界干扰最为敏感,且世代周期最长[28]。在本实验获得的线虫中,以c-p类群为优势类群,c-p4和c-p5类群最少,即在实验样地中以偏r对策者为主。随着施氮水平的不断增加,土壤生境发生显著变化,在样地土壤中c-p2类群显著增加,c-p4和c-p5类群则显著下降,都和施氮梯度成显著的线性关系,由于施肥对表层土壤的影响更剧烈使c-p4和c-p5类群的下降趋势更显著,加快了线虫的世代交替。 氮肥作为北方草原生产的主要限制因子一直是提高草场常量的主要措施。但在长期施氮情况下,土壤的生境会发生显著的变化[29]。随着施氮水平在增加,土壤中pH值显著降低,土壤逐渐酸化,同时土壤线虫的不同营养类群和c-p类群中偏r对策者都与pH值的变化趋势成负相关。说明土壤酸化改变了土壤环境,抑制了土壤微生物的生长和有机质的转化[30],通过食物链的营养级和环境的变化进而抑制了食细菌类群线虫、食真菌类群线虫、寄生类群/杂食类群线虫的生长,但对以植物寄生为主的植物寄生类群线虫影响不显著。 施氮直接增加了土壤中的硝态氮和铵态氮含量,使土壤中的氮含量显著增加,进而增加了土壤养分和土壤生物的食物来源。随着施氮水平的增加,土壤中硝态氮含量显著增加,但食细菌类群线虫和食真菌类群线虫与硝态氮成负相关,随硝态氮含量的增加而降低,而线虫群落与土壤全磷和有机碳的含量关系不显著,说明在草地生态系统中土壤中的氮素对线虫群落的影响更显著,而磷对线虫的影响较小,这也与之前的结果一致[9]。而在c-p类群中,偏r对策者的c-p2类群在养分充足的情况下迅速增长,而偏K对策者的c-p4类群和c-p5类群因对环境敏感,受pH的影响远大于土壤养分的影响,因此在环境发生变化的情况下迅速减少,进而加快了地下生物群落的代谢[31]。 贝加尔针茅草原表层土壤的线虫具有明显的表聚现象。食细菌类群线虫和捕食类群/杂食类群线虫与氮添加水平存在显著负相关。施氮处理对土壤线虫的稳定性、多样性和营养类群的组成会产生一定的负效应,但对土壤瓦斯乐思卡指数和通路指数影响不显著。氮素添加通过改变土壤pH只、硝态氮和铵态氮养分含量,抑制了土壤中食细菌类群线虫和捕食类群/杂食类群线虫以及偏K对策者类线虫的生长。氮素添加使土壤线虫c-p2类群的短世代型增加,c-p4,5类群的长世代型减少,使c-p类群由r对策者向K对策者转移,加快了土壤线虫类群的世代交替和能量流动,降低了地下生态群落的稳定性。 参考文献(References): [1] Luo C Y, Wang S P, Zhao L, Xu S X, Xu B, Zhang Z H, Yao B Q, Zhao X Q. Effects of land use and nitrogen fertilizer on ecosystem respiration in alpine meadow on the Tibetan Plateau. Journal of Soils and Sediments, 2017, 17(6): 1626- 1634 [2] Treseder K K. Nitrogen additions and microbial biomass: a meta-analysis of ecosystem studies. Ecology Letters, 2008, 11(10):1111- 1120. [3] Luo C Y, Xu G P, Chao Z G, Wang S P, Lin X W, Hu Y G, Zhang Z H, Duan J C, Chang X F, Su A L, Li Y N, Zhao X Q, Du M Y, Tang Y H, Kimball B. Effect of warming and grazing on litter mass loss and temperature sensitivity of litter and dung mass loss on the Tibetan plateau. Global Change Biology, 2010, 16(5): 1606- 1617. [4] Xu G L, Mo J M, Fu S L, Per G, Zhou G Y, Xue J H. Response of soil fauna to simulated nitrogen deposition: a nursery experiment in subtropical China. Journal of Environmental Sciences, 2007, 19(5): 603-609. [5] Ochoa-Hueso R, Rocha I, Stevens C J, Manrique E, Luciaez M J. Simulated nitrogen deposition affects soil fauna from a semiarid Mediterranean ecosystem in central Spain. Biology and Fertility of Soils, 2014, 50(1): 191- 196. [6] 李琪, 梁文举, 姜勇. 农田土壤线虫多样性研究现状及展望. 生物多样性, 2007, 15(2): 134- 141. [7] 李玉娟, 吴纪华, 陈慧丽, 陈家宽. 线虫作为土壤健康指示生物的方法及应用. 应用生态学报, 2005, 16(8): 1541- 1546. [8] Ferris H, Bongers T, de Goede R G M. A framework for soil food web diagnostics: extension of the nematode faunal analysis concept. Applied Soil Ecology, 2001, 18(1): 13- 29. [9] 齐莎, 赵小蓉, 郑海霞, 林启美. 内蒙古典型草原连续5年施用氮磷肥土壤生物多样性的变化. 生态学报, 2010, 30(20): 5518- 5526. [10] 桑媛, 贾尝, 阮维斌, 马成仓, 高玉葆. 围封对内蒙古中东部草原植物群落和土壤线虫群落的影响. 生态环境学报, 2010, 19(10): 2332- 2338. [11] Mueller K E, Blumenthal D M, Carrillo Y, Cesarz S, Ciobanu M, Hines J, Pabst S, Pendall E, de Tomasel C M, Wall D H, Eisenhauer N. Elevated CO2and warming shift the functional composition of soil nematode communities in a semiarid grassland. Soil Biology and Biochemistry, 2016, 103: 46- 51. [12] Wei C Z, Zheng H F, Li Q, Lü X T, Yu Q, Zhang H Y, Chen Q S, He N P, Kardol P, Liang W J, Han X G. Nitrogen addition regulates soil nematode community composition through ammonium suppression. PLoS One, 2012, 7(8): e43384. [13] Sun X M, Zhang X K, Zhang S X, Dai G H, Han S J, Liang W J. Soil nematode responses to increases in nitrogen deposition and precipitation in a temperate forest. PLoS One, 2013, 8(12): e82468. [14] 毛小芳, 李辉信, 陈小云, 胡锋. 土壤线虫三种分离方法效率比较. 生态学杂志, 2004, 23(3): 149- 151. [15] Bardgett R D, Usher M B, Hopkins D W. Biological Diversity and Function in Soils. Cambridge: Cambridge University Press, 2005: 117- 256. [16] Bongers T, Bongers M. Functional diversity of nematodes. Applied Soil Ecology, 1998, 10(3): 239- 251. [17] Bongers T. The maturity index: an ecological measure of environmental disturbance based on nematode species composition. Oecologia, 1990, 83(1): 14- 19. [18] Reay D S, Dentener F, Smith P, Grace J, Feely R A. Global nitrogen deposition and carbon sinks. Nature Geoscience, 2008, 1(7): 430- 437. [19] Reich P B, Hobbie S E, Lee T, Ellsworth D S, West J B, Tilman D, Knops J M H, Naeem S, Trost J. Nitrogen limitation constrains sustainability of ecosystem response to CO2. Nature, 2006, 440(7086): 922- 925. [20] Yang H J, Jiang L, Li L H, Li A, Wu M Y, Wan S Q. Diversity-dependent stability under mowing and nutrient addition: evidence from a 7-year grassland experiment. Ecology Letters, 2012, 15(6): 619- 626. [21] Dijkstra F A, Hobbie S E, Reich P B, Knops J M H. Divergent effects of elevated CO2, N fertilization, and plant diversity on soil C and N dynamics in a grassland field experiment. Plant and Soil, 2005, 272(1/2): 41- 52. [22] Liang W J, Lavian I, Pen-Mouratov S, Steinberger Y. Diversity and dynamics of soil free-living nematode populations in a mediterranean agroecosystem. Pedosphere, 2005, 15(2): 204- 215. [23] 李文娇, 刘红梅, 赵建宁, 修伟明, 张贵龙, 皇甫超河, 杨殿林. 氮素和水分添加对贝加尔针茅草原植物多样性及生物量的影响. 生态学报, 2015, 35(19): 6460- 6469. [24] 宋敏, 刘银占, 井水水. 土壤线虫对气候变化的响应研究进展. 生态学报, 2015, 35(20): 6857- 6867. [25] Bai H H, Bao X L, Sun X M, Jiang S W, Bai H H, Bao X L. The effect of stocking rate on soil glomalin under traditional and mixed grazing systems in a temperate steppe. Procedia Environmental Sciences, 2011, 11: 817- 823. [26] 胡宁, 娄翼来, 梁雷. 保护性耕作对土壤线虫c-p类群及功能团的影响. 生态环境学报, 2009, 18(6): 2349- 2353. [27] Kerry B R. An assessment of progress toward microbial control of plant-parasitic nematodes. The Journal of Nematology, 1990, 22(4S): 621-631. [28] 高雪峰, 张功, 卢萍. 内蒙古荒漠草原土壤微生物的分布特征及季节动态变化研究. 内蒙古师范大学学报: 自然科学汉文版, 2007, 36(4): 484- 487. [29] 白春华. 控制性增温和施氮肥对土壤性质的影响[D]. 呼和浩特: 内蒙古农业大学, 2011: 58- 58. [30] 郭永盛, 李俊华, 李鲁华, 危常州, 褚贵新, 王飞, 董鹏. 施氮肥对荒漠草原土壤微生物种群及微生物量的影响. 新疆农业科学, 2011, 48(1): 79- 85. [31] 王静, 胡靖, 杜国祯. 施氮磷肥对青藏高原高寒草甸土壤线虫群落组成的影响. 草业学报, 2015, 24(12): 20- 28.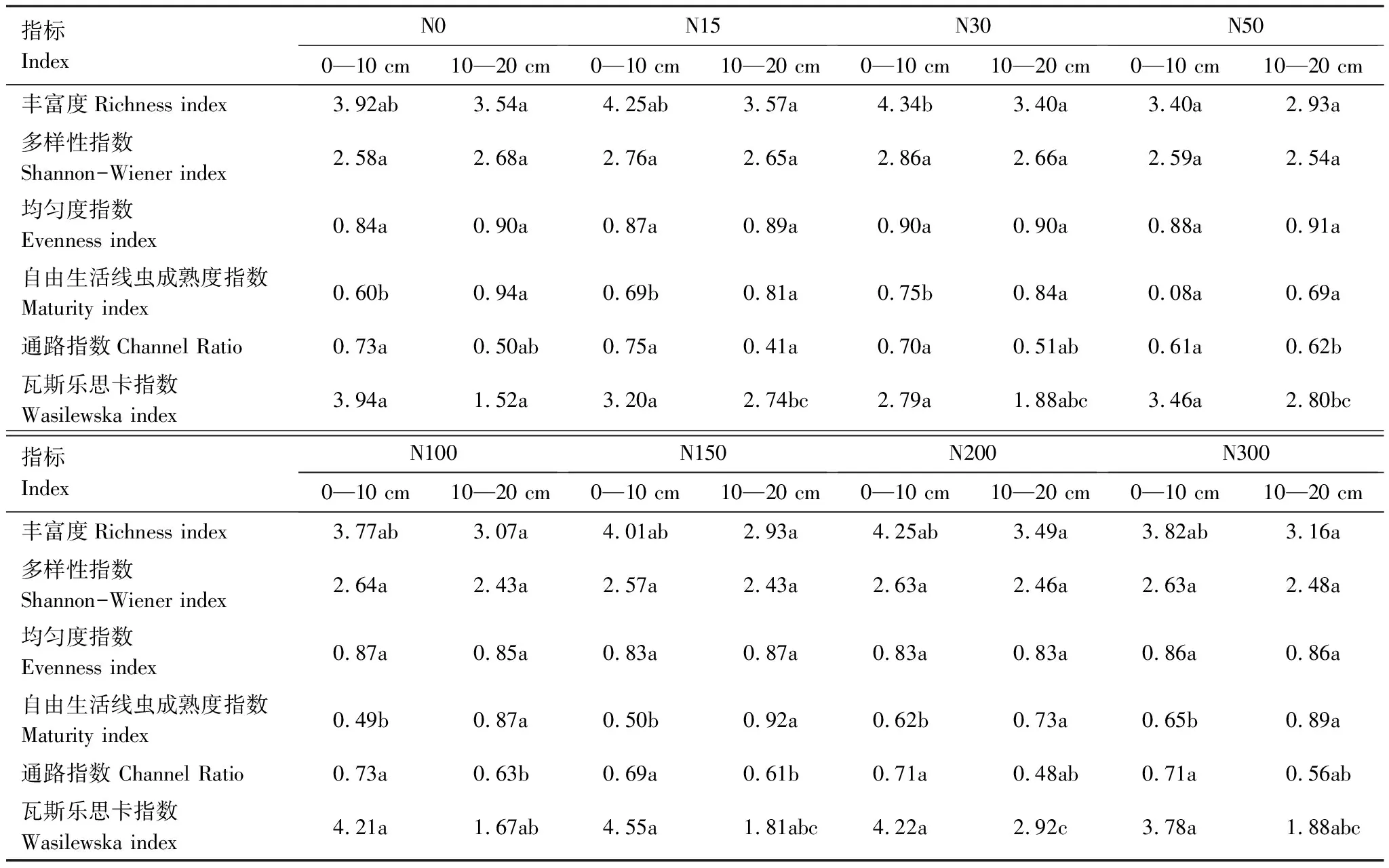
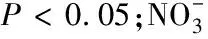
3 讨论
3.1 土壤线虫群落组成和营养类群对氮素添加水平的响应
3.2 土壤线虫生态指数和c-p类群对氮素添加水平的响应
3.3 草原土壤线虫与理化因子的关系
4 结论
