三峡库区不同生境下中华蚊母树叶片表型可塑性及其与土壤环境因子的关系
2018-06-23李晓玲温浩然王雪松黄成名
李晓玲,温浩然,王雪松,杨 进,黄成名
1 三峡大学生物与制药学院, 宜昌 443002 2 三峡地区地质灾害与生态环境湖北省协同创新中心, 宜昌 443002 3 三峡植物园, 宜昌 443111
植物性状与环境的响应关系是反映植物对环境适应过程中内部与外部不同功能之间的权衡,是植物在特定环境下生存适应策略的重要表现,表现为表型可塑性[1]。近年来受到研究学者的广泛关注[2- 4]。表型可塑性是指同一基因型的物种由于环境条件的不同,产生不同表型的特性,这是生物在没有遗传变异的情况下适应环境的一种机制,它是生物体应对环境条件或刺激的最重要的反应特征,是生物适应的表型基础[5]。凭借表型可塑性,植物在异质生境中可以最大限度地获取资源,并进行资源的再分配,从而实现资源的有效利用,提高植物在可变环境中的最大适合度,是植物适应异质生境的重要生态对策[6- 8]。表型可塑性在植物中普遍存在[9],但并非所有的表型可塑性都是适应性的。适应性可塑性指在特定环境中能够增强生物的机能进而可以增加适合度的可塑性[10]。表型可塑性可以增强物种对不利生境抵抗能力,能促使物种适应异质环境,具有更宽的生态幅[11]。植物对异质生境的适应能力可以用表型可塑性大小来衡量[12]。
一般认为表型可塑性和遗传分化包括生态分化是生物适应异质生境的两种主要方式[13]。在表型可塑性模型中,植物的基因型和表型不再是简单的对应关系,表型不只由基因型决定也受环境因素的发育过程的影响。植物叶片是植物与外界环境进行气体交换的主要器官,也是生态系统中初级生产者的能量转换器。叶性状是植物叶片响应环境的变化而形成的基本行为和功能的具体体现,主要包括结构型性状和功能型性状两大类,它们共同体现了植物为了获得最大化碳收获所采取的生存适应策略[14- 15]。因此,探索植物叶性状的表型可塑性对植物种群在异质生境下的生存适应策略具有重要的生态学和生物进化意义。
水淹是水环境胁迫的一种重要表现形式,对植物的代谢、生理和形态都会产生影响[16- 17]。前期研究发现,秋华柳(Salixvariegate)水淹90 d 后存活率仍为100%[18];牛鞭草(Hemarthriaaltissima)可忍耐120 d的完全水淹;狗牙根(Cynodondactylon)忍耐时间甚至长达180 d[19]。近年来通过研究人们已经认识到,水淹耐受能力强的物种往往是通过高度的表型可塑性来适应环境因子的波动以度过水淹逆境期的,例如秋华柳和赤杨(Alnusjaponica)通过茎粗的增加、不定根的发生缓解氧气的不足来增加对水淹的适应[18,20];水芹(Oenanthejavanica)在水下会生成一种有别于气生叶解剖结构的沉水叶来更好地适应水淹环境[21]。植物的表型可塑性受生物和非生物因子的综合影响,如采食者、光照、土壤营养、水分以及温度等。在全球气候变化的影响下,植物的表型可塑性能否适应这种变化以及这些变化会对植物的可塑性造成怎样的影响值得关注[11]。然而,表型可塑性研究多为控制模拟某种因子(如水分、光照或溶氧)的梯度实验[12,22],缺乏大区域和大尺度自然环境下表型可塑性的研究。而种群水平广义的表型可塑性研究可揭示植物在自然环境中的响应及生态适应意义并丰富对植物种群分布的了解。
中华蚊母树(Distyliumchinense)是金缕梅科(Hamamelidaceae)蚊母树属(Distylium)多年生常绿河岸带小灌木[23],是三峡库区河岸带固土护岸的良好树种,同时也是上好的盆景树种,具有较高的观赏价值[24]。中华蚊母树可在陆生和湿生等多种异质生境中生长,是一种耐淹性能较强的小灌木树种[25-26]。Li等等发现完全水淹90 d后其存活率仍高达100%[27]。中华蚊母树能够适应乌江流域和长江流域及其支流水位变动的河岸环境,在河岸带有广泛自然分布。随着水电工程的兴建,乌江流域和长江流域大部分野生中华蚊母树群落伴随着原有自然消落带的消失其原生境也被淹没,再加上人类的过度采伐,导致野生资源数量和遗传多样性遭到破坏,大面积的中华蚊母树已经很少见,现存的中华蚊母树仅零星分布在乌江及长江两岸的河谷及溪流两侧[24]。因此,对其研究及保护具有重要科学意义。目前对岸生植物在不同水文节律异质生境下叶片的表型可塑性及与土壤环境因子的关系研究尚少。作者前期采用ISSR和SRAP分子标记技术对三峡库区5个中华蚊母树种群的遗传结构和遗传多样性进行了研究,结果表明种群遗传多样性丰富,但种群间遗传分化非常低[24-25],这暗示着其有丰富的表型可塑性。因此,本文对生长在自然消落带、反季节消落带及无消涨节律生长区等3种异质生境下36个不同中华蚊母树种群的叶性状表型可塑性进行研究并运用典范对应分析(CCA)来探讨其与土壤环境因子关系,拟解决以下3个问题:(1)中华蚊母树叶片对不同水文节律异质生境是否具有较高的表型可塑性?(2)表型可塑性是否可以揭示中华蚊母在不同水文节律的异质生境下的生态适应性?(3)哪些土壤环境因子是叶片表型可塑性的主要驱动因子?
1 研究区域概况
调查研究区域包括三峡库区香溪河、大宁河、乌江、芙蓉江、古龙溪、南津关、宜昌三峡植物园和重庆巫山县珍稀植物园等,属于亚热带湿润季风气候区域,气候温和湿润,水热条件充足,年降雨量1100—1500m,年均温15—19℃[28],可满足大多数喜温植物的生长。中华蚊母树种群生长在三峡区域河岸带,每年会遭受汛期河水上涨或者三峡库区蓄水而出现水位涨落扰动,生境严酷。其分布区植物区系主要以世界广布、泛热带以及北温带广布种为主,植物群落生活型谱主要以矮高位芽植物和一年生植物为主,主要伴生物种有:小梾木(Cornusquinquenervis)、地枇杷(Ficustikoua)、水杨梅(Geumaleppicum)、节节草(Equisetumramosissimum)和白茅(Imperatacylindrica)等。
目前,三峡库区消落带有维管植物405种,其中122个中国特有种,它们为库区进行植被恢复与重建提供了丰富的物种资源[28]。中华蚊母树便是在三峡库区长江及其支流江岸都有较为广泛分布的优良护堤护岸小灌木优势树种[23- 24]。
2 研究方法
2.1 调查取样
2014年5—6月份,选取了36个中华蚊母树调查取样地,分别属于3个不同水文节律异质生境:(1)自然消落带(natural riparian zone,NRZ),不受三峡库区现行水文节律的影响,受夏季洪汛的影响,自然消落带水淹时间平均90 d左右,水淹深度15 m以下[29],中华蚊母树自然生长区,包括竹子溪、三道拐、白龙过江及古龙溪16个自然样地;(2)反季节消落带(anti-season water level fluctuation zone of Three Gorges Reservoir,ASWLFZ),受现行三峡水库冬季蓄水夏季排水的影响,水淹时间最长可达到237 d,水淹深度最大可达30 m[29],包括万古寺和泗湘溪8个人工恢复样地(为进行三峡水库消落带植被的恢复与重建物种,于2009—2011年陆续在三峡水库香溪河消落带170—175 m移栽了中华蚊母树一年生植物);(3)不受水文节律影响的无消涨节律生长区(no water level fluctuation zone,NWLFZ),既不受夏季洪汛也不受三峡蓄水影响的区域,包括三峡植物园、南津关及巫山珍稀植物园等12个样地。样地基本信息及分布见图1,各取样地具体位置信息见表1。
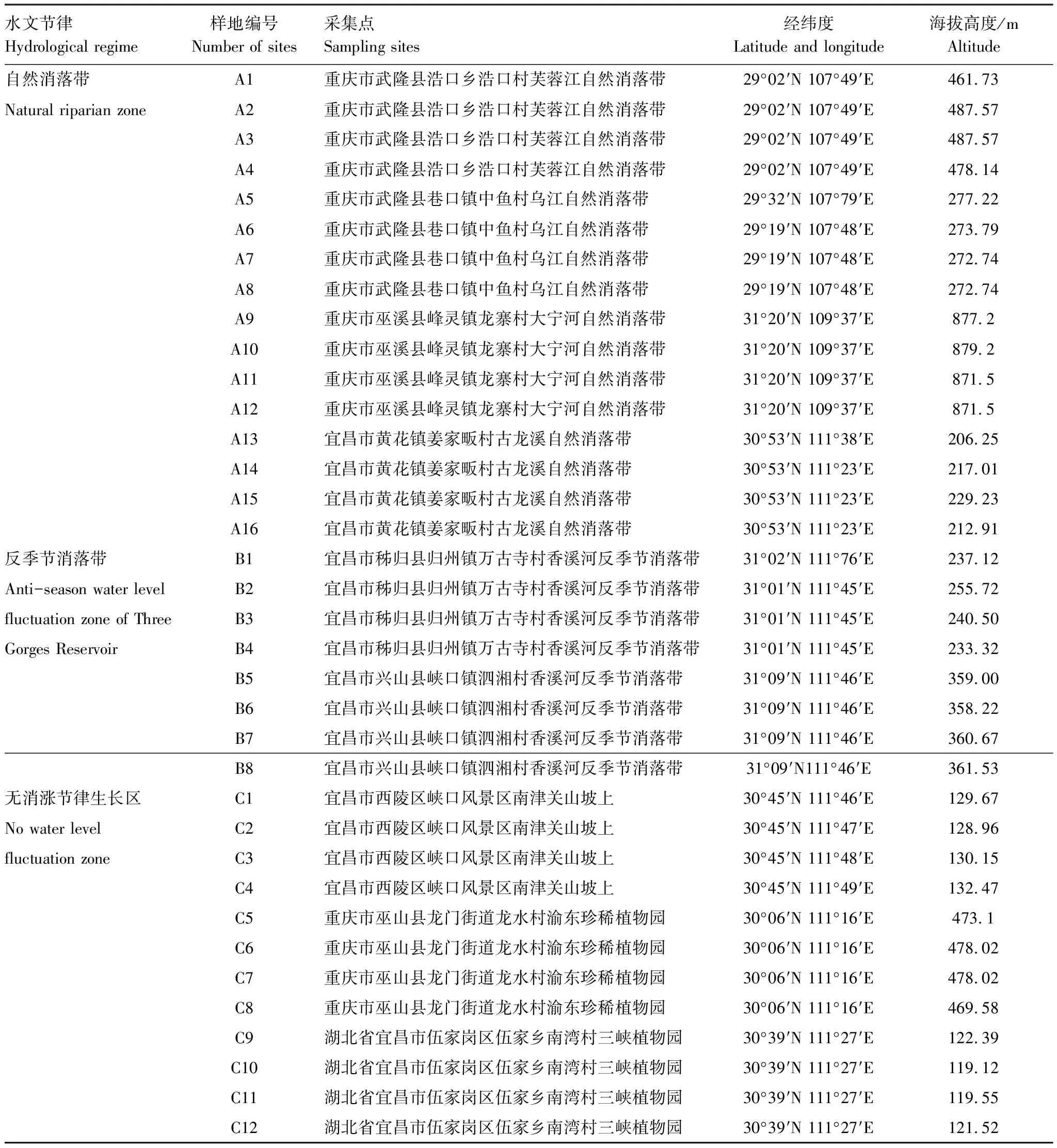
水文节律Hydrological regime 样地编号 Number of sites采集点Sampling sites经纬度Latitude and longitude 海拔高度/m Altitude自然消落带 A1重庆市武隆县浩口乡浩口村芙蓉江自然消落带29°02′N 107°49′E461.73Natural riparian zone A2重庆市武隆县浩口乡浩口村芙蓉江自然消落带29°02′N 107°49′E487.57 A3重庆市武隆县浩口乡浩口村芙蓉江自然消落带29°02′N 107°49′E487.57 A4重庆市武隆县浩口乡浩口村芙蓉江自然消落带29°02′N 107°49′E478.14 A5重庆市武隆县巷口镇中鱼村乌江自然消落带29°32′N 107°79′E277.22 A6重庆市武隆县巷口镇中鱼村乌江自然消落带29°19′N 107°48′E273.79 A7重庆市武隆县巷口镇中鱼村乌江自然消落带29°19′N 107°48′E272.74 A8重庆市武隆县巷口镇中鱼村乌江自然消落带29°19′N 107°48′E272.74 A9重庆市巫溪县峰灵镇龙寨村大宁河自然消落带31°20′N 109°37′E877.2 A10重庆市巫溪县峰灵镇龙寨村大宁河自然消落带31°20′N 109°37′E879.2 A11重庆市巫溪县峰灵镇龙寨村大宁河自然消落带31°20′N 109°37′E871.5 A12重庆市巫溪县峰灵镇龙寨村大宁河自然消落带31°20′N 109°37′E871.5 A13宜昌市黄花镇姜家畈村古龙溪自然消落带30°53′N 111°38′E206.25 A14宜昌市黄花镇姜家畈村古龙溪自然消落带30°53′N 111°23′E217.01 A15宜昌市黄花镇姜家畈村古龙溪自然消落带30°53′N 111°23′E229.23 A16宜昌市黄花镇姜家畈村古龙溪自然消落带30°53′N 111°23′E212.91反季节消落带 B1宜昌市秭归县归州镇万古寺村香溪河反季节消落带31°02′N 111°76′E237.12Anti-season water level B2宜昌市秭归县归州镇万古寺村香溪河反季节消落带31°01′N 111°45′E255.72fluctuation zone of Three B3宜昌市秭归县归州镇万古寺村香溪河反季节消落带31°01′N 111°45′E240.50Gorges Reservoir B4宜昌市秭归县归州镇万古寺村香溪河反季节消落带31°01′N 111°45′E233.32 B5宜昌市兴山县峡口镇泗湘村香溪河反季节消落带31°09′N 111°46′E359.00 B6宜昌市兴山县峡口镇泗湘村香溪河反季节消落带31°09′N 111°46′E358.22 B7宜昌市兴山县峡口镇泗湘村香溪河反季节消落带31°09′N 111°46′E360.67 B8宜昌市兴山县峡口镇泗湘村香溪河反季节消落带31°09′N111°46′E361.53无消涨节律生长区 C1宜昌市西陵区峡口风景区南津关山坡上30°45′N 111°46′E129.67No water level C2宜昌市西陵区峡口风景区南津关山坡上30°45′N 111°47′E128.96fluctuation zone C3宜昌市西陵区峡口风景区南津关山坡上30°45′N 111°48′E130.15 C4宜昌市西陵区峡口风景区南津关山坡上30°45′N 111°49′E132.47 C5重庆市巫山县龙门街道龙水村渝东珍稀植物园30°06′N 111°16′E473.1 C6重庆市巫山县龙门街道龙水村渝东珍稀植物园30°06′N 111°16′E478.02 C7重庆市巫山县龙门街道龙水村渝东珍稀植物园30°06′N 111°16′E478.02 C8重庆市巫山县龙门街道龙水村渝东珍稀植物园30°06′N 111°16′E469.58 C9湖北省宜昌市伍家岗区伍家乡南湾村三峡植物园30°39′N 111°27′E122.39 C10湖北省宜昌市伍家岗区伍家乡南湾村三峡植物园30°39′N 111°27′E119.12 C11湖北省宜昌市伍家岗区伍家乡南湾村三峡植物园30°39′N 111°27′E119.55 C12湖北省宜昌市伍家岗区伍家乡南湾村三峡植物园30°39′N 111°27′E121.52
2.2 土壤环境因子分析及实验方法
调查采样的同时在每个样方内用环刀取0—20cm土层的原状土,土壤理化性质分析方法参照《土壤农业化学分析方法》[30- 31],测定指标有:土壤pH值、土壤有机质含量(OM)、土壤全氮含量(TN)、土壤全磷含量(TP)、土壤全钾含量(TK)、水解氮(AN)、速效磷(AP)、速效钾(AK)及土壤含水量(SWC)等,pH值用电位法测定,OM测定采用K2Cr2O7容量法,TN测定采用凯氏定氮法,TP的测定采用HClO4-H2SO4消煮(钼锑抗比色法),TK的测定采用HF-HClO4消煮-火焰光度法,SWC的测定采用MP- 406 Ⅰ型土壤水分测定仪,AN的测定采用碱解扩散法,AP的测定采用碳酸氢钠提取-钼锑抗比色法,AK的测定采用乙酸铵提取-火焰光度法。各土壤生境环境因子见表2。
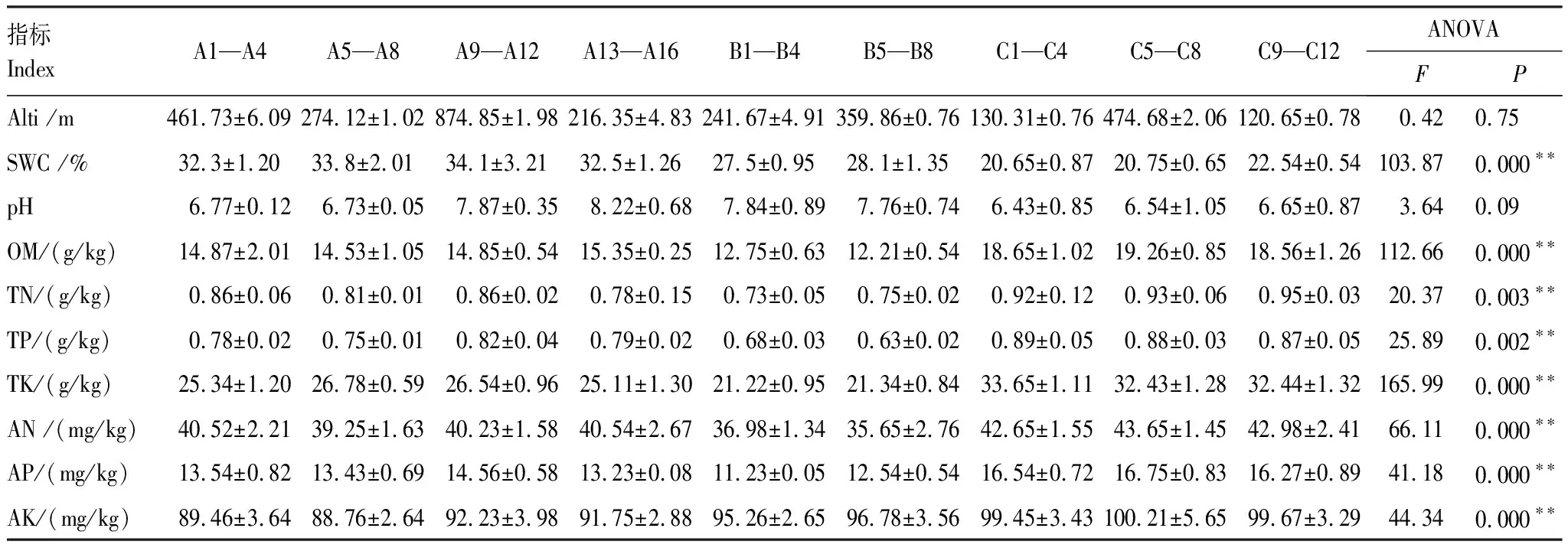
表2 三峡库区不同生境下土壤环境因子的异质性
Alti:海拔高度,Altitude;SWC:土壤含水量,Soil water content;OM:有机质,Organic matter;TN:全氮,Total nitrogen;TP:全磷,Total phosphorus;TK:全钾,Total potassium;AN:水解氮,Hydrolytic nitrogen;AP:速效磷,Available phosphorus;AK:速效钾,Available potassium
2.3 数量性状的测定方法
中华蚊母树种群的调查取样设置样方面积5 m×5 m,按照对角线取样,每个样方选择长势相近的健康叶20片,各个样地中所选枝条的生长方向均包括东南西北方向,为避免自遮荫,所选取的叶片为植株上层小枝顶端1—2片充分展开叶。剪取的这36个异质生境样地中华蚊母树的720株叶片带回实验室4℃保存并调查叶片各形态特征。对每个叶片进行编号并用毫米刻度尺测量其叶长(leaf length, LL)和叶宽(leaf width, LW),用LI- 3000A(LI, USA)叶面积仪测量其叶面积(leaf area, LA),并于80℃烘干48 h后用分析天平测量叶干物重(leaf dry weight, LDW),计算其比叶面积(specific leaf area, SLA) (SLA=LA/LDW)。
2.4 数据统计分析方法
运用Microsoft Excel 2013和SPSS 22.0对各异质生境中华蚊母树叶片的各性状指标做方差分析和相关性分析,对各异质生境下中华蚊母树叶片性状的差异显著性进行分析。将LL、LW、LDW、LA之间的异速生长关系用经典的异速方程Y=βXα描述[5, 32],将各变量经对数转换后做线性回归方程,并用协方差分析比较各生境的异速指数α(即斜率)和异速系数lgβ(即Y轴截距)的差异显著性。
采用 CANOCO 5.0 软件进行典范对应分析(Canonical Correspondence Analysis,CCA),分析异质生境下中华蚊母树种群植物性状与土壤环境因子之间对应关系,了解影响叶片功能性状表型可塑性的主要环境驱动因子。物种性状矩阵和环境因子矩阵经过lg(x+1) 转换使数据更趋于正态分布,为了证明CCA分析中环境因子对植物性状解释量的显著性,对试验进行了Monte Carlo显著性检验(499组排序)。
3 结果与分析
3.1 三峡库区不同生境的土壤环境因子的异质性
从表2可知,在三峡库区不同生境下中华蚊母树的环境因子除海拔高度和pH值外,SWC、OM、TN、TP、TK、AN、AP及AK在不同生境下差异达到极显著水平,这表明同一环境因子在不同生境中是异质性的。
3.2 异质生境下华蚊母树种群叶片的数量性状及其可塑性分析
从表3可以看出,三峡库区不同生境下中华蚊母树叶片性状的差异均达到显著水平(P<0.05),表明不同生境下各样地中华蚊母树间叶片性状存在真实的差异,因此可以进行可塑性分析。同一生境内的可塑性可由各性状的最大值、最小值、标准偏差及变异系数反映出来,变异系数平均值为4.80%—26.12%,其中以LA和SLA在各生境中的平均变异系数最大,分别为14.70%和18.93%。以自然消落带A1—A4、A5—A8和反季节消落带B1—B4、B5—B8的LA和SLA的可塑性较大,表明中华蚊母树LA和SLA的较大可塑性是其适应异质生境的重要原因之一。
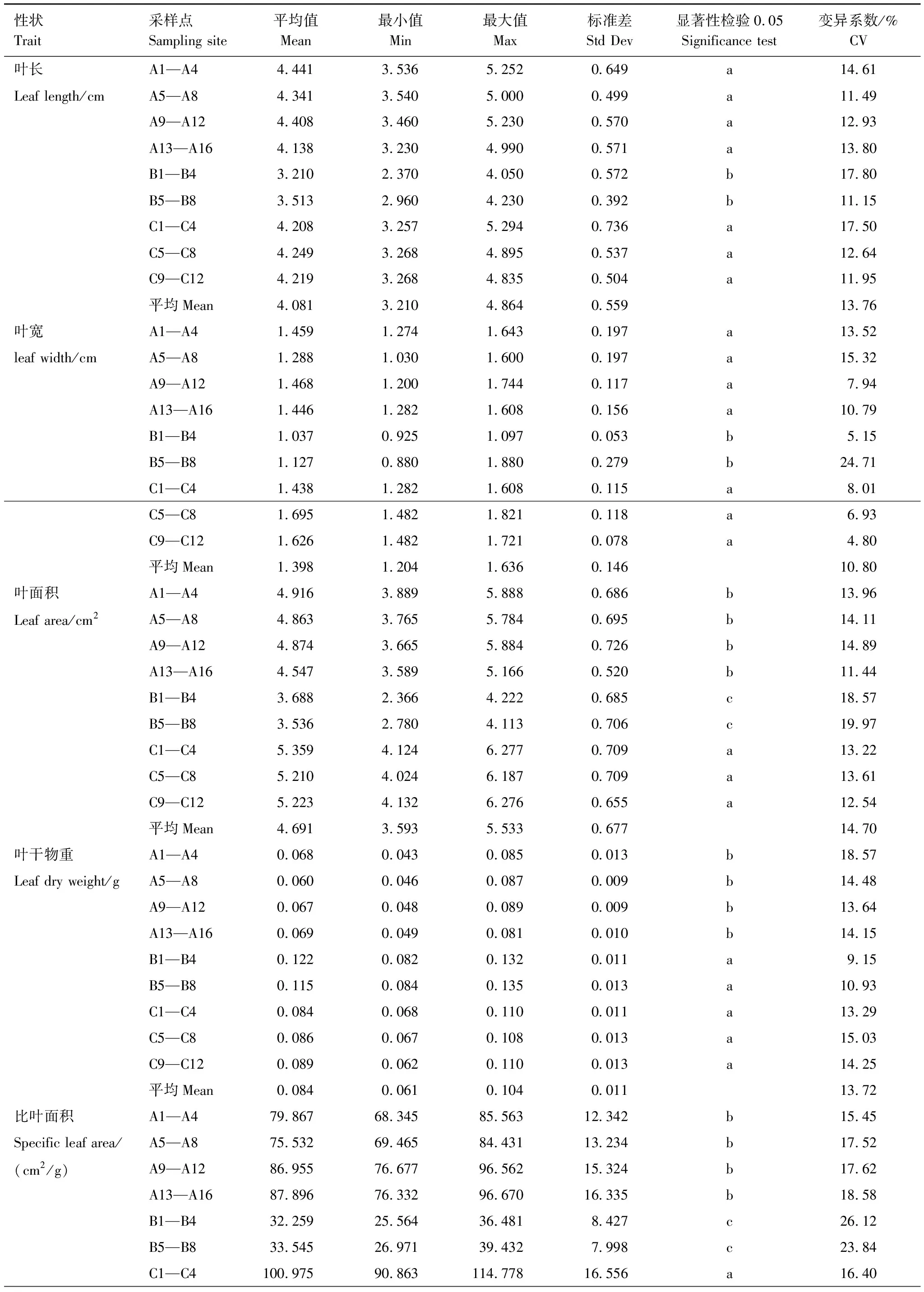
表3 异质生境下中华蚊母树叶片的数量性状及变异系数
3.3 叶片性状的异速生长规律
植物叶片的生长包括长度和宽度的增加,也伴随着叶干物重的增长。叶面积大小与植物的光合生产能力直接相关,叶干物重则反映了叶片的建成成本。统计分析表明,各异质生境下中华蚊母树LW与LL、LDW与LL、LW及LA均呈显著的幂函数异速生长关系(表4)。36个样地中华蚊母树LW与LL的异速指数α值都小于1,表明叶片LW的增长速度总体上比LL的慢。LDW与LL和LW其异速指数α值均大于1,表明叶片LDW的增长速度比LL和LW的生长更快。而LDW与LA的异速指数α值在0.95—1.02之间,都接近于1,表明LDW的增长速率与LA的增长速率比较接近,即在叶片生长过程中SLA趋于稳定。
综上所述,中华蚊母树叶片各性状的生长速率在不同生境下表现出相同的规律:LA ≈ LDW > LL > LW。
3.4 异速生长参数的可塑性分析
异速生长参数是由异速系数(lgβ)和异速指数α组成,经过协方差分析(表4),在各异质生境下中华蚊母树LW与LL、LDW与LL、LW、LA的异速生长关系中,lgβ和α的差异均达到了极显著水平(P<0.01),表明不同生境下其lgβ均具有较大的可塑性,且叶片各结构性状的异速生长均有相对不稳定的速率,也有较大的可塑性。

表4 异质生境中华蚊母树叶片性状异速生长方程参数
**P<0.01
3.5 基于CCA的异质生境下中华蚊母树种群叶片性状与环境因子的相关关系
对异质生境下中华蚊母树种群叶片性状与环境因子之间的关系进行了CCA分析,结果显示前2个排序轴对性状变量累积贡献率分别达到76.65%和91.66%。Monte Carlo随机置换检验表明,所有典范特征轴与中华蚊母树种群叶片性状都极显著相关(P<0.01),表明排序结果是可信的,能够较好的反映异质生境下中华蚊母树种群叶片的性状与环境因子之间的关系(图2)。
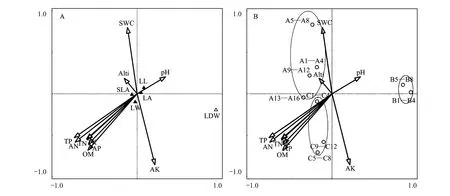
图2 异质生境下中华蚊母树叶片性状与环境因子的 CCA排序图(A)及采样点分布图(B)Fig. 2 CCA ordination diagram of D. chinense leaf traits and environmental factors in heterogeneous habitats (A) and sampling spot distribution (B)SLA:比叶面积,Specific leaf area;LA:叶面积,Leaf area;LL:叶长,Leaf length;LW:叶宽,Leaf width;LDW:叶干物重,Leaf dry weight;TP:全磷,Total phosphorus;TN:全氮,Total nitrogen;TK:全钾,Total potassium;AN:水解氮,Hydrolytic nitrogen;AP:速效磷,Available phosphorus;AK:速效钾,Available potassium;SWC:土壤含水量,Soil water content;OM:有机质,Organic matter;Alti:海拔高度,Altitude
从图2A可看出,TP、AN、TK、TN是第一轴的主要影响因子,相关系数分别为-0.7580、-0.7479、-0.6092、-0.6051,第二轴的主要影响因子为AK、SWC、OM、AP,相关系数分别为-0.8555、0.7983、-0.6805、-0.6078。由此可见,影响SLA、LA、LL、LW和LDW等叶片结构性状的主要因子是TP、AN、AK、SWC。从图2B可看出,沿着第二排序轴由下而上土壤含水量(SWC)逐渐增加,速效钾(AK)含量降低,样点分布顺序依次为:不受水文节律影响的生长区,包括C1—C4、C5—C8及C9—C12;反季节水库消落带,包括B1—B4和B5—B8;自然消落带取样点,包括A1—A4 、A5—A8 、A9—A12 及A13—A16。即影响中华蚊母树种群分布的主要因子是AK和SWC。
4 讨论
4.1 中华蚊母树叶片表型可塑性及其种群生态适应性
表型可塑性在植物对异质环境的适应过程中发挥了重要作用,它是植物适应异质生境的重要生态对策[8, 33]。在异质生境中,表型可塑性大的植物能改变其形态、生长、生物量分配和生理特性等多个方面,从而更好地适应异质生境,提高植物的最大适合度,这些增加适合度的可塑性反应也称为适应性可塑性[34]。表型可塑性的适应意义主要表现为以下两点:首先,表型可塑性是生物适应变化的环境的重要方式。其次,表型可塑性对于生物的分布有重要的意义。表型可塑性使得物种具有更宽的生态幅和更好的耐受性,可以占据更加广阔的地理范围和更加多样化的生境,即成为生态位理论中的广幅种。ISSR分子标记研究显示,中华蚊母树种群内遗传变异占总变异的89.2%,种群间的遗传变异占10.8%[25],表明中华蚊母树遗传变异主要存在于种群内,种群间遗传分化很小,种群内表型可塑性是中华蚊母树适应异质生境的主要方式。在本研究中,中华蚊母树种群叶片LL、LW、LA、LDW及SLA在不同生境间差异均有显著性(P<0.05),而在同一生境的种群内无显著差异,表明中华蚊母树叶片性状对异质生境具有较强的可塑性;其异速生长规律一致遵循幂函数关系,且不同生境下各组异速生长指数都保持稳定,即就生长速率来说,LA ≈ LDW > LL > LW,这与芦苇种群叶片的表型可塑性研究结果一致[35]。异速系数lgβ为Y轴上的截距,是异速生长起始点的表征,而斜率异速指数α可以反映叶片性状对环境的敏感性[35],各组异速生长关系中异速系数lgβ和异速指数α均有极显著差异,表明中华蚊母树叶片各性状异速生长起始点的可塑性较大,且各性状之间在相对生长中对环境变化较为敏感。中华蚊母树叶片表型的可塑性可能使其能够适应更广阔的环境,面对不同生境具有较宽的生态幅,且叶片本身依旧保持生长的有序性,这是中华蚊母树对各种异质生境的一种适应机制。
目前,大多数植物生态学家认为,在众多的植物性状中,植物的叶片性状与植物的生长对策以及植物利用资源的能力紧密联系,能够反应植物适应环境变化所形成的生存对策[36]。在本研究中中华蚊母树种群LL、LW、LA、LDW及SLA等叶片性状在不同水文节律异质生境中表型可塑性差异显著,表现为各异质生境中叶片性状指标的平均数和变异系数差异显著。其中变异系数反映了各生境样本性状的相对变异度和可塑性,本研究结果发现不同水文节律异质生境的中华蚊母树种群叶片的变异系数平均值为4.80%—26.12%,最小的为样地C9—C12三峡植物园中华蚊母树叶宽的变异系数,生长于无消涨节律的山坡上,生境环境相对稳定;最大的为香溪河万古寺村消落带B1—B4中华蚊母树叶片的比叶面积,该样地位于香溪河消落带170—175 m陡坡处,属于反季节消落带,遭遇冬季长期的水淹,生境最为恶劣,而且夏季落干期常会有极度的干旱,其土壤水分、养分以及光照条件和种内种间关系均随季节变化而有较大的变化,致使叶片各性状的可塑性也较大。
LA是衡量叶片光合能力的重要指标,LA越大,越有利于拦截更多的阳光生产有机物。SLA代表植物体投入单位质量的干物质所获得的捕光面积,SLA较高的物种生长速率较高,养分利用效率较低,“防御性”投入较少,叶片寿命较短[37],而低SLA的植物能够好地适应资源贫瘠和干旱的环境[38],是表征植物生长过程中资源收获策略的关键叶性状指标,能够反映植物在不同生境下资源获取能力,所以被认为是研究特定环境条件下植物生理生态学策略的首选指标[39]。本研究中,在万古寺村(B1—B4)和泗湘溪村(B5—B8)这种反季节消落带下,每年水淹持续时间最长、深度最深、最频繁,中华蚊母树种群叶片的SLA显著低于其他生境(表3),叶片可能将大部分干物质用于构建保卫细胞,增加叶厚或叶肉细胞密度,同时使叶片内部水分向叶片表面扩散或外部水分进入叶片内部的距离或阻力增大,保持植物叶片水分平衡。较低的SLA降低了单位叶面积的呼吸碳损失[39],而且通过延长叶寿命增加了碳收获,同时较低的生长速率得以维持正碳平衡,使水淹环境中的中华蚊母树叶片能够渡过不利环境。中华蚊母树可能就是凭借在不同水文节律异质生境中叶片较强的表型可塑性,最大限度地进行光合积累,获取资源,并进行资源的再分配,从而实现资源的有效利用,提高中华蚊母树在不同水文节律异质生境中的适合度,使中华蚊母树能够适应三峡水库长期水淹的恶劣生境。
4.2 影响中华蚊母树种群生长及叶片表型可塑性的主要环境因子
植物生长繁殖的必需资源以及植物所处的环境条件即使在很小的尺度上也存在着异质性[40],环境异质性作为一种选择压力使植物形成了有效获取必需资源的生态适应对策[41],异质生境的营养成分,如N、P、K、水和其他金属离子含量等是影响植物生长的主要因素。钾在光合作用中担负气孔的调节、活化与光合作用有关的关键酶Rubisco及Rubisco活化酶活性和含量、参与同化物的运输等重要的生理功能[42]。钾还能够调节水分代谢和能量代谢,提高植物的抗性[43]。处于水淹状态时的中华蚊母树叶片气孔基本处于关闭状态,光合作用较低或不能进行光合作用,当水淹结束后,随着SWC降低,AK含量增高(图2),AK含量高可能会更快的打开气孔,活化光合作用相关的酶,恢复光合作用能力,进行快速恢复生长。Janssens等人研究指出,土壤中最适宜植被生长的有效钾浓度为200 mg/kg,在达到这个浓度之前物种多样性会随有效钾浓度的增加而增加[44]。Roem和Berendse的研究表明,岸生植物物种多样性还与平衡的氮磷比密切相关,氮磷比小于14说明土壤中缺乏氮元素[45]。而本研究中各生境下土壤AK平均浓度为(94.78±4.47) mg/kg < 200 mg/kg,土壤平均氮磷比为1.07±0.02,表明不同水文节律异质生境下包括香溪河消落带土壤均受钾元素和氮元素的限制。
植物性状反映了植物对生长环境的响应和适应,与环境相互作用,逐渐形成了许多内在生理和外在形态方面的适应对策,以最大程度地减小环境的不利影响[46]。CCA排序结果表明,TP、AN、AK和SWC是影响SLA、LA、LL、LW和LDW等叶片结构性状的主要因子,从而影响中华蚊母树种群的叶片表型可塑性,使不同生境下中华蚊母树对环境采取不同的适应策略。除此之外,AK和SWC也是影响中华蚊母树种群分布的主要土壤环境因子(图2)。
4.3 关于三峡水库消落带中华蚊母树植被恢复的建议
中华蚊母树株型紧凑、叶片茂密可以防止土壤水分散失,对土壤水分具有涵养作用,是固土护岸的良好树种,因此它对消落带植被生态系统的恢复与重建有着重要作用。它本是一种可在陆生和湿生等多种异质生境中生长的耐淹灌木,但在水电工程的兴建和多种人为因素的影响下,外界条件超过其耐受限度,也会对它的生存繁衍构成威胁。改善其生境,对维护消落带的生态环境具有重要意义。结合本文研究结果,在植被恢复需要时在河岸带土壤中适量添加N、K元素,可平衡土壤营养。综合各类环境因子如何控制它们的配比使其达到中华蚊母树最佳的生长条件,尚需进一步研究。
参考文献(References):
[1] de Kroon H, Schieving F. Resource allocation patterns as a function of clonal morphology: a general model applied to a foraging clonal plant. Journal of Ecology, 1991, 79(2): 519- 530.
[2] Lambers H, Poorter H. Inherent variation in growth rate between higher plants: a search for physiological causes and ecological consequences. Advances in Ecological Research, 1992, 23: 187- 261.
[3] Ellers J, Stuefer J F. Frontiers in phenotypic plasticity research: new questions about mechanisms, induced responses and ecological impacts. Evolutionary Ecology, 2010, 24(3): 523- 526.
[4] Gao L, Li B, Liu W Y, Shen Y X, Liu W J. Inhibition effects of daughter ramets on parent of clonal plantEichhorniacrassipes. Aquatic Botany, 2013, 107: 47- 53.
[5] 程栋梁. 异速生长关系在生物学中的应用. 沈阳大学学报, 2009, 21(6): 12- 15.
[6] Macdonald S E, Chinnappa C C. Population differentiation for phenotypic plasticity in theStellarialongipescomplex. American Journal of Botany, 1989, 76(11): 1627- 1637.
[7] 王艳全, 王珂, 邢福. 匍匐茎草本植物形态可塑性、整合作用与觅食行为研究进展. 生态学杂志, 2005, 24(1): 70- 74.
[8] 施建敏, 叶学华, 陈伏生, 杨清培, 黎祖尧, 方楷, 杨光耀. 竹类植物对异质生境的适应——表型可塑性. 生态学报, 2014, 34(20): 5687- 5695.
[9] 耿宇鹏, 张文驹, 李博, 陈家宽. 表型可塑性与外来植物的入侵能力. 生物多样性, 2004, 12(4): 447- 455.
[10] Sultan S E. Phenotypic plasticity and plant adaptation. Plant Biology, 1995, 44(4): 363- 383.
[11] Sultan S E. Phenotypic plasticity for plant development, function and life history. Trends in Plant Science, 2000, 5(12): 537- 542.
[12] 杜宁, 张秀茹, 王炜, 陈华, 谭向峰, 王仁卿, 郭卫华. 荆条叶性状对野外不同光环境的表型可塑性. 生态学报, 2011, 31(20): 6049- 6059.
[13] 史刚荣, 马成仓. 外来植物成功入侵的生物学特征. 应用生态学报, 2006, 17(4): 727- 732.
[14] Kikuzawa K. A cost-benefit analysis of leaf habit and leaf longevity of trees and their geographical pattern. The American Naturalist, 1991, 138(5): 1250- 1263.
[15] 毛伟, 李玉霖, 张铜会, 赵学勇, 黄迎新, 宋琳琳. 不同尺度生态学中植物叶性状研究概述. 中国沙漠, 2012, 32(1): 33- 41.
[16] Kozlowski T T. Responses of woody plants to flooding and salinity. Tree Physiology, 1997, 17(7): 490.
[17] Parolin P. Submergence tolerance vs. escape from submergence: two strategies of seedling establishment in Amazonian floodplains. Environmental and Experimental Botany, 2002, 48(2): 177- 186.
[18] 罗芳丽, 曾波, 陈婷, 叶小齐, 刘巅. 三峡库区岸生植物秋华柳对水淹的光合和生长响应. 植物生态学报, 2007, 31(5): 910- 918.
[19] 王海锋, 曾波, 李娅, 乔普, 叶小齐, 罗芳丽. 长期完全水淹对4种三峡库区岸生植物存活及恢复生长的影响. 植物生态学报, 2008, 32(5): 977- 984.
[20] Iwanaga F, Yamamoto F. Effects of flooding depth on growth, morphology and photosynthesis inAlnusjaponicaspecies. New Forests, 2008, 35(1): 1- 14.
[21] 刘云峰, 秦洪文, 石雷, 张会金, 刘立安, 姜闯道, 王德炉. 水淹对水芹叶片结构和光系统II光抑制的影响. 植物学报, 2010, 45(4): 426- 434.
[22] 许建平, 张小萍, 曾波, 袁慎鸿, 刘建辉, 刘明智. 完全水淹环境中光照和溶氧对喜旱莲子草表型可塑性的影响. 生态学报, 2014, 34(2): 258- 268.
[23] Wu Z Y, Raven P H, Raven P H, Hong D Y. Flora of China. Volume 9: Pittosporaceae Through Connaraceae. Beijing: Science Press, 2003.
[24] 谢春花, 李晓玲, 栾春艳, 杨进, 陈发菊, 李争艳. 湖北河岸带植物中华蚊母树遗传多样性的SRAP分析. 植物研究, 2012, 32(3): 311- 319.
[25] 李晓玲, 李宁, 杨进, 杨文辉, 陈发菊, 张正彬. 湖北中华蚊母ISSR遗传多样性分析及保护策略. 西北植物学报, 2011, 31(1): 38- 44.
[26] Liu Z B, Cheng R M, Xiao W F, Guo Q S, Wang N. Effect of off-season flooding on growth, photosynthesis, carbohydrate partitioning, and nutrient uptake inDistyliumchinense. PLoS One, 2014, 9(9): e107636.
[27] Li X L, Luan C Y, Yang J, Chen F J. Survival and recovery growth of riparian plantDistyliumchinenseseedlings to complete submergence in the three gorges reservoir region. Procedia Engineering, 2012, 28: 85- 94.
[28] 王勇, 厉恩华, 吴金清. 三峡库区消涨带维管植物区系的初步研究. 武汉植物学研究, 2002, 20(4): 265- 274.
[29] 樊大勇, 熊高明, 张爱英, 刘曦, 谢宗强, 李兆佳. 三峡库区水位调度对消落带生态修复中物种筛选实践的影响. 植物生态学报, 2015, 39(4): 416- 432.
[30] 鲍士旦. 土壤农化分析(第三版). 北京: 中国农业出版社, 2000.
[31] 王晓锋, 刘红, 张磊, 罗珍, 袁兴中, 岳俊生, 蔚建军. 澎溪河消落带典型植物群落根际土壤无机氮形态及氮转化酶活性. 中国环境科学, 2015, 35(10): 3059- 3068.
[32] West G B, Brown J H, Enquist B J. A general model for the origin of Allometric scaling laws in biology. Science, 1997, 276(5309): 122- 126.
[33] 黄迎新, 赵学勇, 张洪轩, 罗亚勇, 毛伟. 沙米表型可塑性对土壤养分、水分和种群密度变化的响应. 应用生态学报, 2008, 19(12): 2593- 2598.
[34] Wilson P J, Thompson K, Hodgson J G. Specific leaf area and leaf dry matter content as alternative predictors of plant strategies. New Phytologist, 1999, 143(1): 155- 162.
[35] 严德福, 杨允菲, 赵明清. 松嫩平原异质生境芦苇种群叶片的表型可塑性. 东北师大学报: 自然科学版, 2012, 44(2): 78- 83.
[36] 徐高峰, 申时才, 张付斗. 异质环境下入侵植物薇甘菊的适应性与繁殖特性. 生态环境学报, 2014, 23(8): 1258- 1264.
[37] 齐威, 郭淑青, 崔现亮, 阳敏, 张永东, 杜国祯, 卜海燕. 青藏高原东部4科植物种子大小和比叶面积随海拔和生境的变异. 草业学报, 2012, 21(6): 42- 50.
[38] Munier-Jolain N M, Collard A, Busset H, Guyot S H M, Colbach N. Investigating and modelling the morphological plasticity of weeds. Field Crops Research, 2014, 155: 90- 98.
[39] 胡耀升, 么旭阳, 刘艳红. 长白山森林不同演替阶段比叶面积及其影响因子. 生态学报, 2015, 35(5): 1480- 1487.
[40] Chen J S, Yu D, Liu Q, Dong M. Clonal integration of the stoloniferous herbFragariavescafrom different altitudes in southwest China. Flora-Morphology, Distribution, Functional Ecology of Plants, 2004, 199(4): 342- 350.
[41] Dong M, During H J, Werger M J A. Root and shoot plasticity of the stoloniferous herbAjugareptansL. planted in a heterogeneous environment. Flora-Morphology, Distribution, Functional Ecology of Plants, 2002, 197(1): 37- 46.
[42] 彭海欢, 翁晓燕, 徐红霞, 蒋琴素, 孙骏威. 缺钾胁迫对水稻光合特性及光合防御机制的影响. 中国水稻科学, 2006, 20(6): 621- 625.
[43] 张慧文, 马剑英, 孙伟, 陈发虎. 不同海拔天山云杉叶功能性状及其与土壤因子的关系. 生态学报, 2010, 30(21): 5747- 5758.
[44] Janssens F, Peeters A, Tallowin J R B, Bakker J P, Fillat F, Oomes M J M. Relationship between soil chemical factors and grassland diversity. Plant and Soil, 1998, 202(1): 69- 78.
[45] Roem W J, Berendse F. Soil acidity and nutrient supply ratio as possible factors determining changes in plant species diversity in grassland and heathland communities. Biological Conservation, 2000, 92(2): 151- 161.
[46] 孟婷婷, 倪健, 王国宏. 植物功能性状与环境和生态系统功能. 植物生态学报, 2007, 31(1): 150- 165.
