TACE治疗原发性肝细胞癌合并门静脉癌栓疗效及影响因素
2018-06-23刘开才吕维富周春泽成德雷方伟伟
刘开才,吕维富,周春泽,成德雷,方伟伟
(安徽医科大学附属省立医院影像科,安徽 合肥 230001)
肝细胞癌(hepatocellular carcinoma, HCC)在自然病程中倾向于侵袭门静脉,并继而形成癌栓,原发性HCC患者门静脉癌栓(portal vein tumor thrombosis, PVTT)发生率约为44.0%~62.2%[1]。PVTT不仅可导致HCC肝内播散及根治性切除术后早期复发,还可阻塞门静脉,继而导致肝衰竭及消化道出血、腹腔积液等,导致患者总体预后差,生存时间短[2]。目前临床对HCC合并PVTT主要采用靶向索拉非尼治疗方案[3-5],但价格高昂,并未得到普遍应用,以TACE为主的综合治疗仍是重要治疗方法之一。目前对该方案的疗效存在争议,且鲜见针对其相关危险因素进行的分层研究。本研究回顾性分析TACE治疗原发性HCC合并PVTT影响预后的主要因素,比较不同癌栓分型及肝功能患者接受TACE治疗的获益程度。
1 资料与方法
1.1 一般资料 回顾性分析2009年1月—2015年12月685例HCC合并PVTT患者,男499例,女186例,年龄19~85岁,平均(54.8±11.3)岁。纳入标准:①初诊HCC患者,诊断标准参照卫生部发布的《原发性肝癌诊疗规范(2011年版)》[6];②经影像学检查证实合并PVTT;③肝功能Child-Pugh分级为A或B级;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体力状况评分[7]≤2分。排除标准:①大量腹腔积液;②ECOG体力状况评分>2分;③肝性脑病;④血清胆红素>3 ml/dl;⑤血清白蛋白<2.0 mg/dl;⑥接受靶向治疗或放射治疗;⑦合并其他脏器严重疾病。依据de Kock等[7-8]提出的癌栓分型,218例癌栓分型为Ⅰ型(癌栓累及2级及以上门静脉分支),273例为Ⅱ型(癌栓累及1级门静脉分支),123例为Ⅲ型(癌栓累及门静脉主干),71例为Ⅳ型(癌栓累及肠系膜上静脉或下腔静脉)。685例中,475例接受TACE治疗(TACE组),210例接受保守支持治疗(支持治疗组),2组基线资料差异均无统计学意义,见表1。
1.2 仪器与方法
1.2.1 TACE 采用GE 3820S型DSA系统。以改良Seldinger法穿刺股动脉,将导管(或微导管)超选择至肿瘤供血动脉后进行造影,注入吡柔比星和超液态碘化油制成的混悬液进行栓塞;之后以直径150~350 μm的PVA栓塞肿瘤滋养血管,至血流停止。根据患者肿瘤特征、肝功能、骨髓抑制情况酌情调整具体用药和碘化油用量(一般用量5~20 ml)。术后6周左右复查血常规、肝功能、出凝血、AFP、上腹部CT或MRI(平扫+增强)。根据治疗效果等决定是否再次行TACE治疗。
1.2.2 支持治疗 对支持治疗组给予常规保肝、利尿等静脉营养支持治疗。
1.3 疗效评估及随访 短期疗效评估采用改良实体瘤疗效评价(modified response evaluation criteria in solid tumors, mRECIST)标准[9-11],并计算治疗有效率。对所有入组患者通过门诊、电话或结合邮件、书信形式进行随访,每月随访一次,记录疗效及患者生存情况,随访终点为患者死亡或2016年12月31日。
1.4 统计学分析 采用SPSS 17.0统计分析软件,计量资料以±s表示,2组间比较采用独立样本t检验,计数资料以频数或百分率表示,2组间比较采用χ2检验。采用Cox单因素分析筛选可能影响患者预后的因素,以P<0.05为差异有统计学意义。将单因素分析差异有统计学意义的变量纳入Cox多元回归模型,采用Kaplan-Meier检验比较2组生存时间,校验水准α=0.05。

表1 2组HCC合并PVTT患者基线资料比较
2 结果
2.1 短期疗效 短期疗效判定时间为入组后8周,至疗效判定时间死亡28例,其中TACE组5例、支持治疗组23例。2组短期疗效评估见表2。

表2 2组HCC合并PVTT患者短期疗效
注:CR:完全缓解;PR:部分缓解;SD:稳定;PD:进展
2.2 总体生存情况 至随访终点,共78例患者存活,25例患者失访,582例死亡(TACE组403例,支持治疗组179例)。全部患者中位生存时间为6.3个月(0.1~58.6个月),其中TACE组中位生存时间为7.1个月(0.1~58.6个月),支持治疗组中位生存时间为5.2个月(1.3~25.1个月)。TACE组和支持治疗组患者6、12、24个月累计生存率分别为57.30%、27.30%、12.10%和37.90%、12.20%、3.10%,差异有统计学意义(P<0.001,图1)。

图1 TACE组与支持治疗组患者生存曲线 图2 Ⅰ、Ⅱ型癌栓患者TACE与支持治疗生存曲线 图3 Ⅲ、Ⅳ型癌栓患者TACE与支持治疗生存曲线

分类例数[例(%)]风险比P值95%CI性别0.7190.053(0.515,1.004) 女96(14.01) 男589(85.99)年龄0.9540.688(0.758,1.200) ≤50岁260(37.96) >50岁425(62.04)肝炎病史0.8480.178(0.667,1.078) 无230(33.58) 有455(66.42)肝硬化0.8070.063(0.644,1.012) 无366(53.43) 有319(46.57)甲胎蛋白1.0960.463(0.858,1.400) ≤20 μg/L215(31.39) <20 μg/L470(68.61)总胆红素1.0170.917(0.743,1.392) ≤34 μmol/L581(84.82) >34 μmol/L104(15.18)谷氨酰转肽酶2.1040.009(1.203,3.679) ≤60 IU/L37(5.40) >60 IU/L648(94.60)血清白蛋白0.8310.127(0.656,1.054) ≤35 g/L252(36.79) >35 g/L433(63.21)腹腔积液1.1710.221(0.909,1.508) 无499(72.85) 有186(27.15)HCC病灶数1.050.348(0.939,1.195) 1个433(63.21) 2个36(5.26) ≥3个216(31.53)ECOG评分1.0550.647(0.840,1.325) 0或1分411(60.00) 2分274(40.00)凝血酶原时间0.9850.908(0.769,1.263) ≤14 s491(71.68) >14 s194(28.32)HCC病灶最大径1.3180.004(1.090,1.594) <5 cm52(7.59) 5~10 cm285(41.61) >10 cm348(50.80)转移0.8070.101(0.624,1.043) 无493(71.97) 有192(28.03)谷丙转氨酶0.9120.427(0.726,1.145) ≤40 IU/L275(40.15) >40 IU/L410(59.85)空腹血糖0.9290.655(0.673,1.283) ≤6.1 mmol/L583(85.11) >6.1 mmol/L102(14.89)门静脉高压0.8390.129(0.668,1.053) 无366(53.43) 有319(46.57)抗病毒0.8600.208(0.680,1.087) 无246(35.91) 有439(64.09)Child-Pugh分级1.4330.002(1.141,1.800) A397(57.96) B288(42.04)癌栓分型0.0081.428(1.098,1.857) Ⅰ或Ⅱ型523(76.35) Ⅲ或Ⅳ型162(23.65)
2.3 预后因素 共纳入性别、年龄、肝炎病史等20个因素。单因素分析显示,谷氨酰转肽酶水平、HCC病灶最大径、Child-Pugh分级及癌栓分型可能影响患者预后(表3);多元回归分析显示,Child-Pugh分级和癌栓分型为影响患者预后的独立风险因素(表4)。
2.4 TACE治疗不同癌栓分型及Child-Pugh分级患者疗效 Ⅰ、Ⅱ型癌栓患者中,TACE组和支持治疗组中位生存时间分别为7.8个月和5.5个月,6、12、24个月累计生存率分别为63.20%、30.80%、11.30%和42.40%、11.70%、3.30%,差异有统计学意义(P=0.001,图2)。Ⅲ、Ⅳ型癌栓患者中,TACE组和支持治疗组中位生存时间分别为5.3个月和4.5个月,6、12、24个月累计生存率分别为40.30%、15.80%、4.20%和26.40%、13.30%、4.50%,差异无统计学意义(P=0.662,图3)。Child-Pugh A级患者中,TACE组和支持治疗组中位生存时间分别为8.8个月和5.9个月,6、12、24个月累计生存率分别为64.30%、34.20%、16.80%和49.30%、18.20%、6.30%,差异有统计学意义(P=0.003,图4)。Child-Pugh B级患者中,TACE组和支持治疗组中位生存时间分别为5.5个月和4.0个月,6、12、24个月累计生存率分别为45.20%、17.80%、6.20%和28.70%、12.10%、4.20%,差异无统计学意义(P=0.180,图5)。
3 讨论
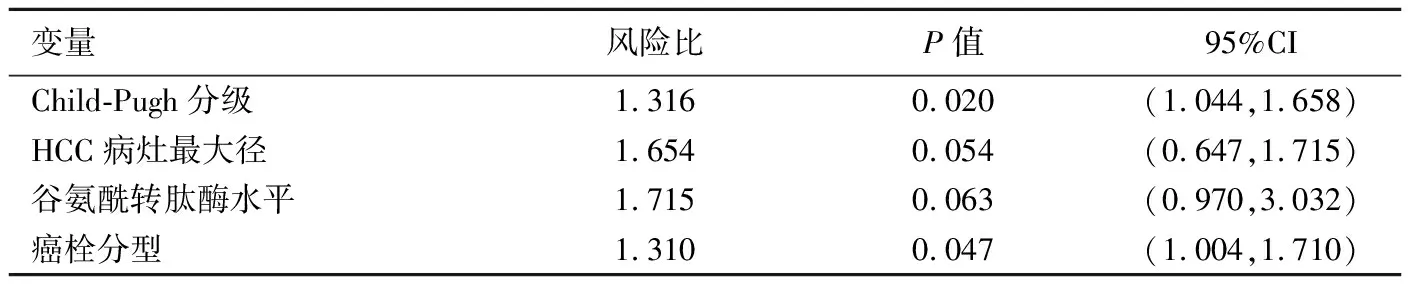
表4 HCC合并PVTT患者预后多因素回析
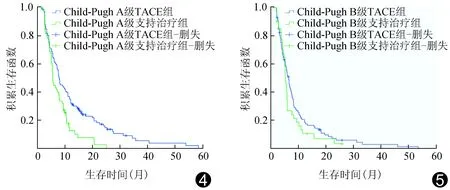
图4 肝功能Child-Pugh A级患者TACE与支持治疗生存曲线 图5 肝功能Child-Pugh B级患者TACE与支持治疗生存曲线
目前对HCC合并PVTT患者能否行TACE治疗仍存在争议。理论上,PVTT形成使肝脏血供受到影响,栓塞肝动脉可能导致肝梗死或肝衰竭。近年相关研究[12-16]表明,对HCC合并PVTT患者行TACE治疗有助于延长患者生存时间。Luo等[13]在一项前瞻性随机对照研究中将164例HCC合并PVTT患者分为TACE组(84例)与保守治疗组(80例),中位生存时间分别为7.1个月和4.1个月。本研究结果同样表明TACE治疗可延长HCC合并PVTT患者生存时间,TACE组中位生存时间长于支持治疗组(P<0.001)。
虽然TACE治疗有助于延长HCC合并PVTT患者的生存时间,但本研究表明癌栓分型是影响患者预后的独立风险因素,提示不同癌栓分型患者的获益程度不同,与Kim等[14]研究结果相符。本研究根据PVTT是否侵犯门静脉主干进行进一步分析,发现TACE治疗可延长Ⅰ、Ⅱ型癌栓患者的生存时间,但对Ⅲ、Ⅳ型癌栓患者TACE与支持治疗并无明显差异。Niu等[15]指出,对Ⅰ~Ⅳ型癌栓患者,TACE与支持治疗患者生存时间差异均有统计学意义(P均<0.05)。本研究与既往研究[15]结果不同,可能与Niu等[15]纳入的样本量较少,且Ⅲ、Ⅳ型癌栓患者样本量更少或纳入此类患者的肝功能较好有关。本研究Ⅲ、Ⅳ型癌栓患者多缺乏再通侧支,TACE术后部分患者出现腹腔积液加重、消化道出血等一系列并发症,甚至出现急性肝衰竭,限制了TACE治疗的应用。
此外,本研究发现Child-Pugh分级是影响HCC合并PVTT患者预后的独立因素。Georgiades等[16]研究也显示,Child-Pugh分级是影响HCC合并PVTT患者预后最密切的相关因素[95%CI(1.78,145.91),P=0.013 5),Child-Pugh A、B级患者中位生存时间分别为11.0个月和4.0个月。本研究分别比较Child-Pugh A级与B级患者TACE治疗组和支持治疗组的生存率,发现在Child-Pugh A级患者中2组生存率差异有统计学意义(P=0.003),但在Child-Pugh B级患者中2组间生存率差异无统计学意义(P=0.180),提示虽然Child-Pugh A、B级患者均能从TACE中获益,但Child-Pugh A级患者获益更大,其主要原因在于Child-Pugh分级越高,肝功能代偿能力越差,肝脏耐受能力低,再次接受TACE治疗的条件差,无法获得良好效果,甚至可能加快部分患者发生肝衰竭。
本研究的局限性在于并非前瞻性研究,纳入样本不随机,尚需前瞻性研究证实。
总之,TACE是治疗HCC合并PVTT的一种有效方式。Child-Pugh分级和癌栓分型是影响患者预后的重要因素,但对于Ⅲ、Ⅳ型癌栓患者行TACE治疗未见明显获益。
[参考文献]
[1] Takizawa D, Kakizaki S, Sohara N, et al.Hepatocellular carcinoma with portal vein tumor thrombosis: Clinical characteristics, prognosis, and patient survival analysis. Dig Dis Sci, 2007,52(11):3290-3295.
[2] Llovet JM, Bustamante J, Castells A, et al. Natural history of untreated nonsurgical hepatocellular carcinoma: Rationale for the design and evaluation of therapeutic trials. Hepatology, 1999,29(1):62-67.
[3] Llovet JM, Fuster J, Bruix J, et al. The Barcelona approach: Diagnosis, staging, and treatment of hepatocellular carcinoma. Liver Transpl, 2004,10(2 Suppl 1):S115-S120.
[4] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med, 2008,359(4):378-390.
[5] Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: A phase Ⅲ randomised, double-blind, placebo-controlled trial. Lancet Oncol, 2009,10(1):25-34.
[6] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).临床肝胆病杂志,2011,16(11):929-946.
[7] de Kock I, Mirhosseini M, Lau F, et al. Conversion of Karnofsky Performance Status (KPS) and Eastern Cooperative Oncology Group Performance Status (ECOG) to Palliative Performance Scale (PPS), and the interchangeability of PPS and KPS in prognostic tools. J Palliat Care, 2013,29(3):163.
[8] Shi J, Lai EC, Li N, et al. A new classification for hepatocellular carcinoma with portal vein tumor thrombus. J Hepatobiliary Pancreat Sci, 201l,18(1):74-80.
[9] 杨嘉嘉,林礼务,薛恩生,等.原发性肝细胞肝癌并发门静脉癌栓的分型及超声表现.中国医学影像技术,2008,24(12):1976-1979.
[10] Edeline J, Boucher E, Rolland Y, et al. Comparison of tumor response by response evaluation criteria in solid tumors (RE-CIST) and modified RECIST in patients treated with sorafenib for hepatocellular carcinoma. Cancer, 2012,118(1):147-156.
[11] Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepato-cellular carcinoma. Semin Liver Dis, 2010,30(1):52-60.
[12] Shim JH, Lee HC, Kim SO, et al. Which response criteria best help predict survival of patients with hepatocellular carcinoma following chemoembolization? A validation study of old and new models. Radiology, 2012,262(2):708-718.
[13] Luo J, Guo RP, Lai EC, et al. Transarterial hemoembolization for unresectable hepatocellular carcinoma with portal vein tumor thrombosis: A prospective comparative study. Ann Surg Oncol, 2011,18(2):413-420.
[14] Kim KM, Kim JH, Park IS, et al. Reappraisal of repeated transarterial chemoembolization in the treatment of hepatocellular carcinoma with portal vein invasion. J Gastroenterol Hepatol, 2009,24(5):806-814.
[15] Niu ZJ, Ma YL, Kang P, et al. Transarterial chemoembolization compared with conservative treatment for advanced hepatocellular carcinoma with portal vein tumor thrombus: Using a new classification. Med Oncol, 2012, 29(4):2992-2997.
[16] Georgiades CS, Hong K, D'Angelo M, et al. Safety and efficacy of transarterial chemoembolization in patients with unresectable hepatocellular carcinoma and portal vein thrombosis. J Vasc Interv Radiol, 2005,16(12):1653-1659.