贵州省典型植烟生态区域根际土壤微生物群落多样性
2018-06-22刘艳霞蔡刘体石俊雄
刘艳霞,李 想, 邹 焱,张 恒,蔡刘体,孟 琳,石俊雄
贵州省烟草科学研究院,贵阳 550000
土壤微生物是土壤中物质形成与转化的关键动力[1],伴随着土壤的形成与发育,在维系土壤结构、保育土壤肥力、影响土壤植被等方面起着不可替代的作用,是土壤质量评价不可缺少的指标之一[2]。土壤微生物多样性是指土壤生态系统中所有的微生物种类、它们拥有的基因以及这些微生物与环境之间相互作用的多样化程度[3],土壤微生物群落功能多样性是土壤微生物群落状态的指标,可以反应土壤中微生物群落的生态特征和土壤肥力特征[4],对于深入认识地下生态系统的结构和功能以及开展微生物多样性资源的保护和利用具有重要意义[5]。土壤微生物群落的多样性主要包括微生物物种多样性、遗传多样性、结构多样性以及功能多样性[6],丰富的微生物群落多样性不仅能缓解连作障碍,而且是维持土壤健康稳定的保证[7]。
近年来研究者们逐渐认识到土壤微生物对农业生产的重要调控作用,采用各种技术手段提高土壤微生物多样性,比如秸秆覆盖提高土壤微生物多样性[8],有机肥的施用改变了土壤微生物的群落结构,改善了土壤微生物的代谢功能[9],同时利用生物有机肥调控土壤微生物群落结构实现烟草青枯病的生物防控[10]。土壤健康尤其是土壤微生态平衡是生产优质烟叶的重要保障,Liu等[11]摸索生物有机肥施用后根际土壤微生物数量、群落功能多样性和结构多样性的变化,李想等[12]利用综合防控措施平衡烟草根际微生物群落进而烟草青枯病发病率显著下降,而Wu[13]等探究了不同烟草品种根系分泌物对微生物群落的影响。
近年来,世界各地相继开展一些生态环境和土壤微生物间的研究,使人们对土壤微生物的组成和功能多样性及其时空分布有了更深入的认识[14]。2011年发起的全球土壤生物多样性倡议(Global Soil Biodiversity Initiative,www.globalsoilbiodiversity.org)旨在促进对土壤生物多样性及其生态服务功能的认识,为制定环境政策提供科学依据。国内对于土壤微生物多样性的监测与研究起步相对较晚,由于技术手段的进步,土壤微生物多样性和生物地理学方面的研究取得了丰硕的成果。对我国黑土生态区域调查研究结果表明,细菌群落的组成主要受土壤pH和有机碳的影响[15],而真菌群落的变化主要受土壤有机碳的驱动[16]。对长白山垂直带谱上土壤细菌[17]和真菌[18]多样性变异进行研究后发现,土壤微生物多样性随海拔的变化与植物表现出不同的趋势,土壤pH也是驱动微生物多样性变异的关键因子。Ren等[19]对太白山不同海拔理的微生物区系进行研究后发现,在不同海拔下细菌比真菌更能反映植株和土壤的变化特性。然而,上述研究都聚焦于生态环境中的某些重要因子,比如海拔、pH、有机质等,但还未见系统分析综合生态因子即生态区划下的微生物结构和多样性的研究。
21 世纪以来,新一代高通量测序技术的发展日新月异,可直接测序16S DNA基因的PCR产物,每次分析获得的基因序列数以百万甚至亿万计,不仅通量高,而且能够同时分析上百个不同的样品,是解析复杂环境中微生物群落物种组成和相对丰度的重要工具[20],探究土壤微生物群落的发展动态,对调节土壤养分的固持和释放,以满足烤烟不同生育时期对养分的需求有重要意义。因此本研究针对贵州省典型植烟生态区域土壤进行微生物群落的研究以及多方面分析,为后续土壤生物修复提供理论依据。
1 材料与方法
1.1 供试材料
在贵州省典型植烟生态区域于烟株移栽后55 d“五点法”采集正常生长烟田的典型根际土壤样品。采集土壤样品时按照采样地点、经纬度、海拔等进行详细记录、编号,采集的土壤样品全部为植烟土壤,且当季都施用无机肥+有机肥,无机肥减氮20%,有机肥种类相同,都为油枯有机肥。样品的采集地块烟株生长健康,长势旺盛,全田基本无病害。选取田块内长势较一致的五株烟株,将烟草根系整体取出,轻轻抖动去除根圈土壤,将根及根表附着的土壤一起置于10 mL灭菌水中,超声波震荡15 min后得到的土壤即为根际土壤[21]。采集的典型土壤样品的基本信息见表1。
1.2 土壤样品理化性状测定方法
土壤的全N和有机碳含量通过Elementar高精度元素分析仪测定;pH采用FiveEasy Plus pH计测定。
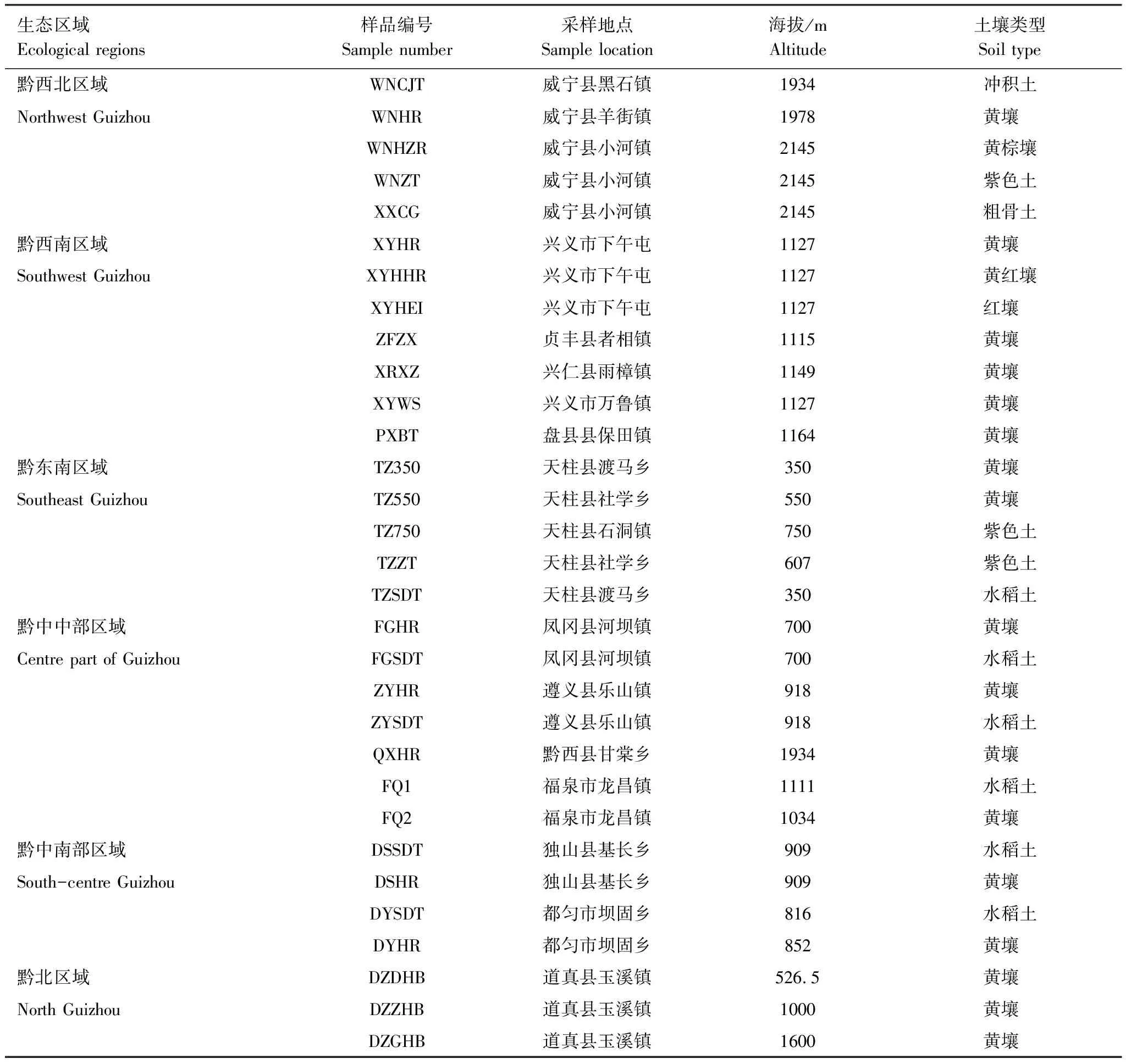
表1 各生态区域概况
1.3 土壤DNA提取及PCR反应
采集土壤DNA采用Soil DNA Isolation Kit(Omega)提取,提取后的土壤DNA,取适量的样品于离心管中,使用无菌水稀释至1×10-3μg/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带标签序列(Barcode)的特异引物和高保真、含有GC缓冲液的PCR混合液(Master Mix with GC Buffer)(纽英伦生物技术公司,New England Biolabs),同时使用高效和高保真的酶进行扩增,确保扩增效率和准确性。引物对应区域:16S V4区引物为515F- 806R。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,使用赛默科学公司(Thermo Scientific)的凝胶回收试剂盒(GeneJET)回收产物。
PCR扩增反应体系: Ex Tq loading Buffer 25 μL,上下游引物各1 μL(25 pmol/μL),模板DNA 2 μL, dd H2O 21 μL,总体积50 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,72 ℃保持10 min,共循环32次,4 ℃保温。
1.4 文库构建、测序和数据分析
使用纽英伦生物技术(New England Biolabs)公司亿美达(Illumina)的超DNA文库制备试剂盒(NEB Next® UltraTMDNA Library Prep Kit for Illumina)进行文库的构建,构建好的文库经过量子位(Qubit)定量和文库检测,合格后,使用MiSeq进行上机测序。基于个人基因组分析测序平台(MiSeq Personal Sequencing System,Illumina,美国)[22],利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。
测序得到的原始数据,存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据。然后基于有效数据利用Uparse[23]软件(Uparse v7.0.1001,美国)对所有样品的全部有效标签序列聚类,以95%的一致性(Identity)进行运算分类单位(Operational taxonomic units, OTUs)聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果[24]。再对OTUs进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。最后在以上分析的基础上,可以进行一系列的基于OTUs和物种组成的聚类分析、主成分分析(Principal component analysis,PCA)等[25]。
1.5 数据处理
实验数据采用Microsoft Excel 2003处理,显著性分析采用SPSS Base Ver.13.0统计软件 (SPSS, IL, Chicago, 美国)进行,最小显著差异法(LSD)或邓肯(Duncan)新复极差进行多重比较(P<0.05)。
2 结果与分析
2.1 不同植烟生态区域土壤样品基本理化特性
由表2可见,土壤的pH值变幅为4.88—7.45,没有>7.5的土样,6.5—7.5的中性土壤占总样品数的29.04%,5.5—6.5的微酸性土壤占35.48%,<5.5的酸性土壤占35.48%。从土壤类型来看,红壤、红黄壤、紫色土和一半的水稻土均为酸性土壤;黄壤以中性和微酸性为主,酸性黄壤仅占总样本数的13%;其他土种以中性为主。
土壤的有机碳含量很丰富(以土壤养分分级评价体系中的有机质指标进行判断,以下相同),平均2.24%,变幅为1.11%—3.69%,有机碳含量总体偏高。土壤有机碳>2.87%的样品占总样品数的22.58%,1.72%—2.87%的占54.84%,0.86%—1.72%的占22.58%,<0.86%的没有。从土壤类型来看,黄棕壤的有机碳含量最高,其次是冲积土和水稻土。总体来看,土壤有机碳变化的随海拔升高,有机碳含量呈增加的趋势,同区域内有机碳含量也海拔升高呈增加的趋势。从区域来看,黔西北区域的全氮含量相对较高,其次是黔西南区域也较高,而黔中区域和黔东南区域相对较低。
土壤的全氮含量很丰富,平均0.23%,变幅为0.14%—0.34%,土壤全氮>0.2%的样品占总样品数的64.52%,0.1%—0.2%的占35.48%,<0.1%的没有。从土壤类型来看,黄棕壤和水稻土的全氮含量最高。同区域内全氮含量于海拔无相关性。从区域来看,黔西北区域的全氮含量相对较高,其他区域差异较小。
2.2 不同植烟生态区域土壤微生物物种多样性(OTU)的差异分析
从不同的生态区域看(图1),土壤微生物的OTUs数量差异明显,总体是西部高于东部,南部高于北部。其中,黔北区域土壤微生物的OTUs数量最多,其次是黔中区域,黔中划分的黔中中部区域和黔中南部区域2个区域在OTUs数量几乎没有差异,黔东南区域与黔中区域差异较小,黔西南区域和黔西北区域的OTUs数量相对较少,最少的是黔西北区域。黔北区域的OTUs数量是分别是黔西南和黔西北区域OTUs的1.44和1.66倍。
同一生态区域不同海拔的土壤样品中OTUs数量差异显著(图2)。在黔东南区域,土壤微生物的OTUs数量随着土壤样品所处的海拔升高而呈现降低趋势,而在黔北区域,土壤微生物的OTUs数量从多到少依次为中海拔的土壤样品,低海拔的土壤样品和高海拔的土壤样品。黔东南区域与黔北区域土壤微生物的OTUs数量在高和低海拔之间无显著差异,但在中海拔上黔北显著高于黔东南,是黔东南的1.65倍。
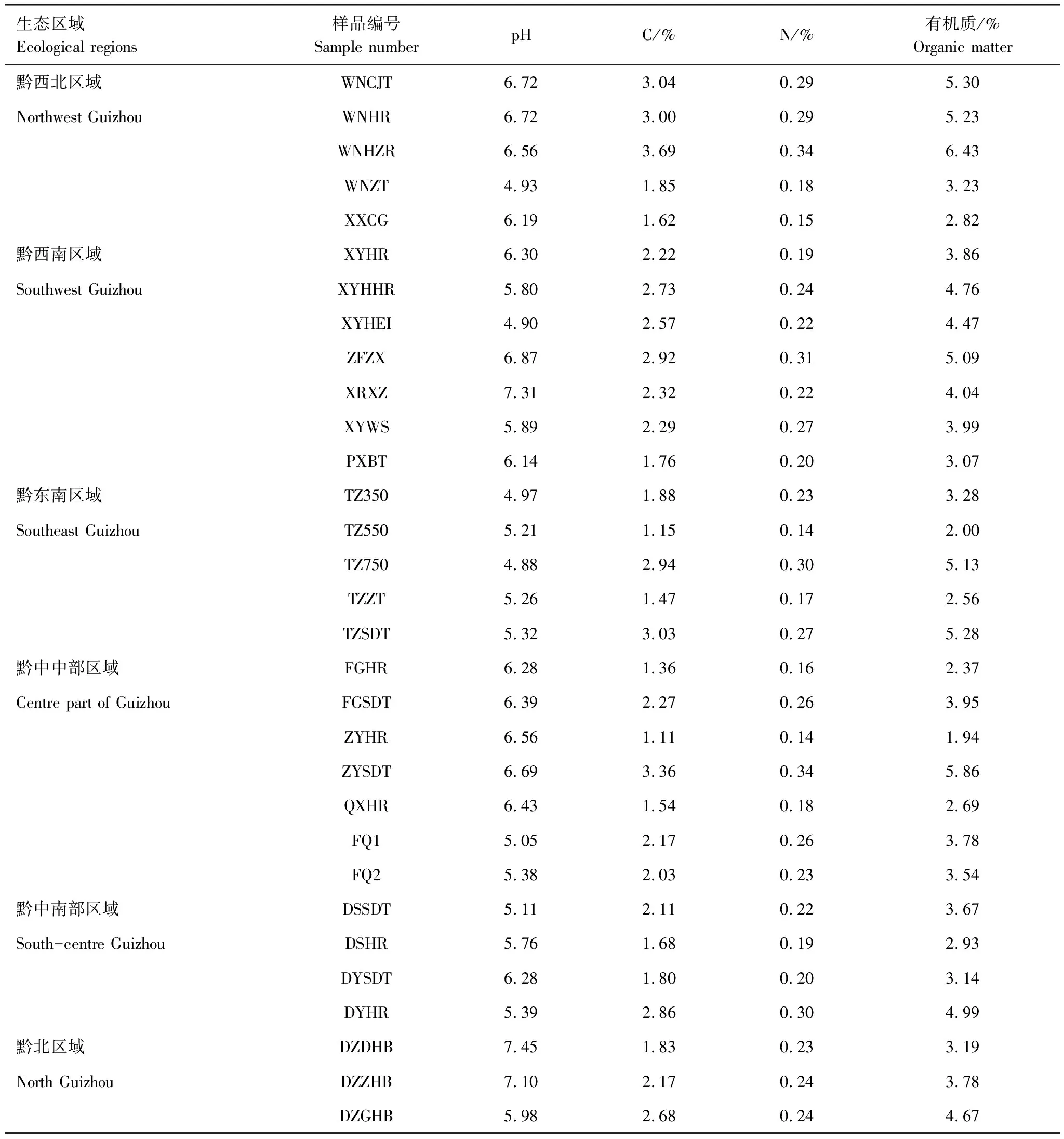
表2 典型生态区域土壤样品的基本理化性质
不同土壤类型的土壤微生物的OTUs数量有差异(图3),紫色土微生物的OTUs数量显著高于黄壤,比黄壤微生物的OTUs数量增加25.5%;黄壤微生物的OTUs数量显著高于冲积土和粗骨土,黄棕壤土壤微生物的OTUs数量最低仅为紫色土的59.5%。
2.3 不同植烟土壤微生物群落属水平丰度结构多样性分析
根据所有检测样品中微生物属水平的物种注释及丰度信息(图4),在不同区域中,天柱紫色土(TZZT)、黔西黄壤(QXHR)、福泉黄壤(FQ2)、盘县保田(PXBT)、凤冈黄壤(FGHR)、遵义水稻土(ZYSDT)、威宁紫色土(WNZT)和天柱的海拔350 m样品(TZ350)具有优势菌群,其他土壤中的微生物属水平的物种较为平衡。
在相同的生态区域中,不同海拔土壤微生物的丰度聚类关系不同。道真低海拔土壤(DZDHB)与道真高海拔土壤(DZGHB)微生物属水平的聚类关系较近,但与道真中海拔土壤(DZZHB)微生物的聚类关系较远;天柱中海拔土壤(TZ550)与高海拔土壤(TZ750)微生物属水平的聚类关系最近,而与低海拔土壤(TZ350)微生物的属水平聚类关系较近。
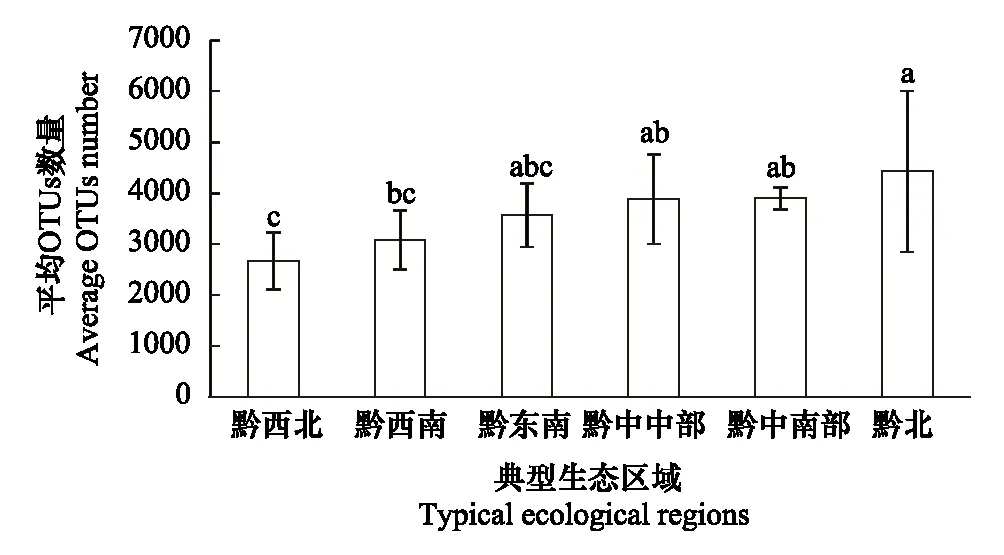
图1 不同生态区域OTUs总量的差异Fig.1 OTUs difference in different ecological regions
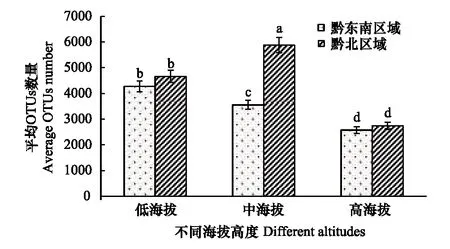
图2 同一生态区域内不同海拔OTUs总量的差异Fig.2 OTUs difference in different altitudes in the same ecological region
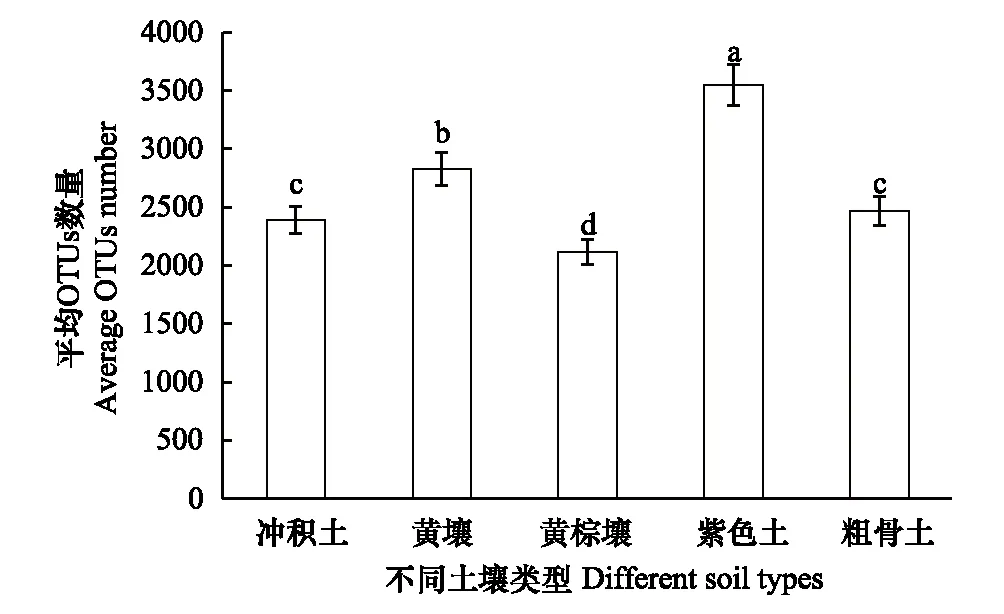
图3 不同土壤类型OTUs数量的比较Fig.3 OTUs difference of different soil types
在不同的土壤类型中,天柱紫色土(TZZT)和威宁紫色土(WNZT)与其他生态区域的各类土壤微生物属水平的聚类关系都为最远;在不同生态区域,相同类型的土壤间的微生物属水平的聚类关系较近,独山水稻土(DSSDT)与都匀水稻土(DYSDT)微生物属水平聚类关系最近,与福泉水稻土(FQ1)和天柱水稻土(TZSDT)微生物属水平聚类关系也较近,只与遵义水稻土(ZYSDT)属水平聚类关系相对较远。
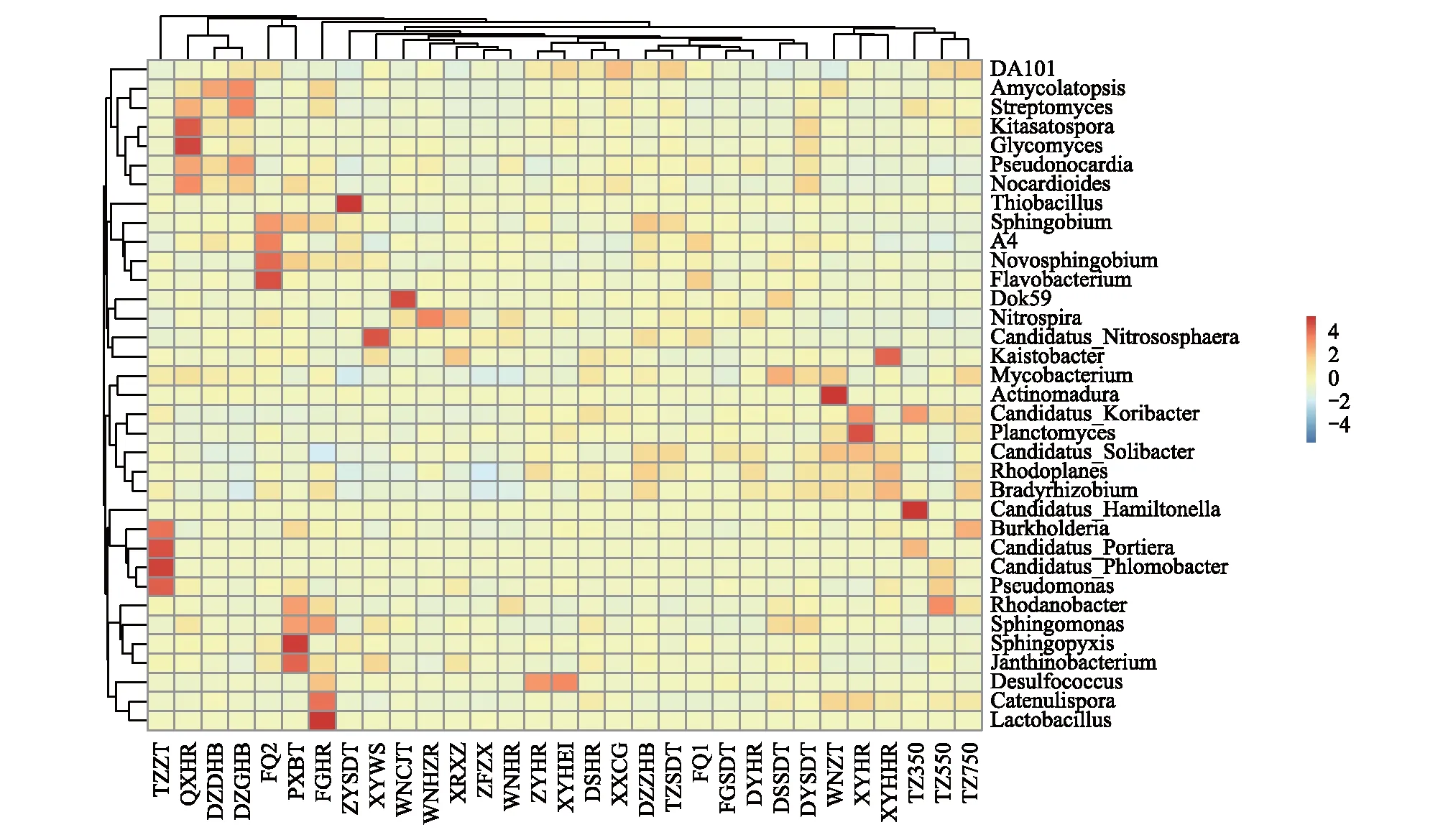
图4 土壤微生物物种丰度聚类图Fig.4 OTUs difference of different soil typesAmycolatopsis:拟无枝菌酸菌;Streptomyces:链霉菌;Kitasatospora:北里孢菌;Glycomyces:糖霉菌;Pseudonocardia:假诺卡氏菌;Nocardioides:类诺卡氏菌;Thiobacillus:硫杆菌;Sphingobium:鞘脂菌;Novosphingobium:新鞘氨醇杆菌;Flavobacterium:黄杆菌;Nitrospira:硝化螺旋菌;Candidatus Nitrososphaera:亚硝化螺旋菌暂定种;Mycobacterium:分支杆菌;Actinomadura:马杜拉放线菌;Rhodoplanes:紫色非硫细菌;Bradyrhizobium:短根瘤菌;Candidatus Hamiltonella:烟粉虱次生内共生菌;Burkholderia:伯克氏菌;Candidatus Portiera:烟粉虱初生共生菌;Pseudomonas:假单胞菌;Rhodanobacter:产黄杆菌;Sphingomonas:鞘氨醇单胞菌;Sphingopyxis:鞘氨醇盒菌;Janthinobacterium:紫色杆菌;Desulfococcus:脱硫球菌;Catenulispora:棒杆菌;Lactobacillus:乳酸菌
2.4 不同植烟生态区域土壤微生物特定功能多样性的差异比较
基于土壤微生物的种类丰度的分析结果,在微生物属水平上进行物种分类树统计,多个土壤微生物的物种分类树(图5)的结果显示,不同区域土壤中的微生物的种类比例显著不同。其中,厚壁菌门绝大部分集中在黔中中部的样品中,天柱紫色土(TZZT)在变形菌(Proteobacteria)门上γ-变形菌亚门(Gammaproteobacteria)所占有的比例最大,变形菌门的肠杆菌目(Enterobacteriales)和粉虱共生细菌目(Aleyrodidarum)的比例在所有检测样品中最高,达到75%以上。而威宁紫色土(WNZT)在变形菌门和硫化细菌属(Thicbacillus)比例居所有土壤样品中所占比例最大。
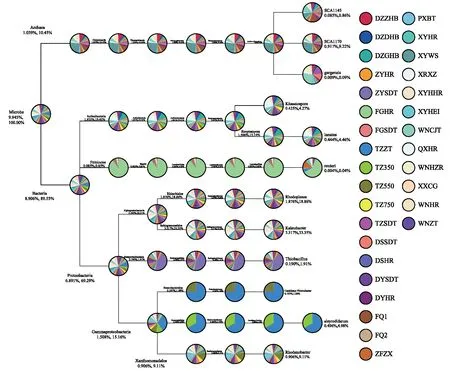
图5 土壤微生物群落中特定物种分类树Fig.5 Classifiction tree of special microbial community in soilArchaea:古细菌;Microbe:微生物;Bacteria:细菌;Proteobacteria:变形菌;Gammaproteobacteria:γ-变形菌;Xanthomonadales:黄色单胞菌
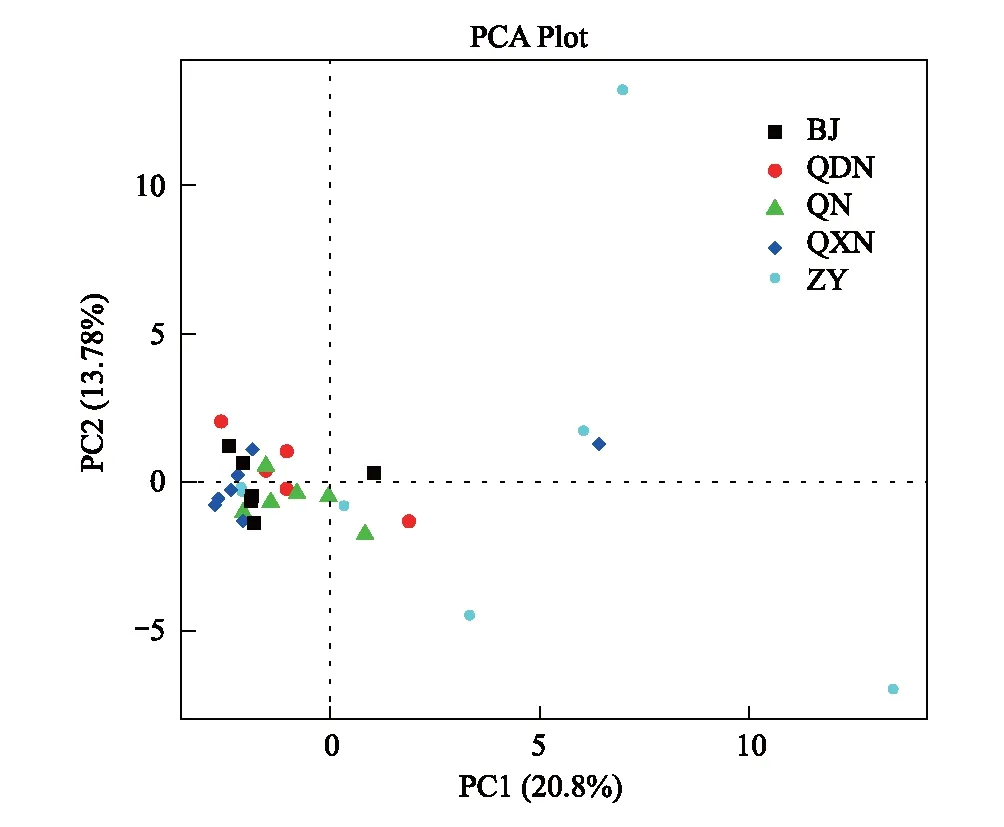
图6 不同生态区域土壤样品β多样性主成分分析 Fig.6 The principal component analysis (PCA) of β-diversity of soil samples in different ecological regionsBJ, 黔西北地区,Northwest Guizhou;QDN, 黔东南地区,Southwest Guizhou; QN, 黔南地区, South Guizhou; QXN, 黔西南地区,Southwest Guizhou; ZY, 遵义地区, Zunyi
2.5 根际土壤微生物丰度与土壤理化性状主成份分析
从图6中可以看出,同一地区的微生物群落在PCA图中较为相近,表明同一地区的微生物群落组成较为相似,而黔西南区域内个别样品的群落组成距离较远,黔北地区的样品间差异特征明显。黔中中部区域,土壤微生物受到土壤营养元素的影响较大,土壤微生物群落组成结构差异显著,而其他地区受条件营养元素和结构的影响较小,土壤微生物的群落组成也较为相似。在黔西北区域、黔东南区域及黔中南部区域的不同生态区域、不同土壤类型及不同海拔高度的土壤,总体的微生物群落组成相近,土壤受到营养元素的影响较大。另外,主成分1(PC1)和主成分2(PC2)是造成不同生态区域土壤微生物群落结构的两个最大差异特征,贡献率分别为20.80% 和13.78%。
3 讨论与结论
土壤微生物生物指标主要包括土壤微生物的数量、生物量、多样性及其活性等方面,这些因素直接或间接决定土壤的理化性质和营养元素有效性。土壤微生物多样性是土壤稳定性与质量的最关键因素[26],而且可以调控土壤各种非生物指标,因此近年来发现研究土壤微生物多样性和其种群结构是研究土壤健康与肥力指标最重要的领域。本研究中贵州典型植烟区域的土壤强酸性土壤(<5.5)占到全部样品的35.48%,存在土壤酸化的危险,土壤pH值与土壤抑病性呈负相关,酸性越强的土壤抑病性越弱[27-28],同时在有机碳和全氮含量丰富情况下,酸性土壤下极易导致土传病害的爆发,从土壤物理指标上对微生物群落失衡进行了预警。从图6看出,在黔中区域内的土壤微生物受到营养元素的影响较大,各土壤间的微生物群落组成结构差异显著;而其他地区受营养元素和结构的影响较小,样品的群落组成也较为相似,说明土壤微生物的群落与土壤营养状况联系不是很密切,可能对生态条件等其他因素有关[29]。同时图1的研究结果也侧面验证了该问题,土壤微生物的OTUs数量总体是西部高于东部,南部高于北部,而贵州烟株移栽55d时的气温与OTUs数量的趋势基本一致。
根际土壤微生物群落的平衡性是土壤健康的重要指标之一。土壤微生物群落结构失衡,种群趋于单一化,土壤从细菌型向真菌型转化,微生物多样性、均匀度降低,青枯病菌茄科劳尔氏菌数量增加[11]。本研究发现土壤类型中紫色土中的普遍存在优势种群,并且与其他土壤聚类关系最远,而水稻土的中微生物丰度聚类关系基本很近(图4),这表明土壤类型对土壤微生物群落多样性的影响比较大,这与Perez等[30]研究相类似,同时黔西南和黔中中部区域土壤微生物丰度优势种群显著高于其他地区,种群平衡度不高,具有土传病害发生的潜在危险。
土壤功能微生物的多少直接表征土壤营养转化能力以及抗病能力[31],通过图5发现厚壁菌门绝大部分集中在黔中中部的样品中,很多厚壁菌可以产生芽孢,它可以抵抗脱水和极端环境,减轻天气灾害对土壤的冲击[32]。天柱紫色土(TZZT)在变形菌(Proteobacteria)门上γ-变形菌亚门(Gammaproteobacteria)所占有的比例最大,可以潜在对土传病原菌进行抵抗[33]。
生态区域为一些外貌结构相似、受相同气候、土壤条件影响的生态系统所构成的区域性单元。以往对贵州不同生态区域的研究主要集中在烟叶品质[34]、施氮量差异[35]和有机肥的影响[36]等方面,未见微生物区系方面的系统研究。李松龄等[37]研究三江源不同生态系统下土壤微生物区系差异,得出结论:湿地生态系统由于水分及热量等环境条件不同,土壤微生物数量显著高于草地生态系统、森林生态系统和荒漠生态系统。但此类研究并不是系统研究微生物区系,而是仅用平板涂布法测定微生物数量差异。第二代高通量测序技术的成熟和普及,使我们能够对环境微生物进行深度测序,不但解决了大部分菌株不可培养的难题、客观还原了微生物菌群结构,还能灵敏地探测出环境微生物群落结构随外界环境的改变而发生的极其微弱的变化,对于我们研究微生物与环境的关系、环境治理和微生物资源的利用等方面有着重要的理论和现实意义。尚天翠等[38]在研究不同生态条件下樱桃林的土壤细菌数量的变化时发现土壤细菌的数量与土壤有机质和全氮含量间存在极显著的正相关,与该研究中微生物的多样性指数和土壤有机质含量呈正比相似。Shen等[17]的研究表明,长白山上的细菌群落多样性与pH显著正相关。本试验中采用的PCA分析是从多维数据中提取出最主要的元素和结构进行分析,较物种相对丰度的聚类更加说明问题[39]。本研究不同生态区域的微生物结构与土壤碳、氮 、有机质及pH值与土壤微生物区系都没有对应关系,生态环境(包括气候、海拔、土壤类别等因素)相似地区土壤微生物结构较为相似,表明土壤微生物结构是受多种因素综合影响和决定的。PCA分析也证明了这一论点:主成分1(PC1)和主成分2(PC2)是造成不同生态区域土壤微生物群落结构的两个最大差异特征,贡献率分别为20.80% 和13.78%,表明并非单一“因素”能够非常显著地影响生态区域土壤微生物的组成,而是综合因素共同作用的结果。
综上所述,通过对贵州省典型植烟生态区域根际土壤的微生物群落的分析与研究为后续土壤生物修复提供理论依据奠定了良好的研究基础。
参考文献(References):
[1] Bastida F, Zsolnay A, Hernández T, García C. Past, present and future of soil quality indices: a biological perspective. Geoderma, 2008, 147(3/4): 159- 171.
[2] Shi Y, Grogan P, Sun H B, Xiong J B, Yang Y F, et al. Multi-scale variability analysis reveals the importance of spatial distance in shaping Arctic soil microbial functional communities. Soil Biology and Biochemistry, 2015, 86: 126- 134.
[3] 林先贵, 陈瑞蕊, 胡君利. 土壤微生物资源管理、应用技术与学科展望. 生态学报, 2010, 30(24): 7029- 7037.
[4] Sun R B, Zhang X X, Guo X S, Wang D Z, Chu H Y. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw. Soil Biology and Biochemistry, 2015, 88: 9- 18.
[5] 李香真, 郭良栋, 李家宝, 姚敏杰. 中国土壤微生物多样性监测的现状和思考. 生物多样性, 2016, 24(11): 1240- 1248.
[6] 林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能. 土壤学报, 2008, 45(5): 892- 900.
[7] Enwall K, Nyberg K, Bertilsson S, Cederlund H, Stenström J, Hallin S. Long-term impact of fertilization on activity and composition of bacterial communities and metabolic guilds in agricultural soil. Soil Biology and Biochemistry, 2007, 39(1): 106- 115.
[8] 董立国, 袁汉民, 李生宝, 袁海燕, 潘占兵. 玉米免耕秸秆覆盖对土壤微生物群落功能多样性的影响. 生态环境学报, 2010, 19(2): 444- 446.
[9] 李胜华, 谷丽萍, 刘可星, 廖宗文. 有机肥配施对番茄土传病害的防治及土壤微生物多样性的调控. 植物营养与肥料学报, 2009, 15(4): 965- 969.
[10] Zhong W, Yang X M, Yin S X, Shen Q R, Ran W, Xu Y C. Efficacy ofBacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field. Applied Soil Ecology, 2011, 48(2): 152- 159.
[11] Liu Y X, Shi J X, Feng Y G, Yang X M, Li X, Shen Q R. Tobacco bacterial wilt can be biologically controlled by the application of antagonistic strains in combination with organic fertilizer. Biology and Fertility of Soils, 2013, 49(4): 447- 464.
[12] 李想, 刘艳霞, 陆宁, 蔡刘体, 袁有波, 石俊雄. 综合生物防控烟草青枯病及其对土壤微生物群落结构的影响. 土壤学报, 2017, 54(1): 216- 226.
[13] Wu K, Yuan S F, Xun G H, Shi W, Pan B, Guan H L, Shen B, Shen Q R. Root exudates from two tobacco cultivars affect colonization ofRalstoniasolanacearumand the disease index. European Journal of Plant Pathology, 2015, 141(4): 667- 677.
[14] Orgiazzi A, Dunbar M B, Panagos P, de Groot G A, Lemanceau P. Soil biodiversity and DNA barcodes: opportunities and challenges. Soil Biology and Biochemistry, 2015, 80: 244- 250.
[15] Liu J J, Sui Y Y, Yu Z H, Shi Y, Chu H Y, Jin J, Liu X B, Wang G H. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China. Soil Biology and Biochemistry, 2014, 70: 113- 122.
[16] Liu J J, Sui Y Y, Yu Z H, Shi Y, Chu H Y, Jin J, Liu X B, Wang G H. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China. Soil Biology and Biochemistry, 2015, 83: 29- 39.
[17] Shen C C, Xiong J B, Zhang H Y, Feng Y Z, Lin X G, Li X Y, Liang W J, Chu H Y. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain. Soil Biology and Biochemistry, 2013, 57: 204- 211.
[18] Shen C C, Liang W J, Shi Y, Lin X G, Zhang H Y, Wu X, Xie G, Chain P, Grogan P, Chu H Y. Contrasting elevational diversity patterns between eukaryotic soil microbes and plants. Ecology, 2014, 95(11): 3190- 3202.
[19] Ren C J, Zhang W, Zhong Z K, Han X H, Yang G H, Feng Y Z, Ren G X. Differential responses of soil microbial biomass, diversity, and compositions to altitudinal gradients depend on plant and soil characteristics. Science of the Total Environment, 2018, 610- 611: 750- 758.
[20] Rinke C, Schwientek P, Sczyrba A, Ivanova N N, Anderson I J, Cheng J F, Darling A, Malfatti S, Swan B K, Gies E A, Dodsworth J A, Hedlund B P, Tsiamis G, Sievert S M, Liu W T, Eisen J A, Hallam S J, Kyrpides N C, Stepanauskas R, Rubin E M, Hugenholtz P, Woyke T. Insights into the phylogeny and coding potential of microbial dark matter. Nature, 2013, 499(7459): 431- 437.
[21] 刘艳霞, 李想, 曹毅, 陆宁, 石俊雄. 抑制烟草青枯病型生物有机肥的田间防效研究. 植物营养与肥料学报, 2014, 20(5): 1203- 1211.
[22] Luo C. Direct comparisons of Illumina vs. Roche 454 sequencing technologies on the same microbial community DNA sample. PLoS One, 2012, 7(2): e30087.
[23] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996- 998.
[24] Wang Q, Garrity G M, Tiedje J M, Cole J R. Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261- 5267.
[25] 林新坚, 林斯, 邱珊莲, 陈济琛, 王飞, 王利民. 不同培肥模式对茶园土壤微生物活性和群落结构的影响. 植物营养与肥料学报, 2013, 19(1): 93- 101.
[26] Cassán F, Diaz-Zorita M.Azospirillumsp. in current agriculture: from the laboratory to the field. Soil Biology and Biochemistry, 2016, 103: 117- 130.
[27] Rimé D, Nazaret S, Gourbière F, Cadet P, Mo⊇nne-Loccoz Y. Comparison of sandy soils suppressive or conducive to ectoparasitic nematode damage on sugarcane. Phytopathology, 2003, 93(11): 1437- 1444.
[28] Lacey M J, Wilson C R. Relationship of common scab incidence of potatoes grown in tasmanian ferrosol soils with pH, exchangeable cations and other chemical properties of those soils. Journal of Phytopathology, 2001, 149(11/12): 679- 683.
[29] Li Y Y, Feng J, Liu H L, Wang L, Hsiang T, Li X H, Huang J B. Genetic diversity and pathogenicity ofRalstoniasolanacearumcausing tobacco bacterial wilt in China. Plant Disease, 2016, 100(7): 1288- 1296.
[30] Perez-Piqueres A, Edel-Hermann V, Alabouvette C, Steinberg C. Response of soil microbial communities to compost amendments. Soil Biology and Biochemistry, 2006, 38(3): 460- 470.
[31] Chen X F, Li Z P, Liu M, Jiang C Y, Che Y P. Microbial community and functional diversity associated with different aggregate fractions of a paddy soil fertilized with organic manure and/or NPK fertilizer for 20 years. Journal of Soils and Sediments, 2015, 15(2): 292- 301.
[32] Huang J F, Wei Z, Tan S Y, Mei X L, Yin S X, Shen Q R, Xu Y C. The rhizosphere soil of diseased tomato plants as a source for novel microorganisms to control bacterial wilt. Applied Soil Ecology, 2013, 72: 79- 84.
[33] Kurabachew H, Wydra K. Characterization of plant growth promoting rhizobacteria and their potential as bioprotectant against tomato bacterial wilt caused byRalstoniasolanacearum. Biological Control, 2013, 67(1): 75- 83.
[34] 李继新, 潘文杰, 田野, 蔡毅, 陈用, 吴邦元, 罗红香. 贵州典型生态区烟叶质量特点分析. 中国烟草科学, 2009, 30(1): 62- 67.
[35] 谢已书, 张方现, 马建光, 谢友成. 贵州不同生态区施氮量与烟叶质量的关系研究. 中国烟草科学, 2005, 26(2): 18- 21.
[36] 潘文杰, 李继新, 姜超英, 蒋光华. 施用有机肥对贵州不同生态区烟叶质量的影响. 贵州农业科学, 2010, 38(5): 38- 41.
[37] 李松龄, 张荣, 蔡晓剑, 任杰. 三江源不同生态系统下土壤微生物区系研究. 青海大学学报: 自然科学版, 2008, 26(4): 64- 67.
[38] 尚天翠, 卫刚, 赵玉. 新疆野生樱桃李林不同生态条件下土壤细菌数量变化及其影响因子研究. 生态学杂志, 2015, 32(2): 58- 60.
[39] Fierer N, Leff J W, Adams B J, Nielsen U N, Bates S T, Lauber C L, Owens S, Gilbert J A, Wall D H, Caporaso J G, Affiliations A. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21390- 21395.
