独山子区优势草本植物根际与非根际土壤微生物功能多样性
2018-06-22吕光辉
陈 悦,吕光辉,李 岩
1 新疆大学资源与环境科学学院,乌鲁木齐 830046 2 绿洲生态教育部重点实验室,乌鲁木齐 830046 3 新疆大学干旱生态环境研究所,乌鲁木齐 830046
土壤微生物是生物地球化学循环的引擎[1],它在维持生态系统整体服务功能方面具有重要作用,常被比作土壤养分元素循环的“转化器”、环境污染物的“净化器”以及陆地生态系统稳定的“调节器”[2]。土壤生态系统中所有的微生物种类、基因以及微生物与环境之间相互作用的多样化程度便是土壤微生物的多样性。而土壤微生物功能多样性是土壤微生物群落状态与功能的重要指标之一[3],包括分解、营养传递以及促进或抑制植物生长的功能,对明确不同环境中微生物群落的作用以及土壤生态功能具有重要意义。
土壤微生物多样性通常以土壤微域结构和空间分异这样的环境条件而被直接影响,其中植物根际是土壤微域结构的主要类型之一[4]。目前,根际土壤微生物的研究主要集中在盐碱地、山区、草地等[5- 7]自然生态系统中,农田连作、施肥和受污染土壤等[8- 10]人为干扰的非自然生态系统中,主要通过对植物根际土壤的微生物量、群落结构及多样性等研究,发现因地域、环境、土地利用方式以及生长时间的不同而得到不同的根际土壤微生物特征,但对干旱区土壤微生物功能多样性的研究,鲜见报道。
新疆克拉玛依市独山子区是西部重要的石化基地和油气引进、加工、储转的战略枢纽,也是天山北坡经济带重点发展地区。独山子石油从开采到现今已有近120年。长期的石油加工作业,使得与工业活动相关的土壤问题变得日益突出,生态恢复迫在眉睫。生态系统的恢复不仅要考虑植物多样性,更要关注土壤微生物多样性,土壤微生物多样性对土壤结构及团聚体的形成、土壤稳定性和肥力、有机物质的转化具有重要意义[11]。植被的存在,为土壤微生物提供其生存的营养物质与能量,并通过影响土壤有机碳、氮和磷的水平、土壤含水量、温度、孔隙度及pH值等来影响土壤微生物多样性[12]。因此,研究植被对土壤微生物群落的影响,揭示不同植被与土壤微生物群落的关系,有助于选择合适的植被类型进行生态恢复和重建。
本研究以独山子区三种优势草本植物的根际与非根际土壤为研究对象,采用Biolog-ECO微平板法,对不同植物根际与非根际土壤化学性质、微生物平均颜色变化率、微生物多样性指数、微生物代谢多样性类型、微生物多样性与土壤化学性质的关系进行研究。通过土壤微生物功能多样性探讨,了解当地优势草本植物根际土壤微生物功能多样性,旨在为独山子区生态环境建设与改善提供一定理论依据。
1 研究区概况
研究区位于克拉玛依市独山子区石化工厂周边具有原生态草场区域。独山子区位于84°43′—85°06′E,44°07′—44°23′N,平均海拔400m,年均气温8.1℃,年降水量108.9mm,年均蒸发量达3008.9mm,为降水量的20.8倍,属典型温带大陆性气候。干旱少雨、春秋多风是其突出的气候特征。研究区域主要土质为荒漠灰钙土和灰棕荒漠土,春夏季主要优势植物有建群种博乐蒿(Artemisiaboratalensis)、骆驼刺(Alhagisparsifolia)及短命植物旱麦草(Eremopyrumtriticeum)、四齿芥(Tetracmequadricornis)、叉毛蓬(Petrosimoniasibirica)、庭荠(Alyssumdesertorum)、涩荠(Malcolmiaafricana)、角果藜(Ceratocarpusarenarius)等。
2 材料与方法
2.1 试验设计
研究样地位于独山子石化工厂下风向2—3km范围的区域,通过样地植被调查,根据重要值选取3种不同科属的优势草本植物作为研究样本,包括博乐蒿、旱麦草和四齿芥,它们的重要值依次为34.70%、23.50%、11.89%,在下文中分别以BLH、HMC和SCJ表示。
样方设置为随机划分的15块3m×3m的区组,区组之间距离≥2m,每块样地中包含以上3种优势草种各至少6株。
2.2 土样采集
土壤样品于2016年5月25日采集,植物根际土参照Riley和Barber的抖落法[13],非根际土壤取植物根际投影范围外自地面垂直0—15cm范围内的土样。在每个样方中随机选择大小适中的3种植物各4株,取其根际与非根际土,分别混合均匀,装于无菌瓶中,置于便携式车载冰箱,在低温条件下运回实验室,储藏于-18℃的环境,用于后续功能多样性和理化性质测定。
2.3 测定方法
土壤微生物代谢活性和功能多样性采用Biolog-ECO微平板法进行测定[14]。
操作步骤:称取相当于10g烘干土壤重量的新鲜土样于无菌250mL三角瓶中,加入90mL无菌NaCl溶液(0.85%),封口后,在摇床振荡15min,静置澄清,取上清液,在超净工作台中用无菌NaCl溶液(0.8%)稀释到10-3,用8通道加样器将稀释后的菌液加入Biolog生态培养板上,每孔加150μL。将接种的Biolog-ECO板放在28℃培养箱中培养8d,每隔24h用ELX- 808型酶标仪读取培养板在590nm波长的吸光值。
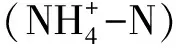
2.4 数据处理
所得数据采用以下公式进行计算分析:
(1)土壤微生物的代谢活性用每孔颜色平均变化率(Average Well Color Development,AWCD)来计算:
AWCD=∑Ci-R/31
式中,Ci为各反应孔在590nm下的光密度值;R为对照孔A1的光密度值;31为Biolog-ECO生态板的C源数目。Ci-R小于零的孔,在计算中记为0,即:Ci-R≥0;
(2)Simpson指数(D):
D=1/∑Pi2
式中,Pi=(Ci-R)/∑(Ci-R),表示有碳源的孔与对照孔A1的光密度值之差与整板总差的比值。
(3)Shannon指数(H):
H=-∑(Pi×lnPi)
(4)McIntosh指数(U),用于评估群落物种均匀度:
数据采用Microsoft Excel 2010、SPSS 22.0以及Canoco 4.5软件计算分析,通过方差分析(Analysis Of Variance, ANOVA)、相关分析(Correlation Analysis)、主成分分析(Principal Component Analysis, PCA)以及冗余分析(Redundancy Analysis, RDA)进行数据处理,所有数据为15次重复的平均值。
3 结果分析
3.1 不同植物根际与非根际土壤化学性质的变化
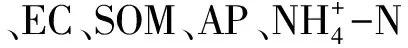
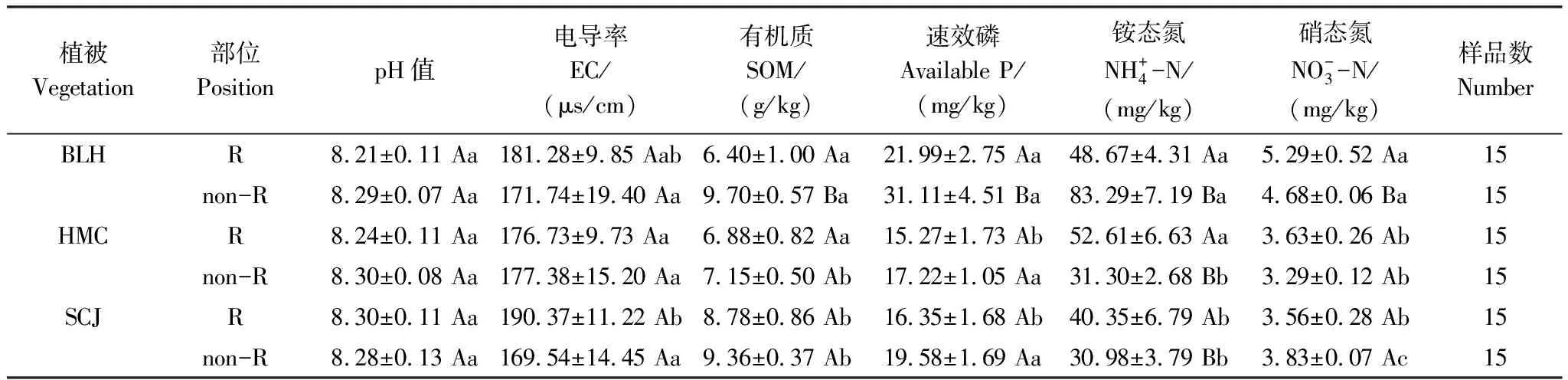
表1 不同植物根际与非根际土壤化学性质
BLH:博乐蒿,Artemisiaboratalensis;HMC:旱麦草,Eremopyrumtriticeum;SCJ:四齿芥,Tetracmequadricornis;EC:电导率,Electrical conductance;SOM:土壤有机质,Soil organic matter;R:根际土壤,Rhizosphere soil;non-R:非根际土壤,non-rhizosphere soil;不同小写字母表示各植物同一部位土壤理化性质差异显著(P<0.05),不同大写字母表示同一种植物不同部位土壤理化性质差异显著(P<0.05),数值为平均值±标准差(Mean±SD)
3.2 不同植物根际与非根际土壤微生物AWCD变化
平均颜色变化率(AWCD)是一个反映土壤微生物活性,表征利用单一碳源能力的重要指标[16],在一定程度上能够反映土壤中微生物种群的数量和结构特征。AWCD值越大,表示微生物活性越高,反之越低。
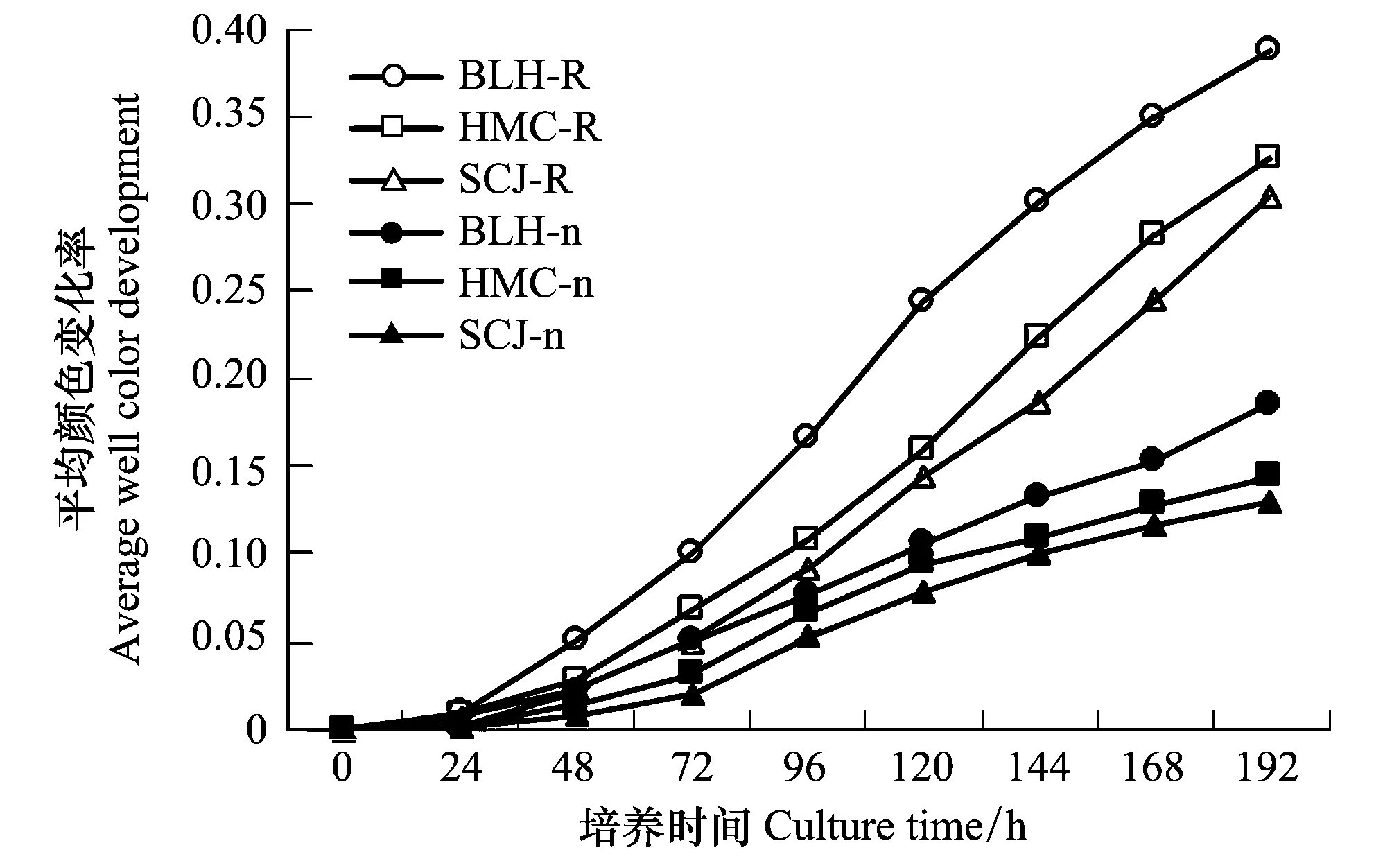
图1 不同植物根际与非根际土壤微生物AWCD随培养时间的变化Fig.1 Average well color development (AWCD) between rhizosphere and non-rhizosphere soil of different speciesBLH:博乐蒿,Artemisia boratalensis;HMC:旱麦草,Eremopyrum triticeum;SCJ:四齿芥,Tetracme quadricornis;R:根际土壤,Rhizosphere soil;n:非根际土壤,non-rhizosphere soil
由图1可知,3种植物类型中AWCD值均随时间延长而增加,表明不同植物土壤的微生物活性都随时培养时间的增加而增加,并且各植物根际土壤的AWCD值在24h内无明显变化,在24h后急剧上升,根际土上升速度快于非根际土。AWCD值表现为:BLH>SCJ>HMC。
3.3 不同植物根际与非根际土壤微生物多样性指数变化
根据不同植物根际与非根际碳源利用情况,综合考虑其变化趋势,选取光密度趋于稳定的120h的光密度值进行土壤微生物群落代谢多样性分析。从表2中看到,BLH和HMC的根际土壤微生物Simpson指数均显著小于非根际土(P<0.05),SCJ根际土壤Simpson最大;Shannon指数中,BLH与HMC根际土壤微生物Shannon均大于非根际土,而SCJ显著小于(P<0.05);BLH非根际土McIntosh指数显著大于HMC与SCJ(P<0.05),SCJ根际土壤均匀度显著小于非根际土(P<0.05),其他比较无显著差异。总体来看,BLH根际土壤微生物群落丰富度与均匀度最好,相比HMC和SCJ具有较宽的微生物种群生态位。

表2 不同植物根际与非根际土壤微生物功能多样性指数(120h)
R与non-R,不同大写、小写字母与数值同上
3.4 不同植物根际与非根际土壤微生物代谢多样性类型的变化
运用SPSS软件对培养120h后的土壤微生物进行主成分分析。数据矩阵包括15行代表独山子试验区的15个样地,31列代表生态板上分布的31种不同的碳源物质。
3种优势草本植物根际土壤微生物碳源的利用结果见表3,共提取了3个主成分,累计贡献率达92.225%。第1主成分(PC1)的方差贡献率为48.515%,第2主成分(PC2)为30.398%,第3主成分(PC3)为13.312%。对第1主成分(PC1)贡献较大的C源有12种,为β-甲基D-葡萄糖苷、D-半乳糖酸γ内酯、D-半乳糖醛酸、吐温80、N-乙酰基-D-葡萄胺、r-羟基丁酸、D-纤维二糖、D,L-a-甘油、a-环状糊精、D-氨基葡萄糖酸、葡萄糖- 1-磷酸盐、以及腐胺;对第2主成分(PC2)贡献较大的C源有5种,为D-木糖、吐温40、I-赤藻糖醇、L-苏氨酸和肝糖;对第3主成分(PC3)贡献较大的有甘氨酰-L-谷氨酸、苯乙基胺和a-D-乳糖3种。上述主成分中包含的碳源类型有糖类7种,脂类、酸类和胺类各3种,醇类、氨基酸类各包含2种,主要碳源利用类型是糖类、脂类、酸类以及胺类,表明这3种植物根际土壤微生物对上述4类碳源比较敏感。

表3 3种优势草本植物根际土壤微生物碳源各个主成分特征值和累计贡献率
3种优势草本植物非根际土壤微生物碳源的利用结果见表4,共提取了3个主成分,累计贡献率达92.470%。第1主成分(PC1)的方差贡献率为63.417%,第2主成分(PC2)为17.323%,第3主成分(PC3)为11.730%。其中对第1主成分(PC1)贡献较大的C源有14种,为β-甲基D-葡萄糖苷、D-半乳糖酸γ内酯、L-精氨酸、D-木糖、D-半乳糖醛酸、I-赤藻糖醇、2-羟苯甲酸、4-羟基苯甲酸、L-丝氨酸、r-羟基丁酸、D-氨基葡萄糖酸、衣康酸以及腐胺;对第2主成分贡献较大的C源有5种,分别是L-苯基丙氨酸、a-环状糊精、N-乙酰基-D-葡萄胺、L-苏氨酸和a-丁酮酸;对第3主成分贡献较大的有肝糖和苯乙基胺2种。以上主成分中的贡献碳源类型包括酸类7种,氨基酸类5种,糖类4种,胺类3种,脂类与醇类各1种。主要碳源利用类型是酸类、氨基酸类以及糖类,表明非根际土壤微生物对上述3种碳源比较敏感。

表4 3种优势草本植物非根际土壤微生物碳源各个主成分特征值和累计贡献率
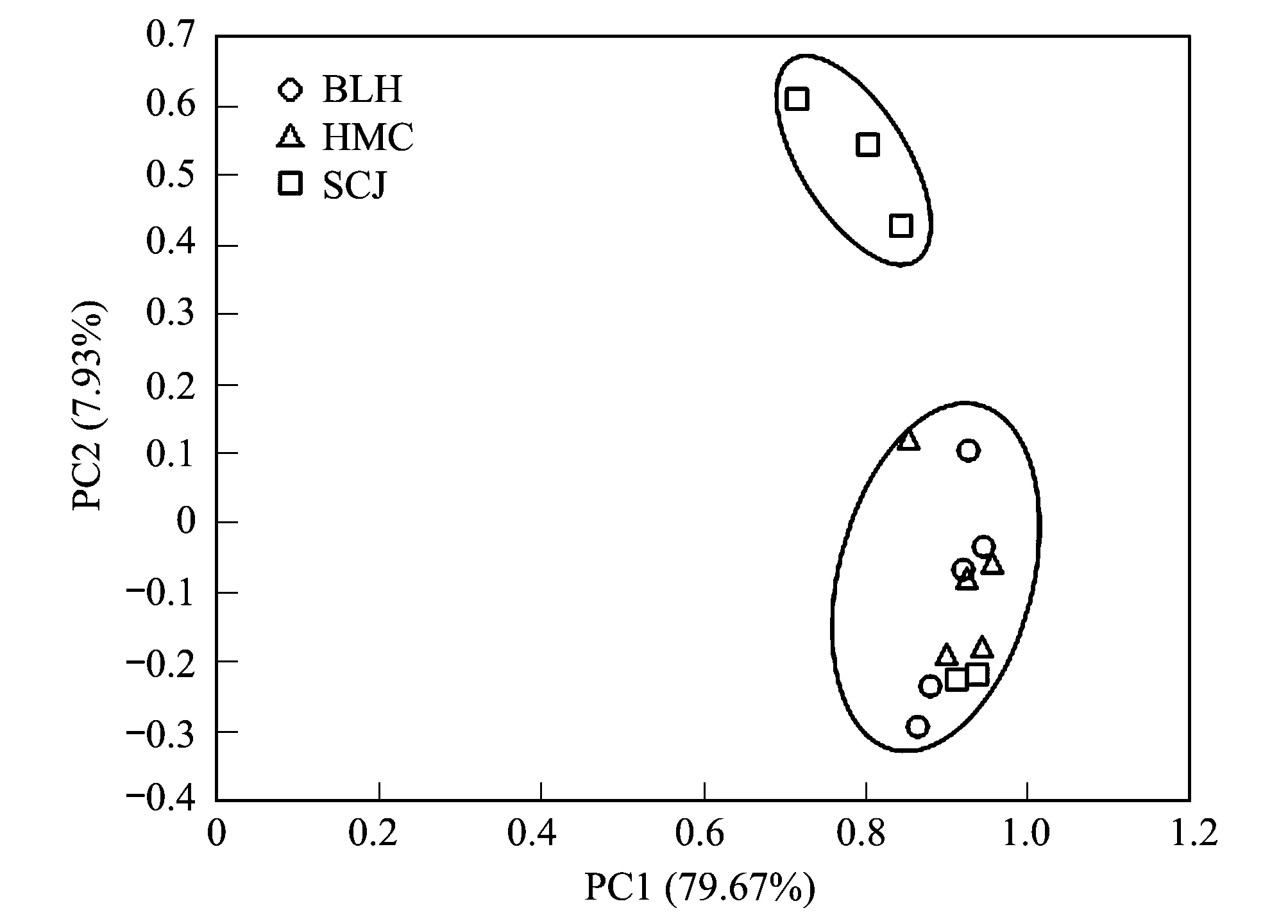
图2 不同草本植物土壤微生物群落功能的主成分分析 Fig.2 Principal component analysis of soil microbial community function at different plants
对3种植物根际与非根际土壤微生物碳源物质利用情况进行主成分分析,得到两个主成分,分别为PC1(79.67%)和PC2(7.93%),累计解释量为87.59%,可以解释BLH、HMC及SCJ这3种植物在碳源物质利用上差异的大部分信息。如图2所示,不同植物根际环境微生物对碳源的利用存在较明显的空间分异,可见植物根际环境微生物代谢特征受不同植物类型的显著影响。其中BLH与HMC之间碳源利用差异不显著。
3.5 不同植物根际与非根际土壤微生物多样性与土壤化学性质的相关关系
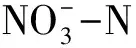
4 讨论
本试验通过Biolog-ECO微平板法对独山子石化工业区周边3种优势草本植物根际与非根际土壤微生物功能多样性进行研究,发现不同植物之间的土壤微生物活性(AWCD)、优势度指数Simpson(D)、丰富度指数Shannon(H)、均匀度指数McIntosh(U)均存在一定差异。其中,博乐蒿相比其他两种植物根际土微生物具有更好的微生物代谢能力、丰富度与多样性,这是因为BLH具有较长的主根,侧根也较发达,根系越旺盛,根际土壤中便会有更多种类和数量的根系分泌物和脱落物,且能够减少外部环境对土壤微生物功能多样性的影响[17],当然,不同的植被类型也是造成差异的原因之一。Melany发现不同植被类型能够影响土壤微生物活性和功能组成格局[18]。Kaiser[19]、Smalla[20]等人也发现同一地区不同植被类型、同一植物不同基因型或同一基因型不同发育阶段的根际土壤微生物多样性均有不同。以上报道均与本研究结果一致,导致差异的原因可能与植被组成、植物残体、根系分泌物和土壤理化性质等生态因子有关[21]。也表明,植物根际土壤微生物功能多样性不仅与植物类型有关,在不同生长阶段也依然存在差异,具有一定时空特征。

表5 石化工业区优势草本植物根际与非根际土壤化学性质与微生物功能多样性的相关关系
*表示P<0.05;**表示P<0.01
研究结果还显示,不同植物根际土壤微生物各指数均大于自身非根际土,这可能是因为植物根系和植物残体给根际土壤微生物提供了适宜生长的场所与物质来源,植物向根际土壤分泌的碳水化合物越多,根际微生物对碳底物利用的能力便越强[22]。与腾应等在研究复垦红壤中牧草根际微生物群落时的结果一致[23]。赵燕娜等人也发现土壤微生物数量与土壤酶活性均表现出根际聚集现象[24]。同时,除SCJ外,其他两种植物根际土壤pH值和EC均小于非根际土,造成这种差异的原因可能是因为BLH与HMC在其根际能够选择性的富集一些盐基离子,从而减少土壤中OH-[25],又由于植物根系对不同物质的吸收速率不同,使植物根际出现土壤矿物质盐分离子的吸收或富集,并与非根际土壤表现出不同的盐分含量[26]。从本研究中可以看出,博乐蒿与旱麦草能够较好的适应盐碱条件,并给土壤微生物提供较好生存环境,提高土壤肥力,改善土壤状况。
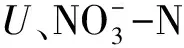
5 结论
(1)不同植物根际与非根际土微生物代谢强度不同,本研究中博乐蒿根际土具有较好的微生物活性;各植物根际土壤微生物对糖类、脂类、酸类和胺类碳源物质比较敏感,非根际土壤微生物敏感于酸类、氨基酸类以及糖类碳源物质,根际土壤微生物利用碳源宽度更大,且不同植物类型根际环境微生物碳源利用特征不同。研究表明,植被的存在能够提高土壤微生物活性和功能多样性,土壤状况越好,越有利于适应环境变化。

参考文献(References):
[1] Falkowski P G, Fenchel T, Delong E F. The microbial engines that drive Earth′s biogeochemical cycles. Science, 2008, 320(5879): 1034- 1039.
[2] 宋长青, 吴金水, 陆雅海, 沈其荣, 贺纪正, 黄巧云, 贾仲君, 冷疏影, 朱永官. 中国土壤微生物学研究10年回顾. 地球科学进展, 2013, 28(10): 1087- 1105.
[3] 罗希茜, 郝晓晖, 陈涛, 邓婵娟, 吴金水, 胡荣桂. 长期不同施肥对稻田土壤微生物群落功能多样性的影响. 生态学报, 2009, 29(2): 740- 748.
[4] 林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能. 土壤学报, 2008, 45(2): 892- 900.
[5] 杜滢鑫, 谢宝明, 蔡洪生, 唐璐, 郭长虹. 大庆盐碱地九种植物根际土壤微生物群落结构及功能多样性. 生态学报, 2016, 36(3): 740- 747.
[6] 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性. 生态学报, 2011, 31(18): 5225- 5234.
[7] Nicolitch O, Colin Y, Turpault M P, Uroz S. Soil type determines the distribution of nutrient mobilizing bacterial communities in the rhizosphere of beech trees. Soil Biology and Biochemistry, 2016, 103: 429- 445.
[8] 马琨, 杨桂丽, 马玲, 汪春明, 魏常慧, 代晓华, 何文寿. 间作栽培对连作马铃薯根际土壤微生物群落的影响. 生态学报, 2016, 36(10): 2987- 2995.
[9] 冯伟, 管涛, 王晓宇, 朱云集, 郭天财. 沼液与化肥配施对冬小麦根际土壤微生物数量和酶活性的影响. 应用生态学报, 2011, 22(4): 1007- 1012.
[10] Wei J, Liu X Y, Zhang X Y, Chen X, Liu S, Chen L. Rhizosphere effect ofScirpustriqueteron soil microbial structure during phytoremediation of diesel-contaminated wetland. Environmental Technology, 2014, 35(4): 514- 520.
[11] Lal R, Mokma D, Lowery B. Relation between soil quality and erosion//Ratta R, Lal R, eds. Soil Quality and Soil Erosion. Washington DC: CRC Press, 1999: 237- 258.
[12] 周桔, 雷霆. 土壤微生物多样性影响因素及研究方法的现状与展望. 生物多样性, 2007, 15(3): 306- 311.
[13] Riley D, Barber S A. Bocarbonate accumulation and pH changes at the soybean (Glycinemax(L.) Merr.) root-soil interface. Soil Science Society of America Journal, 1969, 33(6): 905- 908.
[14] Schutter M, Dick R. Shifts in substrate utilization potential and structure of soil microbial communities in response to carbon substrates. Soil Biology and Biochemistry, 2001, 33(11): 1481- 1491.
[15] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000: 179- 183.
[16] Benizri E, Amiaud B. Relationship between plants and soil microbial communities in fertilized grasslands. Soil Biology and Biochemistry, 2005, 37(11): 2055- 2064.
[17] 曹永昌, 杨瑞, 刘帅, 王紫泉, 和文祥, 耿增超. 秦岭典型林分夏秋两季根际与非根际土壤微生物群落结构. 生态学报, 2017, 37(5): 1667- 1676.
[18] Fisk M C, Ruether K F, Yavitt J B. Microbial activity and functional composition among northern peatland ecosystems. Soil Biology and Biochemistry, 2003, 35(4): 591- 602.
[19] Kaiser O, Pühler A, Selbitschka W. Phylogenetic analysis of microbial diversity in the rhizoplane of oilseed rape (Brassica napus cv. Westar) employing cultivation-dependent and cultivation-independent approaches. Microbial Ecology, 2001, 42(2): 136- 149.
[20] Smalla K, Wieland G, Buchner A, Zock A, Parzy J, Kaiser S, Roskot N, Heuer H, Berg G. Bulk and rhizosphere soil bacterial communities studied by denaturing gradient gel electrophoresis: plant-dependent enrichment and seasonal shifts revealed. Applied and Environmental Microbiology, 2001, 67(10): 4742- 4751.
[21] Kowalchuk G A, Buma D S, de Boer W, Klinkhamer P G L, van Veen J A. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. Antonie van Leeuwenhoek, 2002, 81(1): 509- 520.
[22] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望. 植物生态学报, 2014, 38(3): 298- 310.
[23] 滕应, 黄昌勇, 龙健, 姚槐应. 复垦红壤中牧草根际微生物群落功能多样性. 中国环境科学, 2003, 23(3): 295- 299.
[24] 赵燕娜, 廖超英, 李晓明. 毛乌素沙地4种固沙植物根际与非根际土壤生物学特性. 干旱区研究, 2015, 32(4): 680- 686.
[25] 王宏伟, 黄清俊, 李萍, 朱继军, 陈必胜. 3种草本植物盐碱土栽培地的根际环境变化. 上海农业学报, 2012, 28(3): 66- 69.
[26] Kasuga M, Liu Q, Miura S, Yamaguchi-Shinozaki K, Shinozaki K. Improving plant drought, salt, and freezing tolerance by gene transfer of a single stress-inducible transcription factor. Nature Biotechnology, 1999, 17(3): 287- 291.
[27] 胡婵娟, 傅伯杰, 刘国华, 靳甜甜, 刘宇. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性. 生态学报, 2009, 29(2): 727- 733.
[28] Cartwright J, Dzantor E K, Momen B. Soil microbial community profiles and functional diversity in limestone cedar glades. Catena, 2016, 147: 216- 224.
[29] Torsvik V, Øvreås L. Microbial diversity and function in soil: from genes to ecosystems. Current Opinion in Microbiology, 2002, 5(3): 240- 245.
