食管鳞状细胞癌组织中miR-21、PDCD4表达变化及意义
2018-06-22马光耀孙大强商宏伟周方1天津医科大学天津00070中国人民解放军第二五四医院天津市胸科医院
马光耀,孙大强,商宏伟,周方(1天津医科大学,天津00070;中国人民解放军第二五四医院;天津市胸科医院)
食管癌是常见的消化道恶性肿瘤之一,其较强的侵袭性导致患者病死率较高[1]。根据组织学类型,食管癌可分为食管腺癌和食管鳞状细胞癌(食管鳞癌)[2]。食管腺癌在发达国家的发病率较高,而食管鳞癌则主要分布在亚洲地区,尤其是在中国,食管鳞癌约占食管癌的88.84%[3,4]。微小RNA(microRNA)是长度18~25个核苷酸的非编码小RNA分子,通过靶向特定基因的转录后表达,进而调控基因活性[5]。microRNA参与细胞的各种基本生理过程,如增殖、侵袭和分化等;也参与疾病的发生进展过程,如miR-21通过调控程序性细胞死亡基因4(PDCD4),诱导舌鳞癌产生化疗耐药[6];而抑癌基因PDCD4表达丢失可诱发胃癌[7]。目前,国内关于食管鳞癌组织中miR-21、PDCD4的表达变化及意义研究较少,本研究对此做了探讨,以期为食管鳞癌的治疗提供新思路。
1 资料与方法
1.1 临床资料 选择2012年6月~2015年6月中国人民解放军第二五四医院手术切除的93例份食管鳞癌组织及癌旁组织(距离肿瘤组织>5 cm),立即置于液氮中保存。患者男49例、女44例,年龄29~75岁,均接受常规开胸颈胸腹三切口食管癌根治术,术后均经病理检查确诊。患者纳入标准:年龄≤70岁;卡氏评分≥80分;术前未接受放化疗治疗;具备完整的病历资料。排除标准:合并其他恶性肿瘤;严重心肺功能不全;严重肝肾功能不全;合并代谢系统疾病等。采用门诊或电话随访的方式,对患者进行为期1~60个月的随访,至患者死亡或随访时间结束。患者及家属均签署知情同意书;本研究经医院伦理委员会审核批准。
1.2 组织中miR-21、PDCD4 mRNA表达检测 采用实时荧光定量PCR技术。荧光定量PCR仪(7500)购自美国Applied Biosystems公司。从液氮中取出组织,切取约100 mg组织放至EP管中,加入TRIzol溶液(美国Invitrogen公司)1 mL,电动组织匀浆器(北京优尼康生物科技有限公司)进行匀浆,均严格参照RNA提取试剂盒(北京天根生化科技有限公司)说明书进行操作。紫外分光光度计(美国Thermo公司)对RNA进行纯度及浓度检测,取RNA 500 μg,参照RNA逆转录试剂盒的反应体系和反应条件,将RNA逆转录为cDNA,置于-80 ℃冰箱中保存备用。引物由上海捷瑞生物工程有限公司合成。miR-21上游引物序列5′-GTGCAGGGTCCGAGGT-3′、下游引物序列5′-GCCGCTAGCTTATCAGACTGATGT-3′;内参U6上游引物序列5′-CTCGCTTCGGCAGCACA-3′、下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′;PDCD4上游引物序列5′-CCTGAATTAGCACTGGATACTCCT-3′、下游引物序列5′-CTAGCCTGCACACAATCTACAGTT-3′;内参GAPDH上游引物序列5′-CAGGGCTGCTTTAACTCTGGTAA-3′、下游引物序列5′-GGGTGGAATACATTGGAACATGT-3′。其中miR-21以U6作为内参,PDCD4以GAPDH作为内参。参照SYBR染料法荧光定量试剂盒(美国Applied Biosystems公司)的反应体系和反应条件进行试验。采用2-ΔΔCt法计算miR-21、PDCD4 mRNA的相对表达量。

2 结果
2.1 组织中miR-21、PDCD4 mRNA表达及相关性 miR-21在食管鳞癌组织中的相对表达量(3.65±0.90)高于癌旁组织(1.08±0.35),比较差异有统计学意义(t=25.665,P=0.000);PDCD4 mRNA在食管鳞癌组织中的相对表达量(0.29±0.11)低于癌旁组织(1.01±0.32),比较差异有统计学意义(t=-20.520,P=0.000)。经Spearman相关分析结果显示,食管鳞癌组织中miR-21与PDCD4 mRNA的表达呈负相关(r=-0.883,P=0.000)。
2.2 食管鳞癌组织中miR-21及PDCD4 mRNA表达与患者临床病理参数的关系 食管鳞癌组织中miR-21、PDCD4 mRNA表达均与肿瘤大小、浸润深度、淋巴结转移、分化程度有关(P均<0.05),而与患者性别、年龄、TNM分期无关(P均>0.05)。见表1。
2.3 食管鳞癌组织中miR-21、PDCD4 mRNA表达与患者预后的关系 以平均值为界限[8],将食管鳞癌患者分为miR-21高表达组(n=49)和miR-21低表达组(n=44)。miR-21高表达组、miR-21低表达组术后5年生存率分别为73.47%(36/49)、90.91%(40/44),比较差异有统计学意义(χ2=4.720,P=0.030)。Log-Rank检验结果显示,miR-21高表达组、miR-21低表达组术后生存时间为(51.31±2.29)、(57.50±1.34)个月,比较差异有统计学意义(P=0.029)。以平均值为界限[8],将食管鳞癌患者分为PDCD4 mRNA高表达组(n=45)、PDCD4 mRNA低表达组(n=48)。PDCD4 mRNA高表达组、PDCD4 mRNA低表达组术后5年生存率分别为93.33%(42/45)、70.83%(34/48),比较差异有统计学意义(χ2=7.871,P=0.005);Log-Rank检验结果显示,PDCD4 mRNA高表达组、PDCD4 mRNA低表达组术后生存时间为(57.80±1.30)、(50.90±2.32)个月,比较差异有统计学意义(P=0.006)。
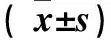
表1 食管鳞癌组织中miR-21、PDCD4 mRNA表达与患者临床病理参数的关系
3 讨论
食管癌位居最常见恶性肿瘤的第8位。目前,以食管癌根治术为基础并辅以放化疗的综合治疗方案仍然是治疗食管癌的主要手段。但即使接受根治手术治疗,食管癌患者的5年总生存率仍较低,预后较差。复发与远处转移是导致食管癌患者预后不良的主要原因[9,10]。近年来,microRNA是肿瘤研究领域的热点之一,miR-21是具有代表性的microRNA,定位于染色体17q23,是具有自主转录单位的microRNA,可通过靶向抑制多种抑癌基因的表达,发挥促癌基因的功能。目前已证实,在肺癌、胃癌、结肠癌和胰腺癌等多种恶性肿瘤组织中,miR-21处于过度表达状态[11],且miR-21高表达也预示着疾病的恶性进展和患者预后不良[12]。在肝癌细胞中,miR-21高表达能够增强细胞的侵袭转移能力[13]。此外,miR-21也能在外周血中稳定存在,且其血清水平对肿瘤患者的预后预测具有重要意义[14]。
PDCD4是一种新发现的抑癌基因,定位于染色体10q24,是miR-21的调控靶基因,miR-21以互补配对方式与PDCD4基因3′-非翻译区(3′-UTR)结合,在转录后水平降低PDCD4基因表达[15]。研究发现,PDCD4通过影响肿瘤细胞增殖、转移和凋亡能力,发挥抗肿瘤效应[16]。PDCD4在肿瘤细胞和组织中均表达下降或缺失。PDCD4可通过与翻译起始因子elF4A结合,抑制蛋白质的翻译过程,促进细胞凋亡[17];还可通过调节激活子蛋白1、MMP-2基因表达,进而抑制肿瘤生长、侵袭转移[18,19]。本研究发现,在食管鳞癌组织中miR-21呈高表达,而PDCD4呈低表达,且两者表达之间呈负相关关系。提示miR-21表达增加,可能靶向下调PDCD4基因表达,共同参与食管鳞癌的肿瘤形成。Cao等[20]在胃癌组织中也发现,PDCD4与miR-21表达之间呈负相关,且miR-21高表达与PDCD4表达丢失均在胃癌发生发展中发挥促进作用,与本研究结果一致。本研究并未对miR-21靶向PDCD4基因的机制进行验证,后续将在细胞水平进行机制探究。
本研究发现,miR-21、PDCD4表达均与肿瘤大小、浸润深度、淋巴结转移及肿瘤分化程度有关,提示在食管鳞癌组织中,高表达miR-21可能与促进肿瘤细胞增殖、侵袭和迁移密切相关,且可能是通过下调PDCD4基因表达实现的。miR-21与PDCD4在乳腺癌组织中表达与肿瘤大小、淋巴结转移和远处转移也相关[21]。以上结果均提示miR-21/PDCD4通路可能与肿瘤细胞增殖、侵袭迁移有关,后续将在细胞水平改变miR-21表达后,检测细胞增殖及侵袭迁移能力的变化。
本研究发现,miR-21高表达患者与PDCD4低表达患者的术后生存率和生存时间均较低。提示miR-21高表达与PDCD4低表达均可预示患者预后较差。Chao等[22]在对恶性胶质瘤中的研究中证实,miR-21高表达与PDCD4低表达可诱导产生放疗耐药性,进而导致患者预后差。可见,miR-21、PDCD4均具有作为食管鳞癌患者不良预后指标的潜能。
综上所述,食管鳞癌组织中miR-21呈高表达,而PDCD4呈低表达,且两者之间呈负相关关系。miR-21高表达与PDCD4低表达均与患者临床病理参数、不良预后相关。
参考文献:
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Siewert JR, Ott K. Are squamous and adenocarcinomas of the esophagus the same disease[J]. Semin Radiat Oncol, 2007,17(1):38-44.
[3] Lin Y, Totsuka Y, He Y, et al. Epidemiology of esophageal cancer in Japan and China[J]. J Epidemiol, 2013,23(4):233-242.
[4] Zeng H, Zheng R, Zhang S, et al. Esophageal cancer statistics in China, 2011: Estimates based on 177 cancer registries[J]. Thorac Cancer, 2016,7(2):232-237.
[5] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004,116(2):281-297.
[6] Ren W, Wang X, Gao L, et al. MiR-21 modulates chemosensitivity of tongue squamous cell carcinoma cells to cisplatin by targeting PDCD4[J]. Mol Cell Biochem, 2014,390(1-2):253-262.
[7] Li C, Deng L, Zhi Q, et al. MicroRNA-183 functions as an oncogene by regulating PDCD4 in gastric cancer[J]. Anticancer Agents Med Chem, 2016,16(4):447-455.
[8] He Z, Xia Y, Liu B, et al. Down-regulation of miR-452 is associated with poor prognosis in the non-small-cell lung cancer[J]. J Thorac Dis, 2016,8(5):894-900.
[9] 刘月姣,李晓敏.提高食管癌放疗疗效的方法综述[J].基层医学论坛,2015,19(7):979-980.
[10] 刘博,吕洋,刘军超,等.食管鳞癌组织中ASPP2、p53、E-cad表达及其与预后的相关性[J].山东医药,2017,57(6):80-82.
[11] 冯春来,刘峰.miR-21和PDCD4在非小细胞肺癌中的表达及其临床意义[J].现代肿瘤医学,2015,23(22):3255-3258.
[12] Fu C, Dong W, Wang Z, et al. The expression of miR-21 and miR-375 predict prognosis of esophageal cancer[J]. Biochem Biophys Res Commun, 2014,446(4):1197-1203.
[13] Zhu Q, Wang Z, Hu Y, et al. miR-21 promotes migration and invasion by the miR-21-PDCD4-AP-1 feedback loop in human hepatocellular carcinoma[J]. Oncol Rep, 2012,27(5):1660-1668.
[14] Pfeffer SR, Yang CH, Pfeffer LM. The Role of miR-21 in Cancer[J]. Drug Dev Res, 2015,76(6):270-277.
[15] Cappellesso R, Tinazzi A, Giurici T, et al. Programmed cell death 4 and microRNA 21 inverse expression is maintained in cells and exosomes from ovarian serous carcinoma effusions[J]. Cancer Cytopathol, 2014,122(9):685-693.
[16] Wang Z, Yao W, Li K, et al. Reduction of miR-21 induces SK-N-SH cell apoptosis and inhibits proliferation via PTEN/PDCD4[J]. Oncol Lett, 2017,13(6):4727-4733.
[17] Suzuki C, Garces RG, Edmonds KA, et al. PDCD4 inhibits translation initiation by binding to eIF4A using both its MA3 domains[J]. Proc Natl Acad Sci U S A, 2008,105(9):3274-3279.
[18] Dikshit B, Irshad K, Madan E, et al. FAT1 acts as an upstream regulator of oncogenic and inflammatory pathways, via PDCD4, in glioma cells[J]. Oncogene, 2013,32(33):3798-3808.
[19] Wang D, Guo S, Han SY, et al. Distinct roles of different fragments of PDCD4 in regulating the metastatic behavior of B16 melanoma cells[J]. Int J Oncol, 2013,42(5):1725-1733.
[20] Cao Z, Yoon JH, Nam SW, et al. PDCD4 expression inversely correlated with miR-21 levels in gastric cancers[J]. J Cancer Res Clin Oncol, 2012,138(4):611-619.
[21] 唐炜,叶熹罡,高进,等.miR-21及PDCD4在乳腺癌的表达及预后的关系[J].广州医学院学报,2013,41(2):33-37.
[22] Chao TF, Xiong HH, Liu W, et al. MiR-21 mediates the radiation resistance of glioblastoma cells by regulating PDCD4 and hMSH2[J]. J Huazhong Univ Sci Technolog Med Sci, 2013,33(4):525-529.
