纳布啡预注用于防治全身麻醉苏醒期躁动的临床观察
2018-06-22韩承河
王 熙,韩承河
(1.宝鸡市第二人民医院麻醉科,陕西 宝鸡 721000;2.泰山医学院附属医院重症医学科,山东 泰安 271000)
全身麻醉苏醒期躁动(Emergence agitation,EA)是发生于全身麻醉苏醒期的一种急性精神障碍,是全身麻醉苏醒期的一种不恰当行为[1]。躁动引起的剧烈应激反应,可导致患者出现严重的血流动力学波动[2],老年人可能会出现心肌梗死或脑血管意外,同时可能会导致患者延迟出院,增加医疗成本[3]。我院自2016年以来,在瑞芬太尼-丙泊酚快通道麻醉下腹腔镜胆囊切除术结束前预注纳布啡0.2 mg/kg,用于预防全身麻醉苏醒期躁动,取得了良好的临床疗效。现报告如下。
1 资料与方法
1.1一般资料:选取我院2016年1月~2016年12月,择期行腹腔镜胆囊切除术气管插管全身麻醉手术患者240例为研究对象,ASA分级Ⅰ~Ⅱ级,年龄20~60岁,平均45岁。根据预注药物不同分为三组。A组0.9% NaCl溶液对照组;B组芬太尼组;C组纳布啡组。各80例患者均拒绝术后镇痛,排除烟、酒等不良嗜好患者。
1.2麻醉方法:患者术前0.5 h接受常规术前用药,肌内注射苯巴比妥钠0.1 g、阿托品0.5 mg。进入手术室后,常规监测NIBP、ECG、HR、SpO2。行静脉-吸入复合全身麻醉,全身麻醉顺序快速静脉诱导,瑞芬太尼1 μg/(kg·min)持续泵注、静脉滴注咪达唑仑0.04 mg/kg、丙泊酚0.2 mg/kg、维库溴铵0.15 mg/kg,2 min后视频喉镜下气管插管成功。接麻醉机辅助呼吸,设定麻醉机参数:RR为12次/min,TV 8 ml/kg,I∶E=1∶2。监测呼气末二氧化碳分压(PetCO2),维持在30~45 mm Hg(1 mm Hg=0.133 3 kPa)之间。术中持续吸入七氟烷0.6~2.5%,持续泵注瑞芬太尼0.3~1 μg/(kg·min)、丙泊酚2~12 mg/(kg·h)、间断按需静脉滴注维库溴铵维持麻醉。术中常规持续监测ECG、NIBP、HR、SpO2、RR、PetCO2。术中根据麻醉深度及时、合理调节各药物即时用量,以维持合理的麻醉深度。三组均于手术进行到胆囊三角区处理完毕,即胆囊管、胆囊动脉生物夹夹闭完成,手术处理完胆囊残端后,立即停止吸入七氟烷、停止泵注丙泊酚。分别予以A组静脉注射NaCl溶液2 ml;B组静脉注射芬太尼1.5 μg/kg;C组静脉注射盐酸纳布啡0.2 mg/kg。手术结束缝合皮肤后即停止泵注瑞芬太尼,记为停药时间。符合拔管指征:充分吸痰后可拔除气管导管。如患者发生躁动,对轻度躁动患者,言语劝导,尽量争取配合。躁动严重者,根据情况予以镇痛或镇静药物处理。
1.3观察指标
1.3.1观察三组患者的术前一般情况:年龄、性别、体质量、ASA分级、手术时间等。
1.3.2躁动评分:研究、观察、比较躁动的发生情况,采用Riker镇静-躁动评分法(Riker sedation-agitation scale,RSS)。Ⅴ级、Ⅵ级和Ⅶ级躁动分别记为轻度EA、中度EA、重度EA。
1.3.3镇静评分:采用Ramsay镇静评分法,根据患者拔管后10 min的神志及对刺激反应等情况,记录相应分值。
1.3.4记录拔管相关情况:记录患者停药后自主呼吸恢复时间(min)、拔管时间(min)及拔管后3 min呼吸频率,同时观察、记录患者术后不良反应,如延迟性呼吸抑制、恶心、呕吐、头晕、皮肤瘙痒等发生情况。

2 结果
2.1三组患者一般情况比较:A组、B组及C组三组患者两两比较,性别、年龄、体质量、ASA分级、手术时间差异无统计学意义(P>0.05),具有可比性。
2.2三组患者全身麻醉苏醒期躁动发生情况比较:A组躁动发生率为33.75%,与B组和C组比较,差异有统计学意义(P<0.01)。中度躁动病例数B组和C组均少于A组,差异有统计学意义(P<0.05)。B组和C组比较,差异无统计学意义(P>0.05)。见表1。
2.3三组患者拔管情况比较:三组患者停药后自主呼吸恢复时间(min),B组较A组及C组延长,差异有统计学意义(P<0.05)。三组在拔管时间(min)比较上,B组较A组及C组延长,差异有统计学意义(P<0.05)。C组与A组自主呼吸恢复时间、拔管时间时间相当,差异无统计学意义(P>0.05)。三组患者拔管后3 min呼吸频率B组较A组及C组减少,差异有统计学意义(P<0.05)。三组患者拔管后10 min的镇静情况评分,B组和C组相对于A组出现了不同程度的镇静,差异有统计学意义(P<0.05)。C组与B组比较,差异无统计学意义(P>0.05)。见表2。
表1全身麻醉苏醒期躁动发生情况
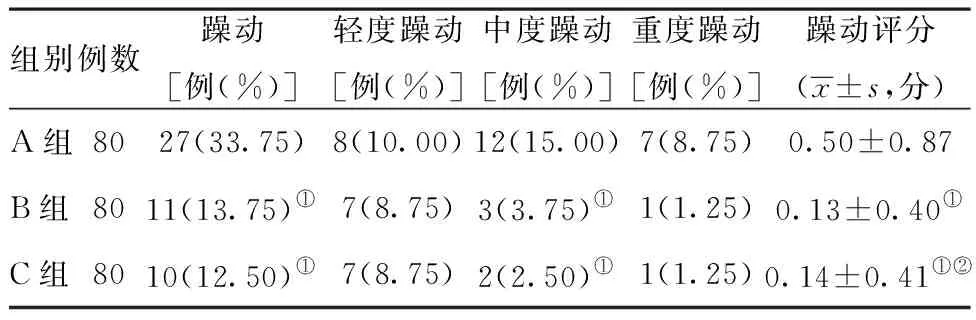
组别例数躁动[例(%)]轻度躁动[例(%)]中度躁动[例(%)]重度躁动[例(%)]躁动评分(x±s,分)A组8027(33.75)8(10.00)12(15.00)7(8.75)0.50±0.87B组8011(13.75)①7(8.75)3(3.75)①1(1.25)0.13±0.40①C组8010(12.50)①7(8.75)2(2.50)①1(1.25)0.14±0.41①②
注:与A组比较,①P<0.05;与B组比较,②P> 0.05
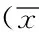

组别例数呼吸恢复时间(min)拔管时间(min)呼吸频率(次/min)镇静评分(分)A组805.45±3.27①8.60±4.38①12.30±2.95①2.05±0.88B组808.35±4.2911.01±5.4611.15±1.792.40±0.81②C组806.30±4.35①8.75±4.06①11.40±1.65①2.47±0.94②③
注:与B组比较,①P<0.05;与A组比较,②P<0.05;与B组比较,③P>0.05
2.4其他不良反应比较:术后恶心发生情况,B组与A组比较,差异有统计学意义(P<0.05),与C组比较,差异有统计学意义(P<0.01)。呕吐发生情况比较,A组与B组间比较,差异无统计学意义(P>0.05),而B组与C组比较,差异有统计学意义(P<0.05)。头晕发生情况比较,三组均有病例出现头晕,A组与B组比较,差异无统计学意义(P>0.05),而B组与C组比较,差异有统计学意义(P<0.05)。三组回病房后延迟性呼吸抑制发生情况比较,A组和B组均有不同例数发生呼吸抑制,C组未观察到发生延迟性呼吸抑制病例。见表3。
表3其他不良反应比较[例(%)]
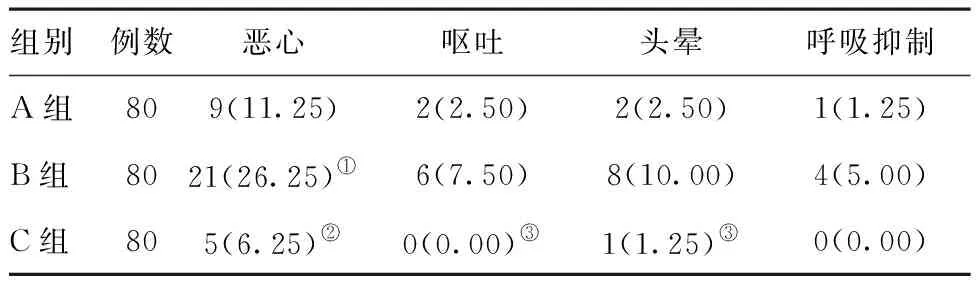
组别例数恶心呕吐头晕呼吸抑制A组809(11.25)2(2.50)2(2.50)1(1.25)B组8021(26.25)①6(7.50)8(10.00)4(5.00)C组805(6.25)②0(0.00)③1(1.25)③0(0.00)
注:与A组比较,①P<0.05;与B组比较,②P<0.01;与B组比较,③P<0.05
3 讨论
EA是全身麻醉苏醒期较为常见的并发症,国外报道EA发生率为21.3%[4],国内EA发生率为22.46%[5],其发生机制目前尚未研究明确。有研究表明,疼痛程度与EA呈现正相关[6],在众多引发EA的病因中,疼痛是最为常见的病因,占比可达92.44%[5]。研究结果显示,A组患者在停药后平均 5.45 min便可恢复自主呼吸,平均拔管时间 8.6 min。麻醉苏醒快,不足之处是显而易见的,出现了一个较高的EA发生率33.75%,较国内邓立琴等报道的22.46%,高出10多个百分点。较高的EA发生率,可能和本次研究选择的病例和麻醉用药有关。
阿片类药物是临床上治疗疼痛中最常见和最为广泛使用的镇痛药,诱导机体产生的痛觉过敏是阿片类药物常见的不足之处,即阿片诱发的痛觉过敏(Opioids induced hyperalgesia,OIH)[7]。瑞芬太尼是一种高效的超短效μ阿片受体激动剂,由于其独特的药理学特性,术中麻醉可控性强,麻醉后苏醒快,与输注的剂量和持续时间无关,消除半衰期仅9.5 min。有人通过在动物模型和人体临床试验研究,结果认为,输注瑞芬太尼与术后痛觉过敏相关[8],并且增加了术后镇痛需求。痛觉过敏的产生与药物使用息息相关,药物作用时间越短,OIH出现越快[9]。阿片类药物的痛觉过敏和术后疼痛相互影响,两者之间具有协同作用,其结果是强化了术后痛觉过敏[10],致使患者主观上感受到更为剧烈疼痛。研究中,丙泊酚-瑞芬太尼全身麻醉,可能因其OIH而增加了EA发病率。
LC是肝胆外科常见手术,因其微创、直观、出血少、恢复快等诸多优点是胆囊切除首选手术方法。日前,LC已经在国内外被诸多医院纳入日间手术进行管理,这就要求无论在麻醉恢复期还是在术后,都要力求快速、平稳与舒适,尽可能减少相关并发症,如EA、呼吸抑制、恶心、呕吐等。有项关于1 000例LC患者术后疼痛状况的研究表明,73.8%的患者术后需要使用止痛剂,而29.3%的患者需要使用阿片类药物[11]。
疼痛是引起EA最主要的因素,在防治EA方面,确切的镇痛是最为有效的处理方案。芬太尼是经典的阿片类药物,镇痛作用强,常用于EA的治疗。但芬太尼强效镇痛的同时,产生呼吸抑制、术后恶心、呕吐、瘙痒等因μ受体激动而出现的阿片类药物不良反应,一直或多或少影响着其安全使用。研究中芬太尼组拔管后3 min自主呼吸频率明显少于A组和C组(P<0.05)。有4例患者在病房出现轻微的呼吸抑制,临床表现为呼吸变浅,呼吸频率下降,定向力下降。床旁监护仪显示SpO2下降,予以轻刺激或呼叫嘱其深呼吸得以改善。
盐酸纳布啡是一种亲脂性的半合成阿片类药物,能与κ、δ和μ受体结合,有较强的κ受体激动和μ受体拮抗作用,镇痛效果与吗啡相当[12]。腹腔镜胆囊切除术,疼痛主要来源于腹腔内脏神经痛和腹部腔镜穿刺鞘的小切口引起的躯体痛。纳布啡主要是激动κ受体而产生镇痛作用,κ受体与内脏痛密切相关,对内脏痛更有效[13]。纳布啡手术结束前预先注射,在发挥其强效镇痛的同时,因其超前镇痛作用,而阻止或延缓了伤害性刺激的外周和中枢致敏,可能缓解了或阻断了瑞芬太尼相关的OIH。当然,也可能有其他机制同时存在,有待进一步从分子药理学层面进行研究。研究中,C组拔管后10 min VAS评分无痛病例数较对照组多(P<0.01),术后疼痛多以轻度疼痛为主占比达61.25%(P<0.05)。而在中度疼痛方面,C组较B组病例明显减少(P<0.05)。结果显示,纳布啡预先注射用于腹腔镜胆囊切除术患者,临床镇痛效果确切,在某种程度上镇痛效果要优于芬太尼。因其确切的镇痛效果,明显减少了全身麻醉苏醒期躁动发生率,C组发生率为12.50%(P<0.05),特别值得一提的是,在减少了躁动发生率的同时,躁动发生的严重程度也明显下降,中重度躁动患者发生例数明显减少(P<0.05)。
纳布啡对μ受体具有拮抗作用,强效镇痛的同时较少产生相关μ受体激动的相关不良反应,如呼吸抑制、瘙痒、恶心、呕吐等[14],使得因μ受体激动相关不良反应明显减少。研究中,C组停药后呼吸恢复时间、拔管时间和拔管后3 min呼吸频率均与A组差异无统计学意义(P>0.05)。而B组麻醉停药后自主呼吸恢复时间、气管导管拔管时间均明显长于A组和C组(P<0.05)。可能是芬太尼的使用,其镇痛镇静的同时,对自主呼吸的抑制作用,使得呼吸恢复时间及拔管时间相应均延长。但也有报道,纳布啡的主要缺点是更显著和长期的术后镇静[15]。本次研究中,C组与B组均出现不同程度的镇静,与A组差异有统计学意义(P<0.05)。观察发现C组与A组自主呼吸恢复时间、拔管时间时间相当,差异无统计学意义(P>0.05),可见纳布啡的镇静作用,并没有明显延长呼吸恢复时间和拔管时间。研究中发现,纳布啡的镇静相较于芬太尼而言似乎是更浅一些,呼之即醒,而且少有定向障碍表现。而芬太尼则恰恰相反,会出现明显的定向障碍和深睡,有待进行更全面的临床对比研究。
综上所述,全身麻醉下腹腔镜胆囊切除术患者在手术结束前静脉预先注射纳布啡 0.2 mg/kg,能通过确切的镇痛效果,而减少患者在全身麻醉苏醒期的躁动发生率。使患者在全身麻醉苏醒期更加平稳舒适,阿片类相关不良反应发生率较低,值得临床参考应用。
4 参考文献
[1] Abdulatif M,Ahmed A,Mukhtar A,et al.The effect of magnesium sulphate infusion on the incidence and severity of emergence agitation in children undergoing adenotonsillectomy using sevoflurane anaesthesia[J].Anaesthesia,2013,68(10):1045.
[2] Kim MS,Moon BE,Kim H,et al.Comparison of propofol and fentanyl administered at the end of anaesthesia for revention of emergence agitation after sevoflurane anaesthesia in children[J]. Br J Anaesth,2013,110(2):274.
[3] Sun L,Guo R,Sun L.Dexmedetomidine for preventing sevoflurane-related emergence agitation in children:a meta-analysis of randomized controlled trials[J].Acta Anaesthesiol Scand,2014,58(6):642.
[4] 刘 新.539例全身麻醉手术患者苏醒期躁动原因分析及护理[J].中华护理杂志,2007,10,(10):886.
[5] 邓立琴,丁凤兰,刘 红.全身麻醉术后躁动225例分析[J].实用医学杂志,2006,22(2):165.
[6] YU Daihua,CHAI Wei,SUN Xude,et al.Emergence agitation in adults:risk factors in 2000 patients[J].Can J Anesth,2010,57(9):843.
[7] Wei Zhang,Yue Liu,Bailing Hou,et al.Activation of spinal alpha-7 nicotinic acetylcholine receptor attenuates remifentanil-induced postoperative hyperalgesia[J].Int J Clin Exp Med,2015,8(2):1871.
[8] Celerier E,Gonzalez JR,Maldonado R,et al.Opioid-induced hyperalgesia in a murine model of postoperative pain:role of nitric oxide generated from the inducible nitric oxide synthase[J]. Anesthesiology,2006,104(3):546.
[9] Thompson JP,Rowbotham DJ.Remifentanil:an opioid for the 21st centrury[J].Br J Anasth,1996,76(3):341.
[10] 张利萍,张 招,张芝翠,等.全身麻醉患者静脉注射瑞芬太尼的药代动力学[J].中华麻醉学杂志,2006,26(1):43.
[11] Ure BM,Troidl H,Spangenberger W,et al.Pain after laparoscopic cholecystectomy.Intensity and localization of pain and analysis of predictors in preoperative symptoms and intraoperative events[J].Surg Endosc,1994,8(2):90.
[12] Zheng Zeng,Jianhua Lu,Chang Shu,et al.A Comparision of nalbuphine with morphine for analgesic effects and safety:meta-analysis of randomized controlled trials[J]. Sci Rep,2015,3(5):10927.
[13] Schmauss C,Doherty C,Yaksh TL.The analgetic effects of an intrathecally administeredpartial opiate agonist,nalbuphine hydrochloride[J].Eur J Pharmacol,1982,86(1):1.
[14] Arnoud JF,Pinaud M.Pharmacology of nalbuphine[J]. Ann Fr Anesth Reanim,1992,11(2):221.
[15] Pugh GC,Drummond GB.A dose-response study with nalbuphine hydrochloride for pain in patients after upper abdominal surgery[J].Br J Anaesth,1987,59(11):1356.
