EDTA和有机酸对毛竹修复重金属污染土壤的强化作用
2018-06-22叶朝军吴家胜陈俊任徐美贞
叶朝军,吴家胜,钟 斌,陈俊任,郭 佳,徐美贞,柳 丹,
(1.温州科技职业学院 科技产业开发处,浙江 温州325006;2.浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300;3.浙江农林大学 浙江省土壤污染生物修复重点实验室,浙江 杭州311300;4.东阳市画水镇人民政府,浙江 东阳 321000;5.浙江诚邦园林股份有限公司,浙江 杭州310008)
随着工农业的发展及人类的活动加剧,重金属污染已经严重危害到人类的健康[1-2]。目前,植物修复因其绿色环保受到广泛的关注,但由于受到土壤中重金属生物有效性的影响,植物修复效率低下[3-4]。利用螯合剂来活化土壤中的重金属,促进植物对重金属的吸收,是提高植物修复效率的方法之一[5],其中,乙二胺四乙酸(EDTA)是使用最广泛的一种螯合剂,能够显著提高铅(Pb),铜(Cu),镉(Cd)等重金属的活性[6-8]。CHIGBO等[9]在铜污染的土壤中施加EDTA强化植物修复后显著提高了土壤中铜的有效态含量,同时显著促进了植物对铜的吸收积累。有研究表明:EDTA的生物降解性差,可能会对环境造成一定污染[10]。草酸、柠檬酸等生物降解性较好的小分子有机酸也被广泛用于植物修复中[11]。DUQUÈNE等[12]研究发现,使用5 mmol·kg-1柠檬酸、柠檬酸铵、草酸等有机酸显著增加了土壤溶液中重金属的质量浓度。相对于其他超积累植物或者重金属富集植物,毛竹Phyllostachys edulis拥有巨大的生物量,并且已被证明作为植物修复材料的可能性[13-14]。本研究采用镀锌厂重金属污染土壤和毛竹苗进行土柱淋洗试验,研究施加螯合剂EDTA和有机酸后毛竹叶片叶绿素荧光特性,毛竹重金属质量分数变化,土壤溶液重金属质量分数及EDTA质量浓度的动态变化,为螯合剂强化重金属污染土壤植物修复提供科学依据。
1 材料与方法
1.1 供试材料
供试土壤来自浙江省杭州市富阳区云纳热镀锌厂附近农田(29°53′17″N, 119°53′24″E), 采集 0~20,20~40,40~60 cm等3个土层的重金属污染土壤,风干过5 mm筛,其土壤基本理化性质见表1。供试植株:由种子培养生长在基质中的毛竹幼苗,选择长势相似且无病虫害的幼苗,用蒸馏水去除附着的基质,在含有1/2 Yoshida营养液(pH 5.8)的黑色塑料盆中预培养。营养液隔5 d更新1次,保持24 h通气。

表1 土壤基本理化性质Table 1 Physicochemical properties of soil
1.2 实验设计与处理
将不同土层的土壤装入土柱中,并且在5,20,40,60 cm土层处装入土壤溶液收集器[15]。栽植毛竹苗3株·土柱-1,并且控制土柱土壤含水率,整个实验培养周期为2个月,在实验结束前10 d,一次性分别添加人工螯合剂和有机酸。所添加的人工螯合剂为质量摩尔浓度1.5 mmol·kg-1(E1.5)和3.0 mmol·kg-1(E3.0)的 EDTA-Na2; 有机酸根据毛竹苗根系分泌物配制, 为 m(草酸)∶m(柠檬酸)∶m(乳酸)=5∶1∶1 的混合物[16], 质量摩尔浓度为 15.0 mmol·kg-1(S15)和 30.0 mmol·kg-1(S30), 以不添加螯合剂和有机酸为对照(ck),共5个处理,重复3个·处理-1,并随机排放。整个试验在浙江农林大学温室大棚内完成。为避免pH值不同所引起的活化差异,所添加的EDTA和有机酸的pH值均调节成供试土壤pH值[17]。
1.3 土壤溶液的收集
在添加螯合剂前1 d,收集土柱各土层的土壤溶液,作为初始溶液,然后一次性加入EDTA和有机酸,并在第1,3,5,7,9天收集土壤溶液[18],共6次。收集到的土壤溶液取10 mL酸化,利用ICPOES测定土壤液中重金属质量分数,其余冷冻保存冰箱备用。
1.4 植物叶绿素荧光的测定
在试验结束前2 d,选择晴朗天气,利用便携式叶绿素荧光仪在9:00-12:00测定每株毛竹第3片叶片叶绿素荧光特征。Fo为初始荧光;Fm为最大荧光产量;Fv/Fm为PSⅡ最大光化学量子产量;Fv/Fo为PSⅡ潜在光化学效率。
1.5 毛竹重金属质量分数测定
收获的毛竹用20.0 mmol·L-1EDTA-Na2浸泡20 min,去除附着的重金属,将毛竹分为根茎叶3部分,粉碎,称取0.1 g的样品,用硝酸/高氯酸消煮定容至50 mL并过滤,用ICP-OES测定重金属质量分数。
1.6 土壤溶液中EDTA质量浓度的测定
EDTA质量浓度测定参考郭晓方等[19]、郑睿行等[20]方法:取1.0 mL样品至管中,加1.0 mL氯化铁溶液(2.5 mmol·L-1)和1.0 mL抗坏血酸(含4.0 mg抗坏血酸),稀释至5.0 mL,水定容摇匀,经0.22 μm微孔滤膜过滤,立即液相色谱法测定。液相色谱为日本LC-20AT,分析柱:C18 Inertsil ODS-SP色谱柱(4.6 mm × 250 mm, 5 μm), 岛津; 保护柱: Inertsil ODS-SP(5 μm, 4.0 mm × 10 mm), 岛津; 流动相:水-甲醇(80+20)含有 0.02 mol·L-1四丁基溴化铵, 0.03 mol·L-1乙酸钠缓冲液(磷酸调 pH 4); 流速: 0.8 mL·min-1, 检测波长: 258 nm。
1.7 数据分析
采用Excel 2013和SPSS 21.0软件进行数据处理,用SigmaPlot 12.5软件作图。采用方差分析和最小差异显著法(LSD)对数据进行统计分析,差异显著性水平为P<0.05。
2 结果分析
2.1 EDTA及有机酸对毛竹叶绿素荧光特性的影响
由表2可知:施加EDTA和有机酸后,Fo略微上升,与对照组之间无显著差异;而Fm,Fv/Fm和Fv/Fo不同程度地下降,且添加3.0 mmol·kg-1EDTA和有机酸后,Fm,Fv/Fm和Fv/Fo显著降低,在30.0 mmol·kg-1有机酸下Fm,Fv/Fm和Fv/Fo下降幅度最大,分别降低了11.7%,5.3%和19.2%。可见,30.0 mmol·kg-1的有机酸处理对毛竹叶片叶绿素荧光特性抑制效果最为显著。

表2 添加EDTA和有机酸后毛竹叶片叶绿素荧光变化Table 2 Changes of chlorophy fluorescence parameter of moso bamboo leaves after adding EDTA and organic acids
2.2 EDTA及有机酸强化毛竹吸收重金属
从图1可以看出:添加EDTA后毛竹对3种重金属的吸收显著增加,且随着EDTA质量摩尔浓度增加而增加;添加有机酸后,毛竹对重金属的吸收无显著差异。毛竹从土壤吸收的重金属主要集中在根部,其次在茎,最少在叶,并且毛竹对镉的转运效率最高,对铜的转运效率最低。
2.3 EDTA及有机酸对重金属在不同土层内迁移的影响
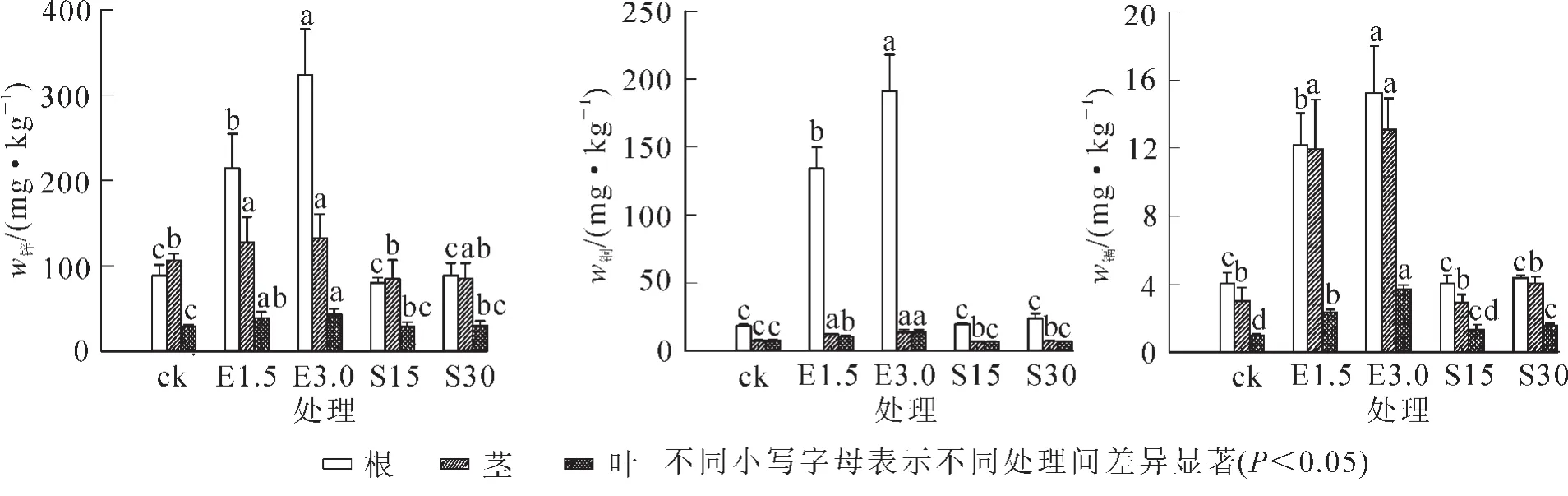
图1 EDTA和有机酸对毛竹吸收重金属的影响Figure 1 Effect of EDTA and organic acids on moso bamboo accumulated heavy metal
2.3.1 EDTA及有机酸对铜在不同土层内迁移的影响 由图2所示:在对照处理中,土壤溶液中铜质量分数随着采集时间的增加始终在低于0.1 mg·kg-1的范围内波动。在土壤中添加螯合剂后,土壤溶液中铜的质量分数显著增加。在EDTA处理中,3.0 mmol·kg-1EDTA对铜的活化作用较强,在添加EDTA后第1天各土层土壤溶液中铜质量分数显著上升,且5 cm土层处土壤溶液中铜质量分数变化最大,与对照相比分别增加了1 215和1 639倍。随着时间的推移,5 cm表层土层土壤溶液中铜质量分数先升高,在第3天的时候达到最大,然后再随时间的增加而降低;在20 cm及更深的土层中,土壤液中的铜不断累积。添加有机酸后,只有表层土壤表现出明显的活化作用。在5 cm土层中,15.0 mmol·kg-1有机酸处理后,土壤溶液中铜质量分数随着时间增加逐渐减少,15.0 mmol·kg-1有机酸处理后,土壤溶液中铜质量分数随着时间增加先增加后减少,在20 cm处,仅在添加有机酸的第1天铜质量分数显著增加。在整个土柱试验中,土壤溶液中铜主要集中在表层土壤。
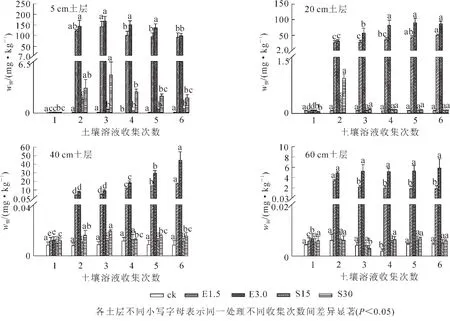
图2 各土层土壤溶液中铜质量分数的变化Figure 2 Change of Cu contents in soil solution of different soil layers
2.3.2 EDTA及有机酸对锌在不同土层内迁移的影响 由图3可知:对照土壤溶液中锌质量分数随着采集时间无显著变化,添加EDTA螯合剂后,土壤溶液中锌质量分数显著增加,且相比添加有机酸作用更加明显。在EDTA处理中,高质量浓度EDTA对锌的活化作用较强,在添加1.5和3.0 mmol·kg-1EDTA后第1天各土层土壤溶液中锌质量分数显著上升。随着时间的增加,5和60 cm土层处锌质量分数逐渐降低,在20和40 cm土层,土壤溶液中的锌质量分数随着时间的增加而增大。添加有机酸后,在5和20 cm土层土壤溶液中锌质量分数显著增加。
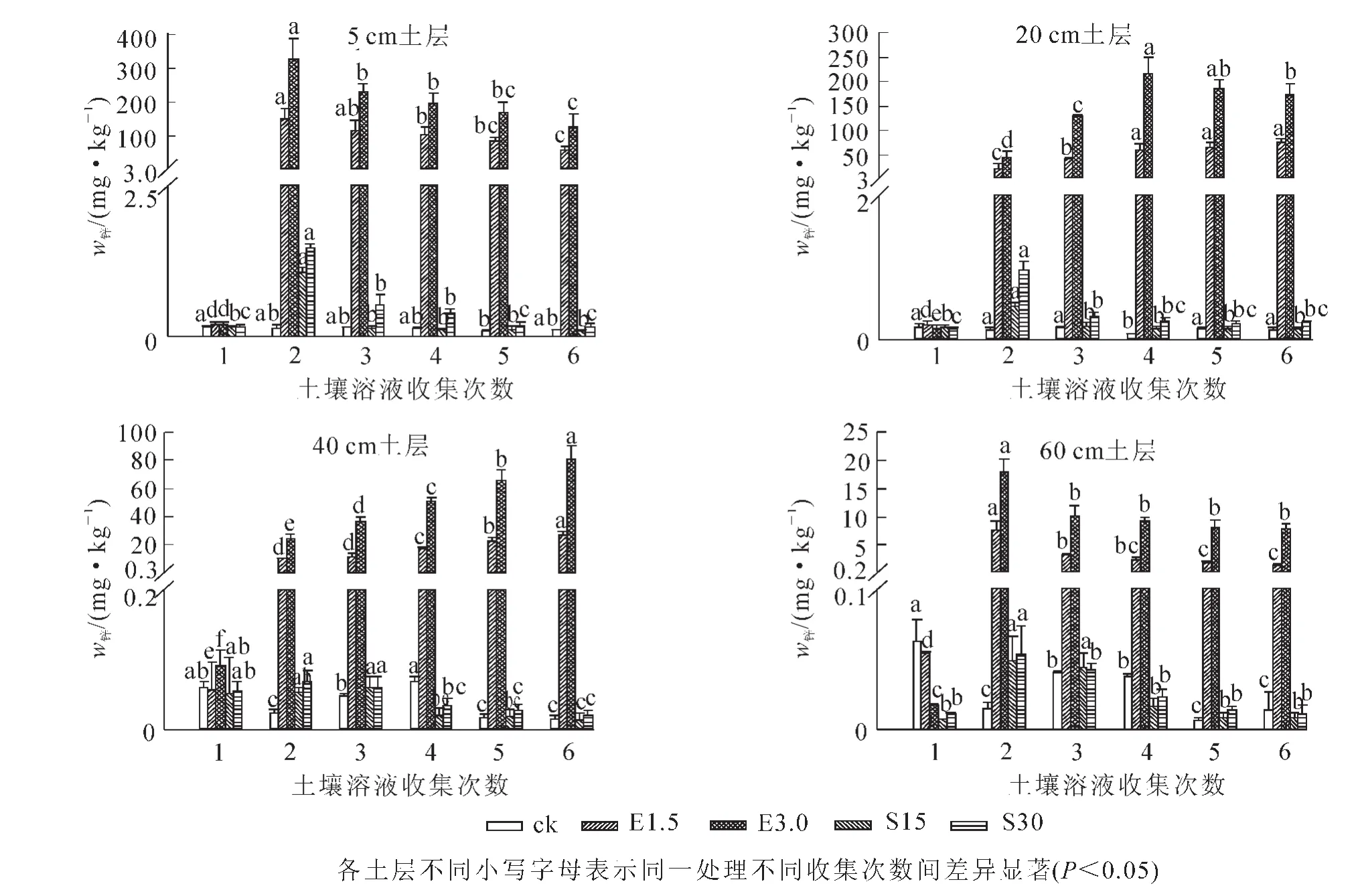
图3 各土层土壤溶液中锌质量分数的变化Figure 3 Change of Zn contents in soil solution of different soil layers
2.3.3 EDTA及有机酸对镉在不同土层内迁移的影响 由图4可见:对照土壤溶液中镉质量分数始终在很低的范围内波动。在土壤中添加螯合剂EDTA后,各土层土壤溶液中镉质量分数显著增加,对镉的活化作用显著强于有机酸处理。在添加EDTA后第1天各土层土壤溶液中镉质量分数显著上升,且5 cm土层土壤溶液中镉质量分数变化最大,相比对照分别增加了353和1 012倍。随时间的增加,各土层土壤溶液中镉与锌的质量分数变化趋势一致。添加有机酸对各土层土壤镉都有活化作用,且表层土壤最显著,随时间的增加镉质量分数不断降低。在整个淋洗柱中,土壤溶液中镉质量分数随土壤深度的增加而减少。
2.4 土壤溶液中EDTA质量浓度的变化
由图5所知:添加1.5和3.0 mmol·kg-1EDTA后,土壤溶液中EDTA主要集中在5 cm土层。随着时间的增加,5 cm土层处EDTA质量浓度显著降低,5 d后达到稳定,分别为110.9~122.9 mg·L-1和257.8~263.3 mg·L-1; 20 cm 土层 EDTA 质量浓度为 47.7~55.6 mg·L-1和 84.4~124.5 mg·L-1, 无显著变化;40 cm土层EDTA施加第1天达到最高,分别为22.3和50.7 mg·L-1,之后显著下降达到稳定;60 cm土层 EDTA 质量浓度相对较小, 分别为 2.9~6.2 mg·L-1和 7.3~10.7 mg·L-1, 差异不显著。
3 讨论
叶绿素荧光是反映植物光合生理的一个指标[21]。本研究中,添加3.0 mg·L-1EDTA和有机酸后毛竹叶片最大荧光Fm,PSⅡ最大光化学效率Fv/Fm和PSⅡ潜在光化学效率Fv/Fo显著降低,表明螯合剂的添加降低了植物的光合生物素,使植物的光合系统遭到破坏。EDTA处理后的毛竹叶片荧光参数降低,主要原因可能是EDTA活化了土壤中的重金属,提高了重金属的生物有效质量分数,高质量分数的重金属损害了毛竹的生长,对毛竹细胞内叶绿体、线粒体及细胞壁等结构产生了毒害作用[13,22]。同样添加有机酸后也降低了毛竹叶片的叶绿素荧光参数,可能有机酸分解后改变了土壤的基本理化性质,从而改变了毛竹苗的生长状况。
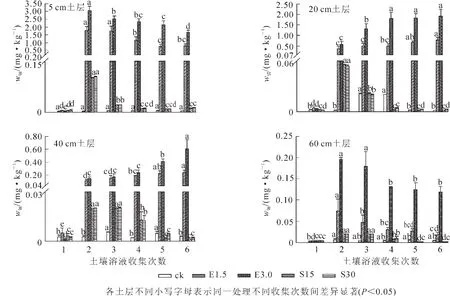
图4 各土层土壤溶液中镉质量分数的变化Figure 4 Change of Cd contents in soil solution of different soil layers
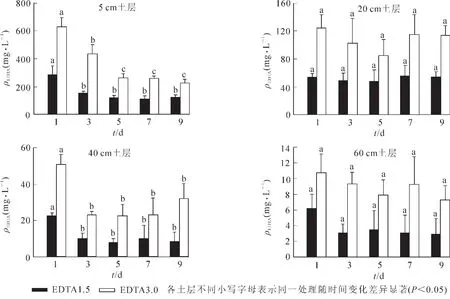
图5 各土层土壤溶液中EDTA质量浓度的变化Figure 5 Change of EDTA contents in soil solution of different soil layers
螯合剂可以活化土壤中难溶态重金属,改善其生物有效性[7,27],提高植物对土壤中重金属的吸收效率[23-24]。EDTA是一种普遍使用的螯合剂,添加EDTA显著提高了毛竹对土壤中锌、铜和镉的吸收,作用效果显著高于有机酸。这与CAY等[25]研究EDTA强化蜀葵Althaea rosea修复重金属污染土壤得出的结果相似。添加有机酸并没有明显促进毛竹对重金属的吸收,可能是由于添加的有机酸分解后改变了土壤的基本理化性质,抑制了毛竹吸收重金属,这与吴龙华等[26]的研究结果类似。本研究中,EDTA淋洗显著增加了0~20 cm土层土壤中可溶性铜、锌和镉的质量分数,由于EDTA活化效果强,土壤溶液中铜、锌和镉的质量分数相对比较高。添加EDTA增强了重金属的迁移性,导致20和40 cm处土壤溶液中铜、锌和镉的质量分数随着时间的增加而增加。YLIVAINIO等[28]研究表明:在石灰性土壤中添加EDTA可持续提高镉、铅和镍在土壤中的溶解性。在本研究中,添加有机酸初期对土壤中铜和锌的活化效果比较明显,随着时间的推移,活化效果消失甚至产生了钝化效果。可能是由于有机酸在土壤中很快被土壤微生物分解,对重金属的活化效果消失,而且可能改变了土壤的pH值,从而产生钝化效果。吴龙华等[26]研究表明:施加3.0 mmol·kg-1,pH 6.3的草酸、柠檬酸或苹果酸对土壤铜含量及其形态分配无显著影响。添加有机酸后,土壤溶液中铜和锌质量分数在40和60 cm土层处变化不显著,说明添加有机酸后铜和锌在土壤中的纵向迁移能力弱;而有机酸处理对镉具有一定的活化和迁移能力。在整个土柱试验中,EDTA处理对重金属的活化和迁移效果始终强于有机酸。李艳丽等[29]采用土柱模拟淋洗试验,研究了EDTA,柠檬酸和草酸3种淋洗剂对污染土壤中镉纵向迁移的影响,结果表明:EDTA对镉的迁移能力强于柠檬酸和草酸。
EDTA添加到土壤后会长时间残留,并迁移到更深的土壤中,从而对环境造成一定的风险[30-31]。有研究表明:可根据土壤类型,通过控制EDTA的施用量及施用时间来控制EDTA在强化修复重金属污染土壤中的残留和迁移[19]。相比EDTA,有机酸在自然界中很容易被生物降解,因此它的环境风险更小[32-33]。本研究中,EDTA主要集中在表层土壤,但第1天在40 cm土壤溶液中检测到相对较高的质量浓度,说明EDTA在土壤中迁移能力强。在第5天到第9天EDTA质量浓度相对稳定且相对较高,也说明EDTA很难被分解。
4 结论
乙二胺四乙酸(EDTA)和有机酸处理抑制了毛竹的叶绿素荧光特性,且30.0 mmol·kg-1有机酸处理的抑制程度最大,3.0 mmol·kg-1EDTA处理其次,15.0 mmol·kg-1有机酸处理最小。在整个土柱试验中,EDTA处理显著提高了土壤溶液中重金属质量分数,加重了重金属向下迁移的风险;有机酸处理对重金属的活化效果及在土壤中的迁移能力不明显。添加EDTA促进了毛竹对铜、锌、镉的吸收,而有机酸则无促进作用。添加1.5和3.0 mmol·kg-1EDTA后,土壤溶液中EDTA质量浓度主要集中在5 cm土层,且短期内很难被分解。
5 参考文献
[1]徐剑锋,王雷,熊瑛,等.土壤重金属污染强化植物修复技术研究进展[J].环境工程技术学报,2017,7(3):366-373.XU Jianfeng,WANG Lei,XIONG Ying,et al.Research progress on strengthening phytoremediation technologies for heavy metals contaminated soil[J].J Environ Eng Technol,2017,7(3):366 - 373.
[2]LI Zhiyuan,MA Zongwei,van der KUIJP T J,et al.A review of soil heavy metal pollution from mines in China:pollution and health risk assessment[J].Sci Total Environ,2014,468/469:843 - 853.
[3]WAN Xiaoming,LEI Mei,CHEN Tongbin.Cost-benefit calculation of phytoremediation technology for heavy-metalcontaminated soil[J].Sci Total Environ,2016,563/564:796 - 802.
[4]席梅竹,白中科,赵中秋.重金属污染土壤的螯合剂诱导植物修复研究进展[J].中国土壤与肥料,2008(5):6-11.XI Meizhu,BAI Zhongke,ZHAO Zhongqiu.Advances on the study of chelate-enhanced phytorermediation for heavy metal contaminated soils [J].Soil Fert Sci China,2008(5):6 - 11.
[5]刘孝利,曾昭霞,铁柏清,等.几种修复措施对Cd淋失及土壤剖面运移影响[J].环境科学,2016,37(2):734-739.LIU Xiaoli,ZENG Zhaoxia,TIE Baiqing,et al.Cd runoff load and soil profile movement after implementation of some typical contaminated agricultural soil remediation strategies [J].Environ Sci,2016,37(2):734 - 739.
[6]张玉秀,黄智博,柴团耀.螯合剂强化重金属污染土壤植物修复的机制和应用研究进展[J].自然科学进展,2009, 19(11): 1149 - 1158.ZHANG Yuxiu,HUANG Zhibo,CHAI Tuanyao.Advances in mechanisms and applications of chelating agents for phytoremediation of heavy metal contaminated soils [J].Progr Nat Sci,2009,19(11):1149 - 1158.
[7]LUO Jie,QI Shihua,SOPHIE X W,et al.An evaluation of EDTA additions for improving the phytoremediation efficiency of different plants under various cultivation systems [J].Ecotoxicology,2016,25(4):646 - 654.
[8]LAI H Y,CHEN Z S.The influence of EDTA application on the interactions of cadmium,zinc,and lead and their uptake of rainbow pink (Dianthus chinensis) [J].J Hazard Mater,2006,137(3):1710.
[9]CHIGBO C,BATTY L.Chelate-assisted phytoremediation of Cu-pyrene-contaminated soil using Z.mays [J].Water Air Soil Pollut,2015,226(3):74.doi:10.1007/s11270-014-2277-2.
[10]龙珍,徐海涛,张亚平,等.活化剂联合植物移除污染土壤重金属的研究进展[J].环境工程,2016,34(10): 172 - 176.LONG Zhen,XU Haitao,ZHANG Yaping,et al.Removal of heavy metals from contaminated soils by activating agents combined with plants [J].Environ Eng,2016,34(10):172 - 176.
[11]易龙生,王文燕,陶冶,等.有机酸对污染土壤重金属的淋洗效果研究[J].农业环境科学学报,2013,32(4): 701 - 707.YI Longsheng,WANG Wenyan,TAO Ye,et al.Removing heavy metals in contaminated soil by the organic acids[J].J Agro-Environ Sci,2013,32(4):701 - 707.
[12]DUQUÈNE L,VANDENHOVE H,TACK F,et al.Enhanced phytoextraction of uranium and selected heavy metals by Indian mustard and ryegrass using biodegradable soil amendments [J].Sci Total Environ,2009,407(5):1496 - 1505.
[13]CHEN Junren,SHAFI M,LI Song,et al.Copper induced oxidative stresses,antioxidant responses and phytoremediation potential of Moso bamboo (Phyllostachys pubescens) [J].Sci Rep,2015,5(3):13554.
[14]PENG Danli,SHAFI M,WANG Ying,et al.Effect of Zn stresses on physiology,growth,Zn accumulation,and chlorophyll of Phyllostachys pubescens [J].Environ Sci Pollut Res,2015,22(19):14983 - 14992.
[15]LIU Dan,ISLAM E,MA Junshan,et al.Optimization of chelator-assisted phytoextraction,using EDTA,lead and Sedum alfredii Hance as a model system [J].Bull Environ Contam Toxicol,2008,81(1):30 - 35.
[16]CHEN Junren,SHAFI M,WANG Ying,et al.Organic acid compounds in root exudation of moso bamboo (Phyllostachys pubescens) and its bioactivity as affected by heavy metals [J].Environ Sci Pollut Res,2016,23(20):20977-20984.
[17]WU L H,LUO Y M,CHRISTIE P,et al.Effects of EDTA and low molecular weight organic acids on soil solution properties of a heavy metal polluted soil[J].Chemosphere,2003,50(6):819 - 822.
[18]DOUMETT S,LAMPERI L,CHECCHINI L,et al.Heavy metal distribution between contaminated soil and Paulownia tomentosa,in a pilot-scale assisted phytoremediation study:influence of different complexing agents [J].Chemosphere,2008,72(10):1481-1490.
[19]郭晓方,卫泽斌,吴启堂.乙二胺四乙酸在重金属污染土壤修复过程的降解及残留[J].农业工程学报,2015, 31(7): 272 - 278.GUO Xiaofang,WEI Zebin,WU Qitang.Degradation and residue of EDTA used for soil repair in heavy metal-contaminated soil[J].Trans Chin Soc Agric Eng,2015,31(7):272 - 278.
[20]郑睿行,张旭,方芳,等.高效液相色谱法测定酱腌菜制品中EDTA残留量[J].中国食品添加剂,2011(2): 212 - 219.ZHENG Ruihang,ZHANG Xu,FANG Fang,et al.Technical studies of detection method of EDTA residue in the pickled product[J].China Food Add,2011(2):212 - 219.
[21]简敏菲,汪斯琛,余厚平,等.Cd2+,Cu2+胁迫对黑藻(Hydrilla verticillata)的生长及光合荧光特性的影响[J].生态学报, 2016, 36(6): 1719- 1727.JIAN Minfei,WANG Sichen,YU Houping,et al.Influence of Cd2+or Cu2+stress on the growth and photosynthetic fluorescence characteristics of Hydrilla verticillata [J].Acta Ecol Sin,2016,36(6):1719 - 1727.
[22]AZZARELLO E,PANDOLFI C,GIORDANO C,et al.Ultramorphological and physiological modifications induced by high zinc levels in Paulownia tomentosa [J].Environ Exp Bot,2012,81(3):11 - 17.
[23]卫泽斌,陈晓红,吴启堂,等.可生物降解螯合剂 GLDA诱导东南景天修复重金属污染土壤的研究[J].环境科学, 2015,36(5):1864 - 1869.WEI Zebin,CHEN Xiaohong,WU Qitang,et al.Enhanced phytoextraction of heavy metals from contaminated soils using Sedum alfredii Hance with biodegradable chelate GLDA [J].Environ Sci,2015,36(5):1864 - 1869.
[24]LEE J,SUNG K.Effects of chelates on soil microbial properties,plant growth and heavy metal accumulation in plants [J].Ecol Eng,2014,73:386 - 394.
[25]CAY S,UYANIK A,ENGIN M S,et al.Effect of EDTA and tannic acid on the removal of Cd,Ni,Pb and Cu from artificially contaminated soil by Althaea rosea Cavan [J].Int J Phytoremed,2015,17(6):568 - 574.
[26]吴龙华,骆永明.铜污染土壤修复的有机调控研究(Ⅲ)EDTA和低分子量有机酸的效应[J].土壤学报,2002, 39(5): 679 - 685.WU Longhua,LUO Yongming.Chelate-enhanced phytoremediation of copper polluted soil (Ⅲ)effect of EDTA and low molecule weight organic acids [J].Acta Pedol Sin,2002,39(5):679 - 685.
[27]UDOVIC M,LESTAN D.Pb,Zn and Cd mobility,availability and fractionation in aged soil remediated by EDTA leaching [J].Chemosphere,2009,74(10):1367 - 1373.
[28]YLIVAINIO K.Effects of iron (III) chelates on the solubility of heavy metals in calcareous soils [J].Environ Pollut,2010,158(10):3194 - 3200.
[29]李燕丽,李博文,刘微,等.有机酸淋洗对土壤Cd纵向迁移及有效性的影响[J].水土保持学报,2011,25(1): 34 - 38.LI Yanli,LI Bowen,LIU Wei,et al.Effects of soil leaching with organic acid on vertical movement and the availability of Cd in soil[J].J Soil Water Conserv,2011,25(1):34 - 38.
[30]WU L H,LUO Y M,XING X R,et al.EDTA-enhanced phytoremediation of heavy metal contaminated soil with Indian mustard and associated potential leaching risk [J].Agric Ecosyst Environ,2004,102(3):307 - 318.
[31]SHAHID M,AUSTRUY A,ECHEVARRIA G,et al.EDTA-enhanced phytoremediation of heavy metals:a review[J].Soil Sedim Contam Int J,2014,23(4):389 - 416.
[32]MEERS E,RUTTENS A,HOPGOOD M J,et al.Comparison of EDTA and EDDS as potential soil amendments for enhanced phytoextraction of heavy metals [J].Chemosphere,2005,58(8):1011 - 1022.
[33]EVANGELOU M W H,EBEL M,SCHAEFFER A.Evaluation of the effect of small organic acids on phytoextraction of Cu and Pb from soil with tobacco Nicotiana tabacum [J].Chemosphere,2006,63(6):996 - 1004.
