体素内不相干运动扩散加权成像对前列腺癌的诊断价值
2018-06-21莫树群曹惠霞韩立新张丽沈君
莫树群, 曹惠霞, 韩立新, 张丽, 沈君

表1 前列腺癌组与前列腺增生组各IVIM-DWI参数值

表2 IVIM-DWI各参数对前列腺癌的诊断效能
前列腺癌是西方发达国家男性最常见的恶性肿瘤。近年来随着国人人均寿命逐步提高,饮食习惯及生活方式逐渐西化,前列腺癌的发病率迅速上升,严重威胁中老年男性的健康[1]。前列腺癌的临床诊断方法包括血清前列腺特异性抗原、直肠指诊和经直肠超声引导下穿刺活检,但肿瘤的检出率不尽人意。MRI对前列腺癌较敏感,尤其是扩散加权成像(diffusion-weighted imaging,DWI)。近年来随着IVIM-DWI的应用,有望进一步提高前列腺癌的检出能力,但相关报道不多,且结果不一致[2-3]。
材料与方法
搜集2013年6月至2015年1月我院经活检证实的前列腺癌30例及前列腺增生21例,30例前列腺癌患者年龄56~84岁,平均64岁;21例前列腺增生患者年龄50~81岁,平均62岁。组织活检均于完成MRI检查后3d内进行,对MRI上所显示的可疑病灶,采用经直肠超声引导下穿刺活检。
51例患者均行常规MRI检查常规(包括横轴面T1WI、T2WI以及冠状面T2WI、矢状面T2WI)及IVIM-DWI成像,扫描机型为GE 3.0T HDx MRI扫描仪, 8通道腹部相控阵线圈。IVIM-DWI参数:单次激发自旋回波平面成像序列,TR 4584 ms,TE 最小值,11个b值(0,10,20,30,50,100,200,400,600,1000,1200 s/mm2)。视野250 mm×250 mm,矩阵256×256,层厚4 mm,层间隔1 mm,平均激励次数2次。
将IVIM-DWI图像传至GE公司AW4.5工作站,获得D值、f值、D*值及ADC值参数图,根据T2WI及DWI图像并参照病理活检结果,选取病灶最大层面手工勾画ROI,尽可能包含全部实体病灶区,大小约35~100个像素不等。测量前列腺癌及前列腺增生的D值、f值、D*值及ADC值。
采用非参数检验Mann-Whitney U Test法比较前列腺癌组与前列腺增生组的D值、f值、D*值及ADC值。采用ROC曲线法分析各参数诊断前列腺癌的敏感性和特异性。使用SPSS19.0软件进行统计学分析,检验水准均为P<0.05。
结 果
前列腺癌的IVIM-DWI表现:d图及ADC图显示病灶区明显扩散受限,d图更明显,病灶轮廓显示更清晰,f图显示病灶区灌注分数降低,D*图信噪比较低,病灶区与周围腺体区域无明显信号差别(图1)。前列腺增生的IVIM-DWI表现:d图及ADC图显示轻度扩散受限,f图显示灌注分数正常或轻度降低,同样,D*图信噪比较低(图2)。
30例前列腺癌及21例前列腺增生各IVIM-DWI参数结果及比较如下表(表1)。前列腺癌的D值、f值及ADC值均低于前列腺增生(P<0.001),D*值高于前列腺增生(P=0.002)。ROC分析结果显示IVIM-DWI各参数对前列腺癌的诊断效能较高(表2)。
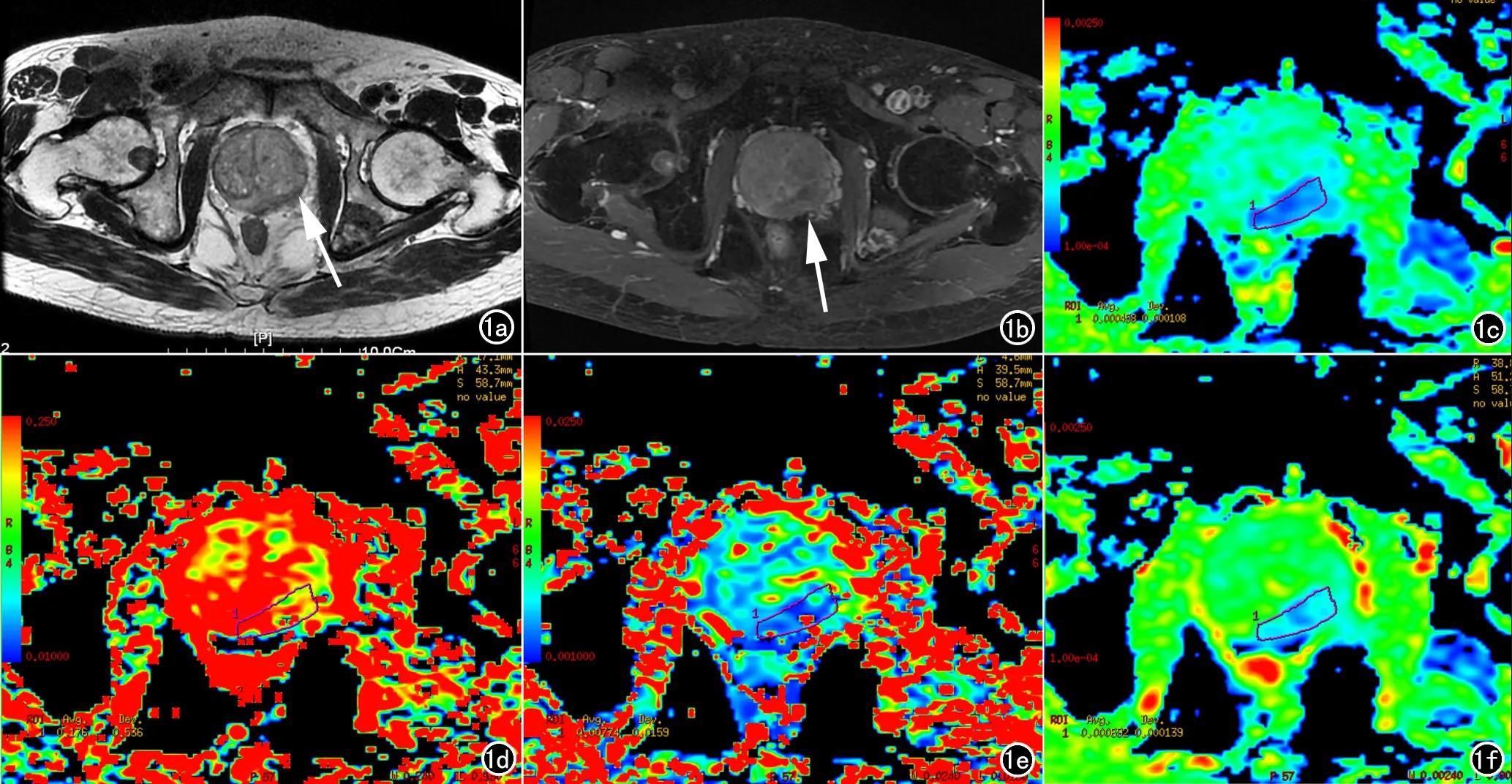
图1 a) T2WI示前列腺左侧外周带信号减低,境界不清(箭); b) 增强T1WI示前列腺左侧外周带不均匀强化(箭); c) 分子扩散系数图显示病灶区扩散受限; d) 灌注分数图显示病灶区灌注分数降低; e) 假扩散系数图信噪比较低,病灶区与周围腺体区域无明显信号差别; f) 表观扩散系数图显示病灶区ADC值降低。
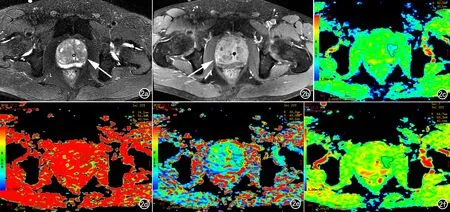
图2 a) T2WI示前列腺移行带多发结节样等、高信号(箭); b) 增强T1WI显示前列腺移行带强化不均匀(箭); c) 分子扩散系数图示前列腺左侧轻度扩散受限区域; d) 灌注分数图未见明确灌注分数降低区; e) 假扩散系数图信噪比较低,前列腺左侧似见假扩散减低区; f) 表观扩散系数图未见明确ADC值降低区。
DWI能从水分子扩散水平反应人体组织及病变组织结构特性。人体组织DWI信号衰减不符合简单的单指数模型,ADC值对毛细血管灌注非常敏感,受b值的影响较大,不同b值所得ADC值差异显著,不同研究中心所得ADC值结果缺乏可比性,给临床应用带来诸多困惑[4-5]。DWI反映的是体素内水分子的运动变化,组织毛细血管网无规则排列,其内血液亦呈无规律运动,故活体组织ADC不仅包括真正意义上的水分子扩散,还包括微循环灌注所造成的水分子运动,即假扩散。IVIM是用来描述随着b值升高组织信号衰减的相互关系的数学模型[6]。IVIM-DWI通过双指数衰减模型公式S/S0=(1-f)exp(-bD)+ fexp(-b(D*+D)),可计算出D值(分子扩散系数)、D*值(假扩散系数)、以及反映组织微循环的f值(灌注分数)。该模型不仅把表观扩散系数(ADC)分解为真扩散系数(D)与假扩散系数(D*)两部分,而且能提供组织灌注信息f值,从而更准确反映组织的病理特征。
Riches等把IVIM-DWI应用于前列腺研究,首次证实应用单指数模型所得ADC值明显高于双指数模型所得D值,随所选最小b值的升高,ADC值逐渐下降,当b值达到一定范围后,ADC值与D值相当,说明双指数模型在低b值时能反映血流灌注效应[7]。Döpfert等[8]对比前列腺癌与正常前列腺组织的ADC、D、 D*及f值,结果发现前列腺癌组织的ADC、D及f值低于正常前列腺组织,而D*没有差别,认为前列腺癌组织ADC值的降低不仅由于细胞密度及形态的改变,而且受血流灌注改变的影响。Shinmoto等[9]通过IVIM-DWI比较了前列腺癌、前列腺增生及正常前列腺外周带组织的ADC、D、 D*及f值,发现前列腺癌组织的ADC、D及f值低于正常前列腺外周带,但前列腺癌与前列腺增生组织的f值之间无统计学差异,三组D*值之间因变异较大而没有统计学意义。本研究结果显示前列腺癌的D值、f值及ADC值均低于前列腺增生,D*值高于前列腺增生,与上述文献报道基本一致。前列腺癌的ADC值、D值低于前列腺增生,主要是因为前列腺癌组织由于细胞的无序增殖,细胞密度大,核浆比高,细胞内外液体含量减少,限制了水分子自由运动。本研究进一步采用ROC分析法,发现D值诊断前列腺癌的敏感度为76.7%,特异度为95.2%,ROC曲线下面积为0.921;f值诊断前列腺癌的敏感度为80%,特异度为90.5%,ROC曲线下面积为0.885;D*值诊断前列腺癌的敏感度为70%,特异度为85.7%,ROC曲线下面积为0.757;ADC值诊断前列腺癌的敏感度为76.7%,特异度为100%,ROC曲线下面积为0.937。IVIM-DWI各参数对前列腺癌的诊断效能高,尤其是D值与ADC值。另一方面该研究显示无论是前列腺癌还是前列腺增生组织,其D值均小于ADC值,表明ADC值受微循环灌注的影响,D值比ADC值能更真实反映细胞内外水分子扩散运动,与以往研究结果一致[10]。
肿瘤血管生成理论以及前列腺磁共振动态增强扫描(Dynamic contrast-enhanced MRI,DCE-MRI)提示前列腺癌血容量高于正常前列腺,本研究结果显示前列腺癌灌注分数(f值)低于前列腺增生。理论上DWI灌注参数与其他技术所测量的灌注参数应该一致,文献也有相应数据支持,Le Bihan及Turner[11]认为通过DWI技术所得灌注参数与示踪剂动力学法所得灌注参数有相关性;IVIM灌注分数与动态磁敏感加权灌注成像法测得的相对脑血容量(rCBV)相关,假扩散系数与相对脑血流量(rCBF)相关[12]。国内也有研究发现前列腺癌组织f值高于增生组织[13]。但是涎腺IVIM研究表明,f值与其他技术所得灌注参数之间无明确相关性,因为f值不仅主要受微血管灌注这一生物学过程的影响,也可能受到腺体分泌及导管内流动因素影响[14]。腺体分泌及导管内流动这种宏观流动现象同样可引起低b值DWI信号的衰减,难以与微血管灌注效应区分。本研究结果显示前列腺癌f值低于良性前列腺增生,可能是由于前列腺癌组织内肿瘤细胞的无序增殖,正常腺体消失或破坏,腺体分泌活动受到抑制,低于正常前列腺组织及增生组织,进而导致f值降低。
IVIM-DWI中使用低b值(<100~200s/mm2)对灌注信息的测量准确性非常关键。迄今使用b值的个数及b值的大小范围尚未达成共识。既往前列腺IVIM研究所使用的b值个数从4~10不等。理论上双指数衰减模型有4个拟合参数,最少需要4个b值。采用更多的b值能使参数分析更准确,目前常用≥10个以上b值。更为复杂的多指数模型比双指数模型能提供更多的信息,但其需要更高质量的数据及多次信号平均,意味着图像采集时间将大幅增加,病人往往不能耐受,临床可行性差。故比较可行的方案是采用6~8个b值。高b值时数据测量比较稳定、可重复性好[15],所以理论上采用少一些高b值(2~3个)而多一些低b值(4个或更多),把采集时间更多集中在灌注敏感区间内是比较可行的。本研究选用11个b值(0,10,20,30,50,100,200,400,600,1000,1200 s/mm2),低于100 s/mm2的b值6个,高于100 s/mm2的b值5个,经与病理结果对照,获得IVIM-DWI各参数D值、f值、D*值及ADC值对前列腺癌的诊断效能均比较高,说明本研究采用的IVIM-DWI技术,既具有临床可行性及实用性,又保证了数据测量的可信度。
本研究不足之处在于病例数相对仍偏少,而且由于IVIM-DWI上D*值的测量结果不稳定,D*在前列腺癌诊断中的价值,有待于进一步加大样本量,或采用更优数学拟合模型,提高参数测量的稳定性,进行研究。
总之,本研究结果表明IVIM-DWID的D值、f值、D*值及ADC值对前列腺癌的诊断敏感性及特异性均较高,尤其是D值与ADC值。IVIM-DWI有助于前列腺癌的诊断。
参考文献:
[1] Attard G,Parker C,Eeles RA,et al.Prostate cancer[J].Lancet,2016,387(10013):70-82.
[2] Valerio M,Zini C,Fierro D,et al.3T multiparametric MRI of the prostate:Does intravoxel incoherent motion diffusion imaging have a role in the detection and stratification of prostate cancer in the peripheral zone?[J]Eur J Radiol,2016,85(4):790-794.
[3] Merisaari H,Movahedi P,Perez IM,et al.Fitting methods for intravoxel incoherent motion imaging of prostate cancer on region of interest level:repeatability and gleason score prediction[J].Magn Reson Med,2017,77(3):1249-1264.
[4] Murphy G,Haider M,Ghai S,et al.The expanding role of MRI in prostate cancer[J].AJR,2013,201(6):1229-1238.
[5] Tan CH,Wang J,Kundra V,et al.Diffusion weighted imaging in prostate cancer[J].Eur Radiol,2011,21(3):593-603.
[6] Le Bihan D,Breton E,Lallemand D,et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J].Radiology,1988,168(2):497-505.
[7] Riches SF,Hawtin K,Charles-Edwards EM,et al.Diffusion-weighted imaging of the prostate and rectal wall:comparison of biexponential and monoexponential modelled diffusion and associated perfusion coefficients[J].NMR Biomed,2009,22(3):318-325.
[8] Döpfert J,Lemke A,Weidner A,et al.Investigation of prostate cancer using diffusion-weighted intravoxel incoherent motion imaging[J].Magn Reson Imaging,2011,29(8):1053-1058.
[9] Shinmoto H,Tamura C,Soga S,et al.An intravoxel incoherent motion diffusion-weighted imaging study of prostate cancer[J].AJR,2012,199(4):496-500.
[10] 孙美玉,刘爱连,李烨,等.体素内不相干运动对前列腺癌和前列腺增生结节的鉴别诊断[J].放射学实践,2016,31(10):947-951.
[11] Le Bihan D,Turner R.The capillary network:a link between IVIM and classical perfusion[J].Magn Reson Med,1992,27(1):171-178.
[12] Wirestam R,Borg M,Brockstedt S,et al.Perfusion-related parameters in intravoxel incoherent motion MR imaging compared with CBV and CBF measured by dynamic susceptibility-contrast MR technique[J].Acta Radiol,2001,42(2):123-128.
[13] 冷晓明,韩晓蕊,赵曼,等.IVIM-DWI在前列腺癌与前列腺增生鉴别诊断中的应用价值及其与Gleason评分的相关性[J].放射学实践,2016,31(8):760-763.
[14] Yoshino N,Yamada I,Ohbayashi N,et al.Salivary glands and lesions:evaluation of apparent diffusion coefficients with split-echo diffusion weighted MR imaging-initial results[J].Radiology,2001,221(3):837-842.
[15] Koh DM,Blackledge M,Collins DJ,et al.Reproducibility and changes in the apparent diffusion coefficients of solid tumours treated with combretastatin A4 phosphate and bevacizumab in a two centre phase I clinical trial[J].Eur Radiol,2009,19(11):2728-2738.
