EMT合并不孕患者AcrAb、Sp17Ab、CA125水平与术后妊娠结局的关系
2018-06-21郭新颖郭华峰
郭新颖,郭华峰
(郑州市妇幼保健院妇产科,河南 郑州 450000)
子宫内膜异位症(endometriosis,EMT)的发生,不仅可以导致患者痛经、月经紊乱等临床症状的出现,同时可以增加不孕的发生风险。流行病学研究显示,EMT合并不孕的发生率可达234-445/10万人左右[1,2]。在探讨EMT合并不孕的发生机制的过程中发现,自身免疫性因子的紊乱是促进患者不孕的重要因素。自身免疫性抗体、精子相关特异性蛋白抗体等因素的变化,能够干预顶体反应、透明带的形成及受精卵的着床等生理过程,导致不孕的发生[3]。顶体蛋白酶抗体(acrosin antibodies,AcrAb)、精子蛋白 17 抗体(sperm protein 17 antibody,Sp17Ab) 及血清糖类抗原 125(carbohydrate antigen 125,CA125)等,能够干扰精子功能、影响受精卵的结合等,增加免疫性损伤导致的不孕等临床结局的发生[4,5]。为了进一步揭示 AcrAb、Sp17Ab、CA125水平在EMT合并不孕患者中的异常表达及其与患者病情的关系,从而为改善生殖临床结局提供参考,本次研究选取我院手术治疗的EMT患者142例,研究了相关指标的变化,报告如下。
1 资料与方法
1.1 一般资料 选取我院手术治疗的EMT患者142例,收治时间2013年5月-2016年4月,年龄25~41 岁,平均 32.6±3.9 岁,不孕年限 3~9 年,平均5.6±2.2 年,依据美国生育协会(AFS)1997 年修正的分期标准:Ⅱ期31例、Ⅲ期58例、Ⅳ期53例;术后 3 个月患者身体质量指数 (BMI)22.6±2.2kg/m2;术后随访12个月,成功自然妊娠74例、未能成功自然妊娠68例。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴患者年龄25~41岁;⑵具有正常性生活及妊娠愿望,不孕年限≥1年;⑶EMT的诊断及分期标准参考美国生育协会 (AFS)1997年修正的诊断及分期标准;⑷所有MET患者均在我院实施手术治疗;⑸AFS分期:Ⅱ期~Ⅳ期;⑹本研究获得研究对象的知情同意及医院医学伦理委员会的批准。
1.2.2 排除标准 ⑴子宫肌瘤等其他妇科肿瘤疾病;⑵既往具有其他病因导致的子宫手术史;⑶伴有甲状腺功能疾病、多囊卵巢综合征等其他不孕因素;⑷因男性肾盂功能障碍导致的不孕。
1.3 手术方法 患者取仰卧位,常规腹部消毒铺单,连续硬膜外麻醉,采用腹直肌纵切口,进腹后血管钳夹持两侧附件,观察子宫内膜异位症的病灶部位,累及范围,采用钝性分离粘连带,对于边界明显的异位症病灶进行切除,采用电凝止血,2-0的微乔线缝合,术后给予常规抗生素预防感染,并定期复查超声。
1.4 指标检测方法 采集空腹静脉血约5ml并分作两份,一份自然抗凝后以3000r/min离心10min,取上清液采用酶联免疫吸附法测定血清中AcrAb、Sp17Ab水平,检测试剂盒购自北京中杉金桥生物有限公司,具体检测步骤严格按照试剂盒说明书进行操作;另一份置于枸橼酸钠抗凝管内,加入CA125检测试剂盒后,利用胶体金法检测CA125水平,试剂盒购自上海奥普生物医药有限公司,具体检测步骤严格按照试剂盒说明书进行。
1.5 统计学方法 统计软件采用SPSS 16.0,采用均数±标准差(±s)进行统计描述,组间比较采用t检验;计数资料组间比较采用χ2检验;多因素分析法采用Logistic回归分析法;P值<0.05表示差异具有统计学意义。
2 结果
2.1 不同自然妊娠结局患者的一般资料比较 成功妊娠患者与妊娠失败患者的年龄、不孕年限、AFS分期、BMI比较,差异均不具有统计学意义(P>0.05)。 见表 1。
2.2 不同自然妊娠结局患者的血浆中 AcrAb、Sp17Ab及血清CA125水平比较 手术前,成功妊娠患者与妊娠失败患者的血浆中AcrAb、Sp17Ab及血清CA125水平比较,差异均不具有统计学意义(P>0.05);手术后 3 个月复查,妊娠成功组的血浆中AcrAb、Sp17Ab及血清CA125水平显著的低于妊娠失败组患者(P<0.05),两组患者术后的血浆中AcrAb、Sp17Ab及血清CA125水平较本组术前均显著的降低(P<0.05)。 见表 2。
2.3 血浆中AcrAb、Sp17Ab及血清CA125水平与EMT患者术后自然妊娠结局的多因素分析 以患者手术后1年随访结果是否成功自然妊娠作为因变量,血浆中AcrAb、Sp17Ab及血清CA125水平作为自变量进行Logistic多因素分析,结果显示:血浆中AcrAb、Sp17Ab及血清CA125水平升高是EMT患者手术后自然妊娠失败的独立危险因素(OR 值分别为 1.885,1.527,1.309,P<0.05)。 见表3。
3 讨论
EMT可以导致患者继发性不孕的发生,其机制主要考虑与自身免疫性反应、炎症反应因子的激活,或者长期的盆腔内脏器的破坏及粘连等因素有关。输卵管摄取卵子的障碍、输卵管阻塞或者宫腔内的子宫内膜微环境的变化等,均可以导致EMT合并不孕的发生[6,7]。近年来基础理论方面的研究显示免疫因素是促进EMT合并不孕发生的核心因素,特别是在重度EMT患者中,免疫性抗体产生导致的顶体反应、卵子的成熟、精子的功能、受精卵的结合及着床等生理过程异常,促进EMT合并不孕的发生[8,9]。
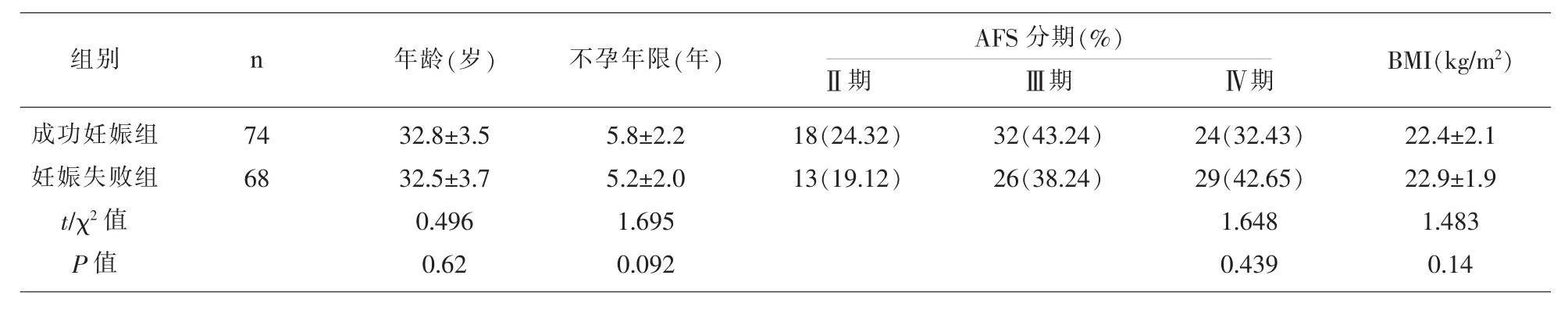
表1 不同自然妊娠结局患者的一般资料比较
表2 不同自然妊娠结局患者的血浆中AcrAb、Sp17Ab及血清CA125水平比较(±s)
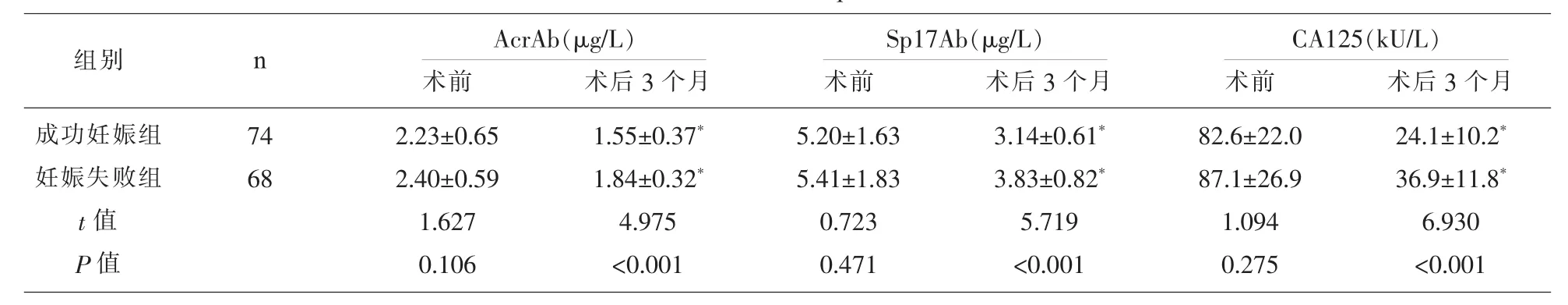
表2 不同自然妊娠结局患者的血浆中AcrAb、Sp17Ab及血清CA125水平比较(±s)
注:与本组术前比较 *P<0.05。
组别 n成功妊娠组妊娠失败组t值P值7 4 6 8 A c r A b(μ g/L)S p 1 7 A b(μ g/L)C A 1 2 5(k U/L)术前 术后3个月 术前 术后3个月 术前 术后3个月2.2 3±0.6 5 2.4 0±0.5 9 1.6 2 7 0.1 0 6 1.5 5±0.3 7*1.8 4±0.3 2*4.9 7 5<0.0 0 1 5.2 0±1.6 3 5.4 1±1.8 3 0.7 2 3 0.4 7 1 3.1 4±0.6 1*3.8 3±0.8 2*5.7 1 9<0.0 0 1 8 2.6±2 2.0 8 7.1±2 6.9 1.0 9 4 0.2 7 5 2 4.1±1 0.2*3 6.9±1 1.8*6.9 3 0<0.0 0 1

表3 血浆中AcrAb、Sp17Ab及血清CA125水平与患者自然妊娠结局的多因素分析
CA125是影响子宫内膜异位症腺体活性的重要糖蛋白,其可以通过结合糖蛋白受体促进体内CD4T淋巴细胞免疫活性的异常活化,促进自然杀伤性T淋巴细胞的细胞毒性作用,增加其对于受精卵的损伤,影响到受精卵的迁移及种植;Sp17作为特异性较高的睾丸特异性相关蛋白,其对于透明带的溶解作用及对于丝氨酸蛋白酶的激活作用,可以为受精卵的结合顶体反应提供前体,而Sp17Ab可以通过激活相关蛋白酶,促进Sp17的溶解,增加Sp17与配体的非可逆性结合程度,导致透明带水解障碍,卵黄囊及卵细胞的难以结合,增加了不孕的发生风险[10,11];AcrAb不仅可以影响到受精过程,同时可以影响到顶体素蛋白的活化,增加自身免疫性复合物的沉积,促进自身免疫损伤及炎症因子的激活,增加单核细胞或者巨噬细胞对于受精卵的浸润,导致胚胎发育不良[12]。部分研究揭示了AcrAb或者SP17等在不孕症患者体内的异常表达,认为相关指标的高表达是促进复发性流产或者不孕的重要风险,但缺乏对于AcrAb等指标在围手术期过程中的动态变化分析。
本次研究发现不孕的时间、AFS分期或者体重指数等,均不会影响不孕的发生,但也有部分研究认为AFS分期的差异可能对于不孕的发生具有直接的关系,认为AFS分期越晚、盆腔粘连越为严重,异位症病灶的机化越为明显,不孕的发生风险越高,这与本次研究的结论存在一定的差别,这主要考虑与AFS分期的分布差异、不孕的既往治疗病史或者EMT患者自身免疫因子紊乱程度的差别有关。手术治疗后患者血清中AcrAb、Sp17Ab及血清CA125水平均明显的下降,提示手术治疗能够改善患者的自身免疫性抗体的上调,抑制过度抗体上升导致的免疫复合物的沉积,改善免疫平衡,这主要与手术治疗对于异位症病灶的清除作用有关,而在成功妊娠组患者血清中,AcrAb、Sp17Ab及血清CA125水平可较失败组进一步下降,提示相关指标与妊娠结局具有密切的关系,这可以从下列几个方面进行理解[13,14]:⑴AcrAb的下降能够改善顶体反应过程中溶酶体酶的激活程度,促进溶酶体对于透明带的溶解,为精子的迁移及卵子的结合提供条件;⑵Sp17Ab的下降,降低了treg T淋巴细胞激活导致的自然性淋巴细胞免疫损伤,保护受精卵分裂、成熟、分化,并为改善子宫内膜的容受性提供前体;⑶CA125的下降则可以提示子宫内膜异位症腺体细胞的破坏、出血等的改善。Bouet P等[15]研究者探讨了部分重度EMT患者的不孕发生机制,认为AcrAb、Sp17Ab等上升导致的精子抗原抗体活性的改变是提高睾丸特异性蛋白的免疫原性、促进免疫损伤的重要因素。危险因素分析也可以发现,血浆中AcrAb、Sp17Ab及血清CA125水平升高是EMT患者手术后自然妊娠失败的独立危险因素,临床上对于EMT术后合并有不孕高危因素时,应通过随访血清中相关指标的变化,进而评估EMT患者不孕的风险,并及时临床干预,必要时可以通过免疫调节剂类药物改善临床结局。
综上所述,EMT合并不孕患者手术后血浆中AcrAb、Sp17Ab及血清CA125水平较术前显著降低,且与患者术后成功自然妊娠关系密切。
[1]Zieba A,Sjostedt E,Olovsson M,et al.The Human Endometrium-Specific Proteome Defined by Transcriptomics and Antibody-Based Profiling[J].OMICS,2015,19(11):659-668.
[2]Bailleux M,Bernard JP,Benachi A,et al.Ovarian endometriosis during pregnancy:a series of 53 endometriomas[J].Eur J Obstet Gyn RB,2017,209(6):100-104.
[3]李丽娜.血清EMAb水平对子宫内膜异位症导致不孕诊断价值的探讨[J].吉林医学,2014,35(4):731-733.
[4]钟煊.子宫内膜异位症并不孕症患者血清内分泌激素水平与自身免疫抗体观察[J].深圳中西医结合杂志,2017,27(8):12-13.
[5]李焱,张震宇,刘崇东.子宫内膜异位症合并不孕患者腹腔镜术后药物治疗妊娠结局分析[J].实用妇产科杂志,2015,31(1):53-56.
[6]李波,洛若愚.子宫内膜异位症合并不孕患者术后药物干预对生育能力影响[J].现代仪器与医疗,2015,(4):95-97.
[7]黄俊花,刘明星,陈晓红,等.不同临床病理类型子宫内膜异位症合并不孕患者生育力的研究 [J].中国微创外科杂志,2017,17(7):594-598.
[8]Coelho Neto MA,Martins WP,Lima ML S,et al.Ovarian response is a better predictor of clinical pregnancy rate following embryo transfer than is thin endometrium or presence of an endometrioma[J].Ultrasound Obst Gyn,2015,46(4):501-505.
[9]Moberg C,Bourlev V,Ilyasova N,et al.Levels of oestrogen receptor,progesterone receptor and αB-crystallin in eutopic endometrium in relation to pregnancy in women with endometriosis[J].Hum Fertil,2015,18(1):30-37.
[10]秦庆双,高美华.子宫内膜异位症与免疫不孕的相关性研究[J].山东医学高等专科学校学报,2016,38(1):59-61.
[11]王丁然,迟洪滨,乔杰.子宫内膜异位症与自身免疫性甲状腺炎的相关性及对生殖功能影响的研究进展 [J].中华医学杂志,2017,97(3):238-240.
[12]王鑫,黄豪光,万美兰,等.子宫内膜异位症合并不孕患者血清内分泌激素、VEGF、IGF-I水平及自身免疫抗体变化及其意义[J].检验医学与临床,2017,14(15):2299-2301.
[13]高艳,宋静慧.子宫腺肌病及其不孕相关因素[J].国际妇产科学杂志,2014,41(06):624-627.
[14]朱美凤.子宫内膜异位症患者血清中VEGF、TNFα、CA125检测及其临床意义[J].实验与检验医学,2016,34(5):670-672.
[15]Bouet P,El Hachem H,Monceau E,et al.Chronic endometritis in women with recurrent pregnancy loss and recurrent implantation failure:prevalence and role of office hysteroscopy and immunohistochemistry in diagnosis[J].Fertil Steril,2016,105(1):106-110.
