妊娠期SCH患者Hcy、叶酸及血脂代谢变化与患者TSH水平的关系
2018-06-21李新玲
李新玲
(新乡市妇幼保健院检验科,河南 新乡 453000)
妊娠期亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)是临床常见的内分泌疾病,与妊娠期间胎盘分泌多种激素、内分泌和代谢改变、母体的下丘脑-垂体-甲状腺轴处于应激状态等诸多因素有关[1]。SCH如得不到及时纠正,可导致孕妇贫血、产后出血、流产、早产等不良妊娠结局,还可能对胎儿的神经系统发育造成不可逆影响[2]。
叶酸是DNA合成过程中的主要辅酶,叶酸缺乏可能导致孕妇贫血、胎儿神经管缺陷,影响血同型半胱氨酸(Homocysteine,Hcy)的代谢途径。Hcy可抑制血管内皮细胞的增殖和修复功能,母体Hcy水平升高可引起凝血系统异常、胎盘血管病变而导致流产、早产、畸胎、妊高征等不良妊娠结局[3]。目前对于SCH患者是否也存在上述代谢异常鲜有报道。本研究探讨了SCH患者Hcy、叶酸及血脂代谢变化与促甲状腺激素(TSH)水平的变化,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取我院确诊的60例妊娠期SCH患者(SCH组)、60例人群甲状腺功能正常妇女(对照组)。 SCH 组,年龄 22~38 岁,平均 30.8±5.0 岁,体 质 量 68.1 ±3.6kg, 收 缩 压 (SBP)116.8 ±11.3mmHg,舒张压(DBP)69.5±7.9mmHg,检测孕周28~32 周,平均 30.8±1.0 周。 对照组,年龄 22~37岁, 平均 30.1±4.8 岁 , 体 质 量 69.0±3.9kg,SBP 117.1±9.6mmHg,DBP 70.6±8.1mmHg, 检 测 孕 周28~32 周,平均 30.6±1.0 周。两组患者的年龄、体质量、血压情况、监测孕周比较,差异均无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴年龄22~38岁;⑵妊娠期亚临床甲状腺功能减退的诊断标准参考2011年ATA指南中的标准[4]:妊娠早期 TSH2.50~10.00mIU/L,妊娠中晚期 TSH3.00~10.00mIU/L,FT4水平在正常范围;⑶所有纳入对象均在我院接受产前检查并建卡;⑷本研究获得研究对象及医学伦理委员会的批准。
1.2.2 排除标准 ⑴妊娠前具有甲状腺功能疾病;⑵既往具有内分泌疾病、免疫性疾病、遗传疾病;⑶合并急慢性感染性疾病;⑷伴有肿瘤疾病;⑸肝肾功能疾病;⑹长期使用激素、免疫抑制剂。
1.3 观察指标及检查方法 检测并比较两组妊娠期妇女的血清同型半胱氨酸(Hcy)、叶酸、甘油三酯 (TG)、总胆固醇 (TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、促甲状腺激素(TSH)、游离甲状腺激素(FT4)、游离三碘甲状腺原氨酸 (FT3)、抗甲状腺过氧化物酶抗体(TPOAb)。所有研究对象均抽取空腹静脉血,采用美国贝克曼 AU680全自动生化分析仪检测 TG,TC,HDL,LDL,HCY。采用贝克曼化学发光分析仪检测叶酸,TSH,FT4,FT3,TPOAb。
1.4 统计学方法 统计软件采用SPSS 16.0,采用均数±标准差(±s)进行统计描述,组间比较采用t检验,计数资料组间比较采用χ2检验;相关性分析采用Pearson线性相关分析法;P值<0.05表示差异具有统计学意义。
2 结果
2.1 两组妊娠妇女的血清Hcy、叶酸水平比较SCH组的血清Hcy显著的高于对照组 (P<0.05),SCH组的叶酸水平显著的低于对照组 (P<0.05);(表 1)。
表1 两组妊娠妇女的血清Hcy、叶酸水平比较(±s)
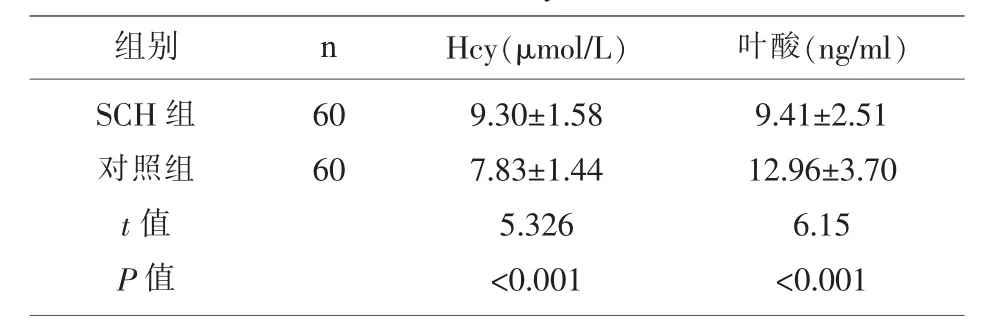
表1 两组妊娠妇女的血清Hcy、叶酸水平比较(±s)
?
2.2 两组妊娠妇女的血清甲状腺激素及TPOAb阳性率比较 SCH组的血清TSH、TPOAb阳性率显著的高于对照组(P<0.05);SCH 组的 FT3、FT4水平与对照组比较,差异无统计学意义(P>0.05);(表 2)。
表2 两组妊娠妇女的血清甲状腺激素及TPOAb阳性率比较(±s)
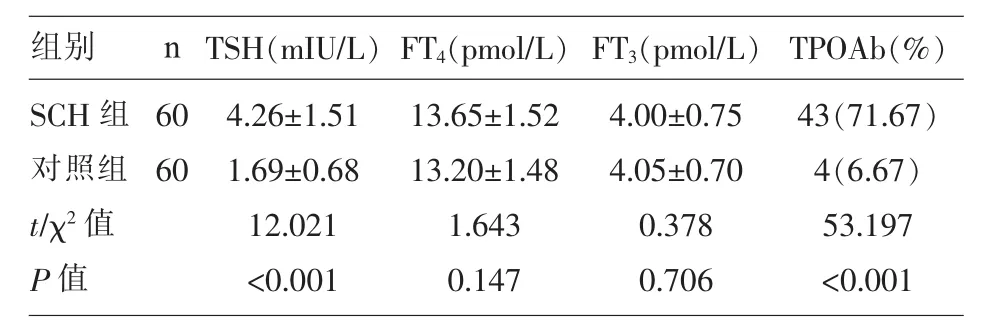
表2 两组妊娠妇女的血清甲状腺激素及TPOAb阳性率比较(±s)
组别SCH组对照组t/χ2值P值n 60 60 TSH(mIU/L) FT4(pmol/L) FT3(pmol/L) TPOAb(%)4.26±1.51 1.69±0.68 12.021<0.001 13.65±1.52 13.20±1.48 1.643 0.147 4.00±0.75 4.05±0.70 0.378 0.706 43(71.67)4(6.67)53.197<0.001
2.3 两组妊娠妇女的血脂相关指标比较 SCH组的 TG、TC、LDL-C 显著的高于对照组 (P<0.05);SCH组的HDL-C水平与对照组比较,差异无统计学意义(P>0.05);(表 3)。
表3 两组妊娠妇女的血脂相关指标比较(±s)
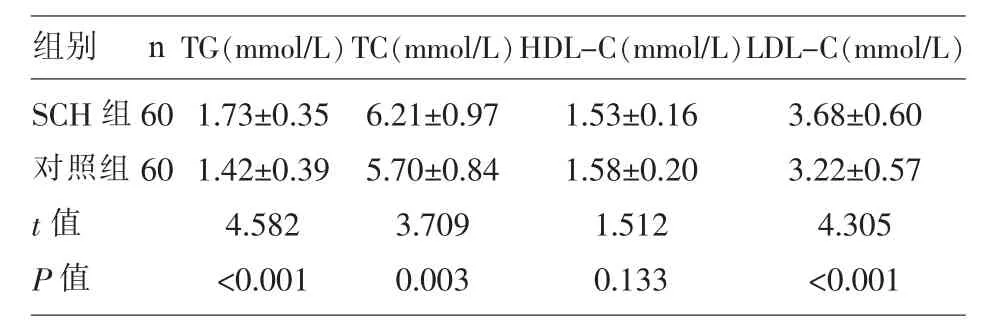
表3 两组妊娠妇女的血脂相关指标比较(±s)
组别S C H组对照组t值P值n 6 0 6 0 T G(m m o l/L)T C(m m o l/L)H D L-C(m m o l/L)L D L-C(m m o l/L)1.7 3±0.3 5 1.4 2±0.3 9 4.5 8 2<0.0 0 1 6.2 1±0.9 7 5.7 0±0.8 4 3.7 0 9 0.0 0 3 1.5 3±0.1 6 1.5 8±0.2 0 1.5 1 2 0.1 3 3 3.6 8±0.6 0 3.2 2±0.5 7 4.3 0 5<0.0 0 1
2.4 相关性分析 SCH 组的 TG、TC、LDL-C、Hcy水平与 TSH 呈显著的正相关关系 (P<0.05),SCH组的叶酸水平与TSH的相关性不显著 (P>0.05);(表 4)。
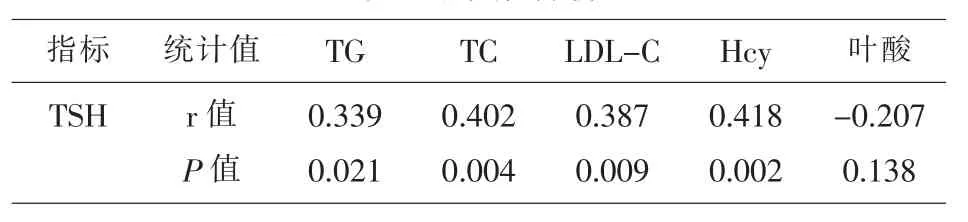
表4 相关性分析
3 讨论
甲状腺是人体内最大的内分泌器官,其合成、分泌的甲状腺激素参与全身各器官、各系统的功能调节[5]。妊娠期间由于血清人绒毛膜促性腺激素水平升高、甲状腺体积代偿性增大、血容量增加、肾脏对碘的清除率增加等导致妊娠期甲状腺激素的合成和代谢发生改变,亚临床甲状腺功能减退在妊娠期比较常见[6]。而妊娠期母体的甲状腺激素水平对于胎儿的神经系统发育具有重要的作用,尤其在妊娠20周之前,由于胎儿的下丘脑-垂体-甲状腺轴发育尚未成熟,这一阶段胎儿大脑发育所需的甲状腺激素完全来源于母体,亚临床甲减的发生会对后代的神经系统发育造成不可逆的影响[7]。
妊娠期亚临床甲减往往起病比较隐匿,无症状或症状较轻,易被妊娠期间生理现象所掩盖,需要通过实验室检査方能确诊,实验室检查结果提示TSH高于正常参考范围上限值,血清FT4在正常范围内[8]。本研究对患者进行实验室检查,结果也证实了这一点,SCH患者的血清TSH阳性率显著的高于对照组,而FT3、FT4水平与对照组无统计学差异。
有研究发现,妊娠期甲状腺功能的下降与孕妇机体免疫功能的变化密切相关,淋巴细胞浸润甲状腺而产生甲状腺过氧化物酶抗体[9]。甲状腺过氧化物酶是催化甲状腺激素合成的关键酶,甲状腺过氧化物酶抗体水平的升高可引起甲状腺滤泡损伤而导致甲状腺功能减退[10]。本研究中SCH患者的血清TPOAb阳性率显著的高于对照组,这一结果提示,甲状腺过氧化物酶抗体水平的升高是引起妊娠期亚临床甲减的机制之一。
叶酸是一种水溶性维生素,嘌呤、胸腺嘧啶、蛋氨酸等胎儿生长发育的必需物质的代谢需要叶酸的参与[11]。同时叶酸也是Hcy再甲基化过程中的重要辅助因子,Hcy是一种含硫的非必需氨基酸,人体Hcy水平主要由遗传因素决定,同时还受到叶酸、B族维生素、雌激素水平、肾功能、吸烟、饮酒等诸多因素的影响[12,13]。本研究中SCH患者的血清Hcy显著的高于对照组,而叶酸显著的低于对照组,这是由于妊娠期间母体雌激素水平升高,加快嘌呤类物质的代谢,使叶酸的利用增加而致相对缺乏。同时还会引起纤维蛋白合成增加,激活纤溶系统,为维持妊娠期间凝血-纤溶系统平衡,血清Hcy代偿性升高。亚临床甲状腺功能减退状态下母体代谢率减慢,肠道蠕动减慢、肠壁水肿、肠道细菌过度繁殖可导致胃肠道吸收功能下降,进而引起人体内叶酸缺乏,使妊娠期女性血清叶酸水平进一步降低,这可能是导致其发生不良妊娠结局的原因之一。
妊娠期母体对脂类物质的吸收能力增加,加上各种孕激素的作用,可造成生理性高脂状态[14]。亚甲减状态时进一步加重血脂代谢紊乱,增加血液粘稠度、增强氧化应激反应、诱导血栓形成,以导致胎盘血管病变而影响妊娠结局[15]。本研究中SCH患者的TG、TC、LDL-C显著的高于对照组,差异有显著性;而SCH组的HDL-C水平与对照组比较,差异无统计学意义。这一结果提示,妊娠期间血脂水平升高是正常的生理变化,而发生亚临床甲减时可导致血中TG、TC、LDL-C水平进一步升高,而对HDL-C无影响。
相关性研究结果发现,SCH患者的TG、TC、LDL-C、Hcy水平与TSH呈显著的正相关关系,SCH患者的叶酸水平与TSH的相关性不显著。这一结果表明,TG、TC、LDL-C、Hcy 水平升高的妊娠期妇女往往伴有亚临床甲减,在今后的临床工作中应予以重视。
综上所述,妊娠期SCH患者Hcy水平升高、叶酸及血脂代谢紊乱,并且与患者TSH变化具有相关性。
[1]吴跃跃,陈琳,黄新梅,等.妊娠期亚临床甲状腺功能减退的临床分析及甲状腺激素替代治疗的效果观察[J].中华内分泌代谢杂志,2017,33(3):198-202.
[2]张玲,史梁,张杰,等.血清同型半胱氨酸、维生素B12和叶酸水平与妊娠期亚临床甲状腺功能减退的相关性 [J].重庆医学,2016,45(27):3785-3787.
[3]王亦丹,徐友娣.妊娠期亚临床甲减者TPOAb与妊娠结局相关性分析[J].中国妇幼健康研究,2016,27(3):308-311.
[4]高劲松,边旭明.妊娠期亚临床甲状腺功能减退症的诊断标准及危害和处理[J].实用妇产科杂志,2015,31(12):886-888.
[5]吴美琴.妊娠期亚临床甲状腺功能减退的相关指南对比分析[J].现代妇产科进展,2017,26(2):145-148.
[6]李婷婷,陈江鸿.妊娠期亚临床甲状腺功能减退干预后对母儿的影响探讨[J].中国妇幼保健,2016,31(20):4145-4146.
[7]Nelson DB,Casey BM,McIntire DD,et al.Subsequent pregnancy outcomes in women previously diagnosed with subclinical hypothyroidism[J].Am J Perinat,2014,31(1):77-84.
[8]张倩,陈良苗,卢学勉,等.妊娠期SCH和妊娠并发症关系的研究进展[J].中国妇幼健康研究,2014,25(1):156-158.
[9]李彩霞,石学凤,吴学香,等.孕妇妊娠期甲状腺激素水平变化及与 TPOAb 的相关性研究[J].重庆医学,2015,44(29):4089-4091.
[10]贺译平,贺同强,王艳霞,等.不同标准诊断的亚临床甲状腺功能减退症及甲状腺过氧化物酶抗体阳性对妊娠的影响[J].中华妇产科杂志,2014,49(11):823-828.
[11]周竟雄,李鲁宏,李婷,等.左旋甲状腺素治疗对亚临床甲状腺功能减退症孕妇血清叶酸和甲状腺功能的影响[J].中国临床药理学杂志,2015,31(19):1913-1930.
[12]独海玲.妊娠期亚临床甲状腺功能减退症患者血清叶酸、维生素B12、同型半胱氨酸水平测定及临床意义[J].国际检验医学杂志,2016,37(16):2314-2316.
[13]王利,尹佳欢,李怀芳,等.妊娠期亚临床甲状腺功能减退与后代智力水平及孕前体重指数的相关性分析 [J].中国妇幼保健,2017,32(7):1384-1387.
[14]Yoshioka W,Amino N,Ide A,et al.Thyroxine treatment may be useful for subclinical hypothyroidism in patients with female infertility[J].Endocr J,2015,62(1):87-92.
[15]张增萍.妊娠期甲状腺功能筛查结果分析[J].实验与检验医学,2016,34(1):87-88.
