酶联免疫吸附试验法的自配阴性质控物的均匀性和稳定性评价
2018-06-21岑伟明梁越媚梁宝环黄明兰黄媛萍方凤媚隋洪
岑伟明,梁越媚,梁宝环,黄明兰,黄媛萍,方凤媚,隋洪
(东莞康华医院,广东 东莞 523080)
作为临床诊疗工作的核心,检验结果的准确性对临床医生的诊疗效果起着至关重要的作用。想要获得高质量的检验结果,必须使用安全方便、性能可靠的室内质控物[1],最终才能够有效确保检验结果正确可靠[2]。酶联免疫吸附试验(ELISA)法的影响因素众多[3],常见的有标本状态、实验温度湿度、孵育时间、显色时间等等,为了保证检验结果的准确性,需要使用质控物进行室内质量控制进行监测和控制[4]。在医院等级评审条款中规定血清学检测时须同时进行已知滴度的血清阳性质控与阴性质控。而在ISO15189:2012质量体系中,针对定性试验,明确规定必须选择浓度值为临界值2~4倍左右的弱阳性及浓度值为临界值0.5倍左右的阴性质控物进行室内质控监测。弱阳性质控物已经有较成熟的第三方商业质控物,但阴性质控物由于要求严格,且不同厂家的试剂盒的临界值浓度不一,需求的阴性质控物浓度也不一致,导致目前市面上暂无类似的质控物可供选择。故在保证实验结果的有效性的前提下,本室采用自行配制方案来配制乙肝表面抗原(HBsAg)、人免疫缺陷病毒抗体(HIV)、梅毒特异性抗体(TP)、丙肝病毒抗体(HCV)四个项目的阴性质控物,具体配制方法及评价方案如下:
1 材料与方法
1.1 仪器与试剂
1.1.1 材料 国产酶联免疫吸附试验(ELISA)检测HBsAg、HIV、TP、HCV 试剂盒,合共 4 种试剂盒,除HIV试剂盒为北京万泰公司提供外,其余3种试剂均为英科新创公司提供。上述试剂盒及标准物质均按说明书要求保存,在有效期内使用。
1.1.2 检测仪器 TECAN SUNRISE酶标仪、上海一恒电热恒温水箱、汇松全自动酶标洗板机PW-960。所有仪器均按ISO15189质量体系要求进行校准。
1.2 配制方案
1.2.1 血清基质的制备 收集正常人血清 (乙肝两对半及HIV、HCV、TP均阴性且无溶血或脂血)500 ml,混匀后以 3500~4500r/min 离心 10min,去除残留的纤维蛋白和血细胞成份,56℃加热30min灭活后制得质控物血清基质。
1.2.2 稀释度的确定 用上述血清对项目的检测试剂盒内自带的阳性对照品做5~320倍系列倍比稀释,测定抗体的滴度和各稀释度的质控物吸光度值,每稀释度平行做3孔,取其平均值。HBsAg、Anti-HIV、Anti-TP、HCV-Ab 取样本/临界值 (S/CO)在0.3-0.7范围的稀释度作为外部质控血清的最终稀释倍数。
1.2.3 配制及保存 根据确定的稀释度用制备的血清基质稀释各个项目阳性对照品至目标浓度的质控物。将质控血清用0.12mm滤膜过滤除菌,按每天试验用量分装、标记、封口,-70℃以下保存。
1.3 均匀性评价 根据CNAS-GL03文件中均匀性评价的单因子方差分析方案来设计评价方案:在配制好的质控物中随机抽取m=10个样品,每个样品重复测定n=2次,测试总次数为N=20次,自由度 f1=m-1=9、f2=N-m=10,以 C1-1、C1-2、C2-1、C2-2、……C10-1、C10-2表示每个测试的S/CO值,按下列步骤进行统计分析:
1.3.1 每个样品的2次测试的平均值X1=(C1-1+C1-2)/2、X2=(C2-1+C2-2)/2、……X10=(C10-1+C10-2)/2;
1.3.2 全部样品测试的总平均值X均=(X1+X2+……+X10)/10;
1.3.3 样品内平方和SS1=(X1-X均)2+(X2-X均)2+……+(X10-X均)2,样品内均方 MS1=SS1/f1;
1.3.4 样品间平方和SS2=(C1-1-X1)2+(C1-2-X1)2+(C2-1-X2)2+(C2-2-X2)2+……+(C10-1-X10)2+(C10-2-X10)2,样品间均方MS2=SS2/f2;
1.3.5 统计量F=MS1/MS2;
1.3.6 在当前实验条件下,F临界值为自由度为(f1,f2)及给定显著性水平α(通常α=0.05)的临界值Fα(f1,f2)即 F0.05(9,10),查表结果为 3.02;
1.3.7 若F小于F0.05(9,10)则表明样品内和样品间无显著性差异,样品是均匀的。
1.4 稳定性评价 将制备的质控物样品在-70℃冰箱分别保存1、2、3…12个月,每日每测定批次取一个样品解冻后当天使用,每份样品测定1孔,以月份为单位收集数据,求得每月的平均S/CO值,要求该值小于1.00,即结果需保持为阴性。
1.5 结果统计 所有的结果统计均通过EXCEL完成。
2 结果
2.1 稀释度的测定结果 根据上述稀释度用制备的血清基质稀释各个项目阳性对照品至目标浓度的质控物,按每日用量分装并于-70℃保存备用。见表1。

表1 各项目的稀释测定结果
2.2 均匀性评价 评价结果见表2及表3。由结果可知四个项目的 F 值均小于 F0.05(9,10)值 3.02,表明其均匀性无显著性差异。
2.3 稳定性评价 结果见表3,可知四个项目的在12个月中的S/CO月均值均小于1.00,说明稳定性可以接受。
3 讨论
在临床实验室中,质控物是保证室内质量控制工作的重要物质基础[5]。但是目前临床实验室免疫定性分析使用的质控物存在项目单一且价格昂贵、订购不方便等缺点,很多医院同仁为寻求解决方法,开始自配质控物。王开军等[6]配制出糖化血红蛋白的质控物,效果稳定可靠;董莉等[7]通过收集血清配制出稳定的化学发光法定量质控物,其稳定性,精密度等符合使用要求。定性项目方面,有多篇文献报道通过制备定性项目室内质控物,可以对定性项目的室内质控起到监控作用,实用价值良好[8-11]。综上所述,在当前商业质控品不足的情况下,要解决实验室的质控控制全面监控问题,自配质控物可以起到很好的补充作用。室内质控物的性能包括:基质、稳定性、瓶间差、分析物水平及预处理的要求等,与室内质量控制运行有效性密切相关,CNAS-CL39《医学实验室质量和能力认可准则在临床免疫学定性检验领域的应用说明》文件(下称CNAS-CL39文件)对自配质控物的评价要求至少应包括均匀性及稳定性评价[12]。

表2 均匀性评价结果
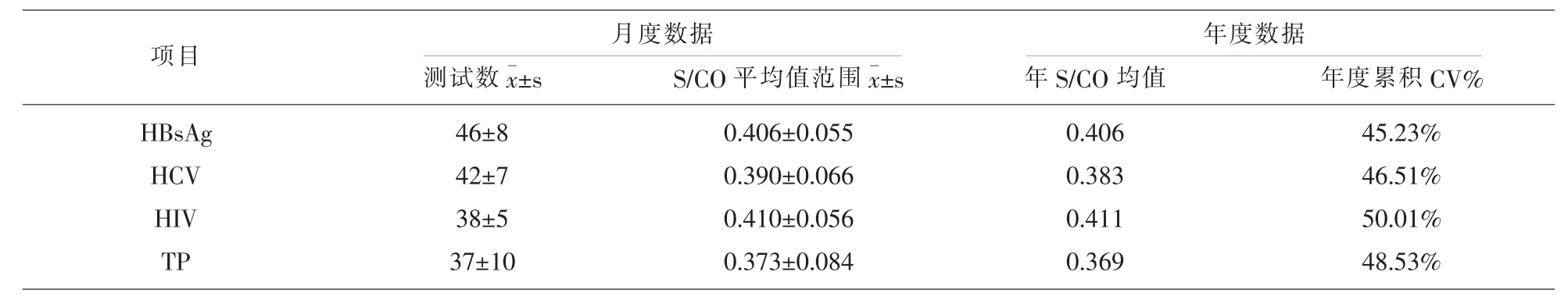
表3 稳定性评价结果
对于自配阴性质控物的均匀性,本文参考了CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》(下称CNAS-GL03文件)中的单因子方差分析方案来进行评价,结果显示四个项目的阴性质控物的F值均小于规定的Fa(f1,f2)值,表明其样品内和样品间无显著性差异,质控物是均匀的。
另一个评价质控物质量的关键指标是稳定性[13,14]。由于试剂批间差、板间差和操作误差等不确定的因素存在,导致ELISA试验的精密度较高,有研究指出,手工实验操作下,样本吸光度值越低,CV值就越大,当S/CO值处于0.92至1.51的范围下,CV值可高达26%[15]。而本文四个项目为阴性质控物,由于其S/CO均值仅为0.4左右,在剔除失控数据后,统计年度累积CV值分别为HBsAg-45.23%、HCV-46.51%、HIV-50.01%、TP-48.53%。CNAS-GL03文件中的稳定性评价方案,要求其测试方法必须是“精密而灵敏的”,故此方案并不适合评价精密度较低的ELISA定性试验,而目前国内暂无适用的评价免疫定性试验自配室内质控物的稳定性的标准文件。ELISA定性试验的报告方法仅有两种,有反应性(阳性)或无反应性(阴性),在CNAS-CL39文件中,有规定定性试验的质控判定规则可以采用肉眼判断结果规则,即阴、阳性质控物的检测结果分别为阴性和阳性即表明在控。故据此笔者认为针对手工操作的定性试验,其质控物的稳定性评价也仅须符合上述规则即可。纵观四个项目一年的质控数据,其S/CO平均值均小于1.00,表明在12个月期间,仍能保持阴性的结果,是稳定的。
综上所述,HBsAg、HIV、TP、HCV 四个项目的阴性质控物的均匀性和稳定性均符合实验室要求,可以应用于临床实验的质量控制当中,保证实验室结果准确。
[1]Pennemans V,Rigo JM,Faes C,et al.Establishment of reference value for novel urinary biomarkers for renal damage in the healthy population:are age and gender an issue?[J].Clinical Chemistry&Laboratory Medicine,2013,51(9):1795-1802.
[2]李书龙.患者免疫检测准确性保证[N].百姓信报,2009,23(7):123-124.
[3]谭立明.ELISA法检测的影响因素及其对策[J].实验与检验医学,2013,31(4):300-305.
[4]缪希莉.临床免疫检验质量影响因素分析[J].检验医学与临床,2014,11(3):396-397.
[5]王治国,李小鹏.临床检验定量测定室内质控系统的建立[J].检验医学,2004,19(1):6.
[6]王开军,郭长青.糖化血红蛋白质控物的研制及应用[J].国际检验医学杂志,2013,34(19):2595-2596.
[7]董莉,易青,杜肖彦.自制质控品在化学发光仪上的应用[J].国际检验医学杂志,2014,35(9):1172-1174.
[8]孔评石.抗肺炎支原体IgG定性测定的室内质控物浓度的选择和批间连续质控延续方法的建立[J].实验与检验医学,2017,35(1):68-70.
[9]刘和录,许瑞娜.5种定性试验质控物的研制与应用[J].国际检验医学杂志,2012,33(3):589.
[10]戴薇,李世云,刘聪,等.巨细胞病毒IgM抗体自制室内质控血清的应用及评价[J].实验与检验医学,2017,35(3):344-350.
[11]马晓东,石怀玉,张旭阳,等.单纯疱疹病毒Ⅱ型抗体室内质控血清制备及临床应用评价[J].医学信息,2014,(7):185-186.
[12]中国合格评审国家认可委员会.实验室质量和能力的认可准则在临床免疫学定性检验领域的应用说明[s].2013.
[13]华丽姿.自制凝血质控物稳定性及复融方式探讨[J].检验医学与临床,2013,10(10):1299-1301.
[14]袁咏梅,刘和录,何亚,等.自制G6PD室内质控物稳定性及瓶间均一性评价[J].国际检验医学杂志,2013,34(13):1733-1735.
[15]李红新,李俊武,聂希会,等.酶免法检测乙肝表面抗原实验精密度研究[J].医学检验与临床,2010,21(4):58-59.
